EDTA对镉胁迫下紫云英种子萌发及幼苗生理抗性的影响
杨 鹏,陈兴银,田玲玲,张凯凯,徐玲玲,关 萍
(贵州大学 生命科学学院,贵州 贵阳 550025)
EDTA对镉胁迫下紫云英种子萌发及幼苗生理抗性的影响
杨 鹏,陈兴银,田玲玲,张凯凯,徐玲玲,关 萍*
(贵州大学 生命科学学院,贵州 贵阳 550025)
采用水培法研究不同浓度EDTA(乙二胺四乙酸)对镉胁迫下紫云英(AstragalussinicusL.)种子萌发及幼苗生理抗性的影响,为重金属污染植物复合修复提供科学依据。结果表明:单一的镉(浓度为100 mg/L)胁迫紫云英时,能促进种子萌发,增加幼苗中丙二醛(MDA)的含量以及过氧化物酶(POD)的活性,但是会抑制幼苗的生长、降低幼苗的叶绿素含量以及超氧化物歧化酶(SOD)的活性。当在镉溶液中添加不同浓度的EDTA时,随着EDTA浓度的增加,其种子发芽率、幼苗长势、叶绿体含量以及POD活性都呈现出先增加后降低的趋势。就供试材料而言,在一定浓度范围内的EDTA能缓解镉胁迫紫云英幼苗的伤害作用,其中以0.05 mmol/L的EDTA处理效果最为明显。
紫云英;种子萌发;镉;EDTA;叶绿素
环境污染问题已成为当今社会关注的一大热点话题。近年来,随着我国工业的快速发展,极大促进了我国经济高速提升的同时也加剧了我国的环境污染。据调查显示,当前我国重金属超标点位占全部超标点位的82.8%,其中镉(Cd)污染最为严重,超标率高达7.0%[1]。由于重金属污染具有隐蔽性、长期性、表聚性和不可逆性等特点,寻求经济、高效、环保等重金属污染解决办法已迫在眉睫[2]。报道显示[3],植物修复机理技术是当前最具有价值的解决重金属污染问题的途径之一,即利用植物本身生长的过程来清理或降低环境中重金属浓度,具有环境友好、经济适用等特点。植物修复机理可分为植物吸取中的螯合诱导修复、植物挥发中的植物转化修复以及根际降解中的植物刺激或根际强化生物降解修复[4-5]。已有研究表明螯合剂的添加可增加某些重金属的可溶性,从而为植物的吸收创造了有利的条件,所以螯合剂诱导修复技术作为一种高效吸取重金属的修复技术备受关注和青睐[6]。
紫云英(AstragalussinicusL.),又名红花草,是我国冬季主要的绿肥植物,有改善土壤理化性状、提升土壤肥力等特点[7]。王文军等[8]研究表明,紫云英对镉有较强的耐性,低浓度的镉对紫云英的生长发育没有显著影响,甚至具有一定的生长促进作用。目前有关EDTA对植物镉污染方面的研究较多[9-11],但对紫云英幼苗生理生化特性影响的研究还未见报道。本研究初步探讨了EDTA对镉胁迫下紫云英幼苗某些生理生化特性的影响,为重金属污染植物复合修复提供科学依据。
1 材料与方法
1.1 供试材料
本实验在贵州大学生物技术实验室进行。供试的紫云英购于杭州鑫源花卉有限公司,胁迫试剂所用氯化镉(CdCl22·5H2O)为分析纯,螯合剂为EDTA(乙二胺四乙酸)。
1.2 方法
1.2.1 植物材料的培养
选择大小均匀且饱满的紫云英种子,70%酒精消毒3~5 min,蒸馏水反复冲洗并浸泡24 h。拿出浸泡过的种子用滤纸将水吸干,选取直径为9 cm的培养皿,培养皿内垫三层滤纸作为发芽床,每个培养皿放入100粒种子,并添加10 mL相应处理液。处理液含镉液和EDTA液,其中镉浓度均为100 mg/L(按氯化镉中Cd2+计算),EDTA分为5个浓度(0.025、0.05、0.1、0.5、1.0、3.0 mmol/L),实验设置两个对照CK0和CK1,CK0用蒸馏水培养,CK1用单一的镉液培养(不含EDTA),材料置于温度为25±1℃的光照培养箱中催芽,催芽期间每天更换一次相应的处理液,每个实验设置3次重复。
1.2.2 幼苗长势及生理指标的测定
紫云英发芽后第7 d测定根长和苗长并统计种子发芽率[12],发芽率(%)=(供试种子的发芽数/供试种子数)×100%,根长和苗长用数显游标卡尺测量,每个处理分别测量30株。第8 d测定幼苗的生理指标,叶绿素用95%的酒精抽提[13],并用分光光度法测定;丙二醛(MDA)含量采用硫代巴比妥酸法测定[14];过氧化物酶(POD)活性采用愈创木酚法测定[15];超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法测定[16]。
1.2.3 数据分析
试验数据采用Microsoft Excel 2007软件进行处理,并采用SPSS 20.0统计软件进行统计分析。
2 结果与分析
2.1 EDTA对镉胁迫下紫云英种子发芽率的影响
由图1可以看出,单一的镉胁迫处理(CK1)明显提高了紫云英种子的萌发,其发芽率较对照CK0增加了58.4%(p<0.05),表明当用浓度为100 mg/L的镉培养液处理紫云英种子时,对其种子的萌发有促进作用。当在镉溶液中添加不同浓度的EDTA,其发芽率随着EDTA的浓度的增加呈现先增高后降低趋势,当EDTA=0.05 mmol/L时,发芽率达到最大值,分别较对照组CK0、CK1提高了29.86%和-17.98%;当EDTA=3 mmol/L时,发芽率降到最低值,分别较对照组CK0、CK1降低了13.75%和45.54%,说明单一的镉胁迫(100 mg/L)和添加0.05 mmol/L的EDTA均能促进紫云英种子的萌发,低浓度(0.025 mmol/L)和高浓度(3 mmol/L)的EDTA的镉复合液在不同程度上均抑制紫云英种子的萌发。
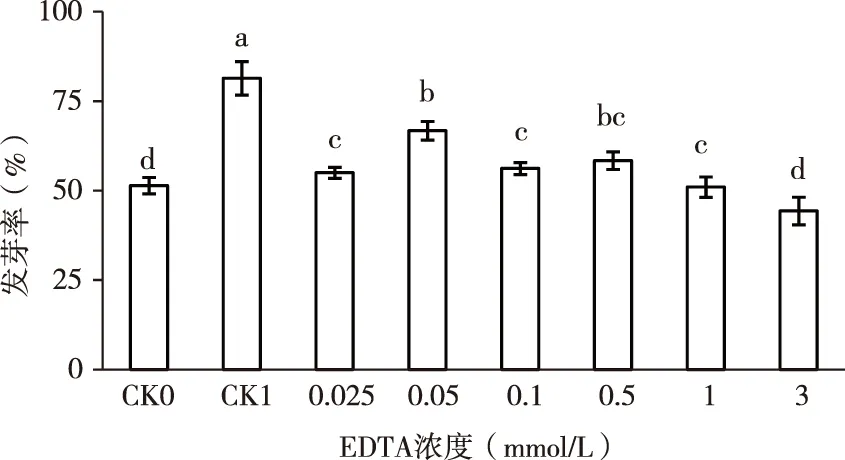
图1 EDTA对镉胁迫下紫云英种子发芽率的影响Fig.1 Effects of EDTA on seed germination rate of Astragalus sinicusunder Cd Stress注:小写字母表示0.05水平差异显著,下同。
2.2 EDTA对镉胁迫下紫云英幼苗长势的影响
重金属胁迫下植物的长势是衡量其对重金属耐受性的重要指标之一。同时植物对重金属的吸收在很大程度上取决于它在培养液中存在的形态,其中容易被植物吸收的形态也容易对植物的生长产生影响[17]。由图2可知,无镉胁迫、同时不添加EDTA的对照(CK0),根长均高于其他对照组,表明镉和EDTA均可影响根的生长。单一的镉胁迫(CK1)处理,其根长、苗长分别较对照CK0降低了65.57%和8.56%,表明浓度为100 mg/L的镉胁迫对紫云英幼苗生长具有明显的抑制作用,且对根的抑制作用大于苗。当镉胁迫处理液中添加不同浓度的EDTA时,紫云英幼苗的长势随EDTA浓度的增加呈现先增加后降低的趋势。当复合液中EDTA=0.5 mmol/L时,其根长达到最大值(8.63 mm),较对照CK1增加了98.4%(p<0.05),当EDTA=0.05 mmol/L时,紫云英幼苗的苗长达到最大值(10.75 mm),分别较对照CK0、CK1增加了24.4%和36.1%,表明当在100 mg/L的镉溶液中添加0.05 mmol/L的EDTA时,能缓解镉胁迫对紫云英幼苗地下部分的抑制作用,当在100 mg/L的镉溶液中混合0.5 mmol/L的EDTA时,能缓解镉胁迫对紫云英幼苗地上部分的抑制作用。
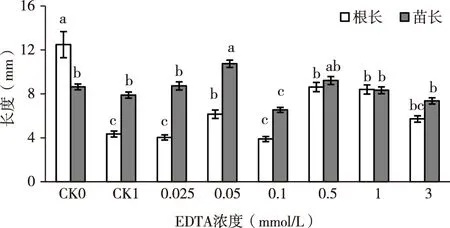
图2 EDTA对镉胁迫下紫云英幼苗长势的影响Fig.2 effects of EDTA on the growth of Astragalus sinicus seedlings under Cd stress
2.3 EDTA对镉胁迫下紫云英幼苗叶绿素含量的影响
叶绿素是植物进行光合作用的重要物质,植物中叶绿素含量变化在一定程度上显示了逆境下植物所遭受的危害程度[18]。由图3可知,单一的镉胁迫(CK1)导致紫云英幼苗叶绿素含量较对照CK0降低了20.25%,原因可能是培养液中重金属镉离子含量过多,使叶绿体内蛋白质合成受到破坏,导致叶绿体分解[19]。当用含低浓度EDTA(<0.05 mmol/L)的镉复合溶液培养后,叶绿素含量开始逐步上升,这说明了EDTA减缓了镉胁迫对紫云英幼苗的叶绿体内蛋白质的破坏程度。当EDTA=0.05 mmol/L时,叶绿素含量达到峰值(1.4 mg/g·FW),此后,随着EDTA的浓度增加,叶绿素含量开始降低,当EDTA=3 mmol/L时,叶绿素含量达到最低值(0.75 mg/g·FW),此时紫云英幼苗叶片出现了不同程度的发黄和萎蔫等症状,说明高浓度EDTA(3 mmol/L)复合镉溶液胁迫紫云英幼苗时,对叶绿体中蛋白质的合成影响较大[19]。

图3 EDTA对镉胁迫下紫云英幼苗叶绿素含量的影响Fig.3 Effects of EDTA on chlorophyll content under Cd stress
2.4 EDTA对镉胁迫下紫云英幼苗MDA含量的影响
植物器官在衰老或逆境胁迫时,会发生膜质过氧化作用,丙二醛(MDA)是其终产物之一,其含量可以反映膜脂过氧化物和植物遭受逆境伤害的程度[20]。由图4可知,单一的镉(CK1)胁迫对紫云英幼苗MDA的含量较对照CK0增加了3.32%(p>0.05),说明用100 mg/L的镉胁迫对MDA的伤害程度不大,当添加一定浓度EDTA时,MDA含量开始下降,当EDTA=0.5 mmol/L时,其MDA含量最低(2.14 mol/g·FW),分别较对照组CK0、CK1降低了28.9%和31.19%。此后随EDTA浓度的增加其MDA含量逐渐增大,表明在一定浓度范围内,低浓度和高浓度的EDTA能缓解镉胁迫对紫云英幼苗MDA的伤害。
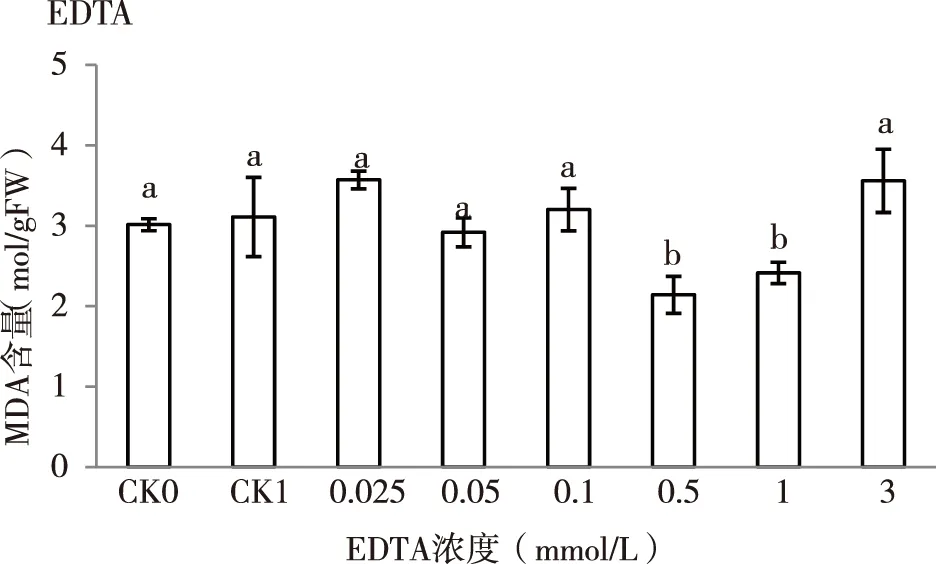
图4 EDTA对镉胁迫下紫云英幼苗MDA含量的影响Fig.4 Effects of EDTA to content of MDA under cadmium stress
2.5 EDTA对镉胁迫下紫云英幼苗SOD含量的影响
SOD是自然界唯一的以氧自由基为底物的酶,在活性氧代谢中处于重要地位,可猝灭超氧负离子O2-的毒性,终止由O2-启动的一系列自由基连锁反应所造成的生物毒性损伤,为生物体内最重要的清除活性氧自由基的酶类[21]。由图5可知,与对照组(CK0)相比,浓度为100 mg/L的镉(CK1)胁迫,SOD活性降低。添加EDTA后,除最低浓度EDTA(0.025 mmol/L)下SOD活性明显升高外,其余浓度下SOD活性均不同程度降低。当EDTA=0.1 mmol/L时,其SOD活性达到最低,分别较对照CK0、CK1降低了71.6%和67.4%,此后SOD活性随EDTA浓度的增加而增大,表明在一定浓度范围内,低浓度和高浓度的EDTA能缓解Cd胁迫对紫云英幼苗SOD活性的影响,达到清除镉胁迫产生的活性氧[22]。
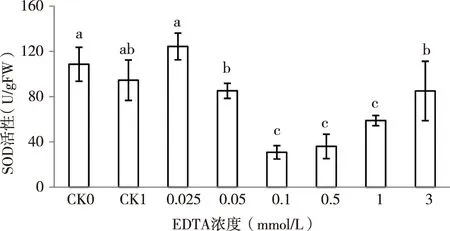
图5 EDTA对镉胁迫下紫云英幼苗SOD含量的影响Fig.5 Effects of EDTA to content of SOD under cadmium stress
2.6 EDTA对镉胁迫下紫云英幼苗POD含量的影响
过氧化物酶(POD)是植物体内重要的保护酶,能有效清除逆境条件下细胞中产生的自由基,在抗逆境胁迫中起着关键作用[23],由图6可知,当紫云英幼苗被浓度为100 mg/L的镉胁迫(CK1)时,其POD活性急剧增强,较对照组CK0增加了1.5倍(p<0.05)。与对照组(CK0)相比,在镉溶液中添加低浓度(0.025 mmol/L)的EDTA时,POD的活性降低,随着EDTA浓度的增加,POD活性与EDTA浓度呈正相关,当EDTA=0.5 mmol/L时,POD活性达到峰值(13803.4 U/g·FW),分别较对照CK0、CK1增加了94.71%和-21.07,当添加的EDTA大于0.5 mmol/L时,POD活性与EDTA浓度呈负相关。当EDTA=3 mmol/L时,POD活性降到最低(5630.4 U/g·FW),分别较对照CK0、CK1降低了20.58%和67.8%,说明高浓度(3 mmol/L)的EDTA对镉胁迫下抑制紫云英幼苗POD活性。
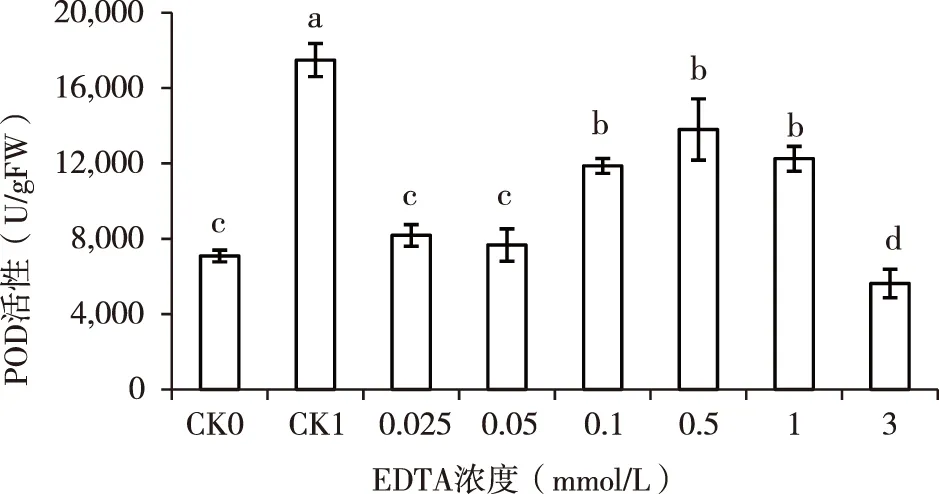
图6 EDTA对镉胁迫下紫云英幼苗POD含量的影响Fig.6 Effects of EDTA to content of POD under cadmium stess
3 结论
3.1 EDTA对镉胁迫下紫云英种子萌发的影响
有报道显示[24],重金属对植物种子萌发具有“低促高抑”现象,低浓度的重金属可以提高种子胚生理活性,促进萌发;高浓度重金属对胚、芽等产生了伤害作用,抑制种子萌发。本实验研究显示,单一的镉胁迫极大促进了紫云英种子萌发,推测100 mg/L的镉胁迫提高了紫云英种子中胚的生理活性,促进了种子胚芽的生长[25]。这与Kaplan等[26]研究铊毒胁迫大豆生长毒害作用相一致。当用一定浓度的EDTA混合镉溶液处理时,在不同程度上也促进了紫云英种子的萌发。随着EDTA的浓度增加,其萌发率呈现出先增加后降低的趋势,但较单一的镉处理(CK1)相比,其发芽率总体是降低的,说明用单一的镉胁迫处理对提高紫云英种子的萌发率比EDTA与镉复合处理要大,这可能与螯合态的镉对紫云英种子呼吸机制有关[27]。
3.2 EDTA对镉胁迫下紫云英幼苗生长的影响
有报道表明[28],重金属进入植物根部细胞后,首先与蛋白质、多糖或核酸等分子结合,大部分累积在植物的根部,仅少量向地上部分迁移。本研究表明,低浓度的镉胁迫对紫云英幼苗的根和苗长都有抑制作用,且这种抑制影响是地下部分>地上部分,这与张杰,孙圆圆等的研究一致[29-30]。当在镉溶液中复合一定浓度的EDTA时,结果发现不仅能缓解镉胁迫对紫云英幼苗根的生长,且对苗的生长有一定的促进作用。由此可见,加入适宜浓度的EDTA能促进植物生长。
3.3 EDTA对镉胁迫下紫云英幼苗生理特征的影响
重金属胁迫导致植物体内活性氧的积累,致使植株组织的氧化胁迫和膜损伤。改变酶系活性,对植株生长产生影响[31]。然而植株本身可以通过自身组织系统来条件其耐受性。通常通过POD、SOD和CAT组成的抗氧化酶系统清除体内活性自由基来提高植株对逆境的抗性[32]。本研究结果发现,叶绿素含量和POD活性随EDTA浓度的增加呈现先增加后降低的趋势,MDA含量和SOD活性随EDTA浓度的增加呈现先降低后增加的趋势,表明随着EDTA浓度的增加,植株通过自身的调剂机制进行综合调控,由于植物对重金属的吸收和转运机理很复杂,其吸收和转运重金属离子能力的大小不仅与植物种类有关,而且与重金属离子在溶液中存在的形式等因素有关,本实验中一定浓度的EDTA复合镉胁迫紫云英幼苗生理的影响机制更为显著,其原因有待进一步分析。
[1] 张 磊. 螯合剂强化棉花对镉污染土壤修复的初步研究[J]. 水土保持学报,2015,29(4):321-326.
[2] 杨启良,武振中,陈金陵,等. 植物修复重金属污染土壤的研究现状及其水肥调控技术展望[J]. 生态环境学报,2015,24(6):1075-1084.
[3] 李文一,徐卫红,李仰锐,等. 重金属污染土壤植物修复机理研究[J]. 广东农业科学,2006,31(4):79-81.
[4] 贾文甫,罗学刚,赵鲁雪,等. 不同螯合剂和pH值对植物富集铀的影响[A].中国核学会核化学与放射化学分会. 第十三届全国核化学与放射化学学术研讨会论文摘要集[C].中国核学会核化学与放射化学分会,2014:2.
[5] 李双喜,吕卫光,郑宪清,等.不同螯合剂处理下黑麦草对重金属Pb、Cr、Hg的吸收作用研究[J]. 上海农业科技,2010(2):20-21,23.
[6] 骆永明. 强化植物修复的螯合诱导技术及其环境风险[J].土壤,2000(2):57-61,74.
[7] 钟小慈,罗庆华.紫云英对土壤理化性状及水稻产量的影响[J].现代农业科技,2015(6):222-230.
[8] 王文军,郭熙盛.紫云英对镉富集效应研究[J].安徽农业科学,2011,39(1):400-401,404.
[9] 罗兰艳,张 洪,王文华,等. 2种螯合剂对油菜吸收Cd的影响[J].安徽农业科学,2011,(39)10:5841-5843,5846.
[10] 王 坤. 土壤主要特性与外源螯合剂对龙葵富集镉的影响研究[D].石家庄:河北农业大学,2014.
[11] 郑明霞,冯 流,刘 洁,等. 螯合剂对土壤中镉赋存形态及其生物有效性的影响[J].环境化学,2007,26(5):606-609.
[13] 张风娟,李继泉,徐兴友,等.环境因子对黄顶菊种子萌发的影响[J].生态学报,2009,29(4):1947-1953.
[13] 戈长水,应 武,陈惠哲,等.遮荫对2个水稻品种叶片生理生态学特征的影响[J].浙江农业科学,2012,(7):927-931,935.
[14] 李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[15] 张志良,翟伟清,李小芳. 植物生理学实验指导(第4版)[M].北京:高等教育出版社,2009.
[16] 张立军,樊金娟.植物生理学实验教程[M].北京:中国农业大学出版社, 2007.
[17] 郭晓方,卫泽斌,许田芬,等.不同pH值混合螯合剂对土壤重金属淋洗及植物提取的影响[J].农业工程学报,2011,27(7):96-100.
[18] 侯 明,陈国勇,梁福晓,等. 钒胁迫对水稻幼苗生理生化和富集特性的影响[J].生态环境学报,2014,23(10):1657-1663.
[19] 王红新,胡 锋,许信旺,等.EDTA对铅锌尾矿改良土壤上玉米生长及铅锌累积特征的影响[J].生态学报,2011,31(23):140-147.
[20] Chen L,Han Y,Jiang H.Nitrogen nutrientstatus induces sexual differences in responses to cadmiuminPopulusyunnanensis[J].JournalofExperimentalBotany,2011,62(14):5037-5050.
[21] 谢志玉,张文辉,刘新成.干旱胁迫对文冠果幼苗生长和生理生化特征的影响[J].西北植物学报,2010,30(5):948-954.
[22] 张玉芬,刘景辉,杨彦明,等.柠檬酸和EDTA对蓖麻生理特性和镉累积的影响[J].生态与农村环境学报,2015,31(5):760-766.
[23] Zeng XC,Xu YZ, Zhang FQ.Difference of Cadmium Difference of Cadmium Responses to Cadmium Stress in Two DifferentSolanumNigrum[J].JournalofAgro-EnvironmentScience,2012,31(5):885-890.
[24] 张义贤. 汞、镉、铅胁迫对油菜的毒害效应[J].山西大学学报(自然科学版),2004,27(4):410-413.
[25] 姚 焱,张 平,刘卫海,等.重金属铊对白菜种子萌发及其生理的影响[J].种子,2007,26(2):25-27.
[26] Kaplan D,Adriano DC,Sajwan KS. Thallium toxicity in bean[J].JournalofEnvironmentalQuality,1990,19(3):359 -365.
[27] 马成仓,洪法水.EDTA对汞毒害下小麦种子萌发代谢的影响[J].农业环境保护,1996,15(3):134-135,133.
[28] 覃勇荣,覃艳花,严 军,等.EDTA对桑树和任豆幼苗吸收重金属Pb的影响[J].南方农业学报,2011,42(2):168-172.
[29] 张 杰,黄永杰,刘雪云.镧对镉胁迫下水稻幼苗生长及生理特性的影响[J].生态环境,2007,16(3):835-841.
[30] 孙园园,张光兰,杨文杰,等.镉胁迫对1年生黑麦草种子萌发及幼苗初期生理生化特性的影响[J].种子,2014,33(8):25-29.
[31] Yuan ZL,Wu ZH.Effect of cadmium on antioxidative capabilityand phytohormone level in tobacco roots[J].ActaEcologicaSinica,2010,30(15):4109-4118.
[32] Zheng AZ. Effects of cadmium on lipid peroxidation and ATPase activity of plasma membrane from Chinese kale ( Brassica alboglabra Bailey) roots[J].ActaEcologicaSinica,2012,32(2):483-488.
Effects of EDTA mixedCadmium Stress on the Seed Germination an Physiological Resistance Characters of Initial Growth inAstragalussinicus
YANGPeng,CHENXing-yin,TIANLing-ling,ZHANGKai-kai,XULing-ling,GUANPing*
(CollegeofLifeSciences,GuizhouUniversity,Guiyang,Guizhou550025,China)
The effects of different concentrations of EDTA(ethylene diamine tetraacetic acid) on theseed germination and seedling physiological resistance ofAstragalussinicusundercadmium (Cd) stress were studied by hydroponic method to provide scientific basis for remediation of heavy metal polluted plants. The results showedthat single cadmium stress(100 mg / L)promoted the seed germination, increased the seedling malondialdehyde (MDA) content and peroxidase (POD) activity, but inhibited the seedling growth, reduced the seedling chlorophyll content and the superoxide dismutase (SOD)activity. When different concentrations of EDTA were added into Cd solution and with the increase of EDTA concentration,the seed germination rate, seedling growth, chloroplast content and POD activity first increased and then decreased. Therefore, certain range of concentrations of EDTAcould relievethe damage of Astragalus sinicus seedlingsinduced by Cd stress, with the treatment of EDTAconcentration at 0.05 mmol/Lbeing the most effective.
Astragalussinicus; seed germination;cadmium; EDTA;chlorophyll
2016-07-24;
2016-10-11
贵州省社会发展攻关课题(201303137)。
Q945.78
A
1008-0457(2016)06-0026-05 国际
10.15958/j.cnki.sdnyswxb.2016.06.004
*通讯作者:关萍(1961-),女,博士,教授,主要研究方向:植物学、分子生物学及植物生物技术; E-mail:guanp@163.com。

