UV辐射对植物多酚代谢的影响
李 雪,潘学军,张文娥
(贵州大学 农学院/贵州省果树工程技术研究中心,贵州 贵阳 550025)
·文献综述·
UV辐射对植物多酚代谢的影响
李 雪,潘学军,张文娥*
(贵州大学 农学院/贵州省果树工程技术研究中心,贵州 贵阳 550025)
植物多酚是紫外线防御物质,是植物体中重要的次生代谢产物,参与植物的生长发育,赋予植物抗紫外线、抗病害等生理功能。紫外线辐射作为一种逆境因子,与植物多酚间存在着相互制约而又相辅相成的关系。文章综述了植物多酚的合成途径,着重阐述了紫外线辐射对植物生长发育及贮藏品质、植物多酚的种类及含量以及多酚合成相关基因表达的影响,旨为揭示植物多酚合成与紫外辐射的关系及调控植物多酚合成提供更多信息。
UV辐射;植物多酚代谢途径;生长发育;多酚合成酶基因表达
随着环境污染的加剧,地球大气臭氧层变薄,导致地表的太阳辐射强度变大[1],尤其是高海拔地区的紫外辐射量明显增加[2]。作为日光高能区的不可见光线,紫外线依据波长长短可分为长波紫外线(UV-A,400~315 nm)、中波紫外线(UV-B,315~280 nm)和短波紫外线(UV-C,280~100 nm)3类。在分子、细胞、器官、植物个体甚至生态系统水平上影响植物的生长发育,干预植物生理生化的代谢过程及相关基因的表达与调控[3-6]。
植物多酚是次生代谢物重要的组成部分,是指分子结构中包含一个或多个酚官能团的一大类物质,可以抵御紫外线的辐射和病原体的侵染[1],广泛存在于植物的各个组织和器官中,已成为重要的植物源保健功能营养成分。多酚具有极强的自由基清除能力及抗氧化功能,可延缓机体衰老,预防心血管疾病,具有抗炎、防癌、抗肿瘤、抗溃疡等生理功效[7],此外,植物多酚也是重要的非酶类抗氧化物质,参与植物抗逆应答反应。因此,多酚化合物的合成代谢已成为植物生理学、食品营养学和医学等领域的研究热点。
1 植物多酚的合成途径
类黄酮代谢途径、生物碱生物合成途径和异戊二烯代谢途径是植物次生代谢产物合成的主要途径。类黄酮代谢途径产生植物多酚,而苯丙烷代谢途径是类黄酮代谢途径的上游通用途径,连接氨基酸代谢和次生代谢,植物体中几乎所有含苯丙烷骨架的化合物都是由这一途径直接或间接生成的。连接糖代谢和次生代谢的莽草酸途径[10](图1)只存在于高等植物、真菌和细菌中。绿色植物光合作用固定的碳约有20%流向莽草酸代谢途径,最终形成次生代谢物,如芳香族氨基酸、多酚类物质和芳香族类香气物质等[11-12]。固莽草酸途径是植物体内初级代谢和次生代谢的枢纽。
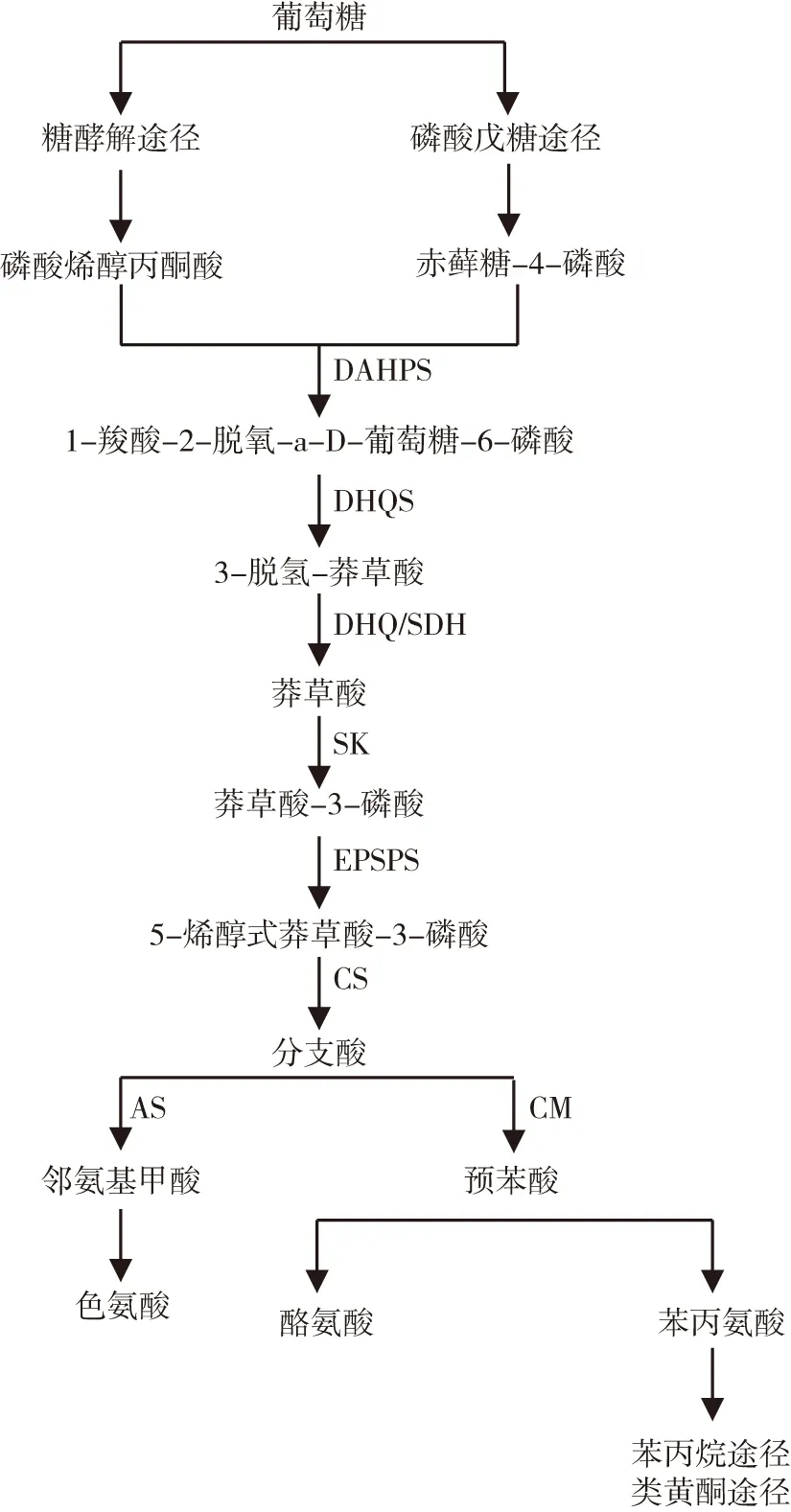
图1 莽草酸途径Fig.1 Shikimate pathway
注:图中DAHPS(3-脱氧-D-阿拉伯糖型-庚酮糖酸-7-磷酸合成酶);DHQS(3-脱氢奎尼酸合成酶);DHQ(脱氢奎尼酸脱氢酶);SDH(莽草酸脱氢酶);SK(莽草酸激酶);EPSPS(5-稀醇式丙酮酰莽草酸-3-磷酸合成酶);CS(分支酸合成酶);CM(分支酸变位酶);AS(邻氨基苯甲酸合成酶)。
糖酵解途径(glycolytic pathway,EMP)产生的磷酸烯醇式丙酮酸(phosphoenolpyruvic acid,PEP)和戊糖磷酸途径(pentose phosphate pathway,PPP)产生的赤藓糖-4-磷酸(erythrose-4-phosphate,E4P)进入莽草酸途径后,经过7个步骤的反应形成的预苯酸和分支酸,再经转氨作用生成苯丙氨酸,进入苯丙烷代谢途径(图2),经苯丙烷代谢生成反式肉桂酸、香豆酸、阿魏酸等中间产物,这些简单酚酸进一步转化为香豆素、绿原酸,或形成CoA酯,最后经类黄酮代谢途径转化为类黄酮、木质素等[10]。
目前研究最为深入的是类黄酮代谢途径[13],莽草酸途径产生的苯丙氨酸经苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)将氨基酸的胺基脱去形成肉桂酸,然后在肉桂酸-4-羟化酶(cinnamate 4-hydroxylase,C4H)催化肉桂酸和羟基形成P-香豆酸,最后P-香豆酸和辅酶A在4-香豆素辅酶A连接酶(4-coumarate CoA ligase,4CL)作用下,与辅酶A以硫酯键形成4-香豆酰CoA。
如图2所示,苯丙烷类代谢途径产生的4-香豆酰CoA在查尔酮合酶(chalcone synthase,CHS)作用下经类黄酮代谢途径缩合3分子的苹果酰COA和P-香豆酰COA,形成15个碳的黄酮类化合物的骨架(亦即查尔酮),然后在查尔酮异构酶(chalcone isomerase,CHI)的作用下形成槲皮素,最后槲皮素经修饰形成各类黄酮类化合物。例如:槲皮素经类黄酮3-羟化酶(flavonoid3’-hydroxylase,F3H)的催化,形成二氢黄酮醇后,经二氢黄酮醇4-还原酶(dihydroflavonol-4-reductase,DFR)形成黄烷-3-4-二醇,作为花色素和原花色素延伸单元的共同体。随后无色花色素双氧化酶(leucoanthocyanidin dioxygenase,LDOX;也称ANS)和花色素还原酶(anthocyidin reductase,ANR;也称BAN)、无色花色素还原酶(leucoanthocyaidin reductase,LAR)催化无色(隐色)花色素分别生成(-)-表儿茶素和(+)-儿茶素[14]。缩合途径是以类黄酮代谢途径生成的(+)-儿茶素和(-)-表儿茶素作为生成原花色素的起始单元,在缩合酶的作用下形成二聚体、三聚体以及多聚体,即原花色素,目前对这一反应过程的研究尚不明确[15]。
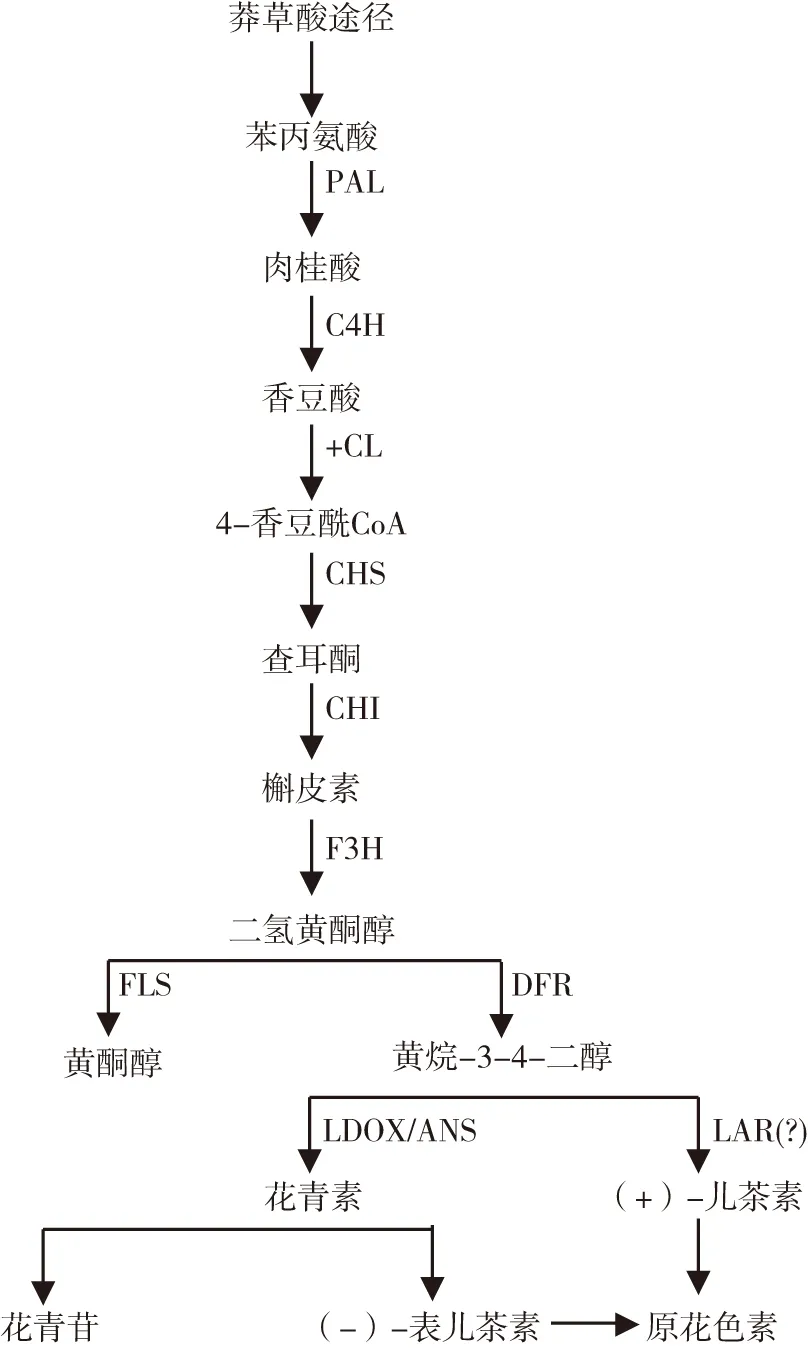
图2 苯丙烷代谢途径和类黄酮代谢途径Fig.2 Phenylpropanoid metabolic pathway and Flavonoid pathway
注:图中PAL(苯丙氨酸解氨酶);C4H(肉桂酸羟化酶);4CL(对香豆酰连接酶);CHS(查尔酮合成酶);CHI(查尔酮分异构酶);F3H(黄烷酮-3-羟基化酶);DFR(二氢黄酮醇还原酶);LDOX(花白素双加氧酶);UFGT(类黄酮-3-O-葡萄糖基转移酶);ANS(原花色素合成酶)。
2 紫外线照射对植物多酚积累的影响及其调控
来源于芳香族氨基酸的类苯基丙烷物质,在植物结构构建、信号转导和防御功能方面起着至关重要的作用[16]。苯丙烷代谢途径的调控是环境和基因综合作用的结果,当植物遭受机械损伤、病虫害、紫外辐射等逆境伤害时,植物体内随之积累大量类黄酮等多酚类物质[19]来抵御伤害。这是类黄酮途径中的酶基因对外界因素变化或诱导做出的积极响应。如紫外光或诱导因子会诱导葡萄糖-6-磷酸脱氢酶和磷酸戊糖途径氧化酶的活性升高,而且莽草酸途径中的酶基因在转录水平上的表达也随之提升[17-18]。此外,体内代谢物质、激素、组织的特殊发育阶段等也会刺激多酚的合成。由于多酚不仅是构成植物特有品质和特征香气的主要成分,而且在植物抵抗紫外线辐射、抵抗病原伤害等方面发挥着重要作用,因此研究紫外线与多酚合成的相互关系,可指导我们利用光质调控从植物体内“高效”获取多酚类物质。
2.1 紫外线辐射对植物生长发育及果实内多酚积累的影响
紫外线辐射对植物生长发育的影响具有双重性,生长发育过程中的植物进行紫外线辐射后,会产生不同程度的逆境伤害。紫外线对植株生长的影响可通过植物的形态特征和生物量的变化来反应。增强UV-B辐射可抑制葡萄幼苗的生长发育,主要表现在叶面积减少,节间缩短,植株矮化,且辐射强度与抑制程度呈正相关[20]。UV-B辐射明显抑制葡萄果实的生长,随着辐射强度的增加,葡萄果穗、果粒个体明显变小,重量下降[21]。且葡萄着色指数、总糖、可溶性固形物含量减少,总酸含量增加,糖酸比降低,单宁含量上升,进而影响葡萄酒的质量[22]。同时,UV-B长时间、高强度辐射会破坏植物叶绿体结构,阻碍叶绿素合成,降低叶绿素含量和RuBP羧化酶活性,使净光合速率下降,导致光合产物的积累减少[23],由此引起的还原性糖含量降低,植物多酚合成的前提物质减少,直接影响次生代谢中植物多酚的累积。
长时间、高强度的紫外线辐射虽对植物的生长发育产生不利的影响,但适宜剂量的紫外线则可提高采后果实的品质,这主要由于紫外线辐射能杀死大多数的微生物,延缓采后果实的呼吸作用,诱导果蔬本身的抗病性和耐贮性。有研究表明,0.75 kJ/m2和1.5 kJ/m2的UV-C辐射均可显著增加桃的可溶性糖含量,但辐射强度增加到3.0 kJ/m2的时候可溶性糖含量较对照有所降低[24]。此外,UV-C辐射采后香梨既能增加果实硬度,又会降低细胞膜透性和丙二醛(malondialdehyde,MDA)含量,还可以促进还原性糖的积累和多酚的合成,进而有效的提高香梨藏期间的品质[25]。水蜜桃果实在UV-C辐射处理后,多酚氧化酶(polyphenoloxidase,PPO)活性降低[26],其呼吸高峰值降低,峰值出现时间推迟,减缓果实软化的进程;UV-C辐射处理香菇会抑制其MDA含量的上升,促进类黄酮的合成[27]。由于植物多酚是重要的非酶抗氧化物质,可以推测适宜的紫外线辐射降低细胞膜透性和MDA含量,可能与辐射提高了多酚物质的含量有关。
2.2 紫外线辐射对植物多酚种类及含量的影响
近些年,随着国家供给侧结构性改革的不断推进,以及外部宏观形势的改变,国内化肥领域遇到了巨大的困难和挑战。化肥作为农业生产中必不可少的资料,对于作物的生长具有着重要的意义。传统肥料产业方面,因传统肥料肥效期短,且养分容易流失,已经成为制约我国农业发展的主要原因,如今面临着政策和市场的双重挑战,转型升级已经成为产业发展当务之急。而新型肥料具有高效、绿色、环保等优点,是实现农业发展和环境保护的强有力助推,新型肥料也将迎来一个势头强劲的产业风口。
当植物遭受紫外线逆境时,其多酚等次生代谢物质含量会明显增加,但紫外线的辐射剂量和辐射时间需要严格控制。如短暂的UV-C辐射会诱导大豆产生更多的次生代谢物,提高总酚含量[28]。紫外线辐射芹菜悬浮细胞,能够有效诱导细胞中类黄酮及其衍生物的积累,并促进了初生代谢向次生代谢的转化,提高了芹菜悬浮细胞的抗性[18]。采后UV-C照射,能有效提高无核小蜜橘的酚类物质含量和其抗氧化能力[29]。紫外线辐射能够诱导葡萄果实中总酚、总花色苷、总类黄酮的积累,并且使类黄酮代谢入口酶-CHS转录水平和蛋白含量明显增加[9]。采后柠檬果实经UV-B辐射后其总酚和总类黄酮含量增加[30],UV-B辐射同样会诱导莴苣叶片花色苷的积累,且花色苷相关基因(如CHS、F3H和DFR)的表达量与花色苷的积累成正相关[31]。
马铃薯叶片内的类黄酮含量随着UV-B辐射剂量的增加和处理时间的持续而不断增加,并且存在着明显的品种差异[32]。2.4 kJ/m2的UV-C辐射虎杖嫩叶时,白藜芦醇含量会增加1倍,虎杖苷含量也会有明显提高,但随着紫外线剂量的增加其增长趋势有所下降,佐证了UV-C辐射会诱导植物产生白藜芦醇类植物抗毒素[33]。此外,紫外线对植物多酚含量的诱导还与植物的生长发育时期密切相关,UV-C辐射可提高幼果期(花后20-60d)葡萄果实中黄烷醇类多酚合成关键酶的活性,进而合成更多的黄烷醇类多酚,但随着果实的进一步发育,其诱导效率持续下降[34],同时存在照射剂量依赖性[35]。在葡萄发育过程中给以短时间、低剂量的UV-C辐射会明显增加葡萄总糖和花色苷含量,促进类黄酮、黄酮醇类多酚的合成,进而提高果实的综合品质[36]。
UV-C辐射诱导葡萄果皮和果肉中总黄烷-3-醇的积累,却导致原花色素含量降低[35],其原因有两方面:一是原花色素参与体内自由基清除而消耗;二是UV-C辐射抑制原花色素合成相关的基因表达。研究表明可见光主要促进葡萄中原花色素的生物合成,紫外线辐射则特异性的促进黄酮醇等类黄酮的生物合成[9],最高可增加1倍左右,合成的类黄酮可有效地吸收紫外线,降低或避免植物组织受到伤害[37]。类黄酮又被称为“维生素P”,其自然界中存在形态多达5000多种,根据结构差异,类黄酮主要分为黄酮醇、黄烷酮、黄酮、黄烷醇、原花青素和花青素六大类[38]。
2.3 紫外线辐射对植物多酚合成相关基因表达的影响
紫外线辐射对多酚含量的影响,主要是紫外线引起多酚合成底物及合成途径中关键酶活性的提高及相关酶基因的表达所致。Logemann[18]等研究表明UV辐射提高了西芹悬浮细胞酚类物质合成的底物相关酶的基因表达量,如6-磷酸葡萄糖脱氢酶(6-phosphate dehydrogenase,6-PDH)、DAHPS、乙酰CoA氧化酶(acetyl CoA oxidase,ACO)、PAL、CHS。同时UV-A辐射会影响莽草酸途径中催化分支酸进入Phe/Tyr支路的关键酶分支酸变位酶(chorismate mutase,CM)基因的表达,且随剂量的增加呈现先上升后下降的趋势[39]。葡萄果实莽草酸途径和后分支酸途径中大部分基因都可以在紫外线的辐射下增加其表达量,尤其VvDAHPS-1和VvDAHPS-2。且UV-A辐射比UV-B辐射和UV-C辐射更能有效的提高莽草酸途径入口酶DAHPS的两个同源基因VvDAHPS-1和VvDAHPS-2的表达量[6],而且受紫外线辐射剂量的影响。Henstrand等通过荧光照射西芹悬浮细胞发现DAHPS和PAL的酶活性和基因表达量均明显的提高[40]。
Gonzalez-Aguilar等[41]认为釆后芒果经UV-C辐射后,果实中PAL活性增加,总酚、总类黄酮含量增加。UV-B辐射则促进了苹果中类黄酮途径CHS、DFR、F3H、LDOX、UFGT的基因表达[42],表明紫外线辐射能诱导类黄酮代谢途径中的相关酶做出积极响应。目前苯丙烷代谢途径和类黄酮代谢途径中关键酶基因,如PAL、CHS、CHI、F3H、DFR、ANS、UFGT、LDOX已成功克隆[43],并构建了带有GUS(b-glucuronidase)报告基因的CHS启动子,转化拟南芥[44]中。CHS基因启动子区域既含G-box序列光响应元件,也具有转录因子家族MYB的特异识别域[45],且转录因子家族MYB基因的启动子区含有与CHS相似的G-box序列光响应元件,说明通过UV辐射可诱导MYB基因的表达,进而调节花色苷生物合成相关基因的表达。
随着调控苯丙烷代谢和类黄酮代谢途径中的转录因子逐渐被鉴定及相关基因启动子的克隆与功能分析,对UV辐射诱导植物多酚产生的分子机制进一步深入[39]。在拟南芥和矮牵牛等模式植物上的研究表明,类黄酮途径的调控主要由MYB、bHLH、WD40这三类转录因子的协同作用。植物MYB蛋白具有可结合DNA的MYB结构域,且高度保守。MYB蛋白中R基序中第三个α螺旋能识别DNA,并且可结合到DNA双螺旋的大沟结构内,能使MYB精确地结合到特定DNA序列上[46-47]。Takos等分离出调控苹果果皮花青苷生物合成的MdMYBl,而且该基因的转录丰度受光照诱导与花青苷的积累呈正相关[48];经进一步研究证实光照可增强MdMYB10蛋白的稳定性,促进花青苷的积累[49]。作为植物中第2大转录因子家族的bHLH,其基序具有高度的保守性,可结合基因启动子序列中的六核苷酸E-box基序,以此来调控靶基因的转录[47]。bHLH转录因子既可以直接与MYB家族相互作用,共同调控花青苷的合成;也可以通过诱导VvANR,VvCHI和VvMYCl启动子的活性,如MYBPAl-VvMYCl,进而增强花青苷的合成[50]。但WD40蛋白本身不具有催化功能,而是通过与其他蛋白进行可逆的相互作用,进而参与不同的代谢途径[51]。随着研究的深入,参与类黄酮生物合成调控的WD40陆续在苜蓿(MtWD40-1)[52]、葡萄(VvWDRl)[53]、苹果(MdTTG1)[54]中分离出来。
植物多酚类物质的生物合成受到光照、紫外线、温度等多种外界因素的影响,但目前研究仅表明MYB家族的转录因子受光照的诱导,如AtMYB15的过量表达可提高莽草酸途经中绝大多数合成相关酶基因在转录水平上的表达量。因此,AtMYB15对该途径中的合成酶基因在转录水平有调控作用,主要是由于花色苷生物合成相关基因的启动子中含有一个或多个与AtMYB15结合的AC元件[55]。一定剂量的紫外光/蓝光使hy4-2.23型拟南芥突变体叶片内查耳酮合成酶(CHS)基因在转录和翻译水平上得到显著的诱导和促进[56]。且蓝光对转基因植株中GUS活性的增强效应明显大于UV-B和UV-A[44],即光质对CHS转录稳定性存在影响。而bHLH、WD40家族是否受光照或紫外线的诱导还有待进一步的研究,而且外界因子和MBW转录复合体在调控多酚类物质合成的过程中存在怎样的联系也尚未清楚。
此外UV-C辐射能提高赤霞珠葡萄果实白藜芦醇合成酶(stilbene synthase,STS)基因在转录水平上的表达,进而促进白藜芦醇含量增加,且该诱导作用在基因型、组织类型[58]及发育阶段[59]间存在差异。植物类黄酮生物合成途径的基因主要调控发生在转录水平上,包括在发育阶段和应对各种生物和非生物胁迫因子的转录调节[43]。
3 展望
综上可见,UV辐射在植物多酚合成调控中发挥着重要作用,它不仅影响多酚合成上游底物的基因表达与合成,更重要的是控制多酚合成途径中关键酶基因的表达和转录因子的功能,从而调控多酚的合成。但到目前为止,植物初生代谢和次生代谢间的调控枢纽还不清楚,多酚合成途径中的关键酶基因家族数量不甚明了,关键酶活性测定方法相对缺乏,该合成途径还存在诸多值得进一步探讨的问题。UV辐射对多酚合成的影响是不容置疑的,但UV辐射类型、剂量以及与植物基因型、器官类型及发育阶段的关系缺乏精确的把握,因此UV辐射对多酚合成途径的调控机制需进一步的明确。这些问题的阐述将为精准控制植物多酚化合物的合成,为高多酚类植物品种的选育和高多酚类植物的栽培技术调控措施提供理论依据。
[1] 李 元,李 想,何永美,等. UV-B辐射增强对植物-病原菌互作体系的影响及评价[J].植物生理学报,2015,51(10):1557-1566.
[2] Kerr JB, Mcelroy CT. Evidence for large upward trends of ultraviolet-B radiation linked to ozone depletion[J].Science,1993(262):1032-1034.
[3] Gao W, Zheng Y, Slusser JR,etal. Impact of enhanced ultraviolet-B irradiance on cotton growth, development, yield, and qualities under field conditions [J].AgricultureForestMeteorology, 2003, 120(1-4):241-248.
[4] 孙令强,李召虎,段留生,等. UV-B辐射对黄瓜幼苗生长和光合作用的影响[J].华北农学报,2006,21(6):79-82.
[5] Van TK, Garrard LA, West SH. Effects of UV-B radiation on net photosynthesis of some crop plants [J].Cropence, 1976, 16 (5):715-718.
[6] Zhang ZZ, Li XX, Chu YN,etal. Three types of ultraviolet irradiation differentially promote expression of shikimate pathway genes and production of anthocyanins in grape berries [J].PlantphysiologicBiochemistry, 2012(57):74-83.
[7] Amit KD, Deepti B, Vineet K,etal. Antioxidant potential and radioprotective effect of soy isoflavone against gamma irradiation induced oxidative stress [J].JournalofFunctionalFoods, 2012, 4(1):197-206.
[8] Tegelberg R, Julkunen-Tiitto R, Aphalo R. The effects of long-term elevated UV-B on the growth and phenolics of field-grown silver birch (Betulapendula) [J].GlobalChangeBiology, 2001(34):71-89.
[9] Koyama K, Ikeda H, Poudel PR,etal. Light quality affects flavonoid biosynthesis in young berries of Cabernet Sauvignon grape [J].Photochemistry, 2012(78):54-64.
[10] 欧阳光察,薛应龙.植物苯丙烷类代谢的生理意义及其调控[J].植物生理学通讯,1988,24(3):9-16.
[11] Hermann KM. The shikimate pathway as an entry to aromatic secondary metabolism [J].PlantPhysiology,1995,107(1):7-12.
[12] Hermann KM. The shikimate pathway: early steps in the biosynthesis of aromatic compounds[J].PlantCell,1995,7(1):907-919.
[13] Grotewold E. The science of flavonoids[M]. USA: Springer Press, 2006:71-90.
[14] 马君兰,李 成,魏 颖,等.异黄酮的生物合成途径及其调控[J].东北农业大学学报,2007,38(5):692-696.
[15] Fei H, Fang XX, Hu M,etal. Preparation and biological application of antibodies against leucoanthocyanidin reductase and anthocyanidin from grape berry [J].VitisJournalofGrapevineResearch,2009,48(2):69-75.
[16] Dixon RA, Paiva NL. Stress-induced phenylpropanoid metabolism[J].PlantCell, 1995(7):1085-1097.
[17] Bata O, Logemann E, Reinold S,etal.Extensive reprogramming of primary and secondary metabolism by fungal elicitor or infection in parsley cells [J].BiologicalChemistry,1998,379(8-9):1127-1135.
[18] Logemann E, Tavernaro A, Schulz W,etal.UV light selectively coinduces supply pathways from primary metabolism and flavonoid secondary product formation in parsley [J].ProceedingofNationalAcademyofSciences,2000,97(4):1903-1907.
[19] Peters DJ, Constabel PC.Molecular analysis of herbivore-induced condensed tannin synthesis:cloning and expression of dihydroflavonol reductase from trembling aspen (Populustremuloides) [J].PlantJournal,2002,32(5):701-712.
[20] 吴鲁阳,张振文,贺 猷.紫外线-B辐射增强对葡萄植株形态的影响[J].干旱地区农业研究,2006,24(4):87-89.
[21] 孙 莹,张振文,张景昱,等.紫外线-B辐射增强对葡萄浆果的影响[J].干旱地区农业研究,2010,28(1):164-167,205.
[22] 孙 莹,张振文,岳泰新,等.不同强度紫外线UV-B辐射对葡萄品质影响[J].中国酿造,2009(10):15-18.
[23] Savitch LV, Pocock T, Wilson KE,etal. Effects of growth under UV-A radiation and CO2 assimilation, carbon partitioning, PSII photochemistry and resistance to UV-B radiation in Brassicanapuscv. Topas[J].AustralianJournalofPlantPhysiological,2001, 28(3):203-212.
[24] 荣瑞芬,郭 堃,刘京萍,等.采后UV-C处理对桃果抗病性和品质的影响[J].食品科技,2008(1):55.
[25] 陆仙英.短波紫外线诱导采后香梨品质与抗氧化体系变化及其生理机制[D]杭州:浙江大学,2013:34-44.
[26] 陈奕兆,刚成诚,王亦佳,等.UV-C处理对水蜜桃常温保鲜效果的研究[J].天津农业科学,2012,18(4):11-14.
[27] 姜天甲,陆仙英,蒋振晖,等. 短波紫外线处理对香菇采后品质的影响[J].农业机械学报,2010,41(2):108-112.
[28] Wei ZF, Luo M, Zhao CJ,etal.UV-induced changes of active components and antioxidant activity in postharvest pigeon pea(CajanuscajanL. Millsp.)leaves [J].JournalofAgriculture&FoodChemistry,2013,61(6):1165-1175.
[29] Shen Y, Sun Y, Qiao L,etal.Effects of UV-C treatments on phenolic compounds and antioxidant capacity of minimally processed satsuma mandarin during refrigerated storage[J].PostharvestBiology&Technology,2013,76:50-57.
[30] Interdonato R, Rosa M, Nieva CB,etal.Effects of low UV-B doses on the accumulation of UV-B absorbing compounds and total phenolics and carbohydrate metabolism in the peel of harvest lemons[J].Environmental&ExperimentalBotany,2011,70(2-3):204-211.
[31] Park JS, Choung MG, Kim JB,etal.Genes up-regulated during red coloration in UV-B irradiated lettuce leaves[J].PlantCellReports,2007,26(4):507-516.
[32] 张新永,郭华春,艾星梅,等.增强UV-B辐射对彩色马铃薯相关生理生化特性的影响[J].生态环境学报,2009,18(2):664-668.
[33] 张 楠,刘建利.UV-C和水杨酸对虎杖叶中白藜芦醇和虎杖苷的诱导作用[J].西北植物学报,2008,28(5):990-996.
[34] 温鹏飞,邢延富,牛铁泉,等.UV-C对葡萄果实品质和植物多酚积累的影响[J].华北农学报,2013,28(2):133-138.
[35] 温鹏飞,牛兴艳,邢延富,等.UV-C对葡萄黄烷醇类多酚时空积累、LAR活性和组织定位的影响[J].园艺学报,2013,40(7):1251-1261.
[36] Ivanova V, Stefova M, Vojnoski B,etal. Identification of polyphenolic compounds in red and white grape varieties grown in R. Macedonia and changes of their content during ripening [J].FoodResearchInternational, 2011, 44(5):2851-2860.
[37] Stafford HA. Flavonoid evolution: an enzymic approach[J].PlantPhysiology, 1991(96):680-685.
[38] 舒 波,李伟才,刘丽琴,等. 调控丛枝菌根形成的相关信号物质研究进展[J].植物生理学报,2015,51(8):1185-1194.
[39] 初英娜,张珍珍,潘秋红. 紫外照射对葡萄果实莽草酸途径相关基因表达的影响[J].植物生理学通讯,2010,46(9):902-909.
[40] Henstrand JM, Mccue KF, Brink K,etal. Light and fungal elicitor induce 3-deoxy-D-arabino-heptulosonate 7-phosphate synthase mRNA in suspension cultured cells of parsley (PetroselinumcrispumL.) [J].PlantPhysiology, 1992(98):761-763.
[41] Gonzalez-Aguilar GA, Zavaleta-Gatica R, Tiznado-Hernandez ME. Improving postharvest quality of mango ‘Haden’ by UV-C treatment[J].PostharvestBiology&Technology, 2007(45):108-116.
[42] Ubi BE, Honda C, Bessho H,etal. Expression analysis of anthocyanin biosynthetic genes in apple skin: Effect of UV-B and temperature [J].PlantScience, 2006(170):571-578.
[43] 李春兰. 葡萄果实中莽草酸途径与多酚积累的关系[J].现代农业科学,2010(12):4.
[44] Jackson JA, Geeta F, Brown BA,etal. Isolation of Arabidopsis mutants altered in the light regulation of chalcone synthase gene expression using a transgenic screening approach [J].PlantJournalforcell&MolecularBiology, 1995, 8(3):369-380.
[45] Hartmann U, Sagasser M, Mehrtens F,etal. Differential combinatorial interactions of cis-acting elements recognized by R2R3-MYB, BZIP and BHLH factors control light-responsive and tissue-specific activation of phenylpropanoid biosynthesis genes[J].PlantMolecularBiology, 2005(57):155-171.
[46] Dubos C, Stracke R, Grotewold E,etal. MYB transcription factors inArabidopsis[J].TrendsinPlantScience, 2010, 15(10):573-581.
[47] Feller A, Machemer K, Braun EL,etal. Evolutionary and comparative analysis of MYB and bHLH plant transcription factors [J].PlantJournalforCell&MolecularBiology, 2011, 66(1):94-116.
[48] Takos AM, Walker AR. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples [J].PlantPhysiology, 2006, 142(3):1216-1232.
[49] Li YY, Mao K, Zhao C,etal.MdCOPlUbiquitin E3 ligases interact withMdMYBlto regulatelight-induced anthocyanin biosynthesis and red fruit coloration in apple [J].PlantPhysiology, 2012, 160(2):1011-1022.
[50] Hichri I, Heppel SC, Pillet J,etal. The basic Helix-Loop-Helix transcription factorMYC1 is involved in the regulation of the flavonoid biosynthesis pathway in grapevine [J].MolecularPlant, 2010, 3(3):509-523.
[51] Ouyang Y, Huang X, Lu Z,etal. Genomic survey, expression profile and co-expression network analysis of OsWD40 family in rice[J].BMCGenomics, 2012, 13(1):100.
[52] Pang Y, Wenger JP, Saathoff H,etal. A WD40 repeat protein from medicago truncatula is necessary for tissue-specific anthocyanin and proanthocyanidin biosynthesis but not for trichome development [J].PlantPhysiology, 2009.151(3):1114-1129.
[53] Matus JT, Poupin MJ, Canon P,etal. Isolation ofWDRandbHLHgenes related to flavonoid synthesis in grapevine (VitisviniferaL) [J].PlantMolecularBiology, 2010, 72(6):607-620.
[54] Brueggemann J, Weisshaar B, Sagasser M. AWD40-repeat gene fromMalus×domesticais a functional homologue ofArabidopsisthalianatransparent testa glabra1 [J].PlantCellReports, 2010, 29(3):285-294.
[55] Chen Y, Zhang X, Wu W,etal. Overexpression of the wounding-responsive geneAtMYB15 activates the shikimate pathway inArabidopsis[J].JournalofIntegratedPlantBiology, 2006, 48(9):1084-1095.
[56] Fuglevand G, Jackson JA, Jenkins GI. UV-B, UV-A and blue light signal transduction pathways interact synergistically to regulate chalcone synthase gene expression inArabidopsis[J].PlantCell, 1996(10):2347-2357.
[57] Jenkins GI, Long JC, Wade HK,etal. UV and blue light signaling: pathways regulating chalcone synthase gene expression inArabidopsis[J].NewPhytologist, 2001(151):121-131.
[58] Wang W, Tang K, Yang HR,etal.Distribution of resveratrol and stilbene synthase in young grape plants (VitisviniferaL. cv. Cabernet Sauvignon) and the effect of UV-C on its accumulation [J].PlantPhysiology&Biochemistry,2010(48):142-152.
[59] Pan QP, Wang L,Li JM. Amounts and subcellular localization of stilbene synthase in response of grape berries to UV irradiation [J].PlantScience,2010(176):360-366.
Effect of UV Radiation on the Metabolism and the Pathway of Plant Polyphenol
LIXue,PANXue-jun,ZHANGWen-e
(CollegeofAgriculture/GuizhouEngineeringResearchCenterforFruitCrops,GuizhouUniversity,Guiyang,Guizhou550025,China)
Plant polyphenol is a defensive substance against ultraviolet (UV) radiation and animportant product of secondary metabolism. It plays a rich physiological role in the process of plant growth and development and can resist the biotic and abiotic stresses, such as UV radiation and disease. UV radiation as an abiotic stress and plant polyphenolexist as mutual restraint and interaction each other. The synthetic route of plant polyphenol was reviewed and the effects of UV radiation on the growth and development, the content of polyphenol in plant, and the expression of related genes were emphatically evaluated in this paper. The results could provide more information for the relationship between UV radiation and the plant polyphenol, and how the UV radiation regulates the plant polyphenol synthesis.
UV radiation;Plant polyphenol synthesis;Growth and development;Polyphenol synthetic genes expression.
2016-07-27;
2016-10-18
国家重点科技支撑项目(2014BAD23B03);国家自然科学基金(Grant No.31560546)。
张文娥(1976-),女,博士,硕士生导师,主要研究方向:园艺植物种质资源生理生态评价及栽培;E-mail:agr.wezhang@gzu.edu.cn。
Q945.1;S443.3(273)
A
1008-0457(2016)06-0054-07 国际
10.15958/j.cnki.sdnyswxb.2016.06.009

