下调PAK5抑制紫杉醇诱导卵巢癌细胞自噬现象的研究
许红玲,张萍,李笛悠,孙中锋,林亚英
(1.安庆市立医院妇科,安徽 安庆 246000;2.上海交通大学医学院附属新华医院妇科,上海 200090)
下调PAK5抑制紫杉醇诱导卵巢癌细胞自噬现象的研究
许红玲1,张萍2,李笛悠2,孙中锋2,林亚英2
(1.安庆市立医院妇科,安徽 安庆 246000;2.上海交通大学医学院附属新华医院妇科,上海 200090)
目的 初步探讨下调PAK5的表达对化疗药物紫杉醇诱导CAOV-3卵巢癌细胞发生自噬和凋亡的影响。方法通过RT-qPCR检测PAK5在卵巢癌细胞中的mRNA表达情况。在CAOV-3卵巢癌细胞中通过下调PAK5表达后,CCK8实验检测紫杉醇对肿瘤细胞毒性改变,流式细胞术检测细胞凋亡率的改变,以及免疫印迹法检测自噬相关蛋白LC3B的表达变化。结果PAK5在不同卵巢癌细胞中高表达;在CAOV-3卵巢癌细胞中,与阴性对照siRNA组比较,PAK5 siRNA组中无论是PAK5的mRNA水平还是蛋白表达水平均明显降低,差异具有统计学意义(P<0.05);随着紫杉醇浓度的逐渐递增,紫杉醇对CAOV-3卵巢癌细胞毒性逐渐增加,而下调PAK5表达后,紫杉醇对卵巢癌细胞毒性增加更为明显,差异具有统计学意义(P<0.05);在紫杉醇处理的CAOV-3卵巢癌细胞中,下调PAK5的表达后可明显增加细胞的凋亡率,差异具有统计学意义(P<0.05);在紫杉醇处理的CAOV-3卵巢癌细胞中,下调PAK5的表达后可减少自噬相关蛋白LC3B蛋白的表达。结论PAK5过表达于不同的卵巢癌细胞中,下调PAK5基因可以促使自噬相关蛋白LC3B表达减弱,可能是通过抑制CAOV-3卵巢癌细胞发生自噬,促进细胞凋亡,从而提高了CAOV-3卵巢癌细胞对紫杉醇化疗的敏感性,减少紫杉醇获得性耐药的发生。
PAK5;卵巢癌;自噬;紫杉醇
卵巢癌在我国女性生殖系统恶性肿瘤中死亡率高居首位。随着我国老龄化人口的加剧,卵巢癌在我国的发病率呈现逐年增加的趋势[1],卵巢癌的经典化疗方案包括紫杉醇,但应用紫杉醇治疗过程中出现的获得性耐药却明显降低卵巢癌治疗的成功率。PAK5是丝氨酸/苏氨酸激酶(PAKs)家族成员之一,细胞中高表达的PAK5可以促进肿瘤细胞增殖、抗凋亡、迁移、降低肿瘤细胞对化疗药物的敏感性等多种恶性生物学行为的发生。前期研究表明,PAK5的过表达可促进紫杉醇诱导卵巢癌细胞耐药的形成[2]。而PAK5的上调可激活MAPK/ERK信号通路,后者在调节细胞自噬(autophagy)过程中起到关键作用[3-4]。目前认为自噬在肿瘤细胞的发生发展中起着双向效应[5]。研究表明,紫杉醇可以诱导卵巢癌细胞发生保护性自噬,抑制自噬可以提高卵巢癌细胞对紫杉醇的敏感性[6]。而关于PAK5基因、自噬以及化疗之间的关系鲜有报道。本研究通过检测PAK5在卵巢癌中的表达情况,检测紫杉醇对PAK5下调后CAOV-3卵巢癌细胞的毒性及凋亡的变化,以及紫杉醇对PAK5下调后CAOV-3卵巢癌细胞自噬水平的变化,初步探讨下调PAK5的表达对化疗药物紫杉醇诱导CAOV-3卵巢癌细胞发生自噬和凋亡的影响。
1 材料与方法
1.1 主要材料与试剂 卵巢癌细胞系HO-9810、SKOV-3、CAOV-3以及正常胃黏膜上皮细胞系GES-1购自中国科学院上海细胞库,在含10%胎牛血清的DMEM培养液(美国Gibco公司)、37℃、5%CO2、饱和湿度培养箱中培养。紫杉醇由辰欣药业股份有限公司提供(中国山东省),制成溶液,4℃储存。X-treme GENE HP DNA及X-treme siRNA转染试剂购自Roche公司,Annexin V/PI双染法检测试剂盒及Cell Counting Kit-8(简称CCK-8)试剂均购自上海碧云天生物技术有限公司,兔抗人微管相关蛋白LC3B抗体、抗GAPDH抗体及辣根过氧化物酶标记的山羊抗兔二抗均购自Cell Signal Technology公司。
1.2 siRNAs的转染 靶向PAK5的siRNA序列及无关干扰序列即阴性对照NC siRNA由百奥迈科生物技术有限公司合成。PAK5 siRNA的序列(5'-3')如下:正义链GGCGUACAGUGAAAGUGAAdTdT,反义链UUCACUUUCACUGUACGCCdTdT。NC siRNA的序列(5'-3')如下:正义链UUCUCCGAACGUGUCACDUdTdT,反义链ACGUGACACGUUCGGAGAAdTdT。按照X-treme siRNA转染试剂说明书转染CAOV-3卵巢癌细胞。
1.3 定量逆转录聚合酶链反应(RT-qPCR)mRNA的定量分析 使用TRIzol提取细胞中所有RNA,从100 ng总的RNA中合成其互补(c)DNA。在Bio-Rad CFX96实时PCR机器中进行PCR反应。PAK5的引物序列:上游,5'-CCGATACTACTGCTGACTACAC-3';下游,5'-GCTCTCTGATACTCCCACTTG-3'。GAPDH的引物序列:上游,5'-GCACCGTCAAGGCTGAGAAC-3';下游,5'-TGGTGAAGACGCCAGTGGA-3'。通过Bio-Rad处理器2.1软件检测其Ct值,进行数据分析,每组蛋白重复3次。
1.4 Western blot方法检测紫杉醇处理后细胞内LC3B表达的变化 CAOV-3卵巢癌细胞接种于6孔培养板中,每组均取20µg总蛋白,经SDS-PAGE分离、转膜和封闭后,分别加入兔抗人PAK5抗体或LC3B抗体过夜,加入辣根过氧化物酶标记的山羊抗兔二抗,室温孵育2 h,加入ECL工作液,用分子成像系统曝光、拍照。实验重复3次。
1.5 药物敏感性测定 将CAOV-3卵巢癌细胞制成5×104/mL悬液,100µL/孔接种于96孔板中,每组设3个复孔,分别转染阴性对照siRNA和PAK5 siRNA48 h后,分别加入不同剂量紫杉醇(2µg/mL、4µg/mL、6µg/mL以及8µg/mL、10µg/mL)处理细胞24 h后,加入10µL CCK-8溶液,5%CO2、37℃孵育1.5 h,利用酶标仪于450 nm波长测定每孔的光密度。
1.6 细胞凋亡试验 使用Annexin V/PI双染法检测试剂盒来检测细胞凋亡。即细胞在转染siRNA 48 h后,用10µg/mL的紫杉醇处理24 h后收集细胞,制成细胞悬液,200µL结合缓冲液重悬细胞,加入5µL PI溶液和10µL FITC-AnnexinV溶液,在暗盒中孵育达到15 min,加入300µL结合缓冲液,上流式细胞仪进行检测。实验重复3次。
1.7 统计学方法 实验数据用SPSS18.0统计软件包进行分析,使用GraphPad5.0绘制图资料。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 PAK5在卵巢癌细胞中高表达 RT-qPCR分析显示PAK5在卵巢癌细胞系中高表达。正常胃黏膜上皮细胞GES-1作为对照组,我们与GES-1细胞中PAK5 mRNA水平相比,PAK5 mRNA水平在CAOV-3卵巢癌细胞中是其2.73倍,HO-9810细胞中是其3.36倍,SKOV-3细胞中是其2.45倍,说明PAK5在卵巢癌细胞系中明显表达升高,差异具有统计学意义(P<0.05),见图1。
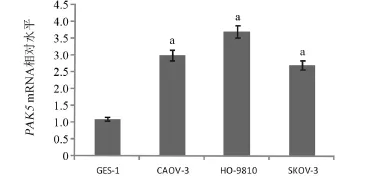
图1 PAK5高表达于不同卵巢癌细胞中
2.2 下调PAK5的表达增加卵巢癌细胞对紫杉醇的敏感性 通过细胞毒性实验观察PAK5的表达在卵巢癌细胞对紫杉醇化疗敏感性方面所起的作用。CAOV-3卵巢癌细胞分别转染50 nmol/L PAK5 siRNA和阴性对照siRNA达48 h后,RT-qPCR实验提示转染PAK5 siRNA组的PAK5 mRNA水平显著下调(图2),Western blot实验也提示了转染PAK5 siRNA组的PAK5蛋白水平显著下调(图3),差异均具有统计学意义(P<0.05)。转染的细胞随后分别用10µg/mL的紫杉醇处理24 h,CCK-8实验表明,PAK5的下调表达显著的提高了紫杉醇对CAOV-3细胞毒性,差异有统计学意义(P<0.05),见图4。
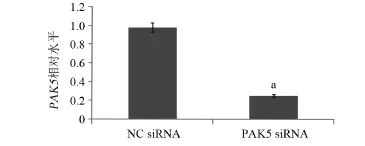
图2 利用siRNA干扰技术可明显下调PAK5 mRNA水平

图3 利用siRNA干扰技术可明显下调PAK5蛋白水平
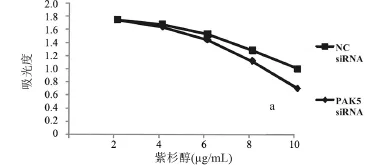
图4 PAK5的抑制表达增加紫杉醇对CAOV-3卵巢癌细胞的细胞毒性
2.3 PAK5的下调表达提高了紫杉醇诱导的卵巢癌细胞的凋亡 在CAOV-3卵巢癌细胞中,共设三组,分别为空白组、阴性对照组NC siRNA以及转染PAK5 siRNA组,再用10µg/mL的紫杉醇处理24 h,然后用Annexin V和PI染色。流式细胞术(图5)结果显示,转染PAK5 siRNA组细胞总凋亡率较空白组及阴性对照组siRNA明显升高(P<0.05),而空白组及阴性对照组siRNA细胞总凋亡率差异无统计学意义(P>0.05)。
2.4 下调PAK5的表达可能抑制了紫杉醇诱导的卵巢癌细胞自噬的形成 两组CAOV-3卵巢癌细胞在分别转染阴性对照siRNA和PAK5 siRNA后,用10µg/mL的紫杉醇同时处理上述两组细胞24 h后。Western blot检测结果(图6)显示在CAOV-3卵巢癌细胞中,PAK5siRNA可以显著下调PAK5蛋白的表达,下调PAK5的表达可显著地抑制自噬相关蛋白LC3B的表达,从而可能抑制了卵巢癌细胞自噬的形成。
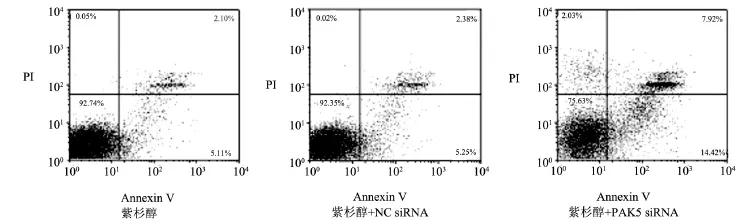
图5 下调PAK5表达增加紫杉醇处理的CAOV-3卵巢癌细胞凋亡率
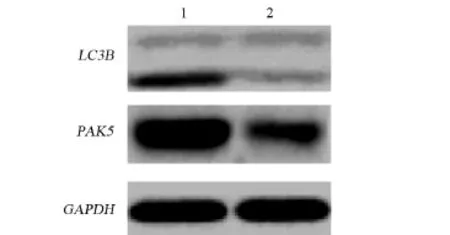
图6 下调PAK5的表达抑制了紫杉醇诱导CAOV-3卵巢癌细胞自噬的形成
3 讨 论
PAK5是丝氨酸/苏氨酸激酶(PAKs)家族中最具特点的成员,在多种实体肿瘤中呈现高表达状态[7-11]。体外研究发现,在胶质瘤细胞中,PAK5的敲除可能促进了肿瘤细胞的凋亡,而抑制了细胞的转移及侵袭[12]。同样在结肠癌细胞中,研究发现PAK5通过在丝氨酸112位直接磷酸化Bad,从而通过Akt信号通路间接导致丝氨酸136位的磷酸化,从而促进了肿瘤细胞凋亡的发生[13]。田聪等[10]认为PAK5在具有侵袭性和转移的卵巢癌细胞中是高度表达的,并且PAK5的高表达与卵巢癌细胞的紫杉醇化疗耐药有关。本研究同样发现在不同卵巢癌细胞中高表达PAK5,因而PAK5在卵巢癌细胞化疗敏感性方面的作用被进一步探究,结果发现通过下调PAK5的表达,显著地增强了紫杉醇对CAOV-3卵巢癌细胞的毒性,另外紫杉醇诱导的CAOV-3卵巢癌细胞凋亡率也明显增加。
此外,在CAOV-3卵巢癌细胞中,下调PAK5的表达可能抑制了紫杉醇诱导的细胞自噬的形成。当前认为自噬对于肿瘤细胞,起着“促进生存”及“诱导死亡”的双向作用。一些化疗药物如表柔比星、吡柔比星、5-Fu等,不但可诱导细胞发生凋亡,同时也观察到了自噬的出现[14-16]。在肿瘤治疗中,Wang[13]发现卵巢癌耐药性的产生来源于化疗诱导自噬的形成,而且通过敲低ERK抑制自噬后,则可提高卵巢癌对顺铂的敏感性。同样研究发现,紫杉醇可以诱导卵巢癌细胞发生保护性自噬,抑制自噬可以提高卵巢癌细胞对紫杉醇的敏感性[6]。紫杉醇属于新型抗微管类化疗药物,属于一线的化疗成分,临床上被用于治疗卵巢癌,乳腺癌、非小细胞肺癌以及许多其他的人类恶性肿瘤[17],紫杉醇主要通过稳定微管,最终导致细胞周期的停滞以及肿瘤细胞的凋亡性的死亡,来发挥它的抗肿瘤作用[18]。肿瘤细胞主要的特征之一就是其可以利用多种机制来逃避细胞凋亡的形成[19-20],而通过破坏肿瘤细胞凋亡机制也可以导致紫杉醇的耐药[21]。本研究发现,下调PAK5的表达显著地减少了自噬相关蛋白LC3B在紫杉醇处理的卵巢癌细胞中的表达水平,说明了下调PAK5的表达,可能抑制了紫杉醇诱导卵巢癌细胞自噬的形成。
已知自噬、凋亡以及坏死性细胞死亡之间存在着紧密的联系,类似的刺激可诱发凋亡或者是自噬,两者可能会相互调控、相互抑制,共同决定着细胞的最终命运。本研究发现在卵巢癌细胞中,下调PAK5的表达后提高了紫杉醇的细胞毒性作用,提高了细胞凋亡率,可能抑制了细胞的自噬活性。由此推断,PAK5可能在卵巢癌细胞存活以及化疗耐药性方面发挥着一个重要的作用,通过靶向抑制PAK5的表达可能提高了卵巢癌细胞化疗疗效,因此PAK5在卵巢癌细胞中充当着一个潜在的治疗靶点。
总之,本研究结果表明,PAK5高表达于卵巢癌细胞中,并初步探讨了下调PAK5基因可能是通过抑制紫杉醇诱导CAOV-3卵巢癌细胞自噬的发生,提高了CAOV-3卵巢癌细胞对紫杉醇的敏感性,促进细胞凋亡形成,从而减少紫杉醇获得性耐药的发生。因此,PAK5可能是卵巢癌的一个潜在的治疗靶点。
[1]邵婷,陈秀玮.卵巢癌的病因假说及危险因素和流行病学研究进展[J/CD].中华临床医师杂志:电子版,2013,7(19):8894-8897.
[2]Li D,Yao X,Zhang P.The overexpression of P21-activated kinase 5 (PAK5)promotes paclitaxel-chemoresistance of epithelial ovarian cancer[J].Molecular&Cellular Biochemistry,2013,383(1-2): 191-199.
[3]Shameem F,Trotter EW,Yaoyong L,et al.Targeted genetic dependency screen facilitates identification of actionable mutations in FGFR4, MAP3K9,and PAK5 in lung cancer[J].Proc Nat Acad Sci USA, 2013,110(30):12426-12431.
[4]Juan W,Gen Sheng W.Role of autophagy in cisplatin resistance in ovarian cancer cells[J].Journal of Biological Chemistry,2014,289 (24):17163-17173.
[5]Giansanti V,Torriglia A,Scovassi AI.Conversation between apoptosis and autophagy:“Is it your turn or mine?”[J].Apoptosis,2011,16 (4):321-333.
[6]Zhang SF,Wang XY,Fu ZQ,et al.TXNDC17 promotes paclitaxel resistance via inducing autophagy in ovarian cancer[J].Autophagy, 2015,11(2):225-238.
[7]Gu J,Li K,Li M,et al.A role for p21-activated Kinase 7 in the development of gastric cancer[J].FEBS J,2013,280(1):46-55.
[8]Han K,Zhou Y,Gan ZH,et al.p21-activated Kinase 7 is an oncogene in human osteosarcoma[J].Cell Biol Int,2014,38(12):1394-1402.
[9]田聪,汤丽娜,林峰,等.p21活化激酶5在骨肉瘤组织中的表达及临床意义[J].中国癌症杂志,2014,24(1):1-7.
[10]田聪,闵大六,姚阳.P21活化激酶7在肿瘤中的研究进展[J].癌症进展,2014,12(1):45-48.
[11]Wang X,Gong W,Qing H,et al.p21-activated Kinase 5 inhibits camptothecin-induced apoptosis in colorectal car-cinoma cells[J]. Tumour Biol,2010,31(6):575-582.
[12]Han ZX,Wang XX,Zhang SN,et al.Downregulation of PAK5 inhibits glioma cell migration and invasion potentially through the PAK5-Egr1-MMP2 signaling pathway[J].Brain Tumor Pathology, 2014,31(4):234-241.
[13]Wang X.p21-activated kinase 5 inhibits camptothecin-induced apoptosis in colorectal carcinoma cells[J].Tumor Biology,2010,31(6): 575-582.
[14]Sun WL,Chen J,Wang YP,et al.Autophagy protects breast cancer cells from epirubicin-induced apoptosis and facilitates epirubicin-resistance development[J].Autophagy,2011,7(9):1035-1044.
[15]Li KL,Chen X,Liu C.Pirarubicin induces an autophagic cytoprotective response through suppression of the mammalian target of rapamycin signaling pathway in human bladder cancer cells[J].Biochemical and Biophysical Research Communications,2015,460(2): 380-385.
[16]Bijnsdorp IV,Peters GJ,Temmink OH,et al.Differential activation of cell death and autophagy results in an increased cytotoxic potential for trifluorothymidine compared to 5-fluorouracil in colon cancer cells[J].Int J Cancer,2010,126(10):2457-2468.
[17]Mekhail TM,Markman M.Paclitaxel in cancer therapy[J].Expert Opin Pharmacother,2002,3(6):755-766.
[18]Blagosklonny MV,Fojo T.Molecular effects of paclitaxel:myths and reality(a critical review)[J].Int J Cancer,1999,83(2):151-156.
[19]Kerr JFR,Winterford CM,Harmon BV.Apoptosis.Its significance in cancer and cancer Therapy[J].Cancer,1994,73(8):2013-2026.
[20]Hanahan D,Weinberg RA.The hallmarks of cancer[J].Cell,2000, 100(1):57-70.
[21]Johnstone RW,Ruefli AA,Lowe SW.Apoptosis:A link between cancer genetics and chemotherapy[J].Cell,2002,108(2):153-164.
Downregulation of PAK5 inhibits paclitaxel-induced autophagy in ovarian cancer cells.
XU Hong-ling1,ZHANG Ping2,LI Di-you2,SUN Zhong-feng2,LIN Ya-ying2.1.Department of Gynaecology,Anqing Hospital,Anqing 246000, Anhui,CHINA;2.Department of Gynaecology,Xinhua Hospital Affiliated to Shanghai Jiaotong University School of Medicine,Shanghai 200090,CHINA
ObjectiveTo investigate the effect of downregulation of PAK5 on paclitaxel-induced autophagy and apoptosis in human ovarian cancer cell line(CAOV-3).MethodsPAK5 mRNA quantification in ovarian cancer was detected by RT-qPCR.In CAOV-3 cells,after down-regulation of PAK5 expression,the change of CAOV-3 cells cytotoxicity by paclitaxel was detected by Cell Counting Kit-8(CCK8),and cell apoptosis was detected by flow cytometry.The expression changes of autophagy-related protein(LC3B)were detected by western blotting.ResultsThe PAK5 is overexpressed in ovarian cancer cell line.PAK5-siRNA can significantly downergulate the expression of PAK5 gene in CAOV-3 cells(P<0.05).Silencing PAK5 significantly increases the sensitivity of CAOV-3 cells to paclitaxel(P<0.05). PAK5 knockdown enhances paclitaxel-induced apoptosis in ovarian cancer,and PAK5 silencing reduces paclitaxel-induced autophagy in CAOV-3 cells.ConclusionThe PAK5 is overexpressed in ovarian cancer cell line,and downregulation of PAK5 gene can inhibit LC3B expression and may promote apoptosis through inhibition of autophagy in CAOV-3 cells.
PAK5;Ovarian cancer;Autophagy;Paclitaxel
R737.31
A
1003—6350(2016)23—3798—04
10.3969/j.issn.1003-6350.2016.23.005
2016-06-27)
张萍。E-mail:727745108@qq.com

