VitaePro抑制线粒体通路对心肌细胞缺氧损伤的保护作用
赵蓓,官功昌,刘红梅
(陕西省人民医院医保办1、心脏内科2、护理部3,陕西 西安 710068)
VitaePro抑制线粒体通路对心肌细胞缺氧损伤的保护作用
赵蓓1,官功昌2,刘红梅3
(陕西省人民医院医保办1、心脏内科2、护理部3,陕西 西安 710068)
目的 探讨VitaePro对心肌细胞缺氧损伤的保护作用及其机制。方法将大鼠心肌细胞H9c2分为四组:正常对照组(H9c2)、缺氧损伤模型组(Hypoxia+H9c2)、红花油组(Safflower oil+hypoxia+H9c2)和VitaePro组(VitaePro+hypoxia+H9c2)。MTT和流式细胞术分别检测心肌细胞增殖和凋亡情况;Western blot检测线粒体凋亡通路相关蛋白的表达,包括B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关蛋白X(BAX)、凋亡蛋白-3(Caspase-3)和裂解后的Caspase-3(Cleaved caspase-3);试剂盒检测各组心肌细胞硫代巴比妥酸反应物(TBARS)水平、丙二醛(MDA)含量和超氧化物歧化酶(SOD)的活性。最后,Western blot检测心血管损伤标志蛋白的表达,包括心肌肌钙蛋白T(cTnT)、肌红蛋白(Mb)、肌酸激酶同工酶MB(CK-MB)和乳酸脱氢酶(LDH)。结果缺氧损伤模型组与对照组比较,细胞增殖显著下降,凋亡率显著增高(4.2%~14.6%,P<0.05),Bcl-2蛋白的表达明显降低,Bax和Cleaved caspase-3的表达显著升高(P<0.05),TBARS水平和MDA含量升高(P<0.05),SOD活性从44.9 U/mg降低到13.2 U/mg,心血管损伤标志蛋白cTnT、Mb、CK-MB和LDH的表达显著升高(P<0.05)。VitaePro组与缺氧组相比,细胞的增殖升高(P<0.05),凋亡率降低到6.4%,Bcl-2的表达升高,Bax和Cleaved caspase-3的表达明显降低(P<0.05),TBARS水平和MDA含量明显降低(P<0.05),SOD活性增大到41.0 U/mg,cTnT、Mb、CK-MB和LDH的表达显著降低(P<0.05)。结论VitaePro可以通过抑制线粒体凋亡通路和通过抗氧化作用减轻缺氧诱导的大鼠心肌细胞损伤。
大鼠心肌细胞H9c2;VitaePro;缺氧;线粒体通路;机制
心肌组织对缺氧具有高度敏感性,与缺氧有关的心血管疾病包括心肌缺血、脑卒中和心肌梗塞等[1]。缺氧引发心肌组织大量的氧化自由基堆积,造成心肌细胞的损伤和凋亡[2-3]。目前已有一些抗氧化自由基的药物被用于心血管疾病治疗的研究中,如银丹心脑通可通过增强抗氧化酶活性和降低丙二醛水平增加抗氧化能力,从而保护心肌细胞免受缺血再灌注损伤[4];红景天甙也能激活Bcl-2有关的生存信号通路,抑制心肌细胞中过度的氧化压力[5]。VitaePro是虾青素、叶黄素和玉米黄素三种类胡萝卜素溶解在红花油(Safflower oil)中形成的新型抗氧化剂[6]。已有研究证实叶黄素和玉米黄素能抵抗活性氧和自由基的形成,具有强抗氧化作用[7]。虾青素比斑蝥黄质、叶黄素、玉米黄素和β-胡萝卜素的抗氧化力强[8],能保护细胞免受氧化应激损伤[9]。已报道虾青素的抗氧化作用能通过抑制线粒体信号通路阻止细胞凋亡[10]。本实验通过建立心肌细胞缺氧模型,探究VitaePro对缺氧诱导的心肌细胞损伤的保护作用及其机制,从而为心血管梗塞的防治提供新的理论基础。
1 材料与方法
1.1 材料与试剂 大鼠心肌细胞H9c2(2-1)购于美国模式培养物保藏所(American Type Culture Collection,ATCC);DMEM-F12培养基、D-Hanks培养基购自美国GIBCO公司;胎牛血清购自HyClone公司;山羊抗鼠Bcl-2、Bax、Caspase-3、Cleaved caspase-3、cTnT、MB、CK-MB、LDH和β-actin一抗以及HRP标记的兔抗山羊二抗购自Pierce公司;硫代巴比妥酸反应物(Thiobarbituric reactive substances,TBARS)检测试剂盒购自Abnova公司;超氧化物歧化酶(Superoxide dismutase,SOD)和丙二醛(Maleic dialdehyde,MDA)检测试剂盒购自德国Sigma-Aldrich公司;VitaePro购自美国NIMIX公司。
1.2 心肌细胞培养及实验分组 大鼠心肌细胞H9c2(2-1)培养于含10%胎牛血清的DMEM-F12培养基中,置于37℃、CO2培养箱中培养。选取生长密度相似,生长状况良好的对数期心肌细胞进行随机分组:(1)正常细胞对照组(H9c2):未经缺氧处理,在含5%胎牛血清的培养基中培养;(2)缺氧损伤模型组(Hypoxia+H9c2):心肌细胞在不含血清的DMEM/F-12培养基中连续培养12 h后,用预先充入95%N2+5%CO2混合气体30 min的无糖D-Hanks培养液替代正常培养基,在经过95%N2+5%CO2混合气平衡的单向气流缺氧装置中,于37℃培养6 h;(3)红花油组(Safflower oil+ hypoxia+H9c2):预处理的D-Hanks培养液中添加入终浓度为0.25 mg/mL红花油后缺氧处理6 h,作为加药组的溶剂对照;(4)VitaePro处理组(VitaePro+hypoxia+ H9c2):预处理的D-Hanks培养液中加入终浓度为0.25 mg/mL的VitaePro抗氧化剂混合物(虾青素2%、叶黄素8.1%、玉米黄素1.23%溶解于红花油中)做同样的缺氧处理。细胞培养至48 h后半量换液,待细胞长至90%左右,按1:3的比例传代,以后每3 d进行一次全量换液,倒置显微镜观察各组细胞形态并拍照记录。
1.3 MTT法检测细胞增殖率 各组细胞在5% CO2于37℃培养条件下同步孵育,每组细胞设3个复孔,待细胞贴壁后给药处理继续培养48 h再取出各组样本,每孔加入20 μL MTT(5 g/L),弃去培养液,37℃继续孵育4 h后弃上清,每孔加入150 μL二甲基亚砜(DMSO)裂解,振荡15 min使结晶充分溶解,用酶标仪检测各组细胞吸光度值A570(630 nm校准),计算细胞增殖率,细胞增殖率=处理组A570/对照组A570× 100%。
1.4 流式细胞法检测心肌细胞凋亡 取分组处理后的心肌细胞,用4℃预冷的PBS缓冲液将细胞洗涤两次,加入0.25%胰酶消化,收集后迅速加入0.5 mL 1×Annexin V结合缓冲液,低速离心后弃掉上清,另加入结合缓冲液10 μL和PI 5 μL并混匀,37℃避光孵育30 min,在488 nm的激发波长和530 nm的发射波长的条件下,用流式细胞仪检测心肌细胞H9c2的凋亡率。
1.5 Western blot检测蛋白表达 将各组心肌细胞培养皿置于冰上,PBS漂洗两次,加入4℃预冷的RIPA细胞蛋白裂解液65 μL,低温条件下超声破碎得到细胞总蛋白,蛋白定量检测采用BCA法。总蛋白经SDS-PAGE电泳后用恒流湿法转膜。加入5%脱脂奶粉-TBST封闭液于室温封闭1 h,再分别加入1:3 000稀释的山羊抗鼠Bcl-2、Bax、Caspase-3、Cleaved caspase-3、cTnT、MB、CK-MB、LDH和β-actin一抗,4℃轻摇过夜;随后加入相应的HRP-标记的兔抗山羊二抗(1:100稀释),37℃恒温摇床孵育1 h。X线胶片曝光显影,Image-Pro Plus分析结果。蛋白的相对表达量用待测蛋白与β-actin的灰度值比值计算。
1.6 氧化应激指标TBARS含量测定 每组细胞用0.01 M PBS溶解制成细胞悬液,调节细胞浓度至2× 107cells/mL。将1 mL TBA:TCA:HCl=1:1:1的溶液混匀(其中含0.37%硫代巴比土酸、15%三氯乙酸和0.25 N HCl),沸水加热15 min后冷却,室温1 000 r/min离心10 min。将一系列2~10 nm的标准溶液(甲氧基丙烷)做类似处理,上清在535 nm波长处检测吸光值。
1.7 SOD活性测定 SOD的活性检测按照试剂盒的说明测定。酶工作液与水溶性四氮唑盐(WST)工作液加入每组心肌细胞中,37℃恒温孵育20 min,于540 nm波长处测吸光值。
1.8 MDA活性测定 MDA含量用酶联法测定,加入20%三氯乙酸(TCA)到各组细胞并孵育20 min,随后加入0.1 mol/L盐酸(HCl)和0.67%硫代巴比妥酸(TBA)于95℃水浴1 h。过氧化脂质降解产物中的MDA能缩合TBA,生成红色产物,离心后在532 nm波长处测吸光值。
1.9 统计学方法 采用SPSS15.0软件对实验数据进行统计学分析,计量数据以均数±标准差(±s)表示,实验数据除心肌细胞形态图为定性资料外,均为定量资料,两组间比较采用t检验,校验水准α=0.05;多组间比较,数据符合正态分布,方差齐性检验符合方差整齐的假设,行单因素方差分析及LSD检验,P<0.05表示差异有统计学意义。
2 结果
2.1 VitaePro处理抑制缺氧诱导的心肌细胞增殖率 各组细胞分别在倒置显微镜下观察细胞形态,由图1A可以看出,与正常细胞对照组相比,缺氧组细胞数目明显降低,部分细胞形态由长梭状皱缩为三角形或片状。红花油组细胞数目与缺氧损伤模型组无明显差异,VitaePro处理组细胞较缺氧组数目明显增多。MTT实验结果表明,与对照组相比,缺氧损伤模型组细胞增殖率明显下降(P<0.05)。与缺氧组比较,VitaePro处理组细胞增殖率明显升高(P<0.05),红花油组与缺氧损伤模型组细胞增殖率差异无统计学意义(P>0.05),见图1B。
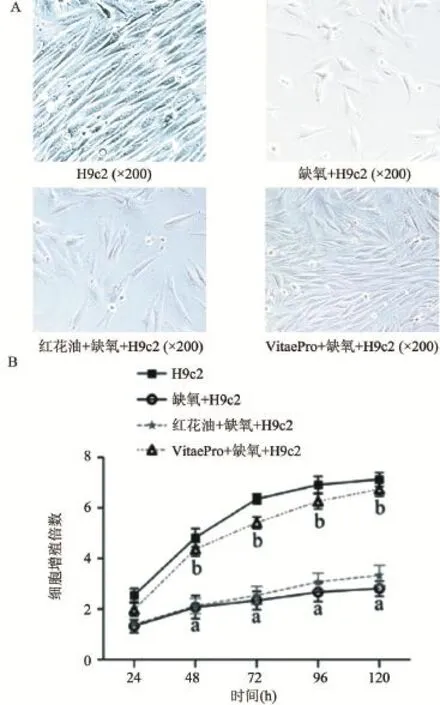
图1 VitaePro对缺氧诱导的大鼠心肌细胞增殖的影响
2.2 VitaePro处理抑制缺氧诱导的心肌细胞凋亡率升高 缺氧损伤模型组与正常细胞对照组比较细胞凋亡率显著增加,从4.2%提高到14.6%(P<0.05);与缺氧损伤模型组比较,VitaePro处理组处理缺氧诱导的心肌细胞凋亡受到明显抑制,凋亡率降低至6.4% (P<0.05),且VitaePro处理组与正常细胞对照组细胞凋亡率差异无统计学意义(P>0.05),见图2。
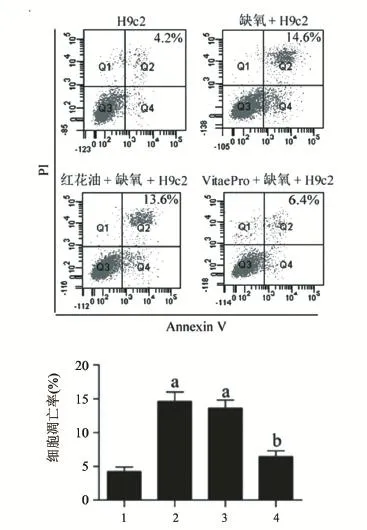
图2 VitaePro对缺氧诱导的大鼠心肌细胞凋亡的影响
2.3 VitaePro抑制缺氧诱导的心肌细胞线粒体凋亡信号通路中Bax表达升高,Bcl-2表达降低和凋亡标志蛋白Cleaved caspase-3的表达升高 为进一步研究VitaePro抑制缺氧诱导心肌细胞凋亡的机制,通过Western Blot检测各组细胞中线粒体凋亡信号通路标志蛋白Bax、Bcl-2、Caspase-3和Cleaved caspase-3的表达。与正常细胞对照组相比,缺氧损伤模型组中Bax和Cleaved caspase-3蛋白的表达显著升高,分别升高5.0倍和6.2倍(P<0.05),Bcl-2的表达显著降低11.0倍 (P<0.05),caspase-3的表达无明显变化;VitaePro处理组与缺氧损伤模型组相比,Bax和Cleaved caspase-3的蛋白表达水平分别降低2.1和2.4倍(P<0.05),Bcl-2水平显著升高,提高5.5倍(P<0.05),且VitaePro处理组与正常细胞对照组各通路蛋白的表达差异无统计学意义(P>0.05),见图3。
2.4 VitaePro抑制缺氧诱导的受损心肌细胞氧化应激指标TBARS升高,MDA水平升高,SOD水平降低 与正常细胞对照组比较,缺氧损伤模型组TBARS和MDA含量显著增加(P<0.05),SOD活性明显降低(P<0.05),TBARS水平从23.1 mmol/mg升高到74.2 mmol/mg,MDA含量从0.84 mmol/mg提高到2.9 mmol/mg,SOD活性从44.9 U/mg降低到13.2 U/mg。VitaePro处理可抑制缺氧引起的TBARS和MDA含量的增加(P<0.05),并显著提高SOD的活性(P<0.05),TBARS水平降低到31.2 mmol/mg,MDA含量降低到1.22 mmol/mg,SOD活性增大到41.0 U/mg,见图4。
2.5 VitaePro抑制缺氧诱导的心肌损伤标志蛋白的表达升高 Western blot检测心肌损伤标志蛋白cTnT、Mb、CK-MB和LDH的表达,结果表明,与正常细胞对照组比较,这四种标志蛋白的表达在缺氧组中显著升高(P<0.05),分别提高了15.2、8.5、1.7和9.2倍,VitaePro处理组与缺氧损伤模型组相比明显降低(P<0.05),分别降低5.4、3.2、2.0和3.6倍,且VitaePro处理组与正常细胞对照组的蛋白表达差异无统计学意义(P<0.05),见图5。
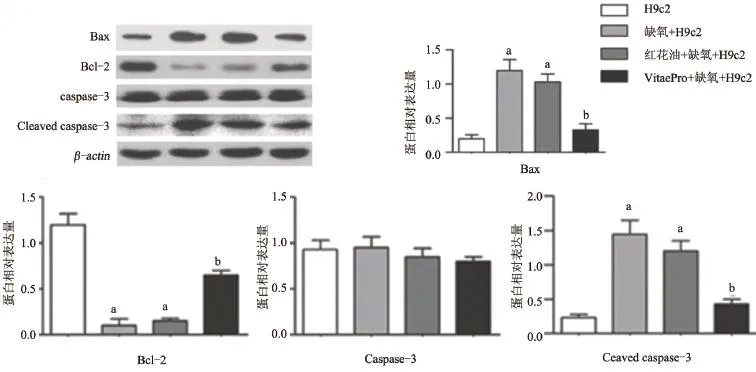
图3 各组心肌细胞中Bax,Bcl,Caspase-3和Cleaved caspase-3的表达水平
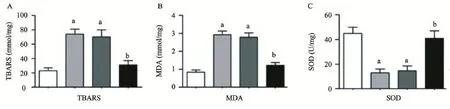
图4 VitaePro对缺氧诱导心肌细胞TBARS与MDA含量以及SOD活性的影响
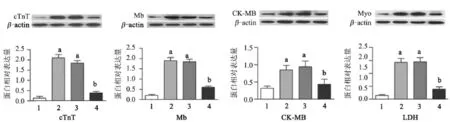
图5 VitaePro对心肌损伤标志蛋白表达水平的影响
3 讨 论
缺氧一直是心血管领域的研究热点之一。研究表明,氧自由基增多是缺氧诱导心肌细胞凋亡的重要因素,它们能直接损伤生物大分子,造成线粒体DNA (mtDNA)突变,引发线粒体代谢功能障碍[11],从而导致抗凋亡蛋白Bcl-2表达降低,促凋亡蛋白Bax蛋白表达升高,并且激活Caspases凋亡蛋白引起心肌细胞凋亡[12]。因此能抵抗氧自由基增多,调节凋亡相关因子表达的抗氧化物质在抑制缺氧引起的细胞损伤中具有重要作用。VitaePro是一种新型抗氧化物质,由虾青素、叶黄素和玉米黄素三种抗氧化物质组成,其中虾青素已被证实能通过抗氧化作用降低四氧嘧啶诱导的糖尿病鼠淋巴球细胞质中Ca2+水平,减少超氧阴离子、一氧化氮和过氧化氢的含量,从而抑制细胞凋亡[13]。本研究首先通过MTT和流式细胞术检测心肌细胞的增殖和凋亡,发现与缺氧心肌细胞相比,经VitaePro处理的细胞增殖率显著提高,凋亡降低。推测VitaePro能抑制缺氧引起的心肌细胞损伤。
线粒体凋亡通路是心肌细胞凋亡的标志性通路之一,主要包括Bcl-2家族的激活,细胞色素C(Cytc)的释放以及Caspase级联反应[14-15]。缺氧致使心肌细胞受损后,凋亡信号因子Bax可能改变线粒体外膜电压依赖性阴离子通道(VDAC)构象,开放线粒体膜通透性转运孔(MPTP),使细胞凋亡因子释放到胞浆[16],Bax也可能发生多聚化,形成膜通道口,使Cytc从线粒体释放到胞浆,从而导致细胞凋亡升高[17]。当缺氧使心肌细胞中凋亡因子作用于线粒体时,Bcl-2可与线粒体外膜的VDAC结合,关闭MPTP,抑制Bax在线粒体的定位和寡聚化,抵抗Cytc诱导的Caspase级联激活,从而抑制细胞凋亡[18]。研究表明虾青素能阻止促凋亡蛋白Bax和Bad的易位,影响Bcl蛋白从线粒体转移到胞质中,从而抑制细胞凋亡[10]。本研究结果表明,缺氧心肌细胞经VitaePro处理能下调Bax和Cleaved Caspase-3蛋白的表达,并上调Bcl-2蛋白的表达。证明VitaePro可以抑制缺氧心肌细胞中的线粒体凋亡通路,与Shen等[19]报道一致。
TBARS、MDA和SOD等氧化指标常用来反映机体氧化应激水平[20]。很多抗氧化剂已被证实能降低细胞中氧化应激水平,促进细胞存活[21-22]。研究表明,类胡萝卜素、叶黄素和玉米黄素是具有强抗氧化力的单药[23]。本研究结果发现,缺氧心肌细胞经VitaePro处理能降低细胞中的TBARS与MDA的含量,并显著提高SOD的活性。表明VitaePro的抗氧化作用可以显著降低缺氧引起的心肌细胞氧化应激,从而保护心肌细胞。
综上所述,我们的实验结果证实了缺氧会引起心肌细胞的损伤,但VitaePro可通过抑制心肌细胞内的线粒体凋亡通路,降低细胞内的氧化应激水平,从而促进心肌细胞的增殖并减少细胞凋亡。说明VitaePro对缺氧引起的心肌细胞损伤有明显的对抗和保护作用。由于时间有限,本实验仅在体外建立心肌缺氧损伤模型,进一步研究计划建立心肌缺氧损伤的动物模型,探究VitaePro在体内实验中对心肌细胞的保护作用。
[1]Lishmanov YB,Maslov LN,Sementsov AS,et al.Stress and infarct limiting effects of early hypoxic preconditioning[J].Ross Fiziol Zh Im I M Sechenova,2015,101(9):1013-1021.
[2]Sendoel A,Hengartner MO.Apoptotic cell death under hypoxia[J]. Physiology,2014,29(3):168-176.
[3]Zhao P,Li F,Gao W,et al.Angiotensin1-7 protects cardiomyocytes from hypoxia/reoxygenation-induced oxidative stress by preventing ROS-associated mitochondrial dysfunction and activating the Akt signaling pathway[J].Acta Histochem,2015,117(8):803-810.
[4]Wang W,Wang L,Yang H,et al.Protective effects of yindanxinnaotong capsule in a rat model of myocardial ischemia/reperfusion injury[J].J Tradit Chin Med,2014,34(6):699-709.
[5]Wang XL,Wang X,Xiong LL,et al.Salidroside improves doxorubicin-induced cardiac dysfunction by suppression of excessive oxidative stress and cardiomyocyte apoptosis[J].Journal of Cardiovascular Pharmacology,2013,62(6):512-523.
[6]Adluri RS,Thirunavukkarasu M,Zhan L,et al.Cardioprotective efficacy of a novel antioxidant Mix VitaePro against ex vivo myocardial ischemia-reperfusion injury[J].Cell Biochemistry and Biophysics, 2013,67(2):281-286.
[7]Musch DC.Evidence for including lutein and zeaxanthin in oral supplements for age-related macular degeneration[J].JAMA Ophthalmology,2014,132(2):139-141.
[8] Zhang XS,Zhang X,Zhou ML,et al.Amelioration of oxidative stress and protection against early brain injury by astaxanthin after experimental subarachnoid hemorrhage:Laboratory investigation[J]. Journal of Neurosurgery,2014,121(1):42-54.
[9]Li J,Wang F,Xia Y,et al.Astaxanthin Pretreatment Attenuates Hepatic Ischemia Reperfusion-Induced Apoptosis and Autophagy via the ROS/MAPK Pathway in Mice[J].Mar Drugs,2015,13(6): 3368-3387.
[10]Song X,Wang B,Lin S,et al.Astaxanthin inhibits apoptosis in alveolar epithelial cells typeⅡin vivo and in vitro through the ROS-dependent mitochondrial signalling pathway[J].Journal of Cellular and Molecular Medicine,2014,18(11):2198-2212.
[11]Vidone M,Clima R,Santorsola M,et al.A comprehensive characterization of mitochondrial DNA mutations in glioblastoma multiforme [J].The international Journal of Biochemistry&Cell Biology,2015, 63:46-54.
[12]Webster KA.Mitochondrial membrane permeabilization and cell death during myocardial infarction:roles of calcium and reactive oxygen species[J].Future Cardiol,2012,8(6):863-884.
[13]Otton R,Marin DP,Bolin AP,et al.Astaxanthin ameliorates the redox imbalance in lymphocytes of experimental diabetic rats[J]. Chemico-biological Interactions,2010,186(3):306-315.
[14]Zhu L,Han MB,Gao Y,et al.Curcumin triggers apoptosis via upregulation of Bax/Bcl-2 ratio and caspase activation in SW872 human adipocytes[J].Molecular Medicine Reports,2015,12(1):1151-1156.
[15]Choe JY,Park KY,Kim SK.Oxidative stress by monosodium urate crystals promotes renal cell apoptosis through mitochondrial caspase-dependent pathway in human embryonic kidney 293 cells: mechanism for urate-induced nephropathy[J].Apoptosis,2015,20 (1):38-49.
[16]Kumarswamy R,Chandna S.Putative partners in Bax mediated cytochrome-c release:ANT,CypD,VDAC or none of them?[J].Mitochondrion,2009,9(1):1-8.
[17]Dewson G,Ma S,Frederick P,et al.Bax dimerizes via a symmetric BH3:groove interface during apoptosis[J].Cell Death&Differentiation,2012,19(4):661-670.
[18]Kinnally KW,Peixoto PM,Ryu SY,et al.Is mPTP the gatekeeper for necrosis,apoptosis,or both?[J].Biochimica et Biophysica Acta (BBA)-Molecular Cell Research,2011,1813(4):616-622.
[19]Shen H,Kuo CC,Chou J,et al.Astaxanthin reduces ischemic brain injury in adult rats[J].The FASEB Journal,2009,23(6):1958-1968.
[20]Utrera M,Parra V,Estévez M.Protein oxidation during frozen storage and subsequent processing of different beef muscles[J].Meat science,2014,96(2):812-820.
[21]Cordero-Herrera I,Martín MA,Goya L,et al.Cocoa flavonoids protect hepatic cells against high-glucose-induced oxidative stress:Relevance of MAPKs[J].Molecular Nutrition&Food Research,2015,59 (4):597-609.
[22]Vurusaner B,Gamba P,Gargiulo S,et al.Nrf2 antioxidant defense is involved in survival signaling elicited by 27-hydroxycholesterol in human promonocytic cells[J].Free Radic Biol Med,2015,91:93-104.
[23]Abdel-Aal ESM,Akhtar H,Zaheer K,et al.Dietary sources of lutein and zeaxanthin carotenoids and their role in eye health[J].Nutrients, 2013,5(4):1169-1185.
Protective effects of VitaePro inhibiting the mitochondrial pathways on hypoxia-induced cardiomyocytes injury.
ZHAO Bei1,GUAN Gong-chang2,LIU Hong-mei3.Department of Medical insurance1,Department of Cardiology2, Department of Nursing3,Shaanxi Provincial People's Hospital,Xi'an 710068,Shaanxi,CHINA
Objective To study the protective effect and mechanism of VitaePro on hypoxia-induced cardiomyocytes injury.MethodsRat myocardial cells H9c2 were randomly divided into four groups:H9c2 group(the control group),Hypoxia+H9c2 group,Safflower oil+hypoxia+H9c2 group and VitaePro+hypoxia+H9c2 group.Cell proliferation and cell apoptosis were detected by MTT and flow cytometry,respectively.The expression levels of mitochondrial apoptotic pathway related proteins were measured by Western blot,including B cell lymphoma 2(Bcl-2),Bcl-2-associated X(Bax),Caspase-3 and Cleaved caspase-3.The thiobarbituric acid reactive substance(TBARS)level,malondialdehyde(MDA)content and superoxide dismutase(SOD)activity were measured by corresponding kits.Finally,the expression of cardiovascular injury markers protein were measured by Western blot,including cardiac troponin T(cTnT),myohemoglobin(Mb),creatine kinase isozyme MB(CK-MB)and lactic dehydrogenase(LDH).ResultsCompared with control group,the cell proliferation in Hypoxia+H9c2 group was significantly decreased(P<0.05),and the cell apoptosis was significantly increased(4.2%~14.6%,P<0.05).The expression level of Bcl-2 was significantly decreased,while Bax and Cleaved caspase-3 were significantly increased(P<0.05).The level of TBARS and the content of MDAwere increased,and the activity of SOD was decreased from 44.9 U/mg to 13.2 U/mg.The expressions of cardiovascular injury markers cTnT,Mb,CK-MB and LDH were significantly increased(P<0.05).Compared with Hypoxia+H9c2 group,the cell proliferation in VitaePro+hypoxia+H9c2 group was increased(P<0.05),and the cell apoptosis was decreased to 6.4%.The expression level of Bcl-2 was increased,while Bax and Cleaved caspase-3 were significantly decreased(P<0.05).The level of TBARS and the content of MDA was significantly decreased(P<0.05),and the activity of SOD was increased to 41.0 U/mg.The expressions of cardiovascular injury markers cTnT,Mb,CK-MB and LDH were significantly decreased(P<0.05).ConclusionVitaePro can reduce hypoxia-induced myocardial cell injury in rats via inhibiting mitochondrial apoptosis pathway and through antioxidant effect.
Rat myocardial cells H9c2;VitaePro;Hypoxia;Mitochondrial pathways;Mechanism
R-332
A
1003—6350(2016)12—1900—06
10.3969/j.issn.1003-6350.2016.12.003
2015-12-31)
官功昌。E-mail:huiqingguohn@163.com

