以模型化合物研究MTG重汽油轻质化的热力学分析
马 杨,赵德智*,宋官龙,李 治,顾绍兴
(1.辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001;2.中石化洛阳工程有限公司,河南 洛阳471000;3.中石油大庆油田有限责任公司,黑龙江 大庆 163000)
以模型化合物研究MTG重汽油轻质化的热力学分析
马 杨1,赵德智1*,宋官龙1,李 治2,顾绍兴3
(1.辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001;2.中石化洛阳工程有限公司,河南 洛阳471000;3.中石油大庆油田有限责任公司,黑龙江 大庆 163000)
MTG重汽油的轻质化对于提高MTG工艺的经济效益具有重要意义。本文以苯和均四甲苯的混合物为模型化合物研究了MTG重汽油中均四甲苯转化为C10以下芳烃化合物的轻质化过程,利用热力学原理计算了摩尔反应焓变、摩尔吉布斯自由能变和平衡常数。计算结果表明,在温度600~800K,各反应可以自发进行,但平衡常数小。温度和压力的改变反应系统平衡组成的影响不能显著,说明反应系统不是受热力学控制的。因此,系统很大程度受到动力学因素的影响,反应速率直接影响原料转化率和产物组成,在实际反应过程中,反应条件和催化剂的选择显得尤为重要。
甲醇制汽油(MTG);重汽油;均四甲苯;热力学计算
甲醇制汽油(MTG)是指在一定工艺条件下,甲醇原料蒸汽通过分子筛催化剂床层进行脱水、聚合及异构等过程转化为C11以下烃类混合物 (汽油)的过程。MTG工艺的汽油产品抗爆震性好,不含硫、氯及重金属等石油基汽油常含有的杂质,而有用的组分与石油基汽油却很相似[2-3]。
在MTG反应过程中,一旦苯环在有未反应的甲醇存在的情况下形成,就会迅速被烷基化成四甲基苯,而分子直径较小的均四甲苯比其同分异构体在ZSM-5孔道内的扩散速度更快[4],因此,均四甲苯在MTG产物中的含量明显高于其他C10芳烃。均四甲苯含量高是MTG合成油的重要特点之一。
均四甲苯又名1,2,4,5-四甲基苯,俗称“杜烯”。均四甲苯的熔点高达80℃,它的存在使汽油的馏程干点达到213℃;在发动机中不完全燃烧会产生苯等致癌物质;低温启动时,在发动机汽化器内结晶而形成沉淀,会导致输油管路和喷油器的堵塞,严重影响汽油的使用;当均四甲苯在汽油中的含量低于2%,便无以上负面影响[5]。
MTG重汽油一般是指由MTG合成油产品中馏出温度在177℃以上的馏分油。重汽油在常温下呈固态,由约50%均四甲苯[6],20%三甲苯以及30%其他C9以上的芳烃所组成。重汽油在合成油产品的占比为10%~20%。能否合理利用这部分重汽油产品将直接关系到MTG工艺的经济效益[7]。
迄今为止,关于MTG重汽油处理的文献报道主要集中在催化剂开发和工艺改进等方面[8-12],尚未查阅到关于热力学分析的计算。本文以均四甲苯和苯的混合物为模型化合物,结合实验结果,在原子守恒的前提下,列出所生成产物,并推测可能发生的化学反应,然后计算体系的反应焓变、吉布斯自由能变、热力学平衡常数及产物平衡组成随温度和压力的变化规律,进而获得温度和压力对系统反应平衡组成的影响。
1 热力学计算
1.1 热力学模型
本课题的目的在于研究脱除MTG重汽油中的均四甲苯,即在给定工艺条件下,实现模型化合物中的均四甲苯转化为C5~C9芳烃化合物。
由于反应途径的选取不影响热力学平衡组成的计算结果,所以对体系的热力学计算做简化处理。首先确定10种物质参与该体系的计算,这些物质均为反应物或在反应产物中检测到的物质;其次,选择7个涵盖上述10种物质的反应,并规定所有方程的初始反应物均为1mol均四甲苯。反应方程式如下:

1.2 热力学计算过程[13-14]
1.2.1 反应焓变、吉布斯自由能和反应平衡常数的计算
温度298.15K下的反应的焓变△Hr(T),吉布斯自由能变△Gr(T)和熵变△Sr(T)分别由式(1)~(3)计算:

温度T下的反应焓变△Hr(T),吉布斯自由能变△Gr(T)和反应熵变△Sr(T)由式(4)~(7)计算:

反应平衡常数Kp由式(8)计算:
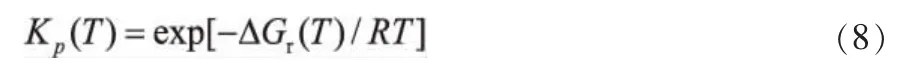
通过(1)~(8)式计算,可以得到系统中各反应在不同温度下的反应焓变△Hr(T),反应吉布斯自由能变△Gr(T)和反应热力学平衡常数Kp(T)。
1.2.2 反应平衡组成的计算
理论上,在给定的温度和压力条件下,无论从化学反应平衡或相平衡,体系的Gibbs自由能都将达到该条件下极小值。基于此原则,在物质守恒的条件下,将系统的Gibbs自由能描述为各组分组成的函数,当体系达到Gibbs自由能最小值时的组成即为理论上的平衡组成,进而可以将求理论平衡组成的问题简化为求解有约束条件的线性规划问题。此算法的优点在于组分数目和相数目可临时假设,而且无需知道体系内的具体反应历程和动力学可行性。
Gibbs反应器模型[15]根据系统的Gibbs自由能在体系平衡时达到最小值的原则,物质平衡组成的求解即转化为有线性约束的最优化问题:

式中,Gmin为最小吉布斯自由能,C和P分别为相数和组分数,nji和λji分别为组分j在i相中的物质的量和化学势,λji由(10)式求得:

式中,fji和是组分j在i相中的逸度和标准态逸度,为组分j在i相中的标准化学势。
当系统达到平衡时,G将达到最小值,并满足以下约束条件:
(a)物质守恒定律。当系统同时存在化学反应平衡和相平衡时,遵守原子守恒:

其中,k为元素数目,mjk为元素k在j组分中的物质的量,Nk为元素k在系统中总的物质的量。
当系统只有相平衡时,遵守物质的总量守恒:
其中,NjT为组分j总的物质的量。
(b)变量边界约束
当系统同时存在化学平衡和相平衡时:


当体系中只有相平衡时:

求解满足式(11)~(14)的关系式(9)的最小值问题就得到系统达到平衡时的物质组成。
1.3 热力学数据
由化学工程手册查得各反应物和生成物在298.15K下的标准摩尔生成焓△Hf(T)和标准摩尔生成吉布斯自由能△Gf(T)[16]。再查得各组分在200~1500K内若干温度点的定压热容值,应用二次曲线回归得到定压热容与温度的热力学函数关系式,形式为:

其中:a,b,c为系数;t=T/1000;T为温度,单位为K。(注:回归所得a、b、c仅适用与200~1500K温度范围内,全部曲线回归相关系数的平方R2≥0.998。)
所得数据列于表1。

表1 各反应组分热力学数据Table 1 Thermodynamic data of substances for reactions
2 结果与讨论
2.1 相关热力学参数的计算结果
不同温度下,各反应焓变见表2。从表2中可以看到,反应(3)、(5)、(6)为放热反应,反应(1)、(2)、(4)、(7)为吸热反应,且焓变在-5.95~21.46kJ·mol-1,均为热效应较低的反应。因此,调节反应温度不能对体系中某单一反应的进行起到明显的促进或者抑制作用。
不同温度下,各反应吉布斯自由能变和反应平衡常数见表2。从表2中可以看出,反应(1)~(6)在温度600~800K,吉布斯自由能变的计算结果均为负值,各反应平衡常数大于1,说明在此温度区间内反应可以自发进行。反应(7)在600K时的吉布斯自由能变为正值,在700K和800K时的吉布斯自由能变为负值,说明反应温度需要达到700K以上,反应(7)才会自发进行。
另一方面,体系中各反应的反应平衡常数均较小(<102),说明这些反应具有可逆性。虽然各反应平衡常数随温度的变化而有所增减,但在实际反应过程中,仍不足以通过调节反应温度来有选择性的获得某一特定产物组分。

表2 不同温度下各反应的焓变△Hr(T)、吉布斯自由能变△Gr(T)和热力学平衡常数Kp(T)Table 2 Enthalpy changes△Hr(T),Gibbs free energy changes△Gr(T)and equilibrium constantsKp(T)of reactions at different temperatures
2.2 热力学平衡组成计算结果
计算所采用的进料组成为m(苯)∶m(均四甲苯) =2∶3,这样做是为了更好的定性分析温度和压力对计算结果中平衡组成的影响。另外,若在计算中引入甲烷、乙烷和氢气,则计算结果产物集中为苯、甲苯和甲烷,造成计算结果与实际反应结果出现巨大差别,失去热力学计算的意义。在实际的反应过程中,之所以只生成微量甲烷,是因为虽然裂解反应的平衡常数比烷基转移的平衡常数大几个数量级,但在实际反应过程中,系统很大程度受到动力学因素的影响,反应进行的程度小,速度慢,只有在较高的温度条件下,满足了反应所需要的活化能才能发生。
2.2.1 温度对平衡组成的影响
表3为温度对产物组成的影响计算结果。由表3可知,在计算条件为常压,温度300~800K,原料苯和均四甲苯的转化率分别为89.08%和95.00%,温度每升高100K,均四甲苯的转化率降低0.1~0.2个百分点。产物组成中,乙基苯的质量分数从0.22%提高到4.66%,有比较明显的变化,这是因为在温度变化范围内,反应(7)的吉布斯自由能变发生了符号改变。1,3,5-三甲基苯、间二甲苯和对二甲苯的质量分数随温度的升高而略微降低,这是因为反应(3)、(5)、(6)为放热反应,由勒夏特列原理,升高温度,反应左移。1,2,3-三甲基苯、1,2,4-三甲基苯和邻二甲苯的质量分数随温度的升高而略微升高,这是因为反应(1)、(2)、(4)为吸热反应,升高温度,反应右移。然而,虽然温度的改变能在一定程度上调整产物的平衡组成,但是由于各反应的热效应比较微弱,不能通过调节温度而显著提高原料转化率或某特定产物的收率。

表3 温度对产物组成的影响Table 3 Effect of temperature on product composition
2.2.2 压力对平衡组成的影响
表4为压力对产物组成的影响。由表4可知,当计算条件为T=450K,压力由0.1MPa变化至2.1MPa。原料转化率和产物组成几乎没有发生改变,这是因为系统在反应前后分子个数没有改变,也没有常温为气态的物质生成,压力条件的改变几乎对产物的平衡组成不造成影响。

表4 压力对产物组成的影响Table 4 Effect of pressure on product composition
3 结论
(1)以苯和均四甲苯混合物为模型化合物研究了MTG重汽油脱均四甲苯轻质化的反应系统中,反应均为烷基转移反应,在温度为600~800K,吉布斯自由能变均为负值(除了反应(7)在600K),但热力学平衡常数较小。说明在该温度范围内各反应可以自发进行,但可逆程度大。
(2)温度和压力的改变不能显著影响反应系统的平衡组成,说明反应系统不是受热力学控制的。系统很大程度受到动力学因素的影响,反应速率直接影响原料转化率和产物组成,在实际反应过程中,催化剂和反应条件的选择显得尤为重要。
符号说明
△Hr(T)-反应焓变,kJ·mol-1;△Gr(T)-反应Gibbs自由能变,kJ·mol-1;△Sr(T)-反应熵变,kJ·mol-1·K-1;△Cp(T)-定压热容,J·mol-1·K-1;Kp(T)-反应平衡常数;Hf-标准摩尔生成焓,kJ· mol-1;Gf-标准摩尔生成Gibbs自由能,kJ·mol-1;Cp-定压摩尔热容,J·mol-1·K-1;μ-化学计量数;T-温度,K;p-压力,MPa;a,b,c-定压热容系数;N,n,m-物质的量,mol;λ-化学势,J·mol-1;f-逸度,Pa.
[1]Kuo J C W.Conversion of methanol to gasoline components[P].US:3931349,1976.
[2]唐宏青.甲醇制汽油工艺技术(上)[J].化工催化剂及甲醇技术,2008,(3):11-15.
[3]唐宏青.甲醇制汽油工艺技术(下)[J].化工催化剂及甲醇技术,2008,(4):19-23.
[4]Chester A W,Chu Y F.Treatment of effluent resulting from conversion of methanol to gasoline in order to decrease durene and produce distillate [P].US:4387261,1983.
[5]于海斌,王银斌,成宏,等.一种甲醇制汽油工艺重芳烃的轻质化方法[P].CN:102925211A,2013.
[6]葛志颖,王成.再谈MTG的发展机遇[J].化工设计通讯, 2013,39(3):1-6.
[7]陈玉民,温高峰.MTG工艺路线的选择方案[J].中氮肥, 2012,(6):1-9.
[8]Dwyer F G,Jr.H A.Treatment of effluent resulting from conversion of methanol to gasoline in order to decrease durene and produce distillate[P].US:4347397,1982.
[9]Han S,Chang C D.Process for reducing the durene content of effluent resulting from the catalytic conversion of C1-C4 oxygenates to gasoline[P].US:4973784,1990.
[10]Owen H,Venuto P B.Conversion of methanol to products Comprising Gasoline Boiling Components [P].US:3969426,1976.
[11]李学宽,张晔,吕占军,等.一种用于均四甲苯转化的催化剂及制法和应用[P].CN:103611564A,2014.
[12]王国兴,张先茂,陈宗杰,等.一种甲醇制汽油副产品重汽油的加氢改质催化剂及其制备方法 [P].CN:103801359A,2014.
[13]张宝珠,赵文平,王桂茹,等.甲醇制烃(MTH)反应热力学研究[J].分子催化,2012,26(6):545-553.
[14]吴文章,郭文瑶,肖文德,等.甲醇制丙烯反应的热力学研究[J].石油化工,2011,40(5):499-504.
[15]黄河,李政,倪维斗.Gibbs反应器模型及其计算机实现[J].动力工程,2004,24(6):902-907
[16]时钧,汪家鼎,余国琮,等.化学工程手册[M].北京:化学工业出版社,1996.
Thermodynamic analysis for decreasing durene in heavy MTG gasoline with model compounds
MA Yang1,ZHAO De-zhi1,SONG Guan-long1,LI Zhi2,GU Shao-xing3
(1.Liaoning Shihua University,Fushun 113001,China;2.Luoyang Petrochemical Engineering Co.,Ltd.,Luoyang 471000,China; 3.Daqing Oilfield Co.,Ltd.,CNPC,Daqing 163000,China)
The conversion of heavy MTG gasoline to light one is of great significance to improve economic performance of MTG technology.The mixture of benzene and durene was taken as model compounds to study the conversion process of MTG heavy gasoline to aromatics below C10.The molar enthalpy changes,molar Gibbs free energy changes and thermodynamic equilibrium constants were calculated by thermodynamic principles.The results indicate that each reactions in system could occur spontaneously, but their equilibrium constants are small.The changes of temperature and pressure barely affected the equilibrium of reaction system, which meants that the system is not thermodynamically controlled.The system could be thus mainly impacted by kinetic factors.Reaction rate immediately influences the rate of conversion and composition of products.Reaction conditions and catalysts would play a vital role during the real reaction process.
methanol to gasoline(MTG);heavy gasoline;durene;thermodynamics
TQ013.1;TQ214
:A
:1001-9219(2016)04-24-05
2016-11-16;
:中石化洛阳工程技术研发中心流化床MTG工艺研究项目 (项目编号:14041s410);
:马杨 (1987-),男,硕士研究生,电邮 241785 4211@qq.com;*
:赵德智,电话 15241329319,电邮fszhaodezhi@163.com。

