5-甲基-1,2,4-三唑-3-硫酮类糖苷化合物的合成及抗菌活性
王宏韫,刘金彪,卢俊瑞,应 明,杨旭云,杨树勋,马 瑶
(天津理工大学化学化工学院,天津300384)
5-甲基-1,2,4-三唑-3-硫酮类糖苷化合物的合成及抗菌活性
王宏韫,刘金彪,卢俊瑞,应明,杨旭云,杨树勋,马瑶
(天津理工大学化学化工学院,天津300384)
摘要在KOH/丙酮体系中,以5-甲基-4-N-取代苯基亚胺/胺基-1,2,4-三唑-3-硫酮为原料,与溴-α-D-四乙酰葡萄糖进行Kenigs-Knorr反应合成了10个新颖的化合物5-甲基-4-N-取代苯基亚胺基/胺基-3-S-( 2',3',4',6'-四-O-乙酰基-β-D-吡喃葡萄糖基) -1,2,4-三唑( 2a~2e,5a~5e) ;并在二氯甲烷/甲醇/甲醇钠混合体系中水解脱除乙酰基,得到10个新颖的化合物5-甲基-4-N-取代苯基亚胺基-3-S-(β-D-吡喃葡萄糖基) -1,2,4-三唑( 3a~3e)及5-甲基-4-N-取代苯基胺基-3-S-(β-D-吡喃葡萄糖基) -1,2,4-三唑( 6a~6e).化合物的结构均经核磁共振波谱( NMR)、红外光谱( IR)和高分辨质谱( HRMS)分析确证.生物活性测试结果表明,目标化合物对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和白色念珠球菌普遍具有较好的抗菌活性.化合物3d和3e对4种菌株的最小抑菌浓度相对较低,表现出较强的广谱抗菌活性.
关键词5-甲基-4-N-取代苯基亚胺/胺基-1,2,4-三唑-3-硫酮; S-β-D-糖苷;抗菌活性
E-mail: lujunrui@ tjut.edu.cn
刘金彪,男,工程师,主要从事仪器分析检测方面的研究.E-mail: liujinbiao007@ 126. com
1,2,4-三唑类希夫碱衍生物具有消炎[1,2]、抗菌[3~5]及抗癌[6~8]等生物活性,因此一直是杂环化学研究领域的热点.研究[9]表明,含有卤素和芳环的1,2,4-三唑类希夫碱化合物的生物活性尤为突出.
糖苷类药物具有水溶性好、化学性质稳定及抗菌谱广等特点[10],近年来已广泛应用于肿瘤、糖尿病、癫痫、血栓及关节炎等的临床治疗[11~13].糖苷类化合物还可用于修饰其它药物,与母体药物相比,修饰后的杂合分子的活性提高,副作用降低[14]且显示出较好的抗菌活性[15,16]、抗病毒活性[17,18]及抗癌活性[19,20].
本文根据生物活性叠加原理,将含有卤素和芳环的1,2,4-三唑类希夫碱和S-(β-D-吡喃葡萄糖基)进行拼接,合成了一系列含有1,2,4-三唑类希夫碱的硫糖苷化合物[5-甲基-4-N-取代苯基亚胺基-3-S-(β-D-吡喃葡萄糖基) -1,2,4三唑]以及希夫碱亚胺结构被还原为饱和键的1,2,4-三唑类硫糖苷化合物[5-甲基-4-N-取代苯基胺基-3-S-(β-D-吡喃葡萄糖基) -1,2,4三唑],并采用核磁共振波谱( NMR),高分辨质谱( HRMS)和红外光谱( IR)对其结构进行了表征.对希夫碱还原前后及乙酰基脱除前后的4组化合物进行了体外抑菌活性测试,受试菌株分别为大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌及白色念珠球菌.
1 实验部分
1.1试剂与仪器
水杨醛、D-葡萄糖和金属钠等试剂均为分析纯,购自天津市江天化工科技有限公司;大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和白色念珠球菌由天津医科大学微生物实验室提供.
Nicolet 205F型红外光谱仪(德国Bruker公司) ; AM400型核磁共振仪( TMS为内标,DMSO-d6为溶剂,瑞士Bruker公司) ; Xevo G2型Q-TOF高分辨质谱仪(美国Waters公司) ; X-4型精密显微熔点测定仪(北京福凯仪器有限公司) ; LRH-250A型生化培养箱(广东省医疗器械厂) ; RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂).
1.2实验过程
目标化合物的合成路线如Scheme 1所示.

a: R1=OH,R2=H; b: R1=Cl,R2=H; c: R1=Br,R2=H; d: R1=OH,R2=Cl; e: R1=OH,R2=BrScheme 1 Synthetic routes of the target compounds 3a—3e and 6a—6e
1.2.1 5-甲基-4-N-取代苯基亚胺基-3-S-( 2',3',4',6'-四-O-乙酰基-β-D-吡喃葡萄糖基) -1,2,4-三唑( 2a ~2e)及5-甲基-4-N-取代苯基胺基-3-S-( 2',3',4',6'-四-O-乙酰基-β-D-吡喃葡萄糖基) -1,2,4-三唑( 5a~5e)的合成参照文献[21,22]方法合成化合物2a~2e和5a~5e.
1.2.2 5-甲基-4-N-(取代苯基)亚胺基-3-S-(β-D-吡喃葡萄糖基) -1,2,4-三唑( 3a~3e)的合成在50 mL三口瓶中加入10 mL甲醇,搅拌下加入金属钠( 0. 023 g,1. 0 mmol)溶解,再加入10 mL二氯甲烷和化合物2a( 1. 0 mmol),于室温反应30 min,用薄层色谱( TLC)监测反应,展开剂为二氯甲烷/甲醇(体积比6∶1),反应结束后用732型强酸性阳离子交换树脂调节pH至中性,抽滤,将滤液浓缩后经硅胶柱层析分离后得目标化合物3a.采用相同方法合成目标化合物3a~3e.
1.2.3 5-甲基-4-N-(取代苯基)胺基-3-S-(β-D-吡喃葡萄糖基) -1,2,4-三唑( 6a~6e)的合成在50 mL三口瓶中加入10 mL甲醇,搅拌下加入金属钠( 0. 069 g,3. 0 mmol)溶解,再加入10 mL二氯甲烷和化合物5a( 1. 0 mmol),于室温反应30 min,用TLC监测反应,展开剂为二氯甲烷/甲醇(体积比6∶1),反应结束后将pH调节至中性,抽滤,将滤液浓缩后经硅胶柱层析分离后得目标化合物6a.采用相同方法合成目标化合物6a~6e.
目标产物及中间体的理化数据和质谱数据见表1,核磁共振数据见表2.
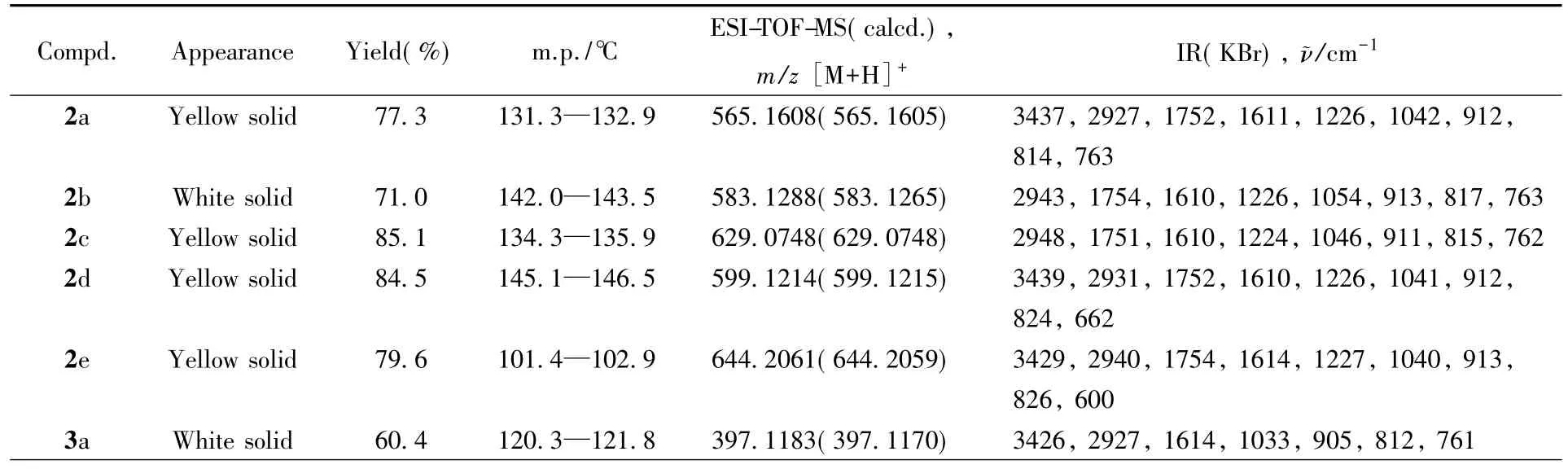
Table 1 Appearance,yield,melting point,ESI-TOF-MS and IR data of compounds 2a—2e,3a—3e,5a—5e and 6a—6e

Continued
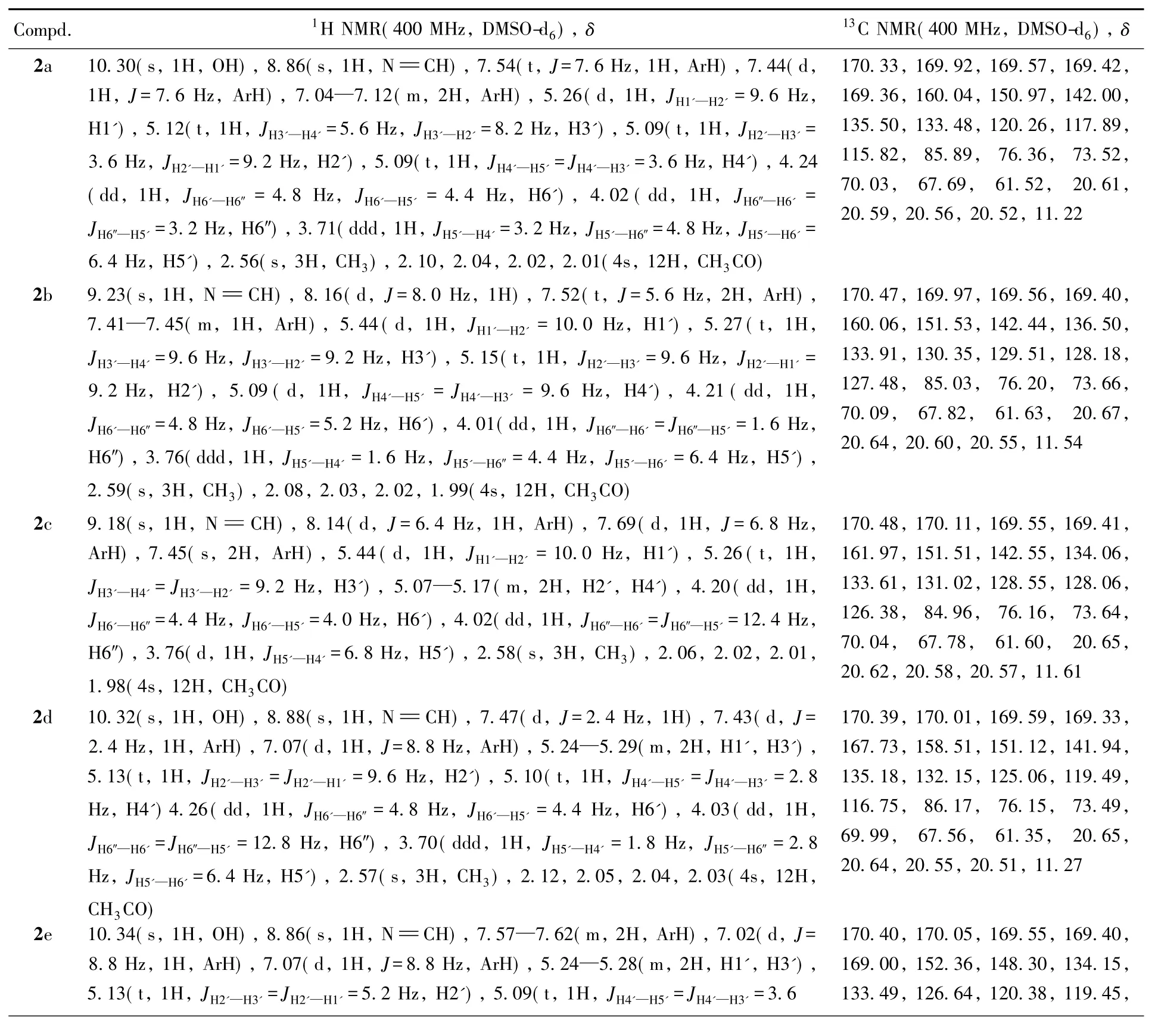
Table 2 1H NMR and13C NMR data of compounds 2a—2e,3a—3e,5a—5e and 6a—6e

Continued

Continued
2 结果与讨论
2.1目标化合物3a~3d和6a~6e的合成
2.1.1温度对脱乙酰基保护反应的影响分别在0,10,25和40℃条件下进行实验,通过TLC监测反应发现,温度过高时反应速度较快,硫苷键断裂的副产物明显增加;温度过低时,反应不易进行或生成乙酰基部分脱除的副产物.实验选择反应温度为25℃,此时产率最高.此外,合理匹配甲醇钠用量和反应温度对有效控制脱保护反应效果、提高目标产物的产率十分有效.
2.1.2溶剂对脱乙酰基保护反应的影响化合物2a~2e和5a~5e在甲醇中的溶解性较差,难以实现乙酰基脱除反应,为此,选用二氯甲烷作为辅助溶剂,能充分溶解原料且易于反应的后处理;并且选择V(二氯甲烷)∶V(甲醇) = 1∶1构建了甲醇钠/甲醇/二氯甲烷体系.实验结果表明,通过恰当选择溶剂配比,既保证了原料在体系中的有效溶解,又便于目标产物在后处理中的有效分离,显著提高了脱除反应效果和目标产物收率.
2.1.3甲醇钠用量对脱乙酰基保护反应的影响实验结果表明,当n(甲醇钠)∶n( 2a~2e) = ( 0. 80~1)∶1时,原料溶解充分,脱保护反应产率较高,副产物较少,方便后续柱层析分离;当高于此摩尔比时,硫苷键断裂的产物明显增多,使目标产物的产率明显降低.
当n(甲醇钠)∶n( 5a~5e) = ( 3~2. 50)∶1时,化合物5a~5e能很好地溶解,低于此摩尔比则原料溶解性较差,脱保护反应难以完全,并有多种部分脱除乙酰化的产物生成,生成物成分复杂.高于此摩尔比,硫苷键断裂的产物也明显增多,使目标产物的产率降低.
由希夫碱还原后甲醇钠的用量不同可知,化合物中含希夫碱结构时脱保护反应的碱用量明显小于希夫碱还原后的化合物.分析原因其可能是希夫碱结构中的碳氮双键为缺电子基团,电子云密度减小,有利于亲和加成反应的进行,所以甲醇钠的消耗量较少.
2.2目标化合物的波谱分析
在化合物2a~2e和5a~5e的红外光谱中,约1750 cm-1处存在乙酰基的碳氧双键基吸收峰,约1373 cm-1处存在乙酰基的甲基吸收峰,而化合物3a~3e和6a~6e在上述2个位置的吸收峰消失,且在约3430 cm-1处出现较强的羟基吸收峰,说明乙酰基被全部脱除.三唑环中C N峰出现在约1650 cm-1处,约1042 cm-1处出现C—S伸缩振动吸收峰,说明目标化合物为硫糖苷而非氮糖苷.
在化合物2a~2e和5a~5e的1H NMR谱图中,在约δ 2. 0处有4个单峰,为4个乙酰基上的甲基峰;约δ 13. 70处SH峰的消失表明硫糖苷的存在.化合物3a~3e和6a~6e在约δ 3. 2处出现的4个H是糖环上的4个羟基峰,同时约δ 2. 0处乙酰基上甲基峰的消除证实了葡萄糖上保护基乙酰基完全脱除.化合物2a~2e和5a~5e的亚胺结构HC N中质子单峰的化学位移出现在约δ 9. 0处,而化合物3a~3e和6a~6e在该范围内的质子吸收峰消失,在约δ 4. 2处出现CH2的信号峰,说明希夫碱的亚胺结构已还原为饱和键.
在化合物2a~2e和5a~5e的13C NMR谱图中,全乙酰化糖上保护基中的甲基峰在约δ 20. 0处,C O峰在δ 170. 0左右,而化合物3a~3e,6a~6e没有这些峰,进一步证实了糖上保护基已完全脱除.δ 54. 48~87. 88处为糖环上碳的吸收峰,脱除乙酰基后的化合物3a~3e和6a~6e糖环上碳的吸收峰略向低场移动,δ值变大.希夫碱(—N CH—)上的碳原子吸收峰在约δ 168. 0处,与氨基相连的亚甲基(—NH—CH2—)中的碳出现在约δ 50. 0处的较高场,也说明希夫碱的亚胺结构被还原为饱和键.
2.3化合物的生物活性
为了考察目标化合物的体外抗菌活性,参照美国临床实验室标准化委员会( NCCLS)的最小抑菌浓度( MIC)测定法,测定其对枯草芽孢杆菌( Bacillus subtilis,B.s.)、金黄色葡萄球菌( Staphylococcus aureus,S.a.)、大肠杆菌( Escherichia coli,E.c.)以及白色念珠菌( Monilia albican,M.a.)的最小抑菌浓度( MIC),并以三氯生和氟康唑作为参照物,结果见表3.
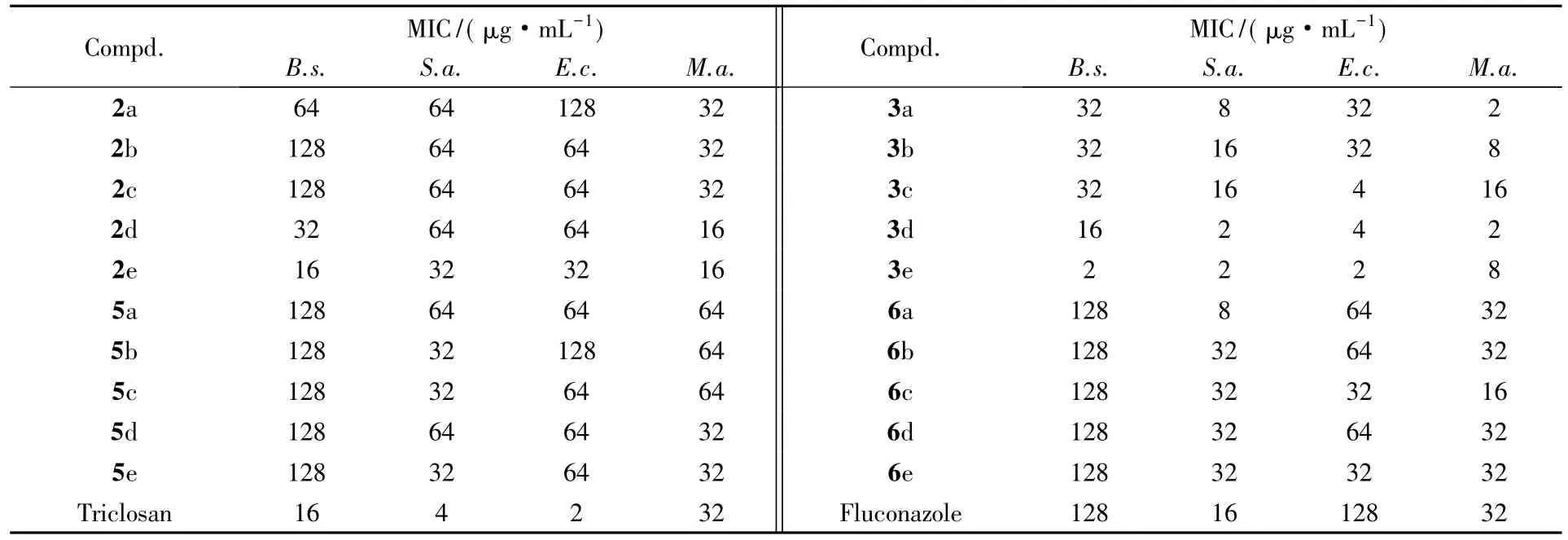
Table 3 Antibacterial activity data of compounds 2a—2e,3a—3e,5a—5e and 6a—6e
体外抑菌活性测试结果表明,目标化合物对4种菌株均具有一定的抗菌活性,且所有目标化合物对枯草芽孢杆菌和大肠杆菌的抑菌活性均优于或等于氟康唑( MIC= 128 μg/mL) ;化合物3a~3e对金黄色葡萄球菌的抑菌活性优于或等于氟康唑( MIC=16 μg/mL) ;除化合物5a~5c外,其余目标化合物对白色念珠球菌的最小抑菌浓度小于或等于三氯生( MIC=32 μg/mL).
从目标化合物的结构与抗菌活性关系可见,脱除乙酰基后的化合物3a~3e和6a~6e对4种菌株的抗菌活性明显优于未脱除乙酰基的化合物2a~2e和5a~5e;化合物3a~3e为希夫碱结构,对4种菌的最小抑菌浓度均小于化合物6a~6e最小抑菌浓度,说明希夫碱结构对抗菌活性起着重要作用;化合物3d和3e对4种菌株的最小抑菌浓度相对较低,表现出较强的广谱抗菌活性,极具开发潜力.分析其化合物结构,苯环2位—OH和5位卤素的同时存在明显增强了化合物的抑菌活性,分析可能是—OH与测试菌株靶标的氨基酸残基以氢键方式结合,5位卤素原子上的孤对电子能参与共轭,有利于电子云分布离域化,使化合物与靶标亲和性增强,从而抑菌活性增强.
3 结 论
将1,2,4-三唑与糖基合理拼接构建了化合物5-甲基-4-N-取代苯基亚胺基-3-S-( 2',3',4',6'-四-O-乙酰基-β-D-吡喃葡萄糖基) -1,2,4-三唑( 2a~2e)及5-甲基-4-N-(取代苯基)胺基-3-S-( 2',3',4',6'-四-O-乙酰基-β-D-吡喃葡萄糖基) -1,2,4-三唑( 5a~5e),经体外抑菌活性测试表明,希夫碱结构抗菌活性强于还原后的抗菌活性,并且脱除乙酰基后的化合物5-甲基-4-N-取代苯基亚胺基-3-S-(β-D-吡喃葡萄糖基) -1,2,4-三唑( 3a~3e)及5-甲基-4-N-取代苯基胺基-3-S-(β-D-吡喃葡萄糖基) -1,2,4-三唑( 6a~6e)对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌和白色念珠球菌的抗菌效果明显增强,表明此类化合物有望成为广谱高效抗菌剂.
参考文献
[1]Baser M.A.,Tadlhav V.D.,Phule R.M.,Oriental J.Chem.,2000,16( 3),553—556
[2]Tozkoparan B.,Gokhan N.,Aktay G.,Eur.J.Med.Chem.,2000,35( 2),743—750
[3]Xu J.M.,Cao Y.B.,Zhang J.,Yu S.C.,Zou Y.,Chai X.Y.,Wu Q.Y.,Zhang D.Z.,Jiang Y.Y.,Sun Q.Y.,Eur.J.Med.Chem.,2011,46( 7),3124—3148
[4]Sun Q.Y.,Xu J.M.,Cao Y.B.,Zhang W.N.,Wu Q.Y.,Zhang D.Z.,Zhang J.,Zhao H.Q.,Jiang Y.Y.,Eur.J.Med.Chem.,2007,42( 9),1226—1233
[5]Li Y.D.,Mao W.T.,Fan Z.J.,Fang Z.,Ji X.T.,Zong G.N.,Li F.Y.,Chem.Res.Chinese Universities,2014,30( 3),390—395
[6]Doma M.R.,Jada S.,Gousia C.,Ajit K.S.,Sampath K.H.M.,Eur.J.Med.Chem.,2011,46( 6),1983—1991
[7]Dhanya S.,Arum M.,Biomedical Engineering and Technology,2011,11( 5),2009—2011
[8]Zhao J.,Xuan L.N.,Zhao H.C.,Cheng J.,Fu X.Y.,Jing F.M.,Chen B.Q.,Chem.Res.Chinese Universities,2014,30( 5),764—769
[9]Yang Q.C.,Sun X.H.,Liu Y.F.,Chen B.,Chen S.Q.,Chinese J.Appl.Chem.,2014,31( 7),788—792(杨青翠,孙晓红,刘源发,陈邦,沈生强.应用化学,2014,31( 7),788—792)
[10]Wang S.,Gao Y.L.,Pham.J.Chin.PLA,2009,25( 4),229—332(王舒,高永良.解放军药学学报,2009,25( 4),229—332)
[11]Du F.,Li Y.S.,Zhejiang Chemical Industry,2015,46( 3),17—22(杜峰,李永曙.浙江化工,2015,46( 3),17—22)
[12]Wang Z.F.,Zhao G.L.,Liu W.,Wang Y.L.,Shao H.,Xu W.R.,Tian L.J.,Chinese J.Org.Chem.,2010,30( 6),849—859(王致峰,赵桂龙,刘巍,王玉丽,邵华,徐为人,田来进.有机化学,2010,30( 6),849—859)
[13]Li X.L.,Hebei Chemical Engineering and Industry,2006,29( 11),25—27(李晓丽.河北化工,2006,29( 11),25—27
[14]Zhang R.B.,Lu J.R.,Xin C.W.,Liu J.B.,Mu J.B.,Yang X.Y.,Wang H.Y.,Wang M.J.,Zhang H.,Chinese J.Org.Chem.,2015,35,858—864(张瑞波,卢俊瑞,辛春伟,刘金彪,穆江蓓,杨旭云,王宏韫,王美君,张贺.有机化学,2015,35,858—864)
[15]Nasser S.A.M.K.,Abdel K.M.,Mohga M.E.,Nucleot.Nucleot.Nucl.,2004,23( 12),1889—1910
[16]Weal A.E.,Randa E.H.M.,Hebat-Allah S.A.,Arch.Pharm.Res.,2011,34( 7),1085—1096
[17]Chen X.M.,Li Z.J.,Ren Z.X.,Huang Z.T.,Carbohydrate Research,1999,315( 3/4),262—267
[18]Wael A.E.,Nahed M.F.,Gad W.A.,Carbohydrate Chemistry,2008,27( 12),357—372
[19]Guo G.,Li G.,Liu D.,Yang Q.J.,Liu Y.,Ting Y.K.,Zhao L.X.,Molecules,2008,13( 7),1487—1500
[20]Sun X.F.,Ji L.,Ren S.M.,Synthetic Communications,2008,38( 23),4116—4124
[21]Wang M.J.,Lu J.R.,Xin C.W.,Liu J.B.,Mu J.B.,Zhang H.,Zhang R.B.,Yang X.Y.,Wang H.Y.,Chem.J.Chinese Universities,2015,36( 3),469—476(王美君,卢俊瑞,辛春伟,刘金彪,穆江蓓,张贺,张瑞波,杨旭云,王宏韫.高等学校化学学报,2015,36( 3),469—476)
[22]Feng Z.N.,Lu J.R.,Xin C.W.,Li J.F.,Bao X.R.,Zhang T.T.,Chem.J.Chinese Universities,2013,34( 5),1143—1150(冯钟念,卢俊瑞,辛春伟,李建发,鲍秀荣,张彤彤.高等学校化学学报,2013,34( 5),1143—1150)
Synthesis and Antibacterial Activities of 5-Methyl-1,2,4-triazole-3-thione Glucosides Compounds†
WANG Hongyun,LIU Jinbiao*,LU Junrui*,YING Ming,YANG Xuyun,YANG Shuxun,MA Yao
( School of Chemistry and Chemical Engineering,Tianjin University of Technology,Tianjin 300384,China)
†Supported by the National Natural Science Foundation of China( Nos.21176194,21476174).
Abstract Ten novel compounds of 5-methy-4-( N-substituted-phenyl) imino/amido-3-S-( 2',3',4',6'-tetra-O-acetyl-β-D-glucopyranoside) -1,2,4-triazole( 2a—2e and 5a—5e) were synthesized via glycosylation of 5-methy-4-( N-substituted-phenyl) imino/amido-1,2,4-triazole-3-thiones with bromo-2,3,4,6-tetra-O-acetylβ-D-glucopyranoside in acetone in the presence of potassium hydroxide.Subsequently,ten novel compounds of 5-methy-4-( N-substituted-phenyl) imino/amido-3-S-(β-D-Glucopyranosyl) -1,2,4-triazole( 3a—3e and 6a—6e) were generated by deacetylate reaction in the system of sodium methylate,methanol and dichloromethane.The structures of all compounds were confirmed by1H NMR,13C NMR,IR and HRMS spectra.The results of preliminary bioassay suggested that nearly all of the new compounds exerted variable inhibitory activity against Escherichia coli,Staphylococcus aureus,Bacillus subtilis and Monilia albican.Especially,compounds 3d and 3e had lower minimum inhibitory concentration values on four tested strains which showed the strong broadspectrum antimicrobial activity and great development potential.
Keywords5-Methy-4-( N-substituted-phenyl) imino/amido-1,2,4-triazole-3-thione; S-β-D-Glucoside; Antibacterial activity
( Ed.: P,H,Y,K)
基金项目:国家自然科学基金(批准号: 21176194,21476174)资助.
收稿日期:2015-09-17.网络出版日期: 2015-12-26.
doi:10.7503/cjcu20150730
中图分类号O626. 26
文献标志码A
联系人简介:卢俊瑞,男,博士,教授,博士生导师,主要从事生物活性化合物分子设计及靶向药物创新的研究.

