苯甲醛在光催化反应中氧化还原选择性的理论研究
黄 晓,甘汉麟,彭 亮,顾凤龙
(环境理论化学教育部重点实验室,华南师范大学化学与环境学院,广州510006)
苯甲醛在光催化反应中氧化还原选择性的理论研究
黄晓,甘汉麟,彭亮,顾凤龙
(环境理论化学教育部重点实验室,华南师范大学化学与环境学院,广州510006)
摘要采用密度泛函理论方法在M06-2X/6-311G*水平上模拟了不同反应条件下,TiO2对苯甲醛的光催化还原和氧化的反应.计算结果表明,苯甲醛的光催化还原和氧化反应均可在常温下发生;在缺氧但有乙醇存在的条件下,乙醇分子可与氧化性物质发生反应,生成醇自由基,苯甲醛主要发生光催化还原反应生成苯甲醇;在有氧气但无乙醇存在条件下,还原性的光生电子被氧气捕获,避免了苯甲醛被还原,主要发生光催化氧化反应生成苯甲酸.
关键词苯甲醛;光催化;选择性氧化还原机理;密度泛函理论
TiO2光催化反应在环境修复[1],水分解和氢气产生[2]及太阳能转换[3]等方面具有广泛应用,已经成为当今光化学领域中非常重要的研究领域.TiO2在光催化过程中产生的光生电子和光生空穴分别具有很强的还原性和氧化性,且光生空穴产生的·OH是主要氧化性物质[4].因此,近年来TiO2光催化反应除用于有机污染物降解外,还广泛地应用于芳香化合物的还原和氧化等有机反应[5~7].
在光催化还原方面,Joyce-Pruden等[5]以TiO2作为光催化剂,乙醇作为溶剂的条件下,研究了苯甲醛及其衍生物的光催化还原反应,认为通过2个电子的转移及质子化过程,苯甲醛被还原为苯甲醇,如Scheme 1所示.在有醇存在的条件下,光生空穴通过一系列反应,可产生相应的醇自由基,醇自由基在还原过程中的作用在实验上还存在争议.Ferry等[8]研究了在不同的醇溶剂中硝基苯被还原为苯胺的反应,认为醇自由基在此过程中并未起到作用.然而,Wu等[9]用电子自旋共振技术检测到醇自由基,认为其具有很强的还原能力且能将对硝基苯胺还原为对苯二胺.

Scheme 1 Possible reaction mechanism of benzaldehyde being reduced to benzyl alcohol photo-catalyzed by TiO2
在光催化氧化方面,Mills等[10]用NMR技术研究甲苯的光催化氧化反应,认为光照时间足够长时,苯甲酸是最终的主要氧化产物.Su等[11]在可见光照射条件下,以mpg-C3N4作为光催化剂,三氟甲苯作为溶剂,研究了苯甲醇的氧化反应,在光照3 h后,不通氧气时其转化率仅为11%;而通入氧气后转化率提高到57%.实验结果[4]推测在光催化氧化过程中,由光生空穴产生的·OH起主要的氧化作用,氧气主要捕获光生电子,避免光生空穴与光生电子复合,同时产生的氧化性物质O-在氧化过程中起辅助作用.但该推测尚未经理论计算结果证实.王大彬等[12]在TiO2光催化过程中检测到O-和H2O2等氧化活性物种,并利用连续流动化学发光法测定了产生O-和H2O2的浓度范围和生成速率,为进一步理论研究提供了可靠的数据,为更细致深入地了解光催化反应机制奠定基础.另外,许宜铭[13]从光催化环境污染物过程中产生的活性物种和反应机理出发,简要总结了近年来二氧化钛、氧化铁、杂多酸和金属酞菁光催化或光敏化在水污染处理方面所取得的研究进展.
在理论研究方面,He等[14]用第一性原理研究了CO2在TiO2的( 101)表面的电子还原反应,认为表面在电子和质子传递过程中发挥非常重要的作用.我们[15]曾采用B3LYP方法研究了在光催化芬顿条件下四溴双酚A的还原和氧化反应,认为还原反应是四溴双酚A得到光生电子导致C-Br键的断裂;而氧化反应是由·OH进攻四溴双酚A不同的位置发生夺氢反应,通过加成反应和取代反应进行.我们[16]采用M06-2X方法研究了对溴苯甲醛在不同溶剂中选择性还原的反应机理,发现对溴苯甲醛在乙醇溶剂中被还原为对溴苯甲醇,而在乙腈溶剂中被还原为苯甲醛,计算结果与实验结果[5]一致.另外,Kçlçç等[17]用B3LYP方法研究了·OH氧化苯酚衍生物的反应,认为邻位加成路径能垒最低,速率常数最高,而氢夺取反应路径刚好相反.申勇立等[18]用B3LYP/6-31G方法研究了·OH夺取白藜芦醇上氢原子的反应机理,计算结果表明,·OH最容易夺取白藜芦醇单羟基环上的羟基氢,生成单羟基环氧自由基.王帅等[19]在M05-2X/6-311++G( d,p)水平上研究了白皮杉醇与·OH的反应机理,结果表明,在气相和水溶液中,加成反应和夺氢反应的能垒均很低,且为放热反应;在气相中单电子转移在热力学上和动力学上均不可行,而在水溶液中可能会进行.
在光催化过程中,光生电子和光生空穴是同时产生的,因此体系中同时存在强还原性和氧化性的活性物种,反应条件影响反应向着还原还是氧化方向进行,尚未见到系统的理论研究.本文采用量子化学计算方法,研究苯甲醛( BHA)在不同反应条件下的光催化氧化还原反应机理,认为BHA在缺氧时被还原成苯甲醇( BA),而在O2存在下发生氧化反应生成苯甲酸( BAC),这对选择合适的反应条件控制芳香醛发生光催化氧化或还原反应具有重要的理论和实际意义.
1 计算方法
采用密度泛函理论M06-2X[20]方法在6-311G*基组下,对反应路径势能面上的可能驻点(反应物、中间体、过渡态和生成物)进行全优化,得到平衡几何构型;并对其进行频率分析,以确定优化得到的极小点的频率全为正,过渡态的频率有且仅有一个虚频,同时得到零点能.所有过渡态采用内禀反应坐标( IRC)[21]计算以确认每个过渡态连接的2个极小点是相应的反应物和产物.因反应在溶液中进行,故本文采用SMD[22]溶剂化模型来考虑溶剂化效应对反应的影响,其中还原反应部分用乙醇(ε= 24. 852)作为溶剂;氧化反应部分用水(ε=78. 3553)作为溶剂.本文给出的所有物质的能量均是在液相下优化得到的吉布斯自由能.计算得到的结构用CYLview[23]软件作图.所有计算均采用Gaussian 09[24]程序包完成.
2 结果与讨论
2.1乙醇溶剂中的反应机理
Jaeger等[25]在光催化剂TiO2存在下,用电子自旋共振技术检测光降解水的自由基中间体,研究表明,水被光生空穴氧化的过程中会产生·OH,且·OH在光催化反应中起着重要的作用.Wu等[9]在TiO2光催化剂和醇溶剂条件下,研究了对硝基苯胺被还原为对苯二胺的反应,认为在光照下产生的·OH会氧化醇产生醇自由基,且其具有很强的还原能力,并用电子自旋共振技术检测到醇自由基的存在.因此本文研究的还原反应以乙醇作为溶剂,用密度泛函理论( DFT)方法计算了·OH夺取乙醇不同位置的氢的反应,反应式如下:

图1给出了·OH在夺取乙醇3个不同位置氢时的自由能剖面图.为了进一步比较C2H5O·,·CH2CH2OH和·CH( OH) CH3的稳定性,计算了C2H5O·和·CH2CH2OH分别与乙醇分子反应生成·CH( OH) CH3的反应:

相应的自由能剖面图见图2.

Fig.1 Gibbs free energy profile for the reactions between·OH and ethanol replete with optimized structuresBond distances are in nm.
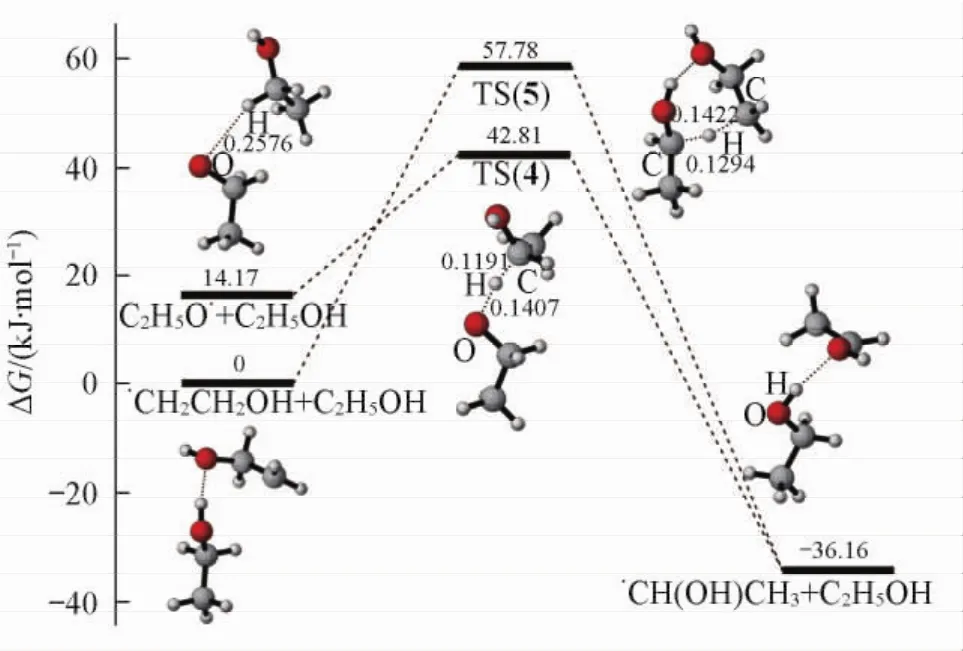
Fig.2 Gibbs free energy profile for the reactions between C2H5O·or·CH2CH2OH and ethanol replete with optimized structuresBond distances are in nm.
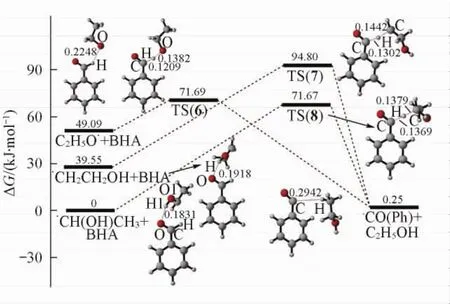
Fig.3 Gibbs free energy profile for the process from BHA to·CO ( Ph ) replete with optimized structuresBond distances are in nm.
由图1可知,·OH夺取乙醇3个不同位置氢是3个平行的竞争过程.·OH夺取乙醇羟基上的氢和β-C上的氢时,分别需要克服38. 12和38. 81 kJ/mol的能垒,同时放出53. 18和55. 77 kJ/mol的热量.而·OH夺取乙醇α-C上的氢时,反应能垒为20. 70 kJ/mol,放热83. 27 kJ/mol.这3个过程均为放热反应,且能垒较低,故在热力学和动力学上都可能发生.通过比较3个竞争反应过程发现,·OH夺取乙醇α-C上的氢生成·CH( OH) CH3的过程需要的能垒最低,放出的热量最多,说明这一过程是反应的主路径,生成的·CH( OH) CH3最稳定.而通过进一步计算发现,C2H5O·与乙醇分子反应生成·CH( OH) CH3这一过程需要克服的能垒为28. 64 kJ/mol,同时放热50. 33 kJ/mol(见图2),说明此过程无论在动力学上还是热力学上都很容易发生.由图2可知,在·CH2CH2OH与乙醇分子反应生成·CH( OH) CH3的过程中,反应能垒为57. 78 kJ/mol,放热36. 16 kJ/mol,对于自由基反应而言,该反应能垒比较高,说明此反应在动力学上较慢,·CH2CH2OH可能会参与其它反应.综上,生成的·CH( OH) CH3最稳定,而·CH2CH2OH在动力学上有较高的稳定性.
C2H5O·,·CH2CH2OH和·CH( OH) CH33种自由基均可能与BHA反应,生成·CO ( Ph)和C2H5OH,反应式如下:

这3个过程对应的自由能剖面图见图3.对于C2H5O·和BHA反应,需要的能垒为22. 60 kJ/mol,放热48. 84 kJ/mol,说明这一反应在热力学和动力学上均易进行.对于·CH2CH2OH和BHA反应过程,反应能垒为55. 25 kJ/mol,同时放热39. 30 kJ/mol,说明这一过程在热力学上可行.而·CH( OH) CH3和BHA反应需要的反应能垒为71. 67 kJ/mol,吸热0. 25 kJ/mol,说明此反应在动力学上较难发生.因此,在这3种自由基中,只有C2H5O·与BHA反应的能垒较低( 22. 60 kJ/mol),而C2H5O·与乙醇分子反应的能垒为28. 64 kJ/mol,表明这2个反应是相互竞争的,考虑到作为溶剂的乙醇的浓度远大于作为反应物的BHA,我们认为C2H5O·与BHA反应的几率较小.
Scheme 2给出了乙醇溶剂中BHA发生光催化还原反应生成BA可能的反应机理.由Scheme 2可见,在BHA到IM2的过程中,有3个竞争过程: 1)·CH2CH2OH的还原过程,2)·CH( OH) CH3的还原过程,3) e-的还原过程.在IM2到产物BA的过程中,IM2会得到第2个电子,然后夺取C2H5OH中羟基上的氢生成产物BA.相应的自由能剖面图见图4和图5.

Scheme 2 Possible reaction mechanism of BHA being reduced to BA in ethanol

Fig.4 Gibbs free energy profile for the process from BHA to IM2 replete with optimized structures Bond distances are in nm.
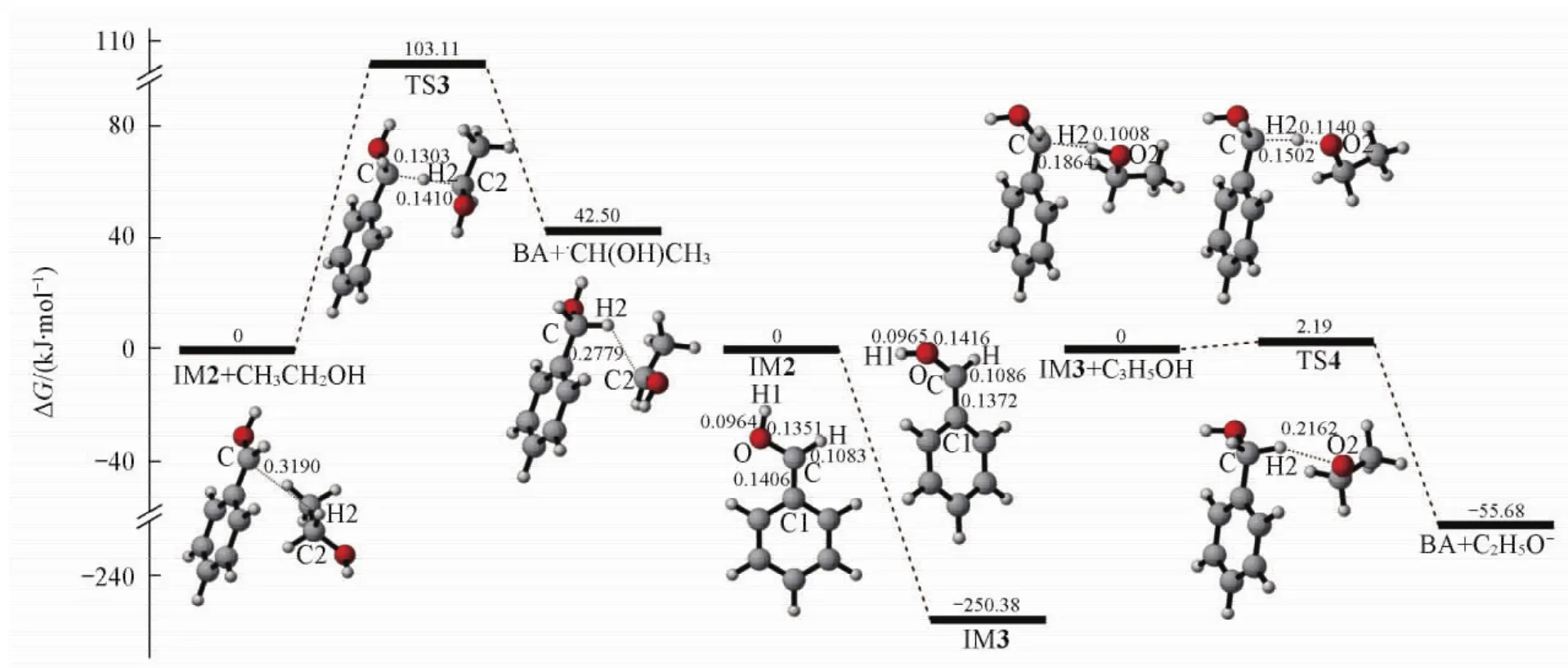
Fig.5 Gibbs free energy profile for the process from IM2 to BA replete with optimized structuresBond distances are in nm.
在BHA到IM2的过程中,如图4所示,对于·CH2CH2OH还原BHA的过程,BHA可能会夺取·CH2CH2OH上的α-H,经过渡态TS1,生成自由基中间体IM2和H2C CHOH.在过渡态TS1中,O…H的距离为0. 1309 nm,C…H的距离为0. 1315 nm.此过程需要的反应能垒为133. 07 kJ/mol,放热16. 60 kJ/mol,说明这一反应在动力学上较难发生.而对于·CH( OH) CH3还原BHA的过程,BHA会夺取·CH( OH) CH3上的羟基氢,经过渡态TS2,生成自由基中间体IM2和CH3CHO.在过渡态TS2中,O1…H1距离增大至0. 1156 nm,O…H1距离减小至0. 1283 nm.最终,O1—H1键的断裂和O—H1键的形成导致IM2的形成.这一过程的反应能垒为35. 93 kJ/mol,同时放热45. 49 kJ/mol,说明此反应在热力学和动力学上都能够进行.另一条可能的路径是BHA先得到一个电子生成自由基负离子( IM1),然后IM1夺取C2H5OH中羟基上的氢,生成IM2和C2H5O-.由图4可知,BHA得电子生成IM1的过程中,C—H键的键长变化很小,C—O键的键长增大0. 0064 nm,而C—C1的键长减小0. 0060 nm;同时这一过程放热232. 89 kJ/mol.在IM1从C2H5OH中夺取羟基氢的过程中,计算发现产物IM2+C2H5O-的结构并不能得到.Dmitrenko等[26]研究表明,溶剂分子在稳定离子和降低反应能量方面起着非常重要的作用.对类似研究体系,4个水分子足以稳定负离子.因此,为了估算这一过程中需要的能量,将IM2+C2H5O-+4H2O中O…H1的距离固定为0. 1000 nm[26,27],并对其进行结构优化.计算结果表明,这一过程需要吸热31. 09 kJ/mol.与我们之前的研究结果相似,考虑到在得到光生电子的过程中放热232. 89 kJ/mol,可以认为这一过程在热力学上是可能发生的.
在IM2到产物BA的过程中,包含2个可能的反应路径.如图5所示,一个路径是自由基中间体IM2可能会夺取乙醇分子上的α-H,经过过渡态TS3,生成产物BA和·CH( OH) CH3.在过渡态TS3中,C…H2的距离为0. 1303 nm,C2…H2的距离为0. 1410 nm.这一过程为吸热过程,吸热量为42. 50 kJ/mol,反应能垒为103. 11 kJ/mol,说明这一过程在热力学和动力学上都很难进行.另一个可能的路径分为两步反应:第一步是IM2得一个电子生成负离子中间体IM3,此过程中,O—H1和C—H键长变化很小,C—O的键长增大0. 0065 nm,而C—C1键长减小0. 0034 nm;同时二面角H—C—O—H1由0°增大至96. 4°,并且这一过程放热250. 38 kJ/mol;第二步是IM3夺取C2H5OH上羟基氢的过程,在此过程中,IM3会夺取C2H5OH上的羟基氢,经过过渡态TS4,生成产物BA和C2H5O-.在过渡态TS4中,C…H2的距离为0. 1502 nm,O2…H2的距离为0. 1140 nm.C—H2键的形成和O2—H2的断裂导致产物BA的生成.这一步反应的能垒仅为2. 19 kJ/mol,且放热55. 68 kJ/mol,说明这一过程在热力学和动力学上都能够进行.
因此,在TiO2光催化剂和乙醇溶剂存在条件下,BHA可以经过两步反应,被光生电子还原生成BA,醇自由基可能在还原过程中起重要作用.
2.2水溶液中的反应机理
在TiO2光催化剂和乙醇溶剂存在条件下,实验[5]上未检测到BHA的氧化产物.可能是因为在乙醇溶剂中,主要的氧化性物质·OH可迅速与周围的乙醇分子反应生成醇类自由基(见图1).浓度很高的乙醇分子与浓度很低的BHA竞争·OH,显然BHA与·OH反应的几率较小,因此我们在建立光催化氧化BHA反应的理论模型时,考虑到避免溶剂分子将·OH淬灭,故选择水作为溶剂,模拟水溶液中BHA的光催化氧化反应.
Jaeger等[25]在光催化剂TiO2和水溶液存在下,用电子自旋共振技术检测到·OH;溶于水中的O2得到光生电子后生成超氧自由基负离子O-[28],O-亦可与水合氢离子反应生成·OOH[29],此3种氧化性物质·OH,O-和·OOH均可将BHA氧化.Scheme 3给出了水溶液中BHA发生光催化氧化反应生成BAC可能的反应机理,包括·OH的加成过程及·OH,O-和·OOH的夺氢过程.由Scheme 3可见,·OH的加成反应及·OH,O-和·OOH的夺氢反应是竞争过程;相应的自由能剖面图见图6和图7.

Scheme 3 Possible reaction mechanism of BHA being oxidized to BAC in waterThe solid lines represent the dominant pathways.

Fig.6 Gibbs free energy profile for the process from BHA to IM4 replete with optimized structuresBond distances are in nm.
由图6可知,在·OH和BHA的加成反应机理中,·OH会进攻BHA上的羰基碳,经过渡态TS5,生成中间体IM4.在过渡态TS5中,C…O1的距离为0. 1877 nm.这一过程的反应能垒是55. 27 kJ/mol,同时放热46. 60 kJ/mol.然后·OH会夺取IM4中的氢,生成氧化产物BAC和H2O,此过程放热466. 98 kJ/mol(见表1).
由Scheme 3和图7可见,夺氢反应包括3个竞争过程.( 1)·OH夺取BHA中的醛基氢,经过渡态TS6,生成自由基中间体IM5和H2O.在过渡态TS6中,C…H距离为0. 1158 nm,O1…H的距离为0. 1542 nm.这一反应需要克服能垒16. 35 kJ/mol,同时放热92. 24 kJ/mol.与·OH和BHA的加成反应机理相比较,·OH的夺氢反应能垒低38. 92 kJ/mol,放热45. 64 kJ/mol,说明·OH的夺氢反应更容易进行.( 2)超氧自由基负离子O-夺取BHA中醛基氢的反应,经过渡态TS7,生成IM5和-OOH.在过渡态TS7中,C…H距离为0. 1504 nm,O2…H的距离为0. 1085 nm.此过程反应能垒高达127. 28 kJ/mol,且吸热123. 15 kJ/mol,说明这一过程在热力学和动力学上都很难进行.( 3)·OOH夺取BHA中上的醛基氢,经过渡态TS8,生成IM5和H2O2;反应能垒为87. 03 kJ/mol,吸热45. 48 kJ/mol.在过渡态TS8中,C…H距离为0. 1295 nm,O4…H的距离为0. 1257 nm.因此,通过比较这3个竞争反应的能垒和放热量发现,·OH的夺氢反应是反应的主通道.IM5直接和·OH发生加成反应,放热423. 37 kJ/mol(见表1),生成氧化产物BAC.这3个夺氢反应的能垒相差较大,与氧化物质夺氢后生成产物的稳定性有关,·OH夺氢后生成很稳定的水分子,能垒最低;·OOH夺氢后生成较稳定的H2O2,能垒较高;而O-夺氢之后生成不稳定的-OOH,能垒最高,这与罗艳玲等[30]在O-在生物发光反应中的作用时提到的超氧负离子的反应活性低的结论一致.对于·OH的加成反应与夺氢反应之间能垒差的来源,我们推测可能是由于·OH在进攻底物的过程中,自由基的单占轨道的电子云与底物的电子云之间存在排斥作用,在加成反应中,这一排斥力发生在单占轨道与羰基的π轨道之间,·OH从π轨道的正面进攻,排斥力较大,能垒较高;而在夺氢反应中,这一排斥力发生在单占轨道与C—H的σ轨道之间,众所周知,σ轨道的电子云主要集中在键的中间,而在本反应中,·OH是从靠近H的外侧进攻,因此排斥力较小,能垒较低;这与王帅等[19]研究白皮杉醇与·OH在水溶液中的反应机理时,得出的发生夺氢反应比加成反应更容易进行的结论一致.
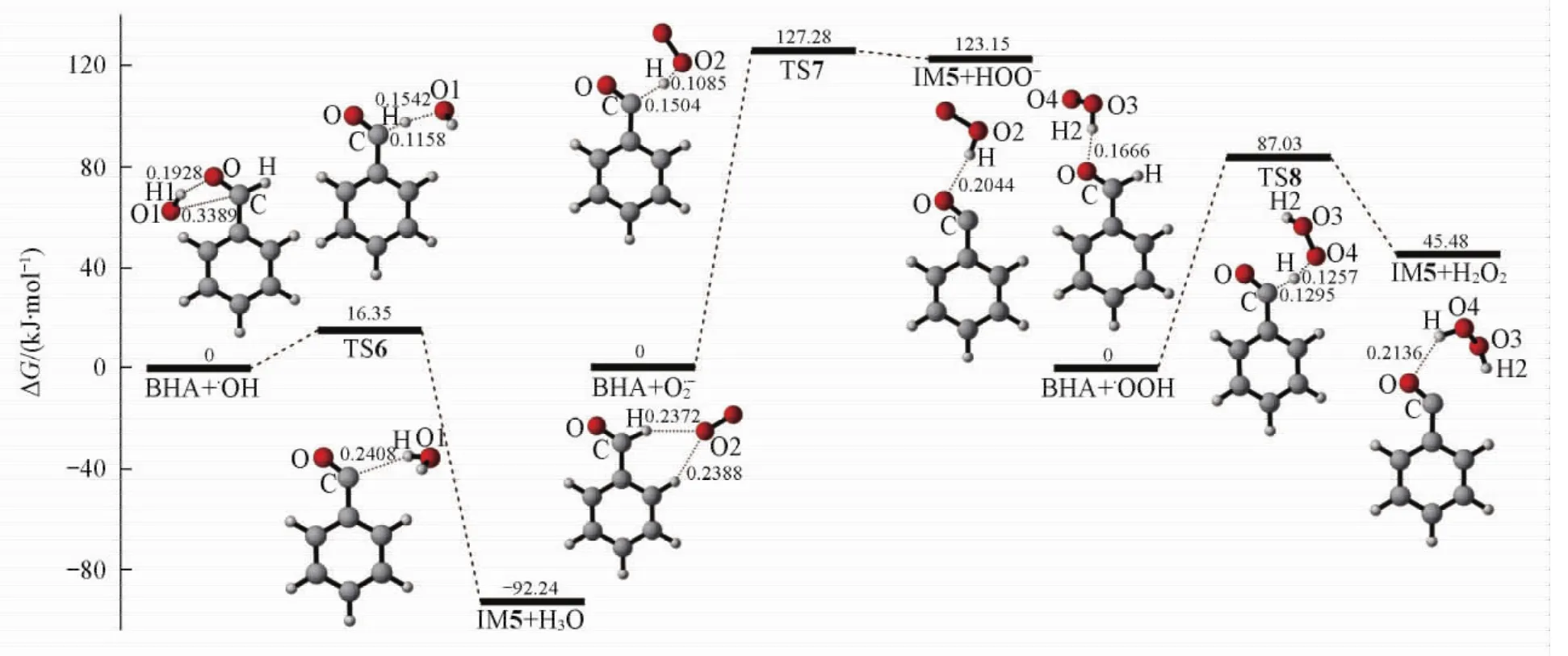
Fig.7 Gibbs free energy profile for the process from BHA to IM5 replete with optimized structuresBond distances are in nm.

Table 1 Relative Gibbs free energies for the processes from IM4 and IM5 to BAC
通过比较BHA与不同的氧化性物质反应的能垒,认为·OH夺取BHA的醛基氢生成IM5过程为放热反应,且反应能垒最低,说明此路径为BHA在水溶液中的主要氧化路径.
2.3苯甲醛光催化氧化-还原反应条件的探讨
为了进一步探讨反应条件对BHA光催化氧化还原反应的影响,分别计算了水溶液中和乙醇溶剂中的O2和BHA及其得电子后的能量,结果见表2.
Table 2 Relative Gibbs free energies for the processes from O2and BHA to O-and IM1 in different solvents

Table 2 Relative Gibbs free energies for the processes from O2and BHA to O-and IM1 in different solvents
Species G/a.u. ΔG/a.u. ΔG/( kJ·mol-1) Species G/a.u. ΔG/a.u. ΔG/( kJ·mol-1) O2( in ethanol) -150.321004 0 0 BHA( in ethanol) -345.433966 0 0 O·-2( in ethanol) -150.439021 -0.118017 -309.85 IM1( in ethanol) -345.522669 -0.088703 -232.89 O2( in water) -150.320706 0 0 BHA( in water) -345.429490 0 0 O·-2( in water) -150.447154 -0.126448 -331.99 IM1( in water) -345.522900 -0.093410 -245.25
由表2可得,在乙醇溶剂中,O2得e-后放热309. 85 kJ/mol,而BHA得e-后放热232. 89 kJ/mol,故在乙醇溶剂中O2更易得电子.因此,在光催化反应中以乙醇作为溶剂时,当溶液中存在O2时,O2会首先得电子生成O-,减少了底物BHA捕获光生电子而被还原的可能性,这可以解释在光催化还原反应中,通常需要通入氮气保护的实验.光生空穴可以直接氧化乙醇分子,产生氢离子和醇自由基,或可氧化水分子或催化剂表面的氢氧根离子,产生氧化性物质·OH.从图1可知,乙醇分子被·OH夺氢反应的能垒为20. 70 kJ/mol,而夺取苯甲醛相应的夺氢反应能垒为16. 35 kJ/mol,考虑到夺氢反应的能垒很低,而作为溶剂的乙醇其浓度远远大于溶液中BHA的浓度,在溶液中乙醇会很快消耗掉光照时产生的氧化性物质·OH,同时生成另一种还原活性物种醇自由基,使得苯甲醛被·OH夺氢而发生氧化反应的可能性很小;这与Joyce-Pruden等[5]的实验以乙醇作为溶剂,且没有通入氧气,只检测到BHA的还原产物的结果一致.
由表2可知,在水溶液中,O2得e-后的放热量比BHA得e-后放热量要多86. 74 kJ/mol,说明在水溶液中O2更容易得电子,与在乙醇溶剂中的结果相似.因此溶于水中的O2也能阻断BHA被光生电子e-还原的反应路径,O2得e-后生成的O-可进一步转化成·OOH和H2O2等氧化性物质;如图7所示,O-和·OOH夺取BHA的醛基氢过程的反应能垒均较高,在常温下较难发生,这与实验推测的O-在氧化过程中起辅助作用一致[11],O-和·OOH在体系中的作用有待进一步探讨研究.由于水溶液中不存在其它分子与BHA竞争与·OH的反应,所以在该反应条件下,BHA主要生成氧化产物BAC.
3 结 论
选用苯甲醛为研究对象,研究了在有乙醇存在的还原性条件以及有O2存在的氧化条件下,TiO2光催化过程中可能产生的光生电子和·OH等活泼中间体迁移到溶液中之后,在反应过程中可能参与的反应,讨论了各活泼中间体在还原和氧化过程中所起的作用,结果表明,在乙醇或水溶液中,O2是一个良好的光生电子捕获剂,可以与苯甲醛捕获光生电子的过程相竞争.O2捕获光生电子,阻止了苯甲醛被光生电子还原.光生电子是起还原作用的主要物质,在有乙醇等溶剂存在时,溶剂可与光生空穴产生的·OH发生反应生成可起还原作用的自由基,从而减少了氧化反应发生的可能性.光生空穴产生的·OH是起氧化作用的主要物质,O-和·OOH等活性中间体的氧化反应的能垒较高,氧化能力较弱,与实验推测的O-在反应过程中起辅助作用的结论一致.由于本文主要研究溶液中游离的活性物种与苯甲醛的氧化-还原反应,有关苯甲醛与催化剂表面光生空穴的反应,以及催化剂表面的吸附作用对苯甲醛或O2捕获光生电子的影响有待进一步研究.
参考文献
[1]Hoffmann M.R.,Martin S.T.,Choi W.,Bahnemann D.W.,Chem.Rev.,1995,95( 1),69—96
[2]Hagfeldt A.,Grätzel M.,Acc.Chem.Res.,2000,33( 5),269—277
[3]Nowotny J.,Sorrell C.C.,Bak T.,Sheppard L.R.,Sol.Energy,2005,78( 5),593—602
[4]Chong M.N.,Jin B.,Chow C.W.K.,Saint C.,Water Res.,2010,44( 10),2997—3027
[5]Joyce-Pruden C.,Pross J.K.,Li Y.Z.,J.Org.Chem.,1992,57( 19),5087—5091
[6]Park H.,Choi W.,Catal.Today,2005,101( 3/4),291—297
[7]Zhang M.,Wang Q.,Chen C.C.,Zang L.,Ma W.H.,Zhao J.C.,Angew.Chem.Int.Ed.,2009,48( 33),6081—6084
[8]Ferry J.L.,Glaze W.H.,Langmuir,1998,14( 13),3551—3555
[9]Wu W.M.,Wen L.R.,Shen L.J.,Liang R.W.,Yuan R.S.,Wu L.,Appl.Catal.B,2013,130—131,163—167
[10]Mills A.,O’Rourke C.,J.Photochem.Photobiol.A,2012,233,34—39
[11]Su F.Z.,Mathew S.C.,Lipner G.,Fu X.Z.,Antonietti M.,Blechert S.,Wang X.C.,J.Am.Chem.Soc.,2010,132( 46),16299—16301
[12]Wang D.B.,Zhao L.X.,Guo L.H.,Zhang H.,Wan B.,Yang Y.,Acta Chim.Sinica,2015,73( 5),388—394(王大彬,赵利霞,郭良宏,张辉,万斌,杨郁.化学学报,2015,73( 5),388—394)
[13]Xu Y.M.,Prog.Chem.,2009,21( 2),524—533(许宜铭.化学进展,2009,21( 2),524—533)
[14]He H.Y.,Zapol P.,Curtiss L.A.,Energy Environ.Sci.,2012,5( 3),6196—6205
[15]Huang X.,Peng L.,Li S.P.,Gu F.L.,Theor.Chem.Acc.,2015,134( 2),3-1—12
[16]Huang X.,Peng L.,Gu F.L.,Zhang R.Q.,Phys.Chem.Chem.Phys.,2015,17( 30),19997—20005
[17]KçlççM.,Koçtürk G.,San N.,ççnar Z.,Chemosphere,2007,69( 9),1396—1408
[18]Shen Y.L.,Hao J.K.,Cao Y.Y.,Yang Y.C.,Chem.J.Chinese Universities,2007,28( 9),1743—1746(申勇立,郝金库,曹映玉,杨恩翠.高等学校化学学报,2007,28( 9),1743—1746)
[19]Wang S.,Wang W.N.,Gao Z.F.,Wang W.L.,Chem.J.Chinese Universities,2015,36( 8),1588—1595(王帅,王渭娜,高志芳,王文亮.高等学校化学学报,2015,36( 8),1588—1595)
[20]Zhao Y.,Truhlar D.G.,Theor.Chem.Acc.,2008,120( 1—3),215—241
[21]Fukui K.,Acc.Chem.Res.,1981,14( 12),363—368
[22]Marenich A.V.,Cramer C.J.,Truhlar D.G.,J.Phys.Chem.B,2009,113( 18),6378—6396
[23]Legault C.Y.,CYL View Version 1.0b,University of Sherbrooke,Sherbrooke,2009
[24]Frisch M.J.,Trucks G.W.,Schlegel H.B.,Scuseria G.E.,Robb M.A.,Cheeseman J.R.,Scalmani G.,Barone V.,Mennucci B.,Petersson G.A.,Nakatsuji H.,Caricato M.,Li X.,Hratchian H.P.,Izmaylov A.F.,Bloino J.,Zheng G.,Sonnenberg J.L.,Hada M.,Ehara M.,Toyota K.,Fukuda R.,Hasegawa J.,Ishida M.,Nakajima T.,Honda Y.,Kitao O.,Nakai H.,Vreven T.,Montgomery J.A.,Peralta J.E.,Ogliaro F.,Bearpark M.,Heyd J.J.,Brothers E.,Kudin K.N.,Staroverov V.N.,Keith T.,Kobayashi R.,Normand J.,Raghavachari K.,Rendell A.,Burant J.C.,Iyengar S.S.,Tomasi J.,Cossi M.,Rega N.,Millam J.M.,Klene M.,Knox J.E.,Cross J.B.,Bakken V.,Adamo C.,Jaramillo J.,Gomperts R.,Stratmann R.E.,Yazyev O.,Austin A.J.,Cammi R.,Pomelli C.,Ochterski J.W.,Martin R.L.,Morokuma K.,Zakrzewski V.G.,Voth G.A.,Salvador P.,Dannenberg J.J.,Dapprich S.,Daniels A.D.,Farkas O.,Foresman J.B.,Ortiz J.V.,Cioslowski J.,Fox D.J.,Gaussian 09,Revision C.01,Gaussian Inc.,Wallingford CT,2010
[25]Jaeger C.D.,Bard A.J.,J.Phys.Chem.,1979,83( 24),3146—3152
[26]Dmitrenko O.,Thorpe C.,Bach R.D.,J.Org.Chem.,2007,72( 22),8298—8307
[27]Boronat M.,Viruela P.,Corma A.,J.Phys.Chem.B,1997,101( 48),10069—10074
[28]Legrini O.,Oliveros E.,Braun A.M.,Chem.Rev.,1993,93( 2),671—698
[29]Bahnemann W.,Muneer M.,Haque M.M.,Catal.Today,2007,124( 3/4),133—148
[30]Luo Y.L.,Liu Y.J.,Chem.J.Chinese Universities,2015,36( 1),24—33(罗艳玲,刘亚军.高等学校化学学报,2015,36( 1),24—33)
Theoretical Study on the Selective Redox Mechanism of Benzaldehyde in Photo-catalyzed Reaction†
HUANG Xiao,GAN Hanlin,PENG Liang*,GU Fenglong*
( Key Laboratory of Theoretical Chemistry of Environment,Ministry of Education,School of Chemistry and Environment,South China Normal University,Guangzhou 510006,China)
AbstractThe photoelectron and photohole could be generated on the surface of TiO2under the UV irradiation.Some reactive species could be produced indirectly.The photoelectron could be trapped by oxygen leading to yield the superoxide anion radicals,while the photohole can react with the solvent molecules to generate the hydroxyl radical and alcohol radical.The substrate may be reduced by the photoelectron directly,or by alcohol radicals.And it may be oxidized by the photohole directly,or by the reactive species of hydroxyl radicals and superoxide anion radicals.The M06-2X/6-311G*method was employed to investigate the selective redox mechanism of benzaldehyde in solution,which was reduced or oxidized by the reactive species generated during the photo-catalyzed process in different reaction conditions.According to the computation results,the photo-redox reaction of benzaldehyde would be happened in room temperature.In oxygen-free ethanol solvent,the ethanol molecules could react with the oxidizing species to yield the alcohol radicals,while benzaldehyde could be mainly reduced to benzyl alcohol.In oxygen-rich without ethanol condition,the reductive photoelectron is trapped by oxygen to prohibit the reduction of benzaldehyde,so benzaldehyde is mainly oxidized to benzoic acid.
Keywords Benzaldehyde; Photocatalysis; Mechanism of selective redox reaction; Density functional theory
( Ed.: Y,Z)
†Supported by the the National Natural Science Foundation of China( Nos.21273081,21403074),the Guangdong Provincial Universities and Colleges Pearl River Scholar Funded Scheme and the Guangdong Provincial Department of Science and Technology.
基金项目:国家自然科学基金(批准号: 21273081,21403074)、广东省高等学校珠江学者岗位计划和广东省科技厅资助.
收稿日期:2015-09-15.网络出版日期: 2015-12-26.
doi:10.7503/cjcu20150719
中图分类号O644.14
文献标志码A
联系人简介:彭亮,男,博士,讲师,主要从事理论与计算化学研究.E-mail: pengliang@ m.scnu.edu.cn顾凤龙,男,博士,教授,博士生导师,主要从事理论与计算化学研究.E-mail: gu@ scnu.edu.cn

