汉中黑稻黄烷酮3-羟化酶基因(F3H)的遗传变异分析
张 涛,尹亚军,路宏朝,王 令
(陕西理工学院生物科学与工程学院,陕西 汉中 723000)
汉中黑稻黄烷酮3-羟化酶基因(F3H)的遗传变异分析
张 涛,尹亚军,路宏朝,王 令
(陕西理工学院生物科学与工程学院,陕西 汉中 723000)
本实验通过PCR和测序拼接获得汉中地区8个黑稻品种黄烷酮3-羟化酶基因(F3H)编码区序列,在NCBI中用BLAST分析首次发现该基因位于水稻4号染色体。发现8种黑稻和普通籼稻F3H序列完全相同,与粳稻相比较,则存在4个突变位点,导致2个氨基酸突变。基于F3H序列信息的进化树表明黑稻与籼稻、粳稻、小麦、玉米的亲缘关系较近;遗传距离和同源性分析表明F3H基因较为保守,是一个古老的基因,可用于种属的鉴定分析。F3H蛋白理化性质分析发现,黑稻与其它禾本科植物存在一定差异,蛋白三维结构及相关位点预测发现粳稻和黑稻无明显差异,初步认为黑稻F3H序列变异可能与花青素的合成无关,需要在其表当量与花青苷和成合成与沉积的关系方面开展进一步研究。
黑稻;黄烷酮3-羟化酶;序列分析;遗传变异
水稻是主要的粮食作物,存在籼稻和粳稻2个变种,籼稻和粳稻中有部分群体的果皮层、种皮和米粒表现为黑色,研究发现黑色与花青素含量和结构有关,这一群体被称为黑稻,是稻种资源库中极具特色而又名贵的类群[1]。由于稻米中富含天然花青素和较多的蛋白质、氨基酸及微量元素,因而具有较高的营养保健功能和经济价值,备受人们关注[2]。学者对于水稻中花色素苷的合成机制进行了大量研究,以期揭示其代谢调控机理,为水稻的育种和种质资源保护提供指导与借鉴[3-4]。
植物色素是天然色素主要来源,其合成机制已经开展了较为广泛和深入研究,现有结果表明花青素合成主要通过苯丙氨酸途径,大致可以分为3个阶段:①由苯丙氨酸到4-香豆酰CoA;②由4-香豆酰CoA和丙二酰CoA到二氢黄酮醇;③由二氢黄酮醇到各种花青素的合成,进一步反应生成各种花青苷[5]。尽管有学者研究发现控制水稻种皮着色的Pb基因位于水稻第4染色体上,紫色种皮对白色种皮呈显性[6],但对于水稻中普通稻和黑稻之间花青素合成与沉积的分子生物学机制尚未阐述清楚,难以在育种中加以推广应用。
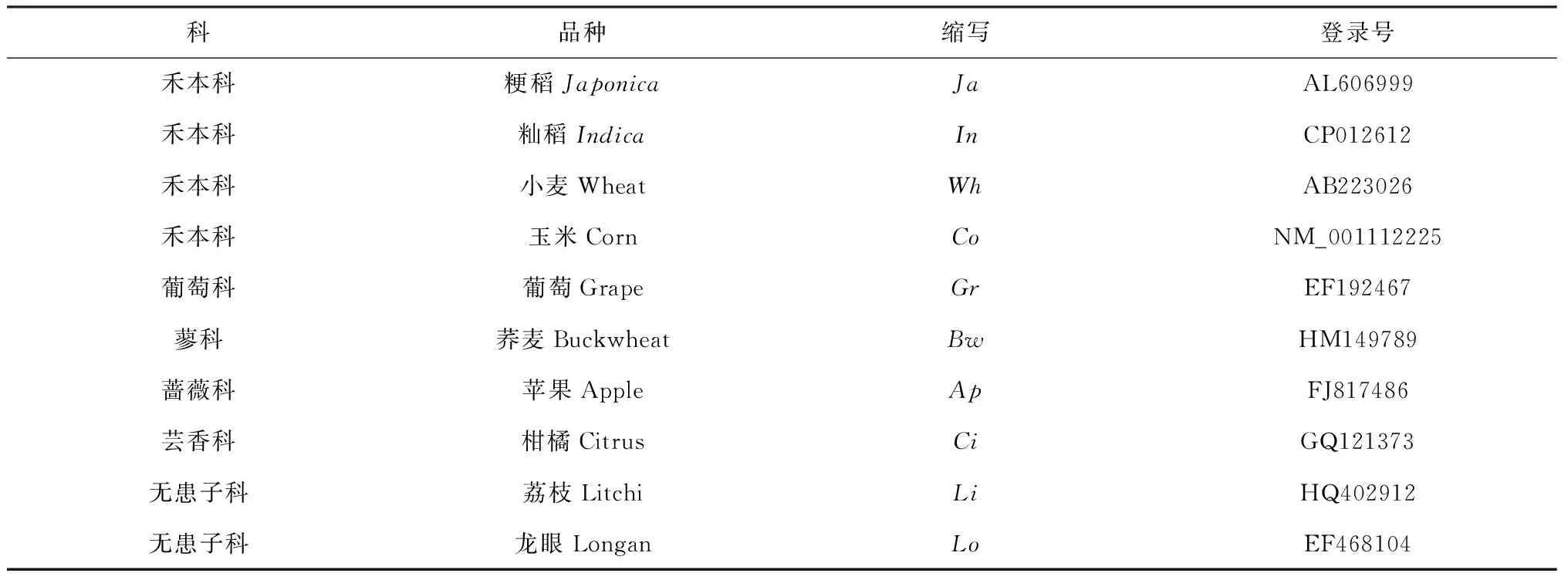
表1 F3H基因序列目录

表2 引物序列目录
本研究基于植物花青素合成机制的研究,选择在花青素合成第二阶段发挥作用的黄烷酮3-羟化酶(F3H,Flavanone 3-Hydroxylase)为靶基因,对汉中地区主要种植的8个黑稻品种进行遗传变异分析,研究F3H基因同时,基于该位点探索水稻的遗传分化,为水稻的起源与进化提供相关的基础数据。
1 材料与方法
1.1 材料及DNA提取
本研究以陕西汉中地区种植的黑宝(HB),黑丰(HF),黑帅(HS),黑米A(HMA),黑米B(HMB),黑优粘(HYZ),培811(P811),云黑(YH)等8个黑稻品种为材料,该8个品种均为籼稻,由陕西省水稻研究所提供。种子在调温调湿箱中进行萌发,取水稻其嫩叶叶尖,按照改良的CTAB法提取基因组DNA[7]。
1.2 引用序列和引物序列
由网站http:/ /www.ncbi.com查得不同植物F3H基因序列(表1),通过BLAST在NCBI中检索到粳稻的F3H序列,采用软件Primer 5.0 设计用于PCR扩增F3H序列的引物(表2),引物序列由上海生物工程技术服务有限公司合成。
1.3 PCR扩增反应体系及程序
PCR反应总体系为25 μl:10×PCR缓冲液2.5 μl,dNTP (10 mM)0.5 μl,上下游引物 (10 pmol)各1.2 μl,TaqDNA聚合酶(5 U/μl)0.2 μl,DNA模板 (50 ng/μl)1.2 μl,超纯水18.2 μl。PCR扩增程序:94 ℃预变性2 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸45 s,35个循环,然后72 ℃延伸10 min,4 ℃保存。
1.4 统计分析
采用DNAMAN对不同黑稻品种和粳稻F3H基因序列进行拼接和比对;以不同物种F3H基因的序列信息为基本数据,通过MEGA5.0进行了物种的聚类分析;在www.expasy.org网站进行了水稻F3H蛋白质结构预测和理化性质分析。
2 结果与分析
2.1 黑稻F3H基因序列比对分析
本研究发现NCBI没有直接标注水稻F3H数据信息,以其他禾本科植物的F3H序列为参照,通过BLAST检索到NCBI中粳稻4号染色体的3个外显子序列(55313..55654,55732..56160,57637..57999,反向互补)与禾本科F3H同源性很高,初步确定该基因为粳稻F3H,同时也得到了籼稻F3H的序列。水稻F3H的编码序列全长1134 bp,其中外显子1长363 bp,外显子2长429 bp,外显子3长342 bp。基于籼稻F3H序列设计了水稻F3H扩增的PCR引物,最终获得了汉中地区选育、栽培的8个黑稻品种的F3H序列,8种黑稻F3H序列完全相同,以黑稻来代表8种黑稻(Br,Black rice)。通过黑稻与籼稻、粳稻的F3HmRNA序列比对分析发现,黑稻与籼稻之间无差异,与粳稻比较则存在4个变异位点(图1)。这4个位点的变异分别为编码区666位的T/G转换,772位的C/G颠换,899位的T/G转换,942位的G/A转换(图2)。结果表明F3H基因可以作为籼稻与粳稻亚种之间鉴定分析的一个候选基因,但是突变位点的变异不影响花青素的合成。

图1 F3H序列比对Fig.1 The sequence alignment of F3H

图2 F3H序列SNPsFig.2 The SNPs of F3H
2.2 不同物种F3H基因的聚类分析
探索黑稻、籼稻和粳稻的起源与分化也是水稻科学研究领域的一个值得关注的问题,F3H是一个较为保守的古老基因,其在不同物种间的遗传变异可以作为系统进化研究的一个参考位点。本实验以F3H的序列信息为基础,通过近邻相接法(NJ,neighbor-joining method)进行8个汉中黑稻和其他物种系统进化树构建(图3),来探讨以F3H序列为参考来进行不同物种系统进化研究的可行性。研究分析发现,汉中8个黑稻品种与籼稻聚为一类,然后与粳稻聚为一个稻属的大类。稻属植物与玉米、小麦等禾本科植物聚在一个分支,荔枝和龙眼形成一个分支,其他不同物种的系统进化关系能够清楚区分,这一研究结果表明F3H可用以鉴定不同属间和种间的进化关系,但不能清楚的进行种内品种间的亲缘关系分析。
2.3 不同植物F3H基因mRNA序列的同源性和遗传距离比较分析
为清楚阐明黑稻、水稻与不同物种间的亲缘关系,本研究计算了不同物种间的同源性和遗传距离(表3)。结果发现黑稻与籼稻完全相同,粳稻和籼稻、黑稻的同源性为99.6 %,与禾本科的小麦﹑玉米相比,同源性分别为84.9 %、83.8 %,水稻与其他植物同源性均在66.7 %以上。水稻与小麦的遗传距离为0.152~0.153,和玉米遗传距离为0.162~0.163,水稻与小麦的亲缘关系较玉米近一些。不同植物之间的同源性都在65.1 %(柑橘和玉米)以上,遗传距离都在0.349(柑橘和玉米) 以内,数据表明F3H序列相对保守,是一个比较原始的基因,对于植物生长发育过程中必是不可少的。由于籼稻、黑稻与小麦和玉米的亲缘关系相对于粳稻要稍近一些,可以基于该结果判断籼稻和本研究的黑稻比粳稻要古老一些,更接近于水稻祖先。
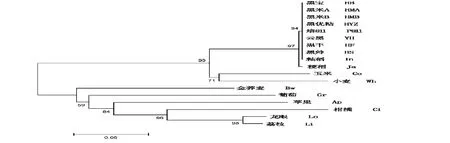
图3 基于F3H基因序列的聚类分析Fig.3 Cluster analysis based on F3H sequence
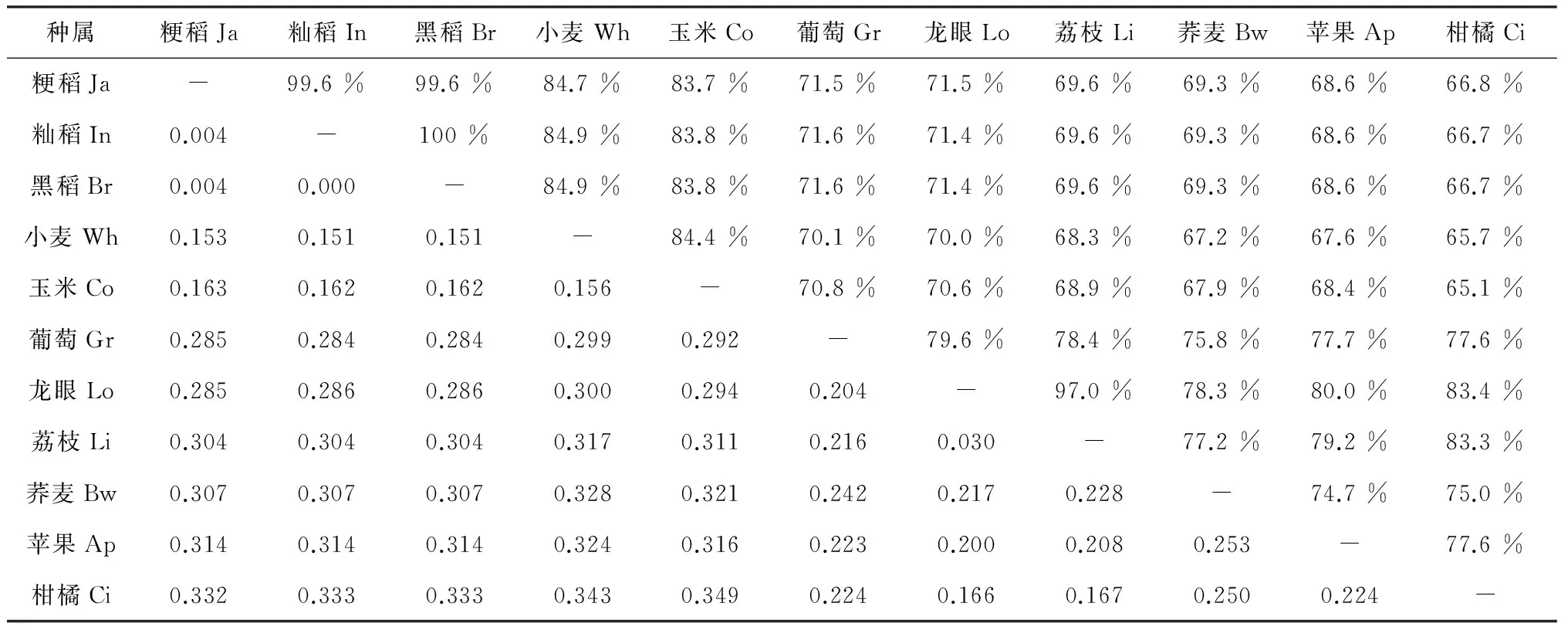
种属粳稻Ja籼稻In黑稻Br小麦Wh玉米Co葡萄Gr龙眼Lo荔枝Li荞麦Bw苹果Ap柑橘Ci粳稻Ja-99.6%99.6%84.7%83.7%71.5%71.5%69.6%69.3%68.6%66.8%籼稻In0.004-100%84.9%83.8%71.6%71.4%69.6%69.3%68.6%66.7%黑稻Br0.0040.000-84.9%83.8%71.6%71.4%69.6%69.3%68.6%66.7%小麦Wh0.1530.1510.151-84.4%70.1%70.0%68.3%67.2%67.6%65.7%玉米Co0.1630.1620.1620.156-70.8%70.6%68.9%67.9%68.4%65.1%葡萄Gr0.2850.2840.2840.2990.292-79.6%78.4%75.8%77.7%77.6%龙眼Lo0.2850.2860.2860.3000.2940.204-97.0%78.3%80.0%83.4%荔枝Li0.3040.3040.3040.3170.3110.2160.030-77.2%79.2%83.3%荞麦Bw0.3070.3070.3070.3280.3210.2420.2170.228-74.7%75.0%苹果Ap0.3140.3140.3140.3240.3160.2230.2000.2080.253-77.6%柑橘Ci0.3320.3330.3330.3430.3490.2240.1660.1670.2500.224-
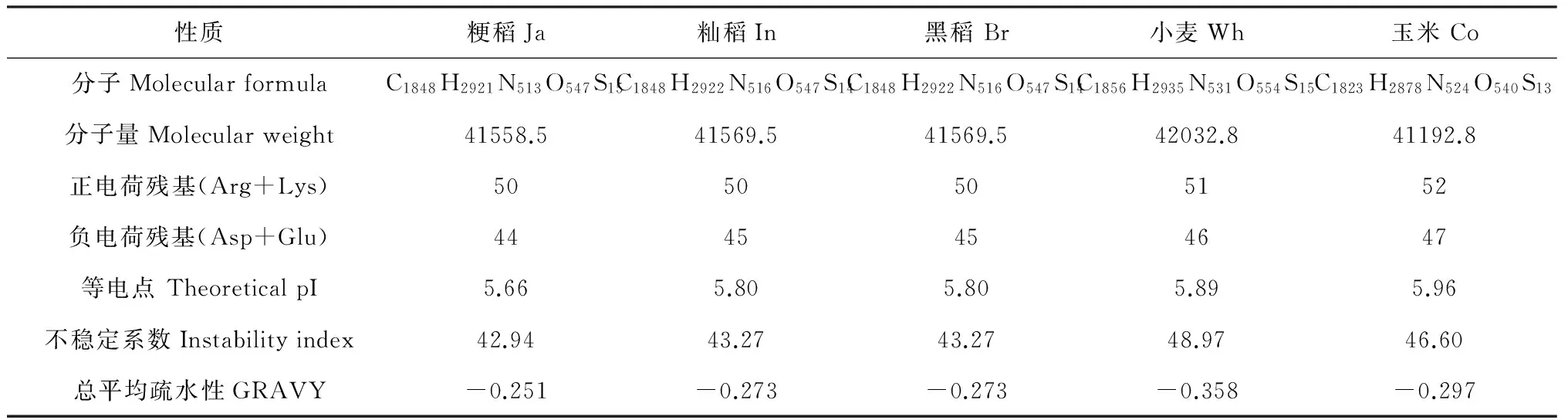
表4 F3H蛋白理化性质
2.4 禾本科F3H蛋白质的理化性质与功能预测分析
稻属植物F3H由377个氨基酸组成,研究发现籼稻和黑稻F3H mRNA序列在编码区有4个突变位点,其中722位的C/G颠换引起的第241位的丙氨酸(Ala)突变为甘氨酸(Gly),899位的T/G转换遗传变异引起第300位氨基酸甲硫氨酸(Met)突变为精氨酸(Arg)。为了进一步分析2个位点氨基酸的变化可能引起的理化性质和功能变化,在www.expasy.org上对不同植物F3H的部分理化性质及三维结构进行了预测分析(表4、图4)。比较发现禾本科4种植物F3H蛋白为370~380个氨基酸;在理论等电点上,籼稻、黑稻为5.80,高于粳稻,低于小麦、玉米;总疏水性上,籼稻、黑稻低于粳稻,高于小麦、玉米;不稳定性上,籼稻、黑稻高于粳稻,低于小麦、玉米;在蛋白质三维结构上,粳稻与籼稻和汉中黑稻无明显差异存在。通过NetPhos2.0、NetOGlyc3.0、NetNGlyc1.0程序对粳稻和籼稻及黑稻F3H的结构进行预测,发现磷酸化位点、O连接糖基化位点、N连接糖基化位点均无差异。
3 讨 论
花青素是一种带有氧正离子的天然色素,具有很强的抗氧化性,能清除体内积累的自由基,对很多疾病有一定的缓解作用[8],因而备受关注。目前,关于黑稻花青素的研究主要集中在花青素的提取、功能活性及开发利用方面[9-12],而关于黑稻花青素合成的分子调控机制研究相对较少。花青素的合成途径受许多结构基因和调控基因影响,结构基因主要包括苯丙氨酸裂解酶、肉桂酸羟化酶、查尔酮合成酶、黄烷酮3-羟化酶(F3H)、二氢黄酮醇还原酶、花青素合成酶等[13]。F3H在花青素合成中负责催化4,5,7-三羟基黄烷酮C3位的羟化,生成二氢黄酮醇,对花色的形成具有重要作用[14]。目前研究表明植物F3H基因均有3个外显子,2个内含子,编码350~380个氨基酸[15]。已经有学者报道一些植物中果色及花色突变体的F3H 表达水平存在差异,表明 F3H 在花青素合成代谢过程中发挥重要作用[16-17]。A.Zuker等利用反义RNA技术抑制香石竹F3H表达,使花色发生不同程度的改变,花瓣颜色变浅,甚至出现了白色[18]。F.Jiang等在草莓中反义抑制F3H的表达,阻断了花青素合成,进而影响果实中花青素积累[19]。L.Jaakola等发现正常蓝莓成熟过程中,F3H大量表达,花青素含量急剧增加,果实由绿色经红色变成黑紫色,但在白色和红色突变体果实中基本检测不到F3H的表达[20]。因此,本研究以黄烷酮3-羟化酶(F3H)作为黑稻花青素合成的一个候选基因来分析,探索该基因的变异是否与黑稻中花青素沉积有一定的关系。
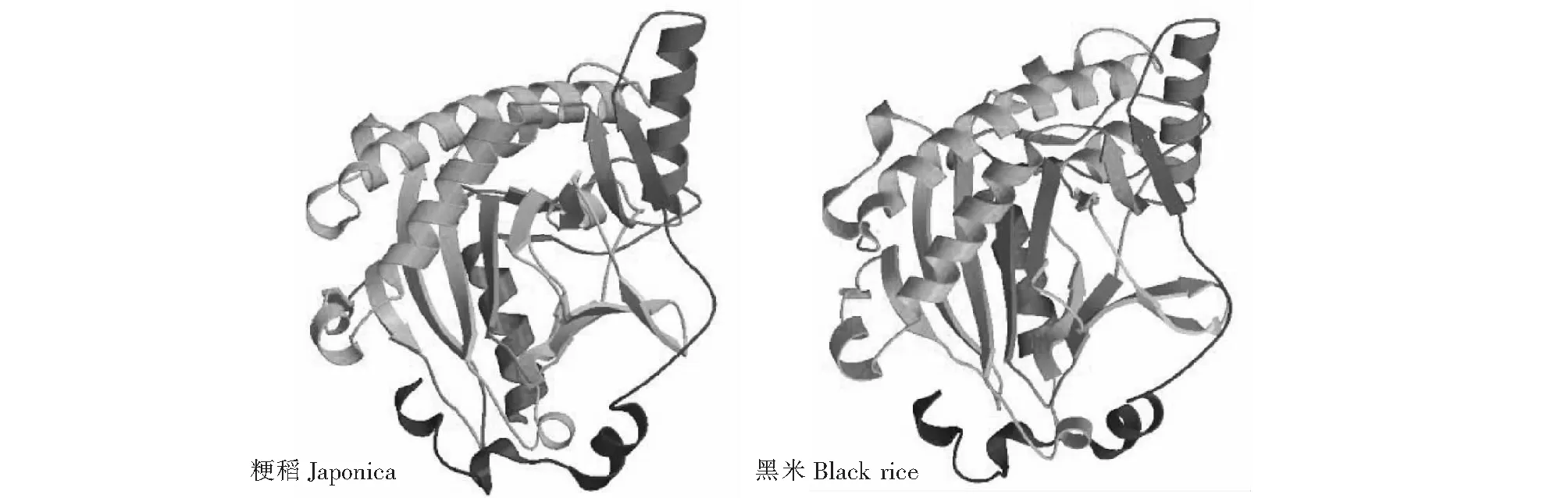
图4 F3H蛋白三维结构Fig.4 Three dimensional model F3H protein
由于植物体内黄酮物质的形成与色素的沉积是植物形成所具有的一个基本特征,所以认为F3H基因是一个相对古老的基因,基因结构和序列相对保守,在漫长的历史进化中,物种遗传分化会导致不同物种的F3H存在很大差异,可以作为花青苷合成和物种鉴定的一个候选基因。本实验首次获得了汉中地区8个黑稻品种F3H基因mRNA序列,通过BLAST分析,将水稻F3H基因定位在4号染色体。研究结果发现8个黑稻品种F3H基因序列相同,且与籼稻一样,与普通粳稻的F3H相比,存在4处突变位点,导致2处氨基酸序列改变。通过蛋白质理化分析发现黑稻F3H的不稳定性较粳稻高一些,而蛋白质结构预测及磷酸化位点、O连接糖基化位点、N连接糖基化位点分析,两者之间均无差异。结合其他学者关于F3H对花青素合成的研究记过,本研究认为黑稻F3H的突变可能与酶的催化活性无关,需要进一步研究黑稻中F3H基因表达水平对花青素合成的影响。另外,本研究基于F3H序列构建的黑稻、籼稻、粳稻和其他物种的系统进化树结果表明F3H基因可以作为种属鉴定的一个候选基因,但不能准确区分种内品种间的遗传关系。聚类分析和遗传距离结果发现籼稻、黑稻与小麦和玉米的遗传距离稍近一点,可能初步判断籼稻要比粳稻更古老一些,要确切分清两者的进化关系,还需扩大范围系统研究。
[1]张 羽,李新生,冯志峰,等.陕西省有色稻资源的SSR多态性分析[J].植物遗传资源学报,2011(5):828-832.
[2]马挺军,任贵兴.色稻功能成分研究进展[J].中国农学通报,2010(11):61-66.
[3]Hu J P,Reddy V S,Wessler S R.The rice R gene family:Two distinct subfamilies containing several miniature inverted-repeat transposable elements[J]. Plant MolBiol,2000(42):667-678.
[4]Sakamoto W, Ohmori T, Kageyama K, et al. The Purple leaf (Pl) Locus of Rice:the Plw Allele has a Complex Organization and Includes Two Genes Encoding Basic Helix-Loop-Helix Proteins Involved in Anthocyanin Biosynthesis [J]. Plant Cell Physiol, 2001(42):982-991.
[5]马廷蕊,张金文,梁慧光,等.植物花青素合成与基因调控(英文)[J].Agricultural Science & Technology, 2012(3):507-511+54.
[6]王彩霞,舒庆尧.水稻紫色种皮基因Pb的精细定位与候选基因分析[J].科学通报,2007(21):2517-2523.
[7]ZHANG Y,BO G.R. Evluation of authentication of methodology on genonmic DNA isolation of plant[J]. Drag Evaluation,2004(4):292-297.
[8]沈 芸,肖 鹏,包劲松.水稻营养成分遗传育种研究进展[J].核农学报,2008(4):455-460+425.
[9]李新生,邓文辉,吴三桥,等.陕西三种特种稻米氨基酸及品质分析[J].氨基酸和生物资源,2001(4):1-3.
[10]丁 锐.黑稻主要栽培品种过氧化物酶同工酶的研究[J].安徽农业科学,2005(6):947-948.
[11]王胜宝,冯志峰,李新生,等.陕西汉中特种稻产业发展现状及前景[J].新疆农业科学,2010(S2):147-150.
[12]曹小勇,李新生.黑米花色素苷类色素研究现状及展望[J].氨基酸和生物资源,2002(1):3-6.
[13]邵雅芳,徐非非,唐富福,等.水稻花青素合成相关基因的时空表达研究[J].核农学报,2013(1):9-14.
[14]李 明,王玉红,李长生,等.花生黄烷酮3-羟化酶基因AhF3H的克隆和表达分析[J].山东农业科学,2013(11):1-6.
[15]石少川,高亦珂,张秀海,等.植物花青素生物合成相关基因的研究及应用[J].植物研究, 2011(5):633-640.
[16]Yang Y, Zhao G, Yue W, et al. Molecular cloning and gene expression differences of the anthocyanin biosynthesis-related genes in the red/green skin color mutant of pear (PyruscommunisL.) [J].Tree Genetics&Genomes,2013(9):1351-1360.
[17]Martin C, Prescott A, Mackay S, et al. Control of anthocyanin biosynthesis in flowers of Antirrhinum majus[J]. The Plant Journal,1991,1(1):37-49.
[18]Zuker A, Tzfira T, Ben-Meir H, et al. Modification of flower color and fragrance by antisense suppression of the flavanone 3-hydroxylase gene[J].Molecular Breeding,2002,9(1):33-41.
[19]Jiang F, Wang J, Jia H, et al. RNAi-mediated silencing of the flavonone 3-hydroxylase gene and its effect on flavonoid biosynthesis in strawberry fruit[J]. Journal of Plant Growth Regulation, 2013, 32 (1):182-190.
[20]Jaakola L, Mättä K, Pirttilä A M,et al. Expression of genes involved in anthocyanin biosynthesis in relation to anthocyanin, proanthocyanidin, and flavonol levels during bilberry fruit development[J]. Plant Physiology, 2002,130(2):729-739.
(责任编辑 李 洁)
Genetic Variation of Flavanone 3-Hydroxylase(F3H)of Black Rice Varieties in Hanzhong
ZHANG Tao ,YIN Ya-jun, LU Hong-zhao, WANG Ling
(School of Biological Science Technology and Engineering, Shaanxi University of Technology, Hanzhong Shaanxi 723100,China)
The full coding sequence of F3H was isolated from the 8 Black rice breeds in Hanzhong by PCR and sequencing. BLAST analysis found that the gene is located on the chromosome 4 of rice for the first time. The 8 black rice breeds andIndicahave the sameF3Hcoding sequence .There were 4 mutational sites betweenIndicaandJaponica, and resulting in 2 amino acid mutations. The phylogenetic tree indicated that black rice was very closely toIndica,Japonica, wheat, corn. The genetic distances and homology analysis showed that conservedF3Hgene was an ancient gene, and can be used to species identification . The physicochemical properties prediction of F3H found no significant differences between Black rice and other gramineae plants. There are no significant differences in the three dimensional structure of F3H protein and the related active site prediction of Japonica and Black rice. Therefore, it is considered that Black riceF3Hsequence variation may be unrelated to the synthesis of anthocyanins, and we need to further study on the expression level ofF3H.
Black rice; Flavanone 3-Hydroxylase; Sequence analysis; Genetic variation
1001-4829(2016)10-2257-06
10.16213/j.cnki.scjas.2016.10.001
2015-12-16
陕西省科技厅农业攻关项目(2013K02-26-02)
张 涛(1978-),男, 硕士,副教授,主要从事分子遗传学研究,E-mail:zl780823@163.com。
S511
A

