干巴菌抗氧化性的研究
刘品华,刘明研,杨 涛,杨 芬*
(1.曲靖师范学院化学化工学院,云南 曲靖 655011;2.广西百色农业学校,广西 百色 533000)
干巴菌抗氧化性的研究
刘品华1,刘明研2,杨 涛1,杨 芬1*
(1.曲靖师范学院化学化工学院,云南 曲靖 655011;2.广西百色农业学校,广西 百色 533000)
采用Schaal烘箱法诱导氧化,以二丁基羟基甲苯(BHT)为参照,研究干巴菌干粉及乙醇、石油醚提取物抗猪油氧化的效果,用过氧化值(POV)抑制率分析抗氧化持续时间,并测试BHT、干巴菌乙醇提取物的还原能力、清除DPPH自由基的能力和清除羟基自由基的能力。结果表明,抗猪油氧化效果是乙醇提取物(0.2 g/kg)>石油醚提取物(0.2 g/kg)>BHT(0.2 g/kg)>干巴菌干粉(10 g/kg)。抗氧化效果的持续时间乙醇提取物=干粉>BHT>石油醚提取物。乙醇提取物还原能力、清除羟基自由基能力低于BHT,清除DPPH自由基的能力高于BHT,用清除DPPH自由基能力反映抗油脂氧化是合理的。
干巴菌;过氧化值;抗氧化;DPPH自由基
干巴菌(ThelephoraganbajunZang) 主要生长于亚热带云南松林或针阔混交林下,为云南特有珍稀野生菌[1],是一种狭域性分布的可食高等真菌,主要分布在昆明、呈贡、嵩明、安宁、楚雄、易门、保山、曲靖、马龙等地市(县) ,其分布区大约在北纬22°~27°,东经99°~106°,集中在海拔1000 ~2200 m的松林中。资料表明,云南省干巴菌年产量超过10 000 t[2-3]。同其它食用菌相比,干巴菌不仅具备独特、浓郁的鲜香味,也含有大量的营养物质,如氨基酸、蛋白质、黄酮、粗多糖、矿质元素、维生素等,具有很高的营养保健价值[4]。目前在油脂食品工业上一直采用添加BHT、BHA、TBHQ等来抑制氧化酸败。许多研究指出,这些人工合成的抗氧化剂,大量或长期使用会导致畸形胎和癌症的发生[5-7]。天然抗氧化剂能有效控制油脂的酸败和降低有害物质的产生,逐渐被应用于油脂工业中。优良的抗氧化剂不但要有好的抗氧化效果还要有较长的持续时间及安全性[[8-9]。干巴菌抗氧化活性相关的报道较少,为此笔者研究了野生食用干巴菌在猪油中的抗氧效果及还原能力、清除DPPH自由基和清除羟基自由基的能力,旨在探讨抗油脂氧化链传递过程中的情况,为油脂食品工业控制酸败,探索高效抗氧化剂的筛选,充分开发利用天然干巴菌资源提供科学依据。
1 材料与方法
1.1 材料
鲜干巴菌(由云南曲靖马龙金发酒楼提供);猪油(农贸市场购买新鲜猪肥膘,实验室火炼法提取);1,1-二苯-2-苦基肼(DPPH)(日本原装进口);BHT(郑州龙和化工有限公司,食品级);水杨酸(天津市化学试剂三厂);乙醇(天津市风船化学试剂科技有限公司)等试剂均为AR级。
1.2 仪器
紫外可见分光光度计(TU-1810型,北京普析通用仪器有限责任公司)、电子天平(AL204-IC型,梅特勒-托利多仪器上海有限责任公司);恒温培养箱(29SN-DP-501,天津实验仪器厂);旋转蒸发仪(RE-52AAA型,上海伊利仪器制造有限公司);万能高速粉碎机(DFY-800C型, 温岭市林大机器有限公司)。
1.3 实验方法
1.3.1 原料预处理 鲜干巴菌于80 ℃烘干后粉碎过80目筛得原料干粉。原料干粉加入约3倍量的乙醇回流提取2 h后,抽滤。重复提取3次,清液用旋转蒸发仪浓缩后于80 ℃烘至恒重得乙醇提取物。同法采用石油醚回流提取得石油醚提取物。
1.3.2 抗氧化试验 猪油融化混匀,取50.0000 g猪油于50 mL比色管中。分别加入0.5000 g原料干粉;0.0100 g乙醇提取物、石油醚提取物、BHT。然后超声波处理10 min,同时做空白试验。置于60±1 ℃培养箱中,按诱导氧化设计时间,精密称取0.0100~1.0000 g试样于10 mL容量瓶中,按照GB/T5009.37中比色法检测过氧化值。试验标准曲线得回归方程:y=0.0273x-0.0113,R2=0.9990。试验结果见表1。
1.3.3 评价方法 按文献[10-11]中相对防效值和Pb值的计算方法做适当修改, 按下列公式计算POV的抑制率( %),POV抑制率越大说明抗氧化效果越好。POV抑制率稳定下降至试验结束的斜率值作为评价抗氧化持续时间能力,其值越大说明抗氧化的持续时间能力就越大。计算结果见表2。
POV抑制率(%)=
1.3.4 还原能力的试验 分别称取0.3360g,BHT、乙醇提取物用乙醇定溶于100mL容量瓶中,从中取出10mL定容到100mL容量瓶得0.336mg/mL待用溶液。
还原能力的测定:分别取待用溶液0.00、0.05、0.10、0.15、0.20、0.25mL,于25mL的比色管中,并补充甲醇至0.25mL(及得质量浓度为0.00、67.20、134.40、201.60、268.80、336.00μg/mL的溶液),考虑到实验样液的可能影响,采用不加铁氰化钾的为对应空白样。分别加入0.2mol/L的磷酸缓冲液(pH=6.6)2.50mL和1 %的铁氰化钾2.50mL,混合均匀,于50 ℃水浴中反应30min后快速冷却,加入10 %的三氯乙酸溶液2.50mL,混合均匀(澄清无需离心)。取清液2.50mL于试管中,加入甲醇2.50mL,再加入0.1 %的三氯化铁溶液0.50mL,混合均匀,于室温下静置反应10min,1cm石英比色皿在700.00nm处测定吸光度值。还原能力测定结果见图1。
1.3.5 清除DPPH自由基试验 待用溶液配置同1.3.4。称取20mg的DPPH用无水乙醇溶解定容于250mL容量瓶中,配制成质量浓度2×10-4mol/L的DPPH溶液,0~4 ℃下避光保存。分别取待用溶液0.10、0.20、0.30、0.40、0.50、0.60mL于比色管中,补充乙醇至2mL,然后加入配制好的DPPH溶液2mL混匀(实验样液质量浓度8.40、16.80、25.20、33.60、42.00、50.40μg/mL),于室温暗处放置反应30min,在517nm下测得的吸光值为A1,以2 mL乙醇代替样液所测得的吸光值为A2,以2 mL乙醇或水代替DPPH溶液测得的吸光值为A3。实验结果见图2。试样对DPPH的清除率计算如下。
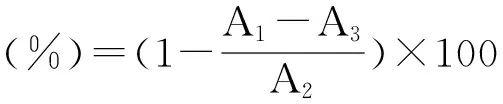
1.3.6 清除羟基自由基试验 待用溶液配置同1.3.4。分别取待用液0.10、0.20、0.30、0.40、0.50、0.60mL,于25mL的比色管中,各加入6mmol/L硫酸亚铁2mL,6mmol/L过氧化氢2mL,放置25min后加入6mmol/L的水杨酸-乙醇溶液,定容至25mL(即样液测试质量浓度为1.34、2.69、4.03、5.38、6.72、8.06μg/mL)。在常温反应30min,1cm石英比色皿于510nm处测定吸光度值Ax,以乙醇代替实验样液测得吸光度值为Ao,以乙醇代替水杨酸-乙醇组测得吸光度值Axo,以乙醇代替实验样液、水杨酸-乙醇的为空白管。对(·OH)的清除率结果见图3。试样对羟基自由基的清除率计算如下。
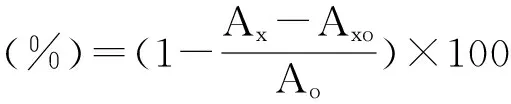
2 结果与分析
表1可知,抗猪油氧化效果:乙醇提取物>石油醚提取物>BHT>干巴菌干粉。乙醇提取物效果明显高于BHT。表2可看出,POV抑制率大于100 %的时间分别是,乙醇提取物为192 h,石油醚提取物的为144 h,BHT的为96 h,干巴菌干粉的为48 h。初期抑制率大于100 %,说明清除了原料猪油中原有的过氧化物及自由基。清除能力:乙醇提取物>石油醚提取物>BHT>干巴菌干粉,与抗氧化效果的总体表现一致。原因是加入的物质能干扰自由基反应的化学物质和消除自由基,显著地抑制了脂肪的自动氧化速率,延长脂肪氧化酸败的引发期,有效控制了油脂的过氧化值[7]。888 h乙醇提取物的抑制率比BHT还高出9 %,石油醚提取物、干巴菌干粉的略高于BHT。随着诱导氧化时间的延长,POV抑制率逐渐下降,当对照样的过氧化物进入增值期后POV抑制率又逐渐上升,随后又逐渐下降。乙醇提取物、干巴菌干粉、BHT、石油醚提取物分别从432、480、480、432 h后抑制率成线性关系逐渐下降,其斜率分别为-0.024、-0.024、-0.029、-0.031,其值大小与抗氧化的持续时间能力成相关性,表明抗氧化效果的持续时间是:乙醇提取物=干巴菌干粉>BHT>石油醚提取物。与抗猪油氧化效果排序不一致的原因可能是:干巴菌干粉中抗氧化有效成分逐渐溶出,表现出较好的持续有效时间能力;而石油醚提取物易溶于油脂,初期消耗抗氧化有效成分过快,随时间的延长易挥发成分也可能挥发,导致抗氧化效果的持续时间能力下降。
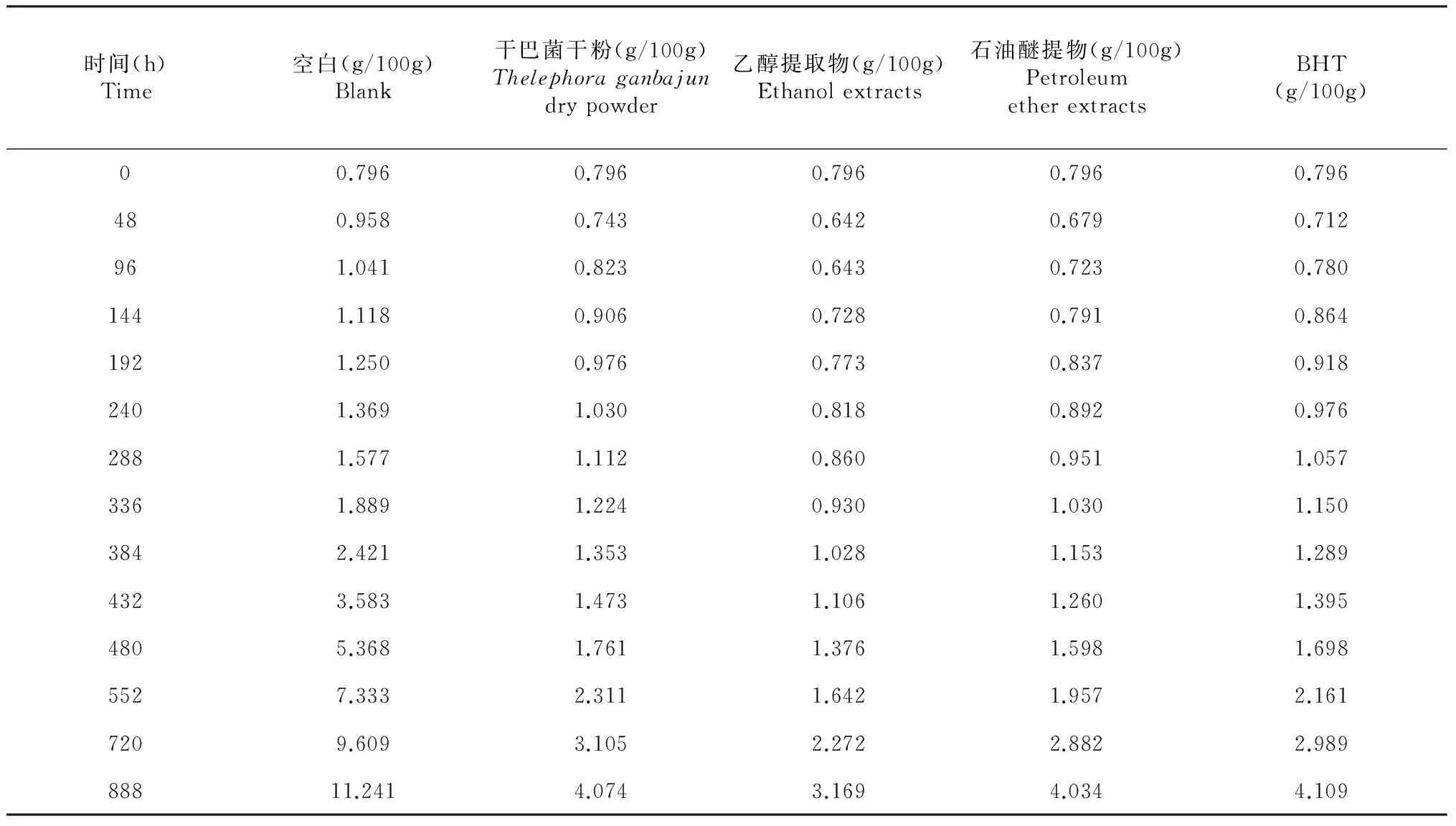
表1 抗猪油氧化POV值

表2 POV抑制率
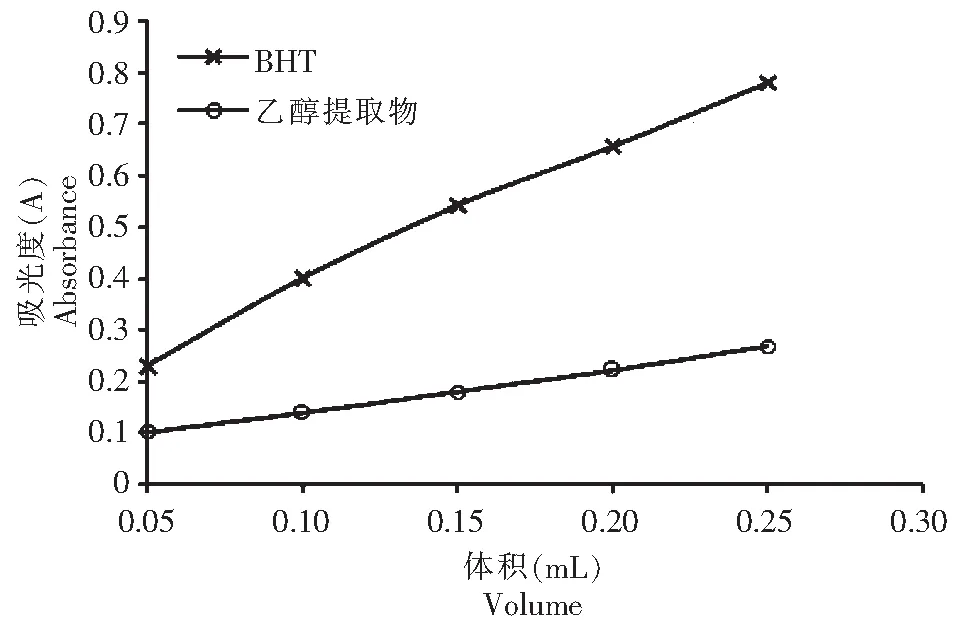
图1 乙醇提取物、BHT的还原能力Fig.1 The reduction activity of the ethanol extract and BHT

图2 乙醇提取物、BHT清除DPPH自由基的能力Fig.2 The scavenging activity to DPPH free radical of the ethanol extracts and BHT
从图1、图3可看出,乙醇提取物的还原能力、清除羟基自由基能力明显低于BHT,与抗油脂氧化能力相反。从图2可看出,乙醇提取物清除DPPH自由基的能力明显高于对照样BHT,与抗油脂氧化能力是一致的。
3 讨 论
脂类有酶与非酶氧化两种机制。热加工过的油脂,酶氧化不是主要的原因。非酶氧化主要是光敏氧化及自动氧化,并且相互作用,光和产生自由基的物质能催化脂肪自动氧化,产生大量的氢过氧化物,光引发的氧化反应量子产额超过1[12],油脂氧化物的电极电势应当大于-2.1065[7]。从脂类中双键的α-位的H原子分裂出来的均裂原子团开始,形成的碳原子团与氧反应生成过氧化原子团,过氧化原子团进入链反应形成一级有机过氧化物,过氧化物作为脂类自动氧化的主要初期产物是不太稳定的,它经过复杂的分裂和相互作用,导致产生二级产物,最终形成小分子挥发性物质,如醛、酮、酸、醇、环氧化物或聚合成聚合物。其中温度越高,过氧化值的结果越高,变化也越快[13]。一级有机过氧化物形成的速率超过其分解速率,而后阶段则相反。
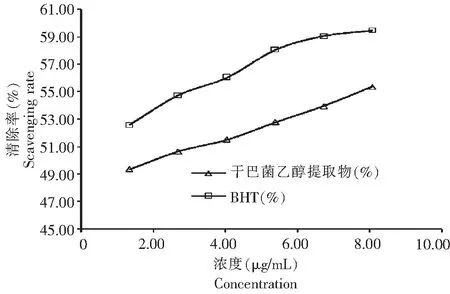
图3 乙醇提取物、BHT清除羟基自由基的能力Fig.3 The scavenging activity to hydroxyl free radical of the ethanol extracts and BHT
铁氰化钾法测试还原能力是通过供给电子把三价铁还原为二价铁进行测试。还原能力是还原物质给出电子的能力,通过给出电子从而还原具有氧化性的物质,其还原能力大小与被还原物质的氧化能力(得电子能力)有关。脂肪自动氧化遵循自由基机制,干扰自由基反应的物质也能显著地抑制脂肪自动氧化的速率[12]。测试还原能力的原理与油脂氧化的自由基机理不一致,试验结果证明用还原能力的大小作为判断在油脂中抗氧化效果是不可靠的。
DPPH 自由基是一种合成的、具有单电子、以氮为中心的顺磁化合物,能稳定存在较长时间,DPPH 法没有底物,DPPH 自由基能直接获得,不需通过化学反应制备。脂质氧化生成的脂质自由基R·、过氧自由基ROO·和烷氧自由基RO·与抗氧化剂间发生的反应是氢原子转移(Hydrogen Atom Transfer,HAT)反应,一般认为DPPH 法与抗氧化剂间的反应也是HAT。而脂质氧化生成的自由基活性高、存在时间短暂[14],所以能有效清除DPPH自由基的物质一定能有效的抑制油脂中主要链传递的自由基,降低一级有机过氧化物的形成,具有较好的抗油脂氧化效果,反之则不一定。
油脂羟基自由基在传递阶段产生[15],是一种能够激发油脂过氧化反应的较强氧化剂,羟基自由基清除能力可能是抗氧化剂还原力、供氢能力和活性氧清除能力的综合体现[16]。但试验结果乙醇提取物清除羟基自由基的能力不如BHT,而抗油脂氧化的能力比BHT强,说明羟基自由基在油脂氧化的链传递过程中不是主要因素。
干巴菌乙醇提取物中含有能高效控制油脂氧化的成分,其抗油脂氧化效果和持续时间的能力明显优于BHT。试验证明,乙醇提取物的还原能力、清除羟基自由基能力比BHT的低,但有更强的清除DPPH自由基的能力,且与抗油脂的氧化能力一致,说明油脂氧化过程的传递主要是脂质自由基R·、烷氧自由基RO·和过氧自由基ROO·,不是羟基自由基。通过测定物质对 DPPH 自由基的清除能力,可以较迅速地评价物质的抗氧化能力[17],用清除DPPH自由基能力作为判断抗油脂氧化效果也是比较合理。试验结果不仅有助于说明抗氧化的主要作用机制,对筛选高效抗氧化剂的研究也有一定的指导意义。进一步对干巴菌乙醇提取物的研究,有望找到抗油脂氧化效果好且安全性高的物质。
[1]陈亚萍, 邱开雄, 陈亚娟, 等. 干巴菌抗氧化活性研究[J]. 昆明医学院学报, 2012(1):40-42.
[2]邰丽梅, 赵春艳, 郭 相, 等. 云南几类野生食(药) 用菌资源开发应用前景[J]. 中国食用菌, 2013, 32(2):4-6.
[3]桂明英, 刘 蓓, 朱 萍, 等. 干巴菌生态学初步研究[J]. 西南农业学报, 2005, 18(3):325-327.
[4]吴少雄, 王保兴, 郭祀远, 等. 云南野生食用干巴菌的营养成分分析[J]. 现代预防医学, 2005, 32(11):1548-1549.
[5]孟 洁, 杭 瑚. 诃子对食用油脂抗氧化作用的研究[J]. 食品科技, 2000(2):36-38.
[6]陈莉华, 左林艳, 唐玉坚. 微波辅助乙醇提取姜辣素及其对油脂的抗氧化性研究[J]. 食品科学, 2011, 32(4):69-73.
[7]刘品华, 刘明研, 尹吉花, 等. 氢气对油脂过氧化值的影响研究[J]. 食品工业科技, 2011, 32(6):111-117.
[8]郑朋朋, 李 珊, 杨正涛,等. 响应面优化玛咖多酚提取工艺及其抗氧化性分析[J]. 南方农业学报, 2015, 46(8):1480-1487.
[9]罗泽萍, 潘立卫, 李 丽. 华山矾多糖提取工艺优化及其抗氧化活性研究[J]. 南方农业学报, 2015, 46(10):1877-1882.
[10]刘明研, 杨光红, 陈兰昕, 等. 大蒜抗油脂氧化效果的研究[J]. 食品工业, 2012, 33(12):121-124.
[11]刘品华, 杨光红, 田雪莲等. 小黑药抗油脂氧化及抑菌效果研究 [J]. 食品工业科技, 2011, 32(10):187-189.
[12]王 璋, 许时婴, 江 波, 等. 食品化学[M]. 北京:中国轻工业出版社, 2003:211.
[13]Seoung W J, Min-Soo K.Preparation and characterization of simvastatin/hydroxyp-ropyl-β-cyclodextrin inclusion complex using supercritical antisolvent(SAS) process[J].European Journal of Pharmaceutics and Biopharmaceutics,2007,66:413-421.
[14]王 会. 筛选和评价天然抗氧化剂的方法-DPPH 法[J]. 广州化工, 2013, 44(22):30-32.
[15]张明成. 油脂氧化机理及抗氧化措施的介绍[J]. 农业机械, 2011(3):49-51.
[16]陈 莹, 朱振中, 邵志芳, 等. 抗氧化活性综合评价方法研究[J]. 应用化工, 2012, 44(1):123-125.
[17]刘品华, 金亚蓉, 刘明研, 等. 臭参地上部分总黄酮含量及抗氧化活性的研究[J]. 西南农业学报, 2014, 27(5):1894-1898.
(责任编辑 王家银)
Study on Antioxidant Activity ofThelephoraganbajun
LIU Pin-hua1, LIU Ming-yan2, YANG Tao1, YANG Fen1*
(1.College of Chemistry and Chemical Engineering, Qujing Normal University, Yunnan Qujing 655011, China; 2.Guangxi Baise Agriculture School, Guangxi Baise 533000, China)
The antioxidant effect of dried-powder, ethanol and petroleum ether extracts fromThelephoraganbajunwas studied by Schaal oven induced oxidation method, meanwhile, dibutylhydroxytoluene (BHT) was used as a reference. The duration time of antioxidant effect was analyzed using Peroxide value (POV) inhibitory rate. The reduction activity, scavenging activity to DPPH free radical and hydroxyl free radical of BHT and the ethanol extracts fromT.ganbajunwere tested. The results showed that the sequence of antioxidant effect to the lard was the ethanol extracts (0.2 g/kg) > the petroleum ether extracts (0.2 g/kg) > BHT(0.2 g/kg) > dried-powder(10 g/kg). The order of duration time of antioxidant effect was the ethanol extracts= dried powder > BHT> the petroleum ether extracts. The reduction activity and scavenging activity to hydroxyl free radical of the ethanol extracts was lower than those of BHT, but the scavenging activity to DPPH free radical of the ethanol extracts was higher than that of BHT. It was reasonable that the scavenging activity to DPPH free radical reflects the anti lipid oxidation.
Thelephoraganbajun; Peroxide value; Antioxidant activity; DPPH Free radical
1001-4829(2016)10-2330-05
10.16213/j.cnki.scjas.2016.10.014
2014-12-17
上海师范大学资源化学省部共建教育部重点实验室;曲靖师范学院资源与环境化学重点实验室(SYS2010BX01)
刘品华(1963-),男,教授,从事食品化学、分析方面的研究工作,E-mail:406051584@qq.com,*为通讯作者,E-mail:yangfen6688@163.com。
S646
A

