3种高山杜鹃对低温的生理响应
黄承玲,赵孝梨,刘广超
(1. 贵州民族大学 化学与环境科学学院,贵州 贵阳 550025;2. 贵州民族大学 人文科技学院,贵州 贵阳 550025)
3种高山杜鹃对低温的生理响应
黄承玲1,2,赵孝梨1,刘广超2
(1. 贵州民族大学 化学与环境科学学院,贵州 贵阳 550025;2. 贵州民族大学 人文科技学院,贵州 贵阳 550025)
为探明高山杜鹃的抗寒性机理,促进其新品种选育及开发利用,通过人工控温方法研究低温对露珠杜鹃、大白杜鹃和迷人杜鹃叶片抗氧化酶活性及渗透调节物质、可溶性蛋白质和丙二醛(MDA)含量的影响。结果表明:随胁迫温度的降低,3种杜鹃叶片SOD活性呈下降后上升再下降趋势。其中,10 ℃时迷人杜鹃叶片SOD活性为对照的87.7 %。大白杜鹃叶片POD活性呈上升趋势,0 ℃时POD活性为对照的1.58倍;迷人杜鹃和露珠杜鹃叶片POD活性呈先上升后下降趋势。3种杜鹃叶片渗透物质含量呈上升趋势。大白杜鹃和迷人杜鹃叶片的可溶性蛋白质含量呈先上升后下降趋势。露珠杜鹃叶片可溶性蛋白质的含量呈持续上升趋势。3种杜鹃叶片的MDA含量和质膜相对透性均呈上升趋势,且大白杜鹃的MDA含量和质膜相对透性较其他2种高,0 ℃时大白杜鹃、迷人杜鹃和露珠杜鹃叶片的MDA含量依次为18.97、12.5和9.97 nmol/mg。露珠杜鹃和迷人杜鹃的抗寒能力比大白杜鹃强。
高山杜鹃;低温;抗氧化酶活性;可溶性蛋白质含量;丙二醛含量;质膜相对透性
高山杜鹃花多且艳,树形美观,具有较高的园林观赏价值,在西方园林里具有重要地位,在国内的园林利用也渐渐兴起。全世界高山杜鹃有1000种左右,我国是主要分布中心之一。原产于我国的高山杜鹃种类达570余种,除新疆和宁夏外,其余省市均有自然分布。朱红等[1]研究发现,受不同海拔(800~5000 m)高度各类立地气候条件的长期影响,杜鹃形成了各种不同的生态型,其对低温寒害均产生了一定的抗性。有研究表明,寒冷温度对杜鹃栽培利用与地理分布密切相关。因此,为了更加科学的应用高山杜鹃,研究其抗寒机理对其开发利用具有重要意义。国外对高山杜鹃抗寒机理的研究开展得较早,但国内对高山杜鹃抗寒性的研究起步较晚。余丽玲等[2-3]研究了低温对西洋杜鹃生理生化指标及叶片叶绿素荧光的影响;张艳红等[4-5]对辽宁的杜鹃种类的耐寒性进行调查评价,并研究了低温对丹东杜鹃花期的影响;刘旭颖等[6-7]分析了辽宁地区9种耐寒杜鹃的亲缘关系,并研究其叶片结构的差异;鲍思伟[8-9]研究了云锦杜鹃(RhododendronfortuneiLindl.)在自然降温过程中水分、渗透调节物质的动态变化,探讨这些物质的动态变化及其与低温半致死温度间的关系;熊燕等[10]探讨了低温胁迫对4种高山杜鹃杂交品种生理的影响。可见,已有的相关研究涉及的杜鹃种类较少,区域较窄。贵州省百里杜鹃自然保护区分布有43种杜鹃[11],其中,露珠杜鹃、大白杜鹃和迷人杜鹃是主要的保护和观赏对象,加之保护区是全国杜鹃天然杂交区域,杂交常发生在常绿杜鹃亚属的种类之间,是培育杜鹃新品种的宝贵资源。为此,笔者选取保护区内自然分布的3种常绿杜鹃亚属的杜鹃为研究对象,通过测定人工低温胁迫条件下其叶片的抗寒性相关生理指标,综合评价3种高山杜鹃的抗寒性,旨在为其耐寒品种选育和开发利用提供依据。
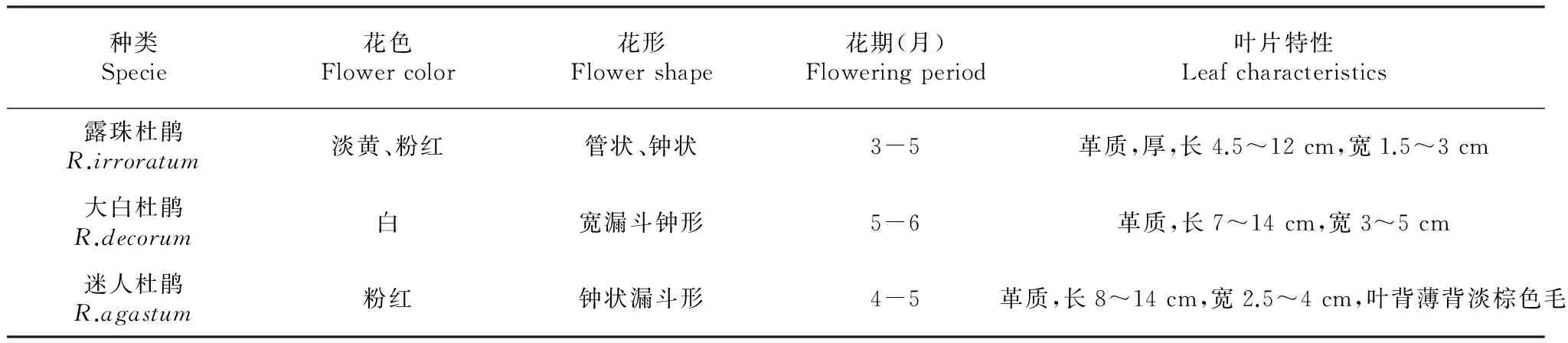
表1 露珠杜鹃、大白杜鹃和迷人杜鹃的生物学特性
1 材料与方法
1.1 供试材料
采用露珠杜鹃、大白杜鹃和迷人杜鹃3种高山杜鹃的3年生幼苗作为试验材料,幼苗取自百里杜鹃保护区的育苗基地,苗木生长正常,其花与叶片特性见表1[11]。
1.2 试验设计
2010年4月分别将3种杜鹃长势一致的3年生实生幼苗移植于普通塑料花盆内(上口径、下口径和高分别为300、200和250 mm),每盆1株,每种54盆。栽培基质为普通园土,每盆盛土5.0 kg,种植后进行常规管理。
抗寒性试验于2010年6月在人工气候箱中进行。试验设5个处理,分别为20(CK)、15、10、5和0 ℃,培养箱空气相对湿度80 %,每天光照12 h,光强约15 000 lx。每个处理3株,3次重复。试验期间及时补充水分,观察记录叶片形态变化。
1.3 生理指标测定
处理10 d后取叶测定相关生理生化指标。摘取同一方向的中部叶3~4片,去除叶柄装袋编号封存,置入冰桶中带回实验室后,立即剪碎分别按种类混合均匀后测试样品的理化指标,测定酶活性和丙二醛(MDA)取样0.2 g,测定可溶性蛋白质含量时取样0.4 g,测定游离脯氨酸和可溶性糖含量时取样0.1 g。
质膜透性采用相对电导率法[12],酶活性及MDA含量采用南京建成生物有限公司的试剂盒测定。超氧化物歧化酶(SOD)活性测定以其抑制氮蓝四唑(NBT)光反应50 %为1个单位酶活性(单位为U/mg);过氧化物酶(POD)活性采用愈创木酚法测定,以每1 min OD470增加0.1为1个单位酶活性,POD单位为U/(mg·min);MDA测定采用TBA法,单位为nmol/mg。可溶性蛋白质、游离脯氨酸和可溶性糖的测定参照文献[13]的方法,可溶性蛋白质用考马斯亮蓝法测定,游离脯氨酸测定采用酸性茚三酮比色法,可溶性糖的测定采用葸酮比色法。
1.4 数据统计与分析
试验数据用SPSS进行方差分析,运用Duncan氏新复极差法进行处理间差异显著性分析。所有数据用 Excel软件进行处理并作图。
2 结果与分析
2.1 低温胁迫3种杜鹃叶片的外部形态
逆境条件下植物外部形态尤其是叶片有明显的变化,观察叶片受损程度是评价植物对逆境抗性强弱最为可靠和直接的指标,0~10 ℃低温会使植物叶片出现变色、坏死等寒害症状。试验中,0~20 ℃3种杜鹃叶片均未出现寒害症状,表明3种杜鹃具有一定的抗低温寒害能力。
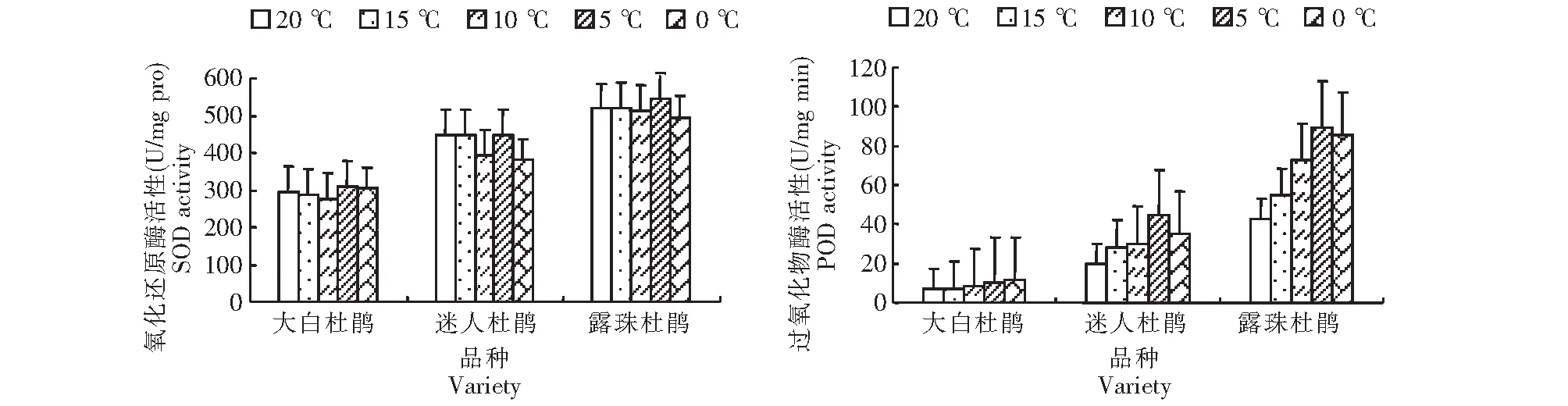
图1 低温胁迫3种杜鹃叶片的抗氧化酶活性Fig.1 Antioxidant enzyme activities of Rhododendron leaves under low temperature stress
2.2 低温胁迫幼苗叶片的抗氧化酶活性
2.2.1 SOD活性 随胁迫温度的降低,叶片SOD活性呈先下降后上升再下降趋势(图1),其中,大白杜鹃叶片SOD活性明显低于其余2种杜鹃,差异达极显著(P<0.01);露珠杜鹃与迷人杜鹃叶片的SOD活性无显著差异。从变化幅度看,15~10 ℃时大白杜鹃SOD活性分别为287.06和276.59 U/mg,与对照(296.28 U/mg)相比下降幅度不大;5 ℃时SOD活性为308.13U/mg,是对照的1.04倍;0 ℃时SOD活性为303.76U/mg,再次小幅下降,但4种低温度处理间SOD活性差异不显著。迷人杜鹃叶片SOD活性在10 ℃时迅速降至393.73 U/mg,为对照(448.76 U/mg)的87.7 %,5 ℃时活性上升至对照水平,0 ℃时活性又降至381.88 U/mg,4种低温度处理间SOD活性无显著差异。15~10 ℃时露珠杜鹃叶片SOD活性下降幅度较小,活性分别为对照(520.71 U/mg)的99.8 %和98.6 %,5 ℃时活性是对照的1.05倍,在0 ℃时其活性较对照小幅下降,4种低温度处理间SOD活性无显著差异。
2.2.2 POD活性 随胁迫温度的降低,大白杜鹃叶片POD活性呈上升趋势(图1),迷人杜鹃和露珠杜鹃呈先增加后下降的变化趋势;露珠杜鹃叶片POD活性极显著高于其他2种杜鹃,迷人杜鹃叶片POD活性极显著高于大白杜鹃。15、10、5和0 ℃时大白杜鹃叶片POD活性分别为对照(7.11 U/mg·min)的1.02、1.19、1.40和1.58倍,变化不大,与对照无显著差异。温度降至5 ℃时,迷人杜鹃叶片POD活性上升至44.5 U/mg·min,与对照(19.56 U/mg·min)差异达极显著。温度分别降至10、5和0 ℃时,露珠杜鹃叶片POD活性分别为对照(42.70 U/mg·min)的1.7、2.1和2.0倍,与对照差异均达极显著。
2.3 低温胁迫幼苗叶片主要生化指标的含量
2.3.1 可溶性糖 随胁迫温度的降低,3种高山杜鹃叶片的可溶性糖含量均呈上升趋势(图2),露珠杜鹃叶片的可溶性糖含量低于其他2种杜鹃。15~0 ℃时,大白杜鹃叶片的可溶性糖含量分别比对照(27.53 mg/g FW)增加3.16、3.41、4.73和5.37 mg/g FW,但与对照差异不显著。迷人杜鹃叶片的可溶性糖含量分别为对照(16.58 mg/g FW)的1.3、1.4、1.5和1.7倍,与对照差异均达极显著。露珠杜鹃叶片的可溶性糖含量分别比对照(14.59 mg/g FW)增加2.46、4.23、4.46和8.43 mg/g FW,与对照差异均达极显著。
2.3.2 脯氨酸 随胁迫温度的降低,3种高山杜鹃叶片的脯氨酸含量均呈上升趋势。15~0 ℃时,大白杜鹃叶片的脯氨酸含量分别是对照(104.98 μg/g FW)的1.0、1.1、1.2和1.4倍,但差异不显著。迷人杜鹃叶片的脯氨酸含量分别较对照(70.86 μg/g FW)增加32.88、35.98、54.23和88.49 μg/g FW,与对照差异达极显著。15~5 ℃时露珠杜鹃叶片的脯氨酸含量分别是对照(134.38 μg/g FW)的1.05、1.06和1.12倍;0 ℃时,脯氨酸含量为206.24 μg/g FW,与对照差异达极显著。
2.3.3 可溶性蛋白质 随胁迫温度的降低,大白杜鹃和迷人杜鹃叶片的可溶性蛋白质含量呈先增高后下降趋势(图2),露珠杜鹃叶片的可溶性蛋白质含量则呈持续上升趋势。大白杜鹃叶片的可溶性蛋白质含量在15 ℃增至3.68 mg/g FW,而后随温度降至10~0 ℃,其含量分别降至2.97、2.76和2.77 mg/g FW,4种低温处理与对照(2.69 mg/g FW)均无显著差异。迷人杜鹃叶片的可溶性蛋白质含量在15~10 ℃时分别升至4.85和5.48 mg/g FW,与对照(3.54 mg/g FW)差异不显著(P<0.05);5~0 ℃时可溶性蛋白质含量为3.94和2.84 mg/g FW,与对照相比没有显著差异。露珠杜鹃叶片的可溶性蛋白质含量在15~0 ℃时分别比对照(3.65 mg/g FW)增加0.59、0.65、1.02和1.35 mg/g FW,但与对照均无显著差异。
2.3.4 丙二醛 随温度降低,3种高山杜鹃叶片的MDA含量呈上升趋势(图2),且大白杜鹃含量明显高于其他2种杜鹃,差异显著。15~10 ℃时,大白杜鹃叶片的MDA含量增幅不大,分别较对照(13.55 nmol/mg)增加1.68和2.11 nmol/mg;5~0 ℃时,含量分别是对照的1.3倍、1.4倍,与对照差异达极显著。迷人杜鹃叶片的MDA含量在15~0 ℃时分别为10.48、11.02、11.7和12.5 nmol/mg,与对照(8.75 nmol/mg)无显著差异。露珠杜鹃叶片的MDA含量在15~5 ℃时增幅不大,分别比对照(6.69 nmol/mg)增加1.0、1.16和1.43 nmol/mg,与对照无显著差异;0 ℃时其含量升至9.97 nmol/mg,是对照的1.5倍,二者差异达极显著。
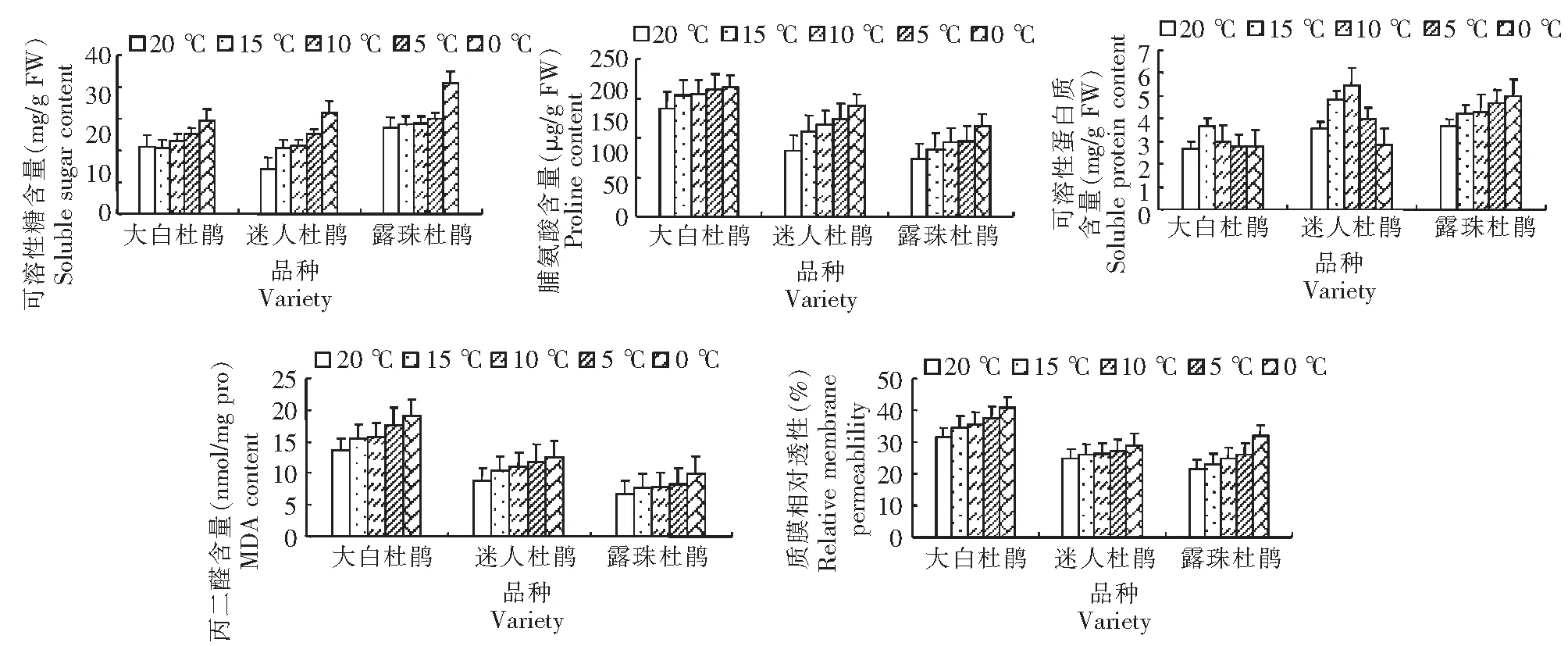
图2 低温胁迫3种杜鹃叶片可溶性糖、脯氨酸、可溶性蛋白质、丙二醛的含量和质膜相对透性Fig.2 Contents of soluble sugar, proline, soluble protein, MDA and the relative membrane permeability of Rhododendron leaves under low temperature stress
2.3.5 质膜相对透性 随温度降低,高山杜鹃叶片的质膜相对透性呈持续上升趋势(图2),且大白杜鹃叶片的质膜相对透性高于其他2种杜鹃。大白杜鹃叶片的质膜相对透性在15~0 ℃时分别较对照(31.59 %)上升3.0 %、4.1 %、4.8 %和9.1 %,与对照无显著差异。迷人杜鹃叶片的质膜相对透性在15~0 ℃时分别较对照(24.8 %)上升1.0 %、1.5 %、2.2 %和4.2 %,与对照无显著差异。露珠杜鹃叶片的质膜相对透性在15~10 ℃时分别较对照(21.6 %)上升1.3 %和3.2 %,与对照无显著差异;5 ℃时,较对照上升4.2 %,二者差异显著;0 ℃时,叶片的质膜相对透性迅速上升至31.8 %,与对照差异达极显著。
3 结论与讨论
脯氨酸和可溶性糖是重要和有效的有机渗透调节物质,二者含量和植物抗寒性密切相关,在植物可忍受的低温胁迫时含量呈上升趋势[16-17]。3种杜鹃叶片的可溶性糖和脯氨酸含量随温度的下降而上升,该变化趋势与李松等[18-19]的研究结果一致。但迷人杜鹃和露珠杜鹃叶片可溶性和脯氨酸含量对低温的响应明显,表明低温刺激这2种杜鹃叶片渗透有机调节物质,以提高细胞液浓度,降低渗透势,从而减轻低温对细胞膜的伤害。
一般情况下,可溶性蛋白质的含量随温度的降低而增加[20]。大白杜鹃和迷人杜鹃在低温胁迫时叶片的可溶性蛋白质含量随温度降低呈先上升后下降趋势,与李鹏程等[21]的研究结果一致;露珠杜鹃叶片可溶性蛋白质含量则持续上升,与邓菊庆等[19]的研究结果一致,且露珠杜鹃的可溶性蛋白质明显高于大白杜鹃。
植物在逆境胁迫下产生过剩自由基会引发或加剧膜质过氧化作用,MDA是脂质过氧化作用的直接产物,其含量能反映细胞脂膜过氧化作用强弱和植物受伤害程度。3种高山杜鹃叶片MDA的含量随温度降低呈上升趋势,与邓菊庆等[19]研究结果类似。大白杜鹃叶片MDA含量明显高于其他2种杜鹃。3种高山杜鹃叶片的质膜相对透性随温度的降低呈持续上升趋势,大白杜鹃叶片的质膜相对透性高于其他2种杜鹃。说明大白杜鹃叶片细胞膜受低温伤害程度比其他2种杜鹃大。
综上所述,露珠杜鹃和迷人杜鹃的抗寒能力比大白杜鹃强,可能是因为大白杜鹃的叶比其他2种杜鹃的大且薄,低温受害的表面积相对较大,露珠杜鹃的叶片较小且厚,而迷人杜鹃的叶片背面密被绒毛。此外露珠杜鹃和迷人杜鹃叶片的革质化程度比大白杜鹃高。因此,需要进一步从叶片微观结构的变化深入研究低温对高山杜鹃的影响。
[1]朱 红,邱新军. 杜鹃属的抗寒性[J]. 江西农业大学学报,1992,14(2):150-155.
[2]余丽玲,陈凌艳,何天友,等. 低温胁迫对西洋杜鹃叶片叶绿素荧光参数的影响[J]. 西南林业大学学报,2013,33(6):1-7.
[3]余丽玲,何天友,陈凌艳,等. 人工低温胁迫下西洋杜鹃生理生化指标的变化[J]. 农学学报,2014,4(1):48-53.
[4]张艳红. 低温对丹东杜鹃花花期的影响[J]. 安徽农业科学,2007,36(25):8213,8228.
[5]张艳红,赵凤军,王文平,等. 辽宁耐寒杜鹃花资源调查[J]. 辽东学院学报:自然科学版,2010,17(2):98-102.
[6]刘旭颖,沈向群,张艳红. 耐寒杜鹃叶片结构研究[J]. 湖北农业科学,2010,49(8):1903-1905.
[7]刘旭颖,沈向群,张艳红. 9种耐寒杜鹃花亲缘关系ISSR分析[J]. 西北农业学报,2010,19(7):89-92.
[8]鲍思伟. 自然降温过程中云锦杜鹃抗寒适应性研究[J]. 福建林业科技,2005,32(2):13-16.
[9]鲍思伟. 云锦杜鹃低温半致死温度对自然降温的适应[J]. 西南民族大学学报,2005,31(1):99-102.
[10]熊 燕,曲彦婷,唐焕伟,等. 低温胁迫及不同基质对高山杜鹃生理和根系活力的影响[J]. 东北农业大学学报,2013,44(10):117-121.
[11]黄承玲,黄家湧,马永鹏,等. 贵州百里杜鹃—杜鹃资源图志[M]. 北京:中国林业出版社,2016:165-169.
[12]王均明,郭向阳. 林木抗旱性与其根次生构造关系的研究[J]. 中国水土保持,1999(6):20-22.
[13]高俊风.植物生理学实验指导[M].北京:高等教育出版社,2006.
[14]李亚军,周伟香,龚 宁,等.低温胁迫对金线兰抗氧化酶活性的影响[J]. 贵州农业科学,2011,39(6):43-45.
[15]曹红星,孙程旭,冯美利,等. 低温胁迫对海南本地种油棕幼苗的生理生化响应[J]. 西南农业学报,2011,24(4):1282-1285.
[16]Janda T, Szalai G. Investigation of antioxidant activity inmaizeduring low temperature stress[J]. Acta Biologica Szegediensis,2005, 49(1-2):53-54.
[17]Siddig K, Ebert G, Ladders P. Tamarind (TamarindusindicaL.)A review on a multipurpose tree with promising future in the Sudan[J]. Angewandte Botanik, 1999, 73(5-6):202-205.
[18]李 松,李枝林,唐开学,等.五个切花品种的抗寒生理分析测定[J]. 西南农业学报,2012,25(4):1232-1237.
[19]邓菊庆,蹇洪英,李淑斌,等.几种云南特有蔷薇资源的抗寒性研究[J]. 西南农业学报,2013,26(2):723-727.
[20]薛 香,吴玉娥,郜庆炉.不同类型小麦品种的主要抗寒生理指标[J].贵州农业科学,2011,39(7):68-70.
[21]李鹏程,郭绍杰,李 铭,等.自然越冬过程中山葡萄抗寒生理指标的变化[J]. 贵州农业科学,2013,41(1):69-71.
(责任编辑 王 海)
Physiological Responses of Three Species ofRhododendronunder Low Temperature
HUANG Cheng-ling1,2, ZHAO Xiao-li1, LIU Guang-chao2
(1. College of Chemistry and Environmental Science, Guizhou Minzu University, Guizhou Guiyang 550025,China; 2. College of Humanities and Sciences, Guizhou Minzu University, Guizhou Guiyang 550025, China)
In order to find out the mechanism of cold resistance ofRhododendronand promote the development and utilization of new varieties, the activities of antioxidant enzymes, the content of osmotic adjustment substance, soluble protein and MDA of threeRhododendronspecies were measured through artificial temperature control. Results:with decreasing temperature, SOD activity ofRhododendrondescend first, then ascend, and descend at last. At 10 ℃, SOD activity ofR.agastumwas 87.7 % of the control. POD activity ofR.decorumraised constantly, POD activity was 1.58 times of the control at 0 ℃. But POD activity ofR.agastumandR.irroratumincreased first and then decreased. The content of soluble sugar and proline increased, the soluble protein content ofR.decorumandR.agastumascend first, then descend last. However, the soluble protein ofR.irroratumincreased constantly. The relative membrane permeablility of them were enhanced constantly, and MDA content continually increased. MDA content and relative membrane permeability ofR.decorumwere higher than that of the other two species, MDA content ofR.decorumwas 18.97 nmol/mg at 0 ℃, MDA content ofR.agastumandR.irroratumwere 12.5 nmol/mg and 9.97 nmol/mg respectively. The cold resistance ofR.irroratumandR.delavayiwere stronger thanR.decorum.
Rhododendron; Low temperature; Antioxidant enzymes activity; Soluble protein content; Malondialdehyde content; Relative membrane permability
1001-4829(2016)10-2346-05
10.16213/j.cnki.scjas.2016.10.017
2016-01-15
贵州省科技厅国际科技合作项目“百里杜鹃杜鹃属植物种类与变异研究”[黔科合体外J字(2013)7035];贵州民族大学引进人才项目“高山杜鹃引种及应用示范研究”(15XRY011)
黄承玲(1977-),女,副教授,博士,从事木本花卉的生理生态研究,E-mail:chenglinghuang@163.com。
S685.21;Q945.78
A

