广西特色蕉类种质资源遗传多样性ISSR分析
邹 瑜,何海旺,赵 明,龙 芳,武 鹏,林贵美,林 茜
(1.广西农业科学院生物技术研究所,广西 南宁 530007;2.广西植物组培苗有限公司,广西 南宁 530007)
广西特色蕉类种质资源遗传多样性ISSR分析
邹 瑜1,何海旺1,赵 明1,龙 芳1,武 鹏1,林贵美2,林 茜1
(1.广西农业科学院生物技术研究所,广西 南宁 530007;2.广西植物组培苗有限公司,广西 南宁 530007)
利用ISSR分子标记技术对广西特色蕉类种质资源的遗传多样性进行分析。结果表明,从合成的35条ISSR引物中,筛选出13条条带清晰、多态性丰富及重复性好的引物,共扩增出96条条带,其中91条为多态性条带,平均多态性百分率达到93.69 %。65份特色蕉类种质资源的遗传相似系数在0.479167~1.000000之间,平均为0.804726。聚类分析结果表明,在遗传相似系数为0.71时,可以将基因型为ABB的大蕉及粉蕉与其他基因型的蕉类种质资源进行区分;遗传相似系数在0.74时,能够把大蕉和粉蕉区分开来。而在相似系数为0.76附近,大蕉种质资源聚成3类,在0.92附近时,粉蕉种质资源可聚为4类。
蕉类;种质资源;ISSR;遗传多样性
香蕉(Musaspp.)属芭蕉科(Musaceae)芭蕉属(Musa)多年生草本植物,是世界上产量最大的水果作物之一,也是部分发展中国家的主要食物来源[1]。根据香蕉的植株形态和经济性状,可将其分为香蕉(香牙蕉)、大蕉、粉蕉和龙牙蕉4大类。其中香蕉(香牙蕉)的种植面积和市场份额最大,故常以香蕉做为食用蕉的总称。
香蕉起源于亚洲南部,原产地为东南亚和印度等地,包括我国华南地区[2-3]。广西地处华南低纬度地区,西南毗邻越南,具有得天独厚的光、温、水等气候条件和优越的地理位置,为蕉类种质资源的生长和传播提供条件,是我国主要的香蕉产区。在广西,有大面积的香牙蕉、粉蕉及少量大蕉的栽培,经过多年的引种交流、自然杂交和变异,及在广西各地发现有丰富的野生蕉类种质资源,造就了其蕉类资源丰富的遗传多样性[4],这些丰富的种质资源将为我国香蕉的新品种选育提供丰富的基因资源。但长期的引种交流及无性繁殖,也导致了大部分种质出现同种异名或同名异种现象,给蕉类种质的合理利用带来极大的困扰。牟海飞等[3]等对32份香蕉品种(系)进行了遗传多样性分析,为香蕉的育种和遗传改良提供重要依据。本文主要针对广西的粉蕉、大蕉及野生蕉等特色蕉类种质资源的遗传多样性进行ISSR分析,为研究特色蕉类在广西的传播、演化以及新品种的选育提供依据。
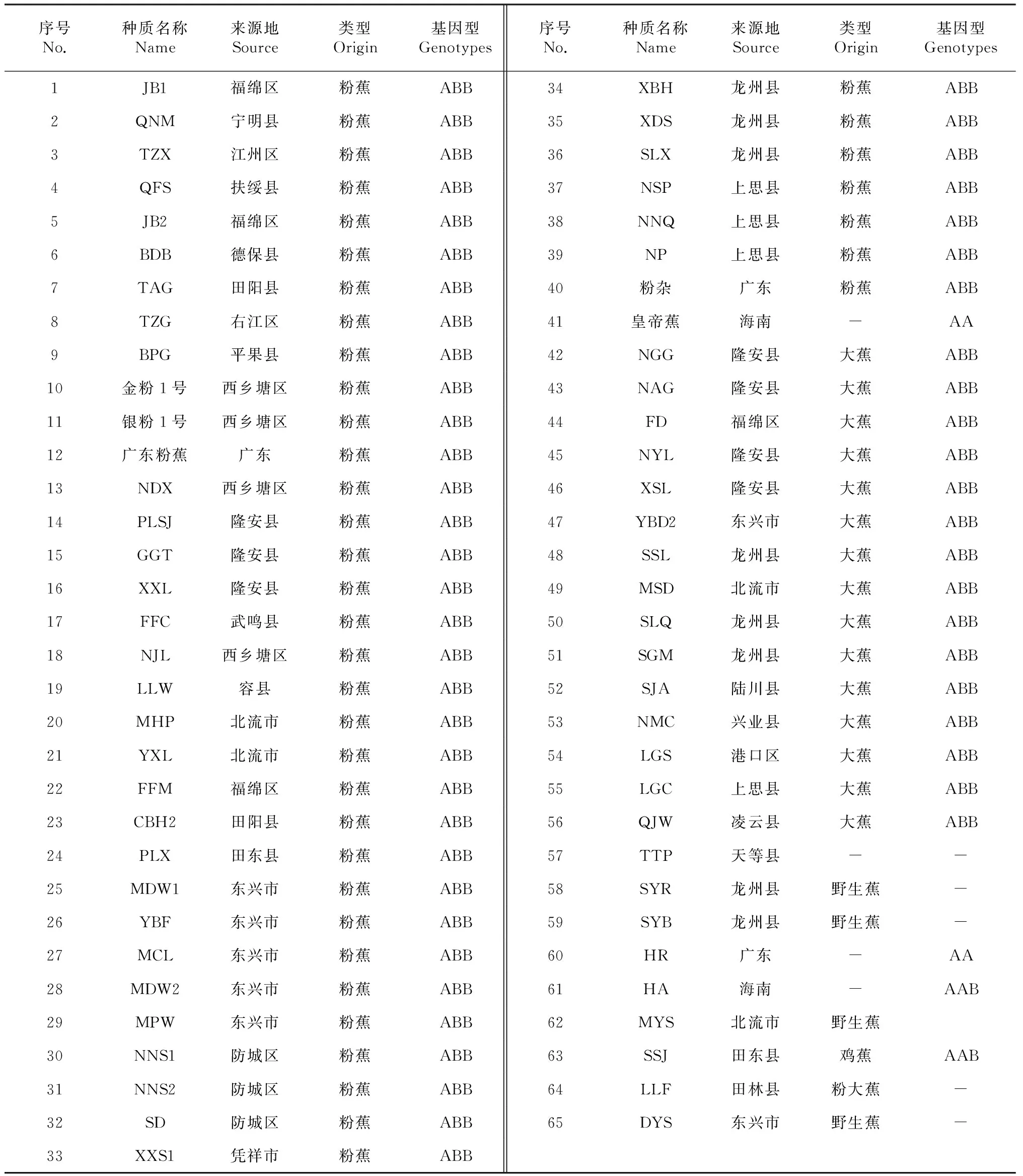
表1 供试验的65份特色蕉类种质资源
1 材料与方法
1.1 试验材料
65份供试材料为本课题组从广西各地收集的具有特异性状的特色蕉类种质资源,包括粉蕉、大蕉以及野生蕉等,其试验序号、种质名称及来源地见表1。
1.2 DNA提取
所有材料均取未展开心叶,立即用液氮速冻后,于-80 ℃保存备用。
采用新型植物基因组DNA提取试剂盒(康为世纪生物科技有限公司,CW0531)提取蕉类种质资源的DNA,提取方法参照试剂盒说明书。提取的DNA用1 %琼脂糖凝胶电泳检测,再用分光光度计测定波长为260 nm时的吸光值,并计算DNA的浓度。将所有的DNA定量至50.0 ng/μl,存放于-20 ℃备用。
DNA浓度=OD260×稀释倍数×50
1.3 ISSR标记及其产物电泳
引物设计参考前人发表的相前文献[1,3,5-6],所有引物均由北京六合华大基因股份有限公司合成。PCR反应体系为25.0 μl,其中DNA模板0.5 μl、ISSR引物2 μl (10 μmol/L)和2×EsTaqMasterMix 12.5 μl(购自康为世纪生物科技有限公司,CW0718)。PCR反应在Bio-RADicycle PCR仪上进行,扩增程序为:94 ℃预变性5 min;94 ℃ 30 s,退火温度30 s,72 ℃ 2 min,进行30个循环;72 ℃延伸10 min,产物于4 ℃保存待用。
1.4 统计分析
扩增产物以0、1统计建立数据库,在相同迁移位置,有带(显性)记为1;无带(隐性)记为0,依此构成0/1遗传相似矩阵。仅记录清晰、稳定且可重复的条带。二元数据矩阵用NTSYS 2.1e软件中的DICE法计算遗传相似系数,UPGMA法进行聚类分析,绘制树状聚类图。
2 结果与分析
2.1 蕉类种质资源的收集与基因组DNA的提取
十几年来,收集了广西中、南部的30多个县(市辖区、县级市)的粉蕉、大蕉、香牙蕉及部分野生蕉在内的种质资源。在收集到的种质资源中,筛选出部分性状优良的单株进行试种,并通过提纯复壮,最终选育出粉蕉优良新品种金粉1号[7]和银粉1号。为了对广西的特色蕉类资源进行更进一步的研究,在收集到200余份的蕉类种质资源中,筛选了65份特色蕉类种质资源(表1)进行ISSR分子标记分析。
采用新型植物基因组DNA提取试剂盒提取蕉类种质资源基因组DNA,1 %琼脂糖凝胶电泳结果见图1,所提取的65份DNA条带清晰,均无蛋白质、多糖及RNA条带,纯度较高,没有明显的降解现象,并且所有的DNA片段大小基本一致,说明提取的DNA适合后续的ISSR分析。
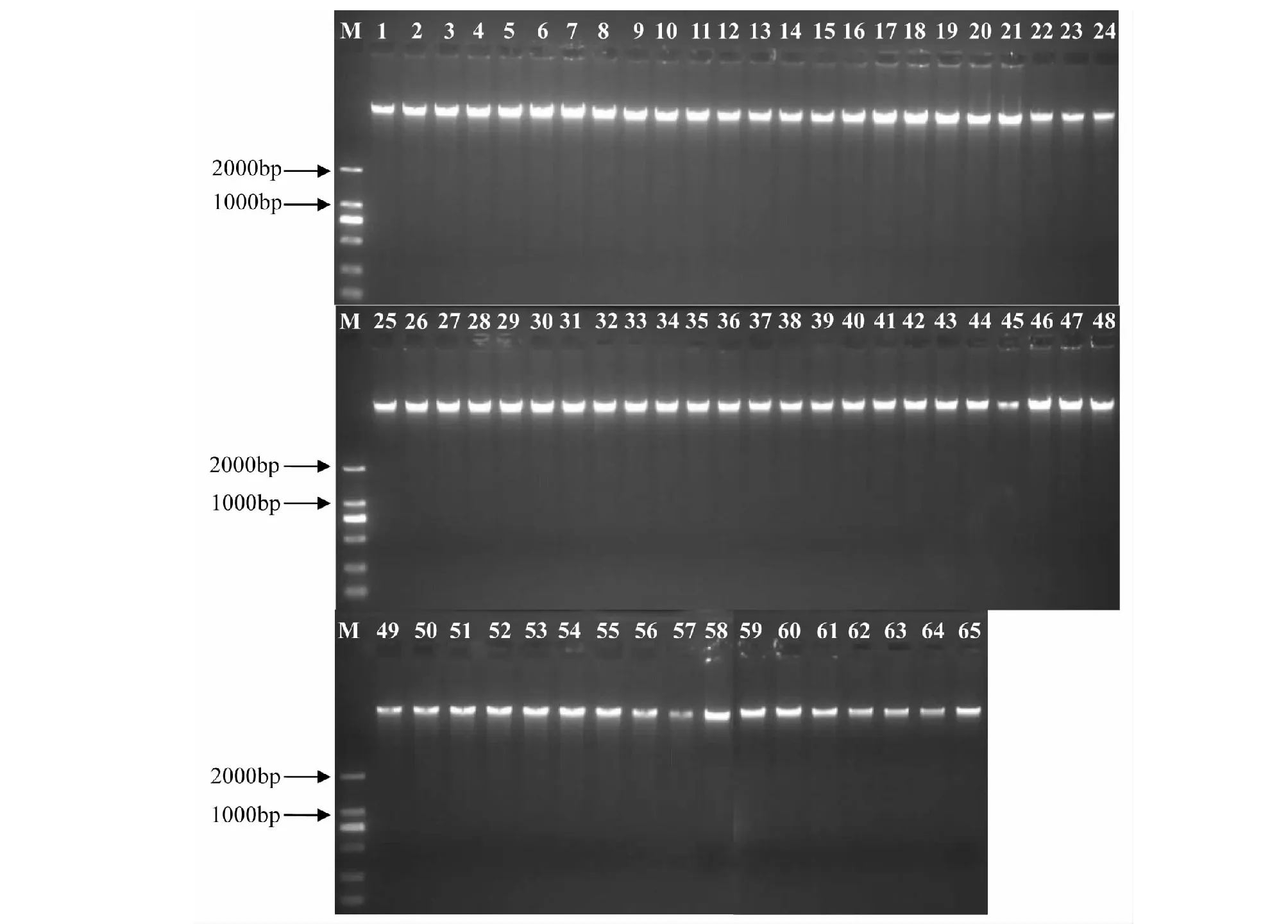
M:DL2000 DNA Marker; 1~24:部分份蕉类种质资源图1 部分供试香蕉材料基因组DNA电泳检测结果Fig.1 Genomic DNA electrophoresis results of some tested banana materials

引物Primer引物序列(5'-3')SequenceTM(℃)最佳退火温度(℃)Suitableannealingtemperature总条带数(条)Totalamplifiedbands多态性条带数(条)Numberofpolymorphicband多态性百分率(%)PercentageofpolymorphicbandUBC807(AG)8T50.054.41717100.00UBC810(GA)8T50.052.0131184.62UBC811(GA)8C52.059.766100.00UBC825(AC)8T50.050.344100.00UBC826(AC)8C52.051.077100.00UBC827(AC)8G52.050.366100.00UBC835(GA)8YC55.055.666100.00UBC836(AG)8YA53.050.388100.00UBC840(GA)8YT53.051.066100.00UBC841(GA)8YC55.053.26583.33UBC842(GA)8YG55.054.488100.00UBC880(GGAGA)348.050.355100.00UBC891HVH(TG)750.750.34250.00合计Total9691平均Average7.38793.69
2.2 ISSR引物退火温度的筛选及扩增多态性
从设计的35条ISSR引物中筛选出13条扩增条带清晰、多态性丰富的引物(表2)进行遗传多样性分析。为确定筛选出引物的最佳退火温度,每条引物设计12个退火温度梯度(50.0、50.5、51.0、52.0、53.2、54.4、55.6、56.8、58.0、59.0、59.5、60.0 ℃)进行实验,由图2可知,除引物UBC811的最佳退火温度与TM值相差较大外,其他引物的最佳退火温度均在TM值前后5 ℃的范围内。
从筛选出来的13条引物序列(图2)可以看出,二碱基重复的引物共有12条,以AG、GA和AC二碱基重复的序列为主,说明收集到的特色蕉类种质资源的基因组含有较多的AG、GA和AC的重复序列,可为今后分子标记的引物设计提供参考。13条引物共扩增出96条条带,每条引物能够扩增出4~17条带,平均为7.38条。其中以UBC807引物扩增的条带数最多,达17条,而UBC810则次之(13条)。扩增的条带中,有91条为多态性条带,每条引物平均产生7条,平均多态性百分率达到93.69 %,多态性较高,说明收集的特色蕉类种质资源遗传多样性较为丰富。
2.3 聚类分析结果
根据PCR扩增的结果(图3),统计条带并构建0、1二元数据库,用NTSYS 2.10 e软件计算广西特色蕉类种质资源间的遗传相似系数。结果表明:65份特色蕉类种质资源的遗传相似系数在0.479167到1.000000之间,平均为0.804726。其中46与59号、60与64号种质资源之间的相似系数最小,均为0.479167,说明这些种质之间的亲缘关系较远。有部分种质之间的遗传相似系数则较大,如10号(金粉1号)与5、9、11、13、16、18、30、31、32、34号等种质之间的遗传相似系数为1.000000,说明它们之间的亲缘关系较近,甚至有可能为同种异名。在广西选育并大面积种植的粉蕉品种金粉1号(10号)与广东选育的2个粉蕉品种:广东粉蕉(12号)及粉杂(40号)之间的遗传相似系数分别为0.989583及0.96875,说明这几个栽培种的亲缘关系均较近,但在遗传上也存在一定的差异。

M:100+2+3 kb DNA ladder-M;1-12:50.0,50.5,51.0,52.0,53.2,54.4,55.6,56.8,58.0,59.0,59.5,60.0 ℃图2 引物UBC825及UBC836有不同退火温度下的PCR电泳图Fig.2 Amplification result using primer UBC825 and UBC 836 at different annealing temperatures
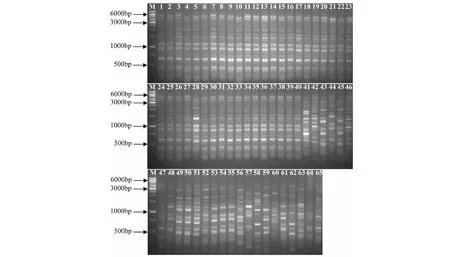
1~65:65份蕉类种质资源图3 引物UBC807对65份蕉类种质资源基因组DNA的PCR扩增结果Fig.3 ISSR fingerprinting of 65 banana germplasm resources with primer UBC807
由图4可以看出,收集到的特色蕉类种质资源的遗传多样性丰富,特别是野生的蕉类种质资源与农家种的蕉类品种之间差别比较显著。遗传相似系数为0.71时,可以将基因型为ABB的大蕉及粉蕉与其他基因型的蕉类种质资源进行区分。遗传相似系数在0.74时,可以将大蕉和粉蕉区分开来。不同地域收集到的大蕉种质资源遗传多样性较为丰富,在相似系数为0.76附近,大蕉种质资源聚为3类,第一类包括43、44、45及47四份种质资源,第二类包括48、49、50、51、52、53、54、55及56号共9份大蕉种质资源,而第三类仅有12及16号2份种质资源。在相似系数为0.92时,粉蕉种质资源可聚为4类,28及64号分别单独为一类;24、26及29号3个种质资源归为一类;其余的再归为一类,这一类包括常见的粉蕉栽培种,如:广东粉蕉(12号)、粉杂(40号)、金粉1号(10号)及其变异株等。相对其它蕉类种质资源来说,粉蕉种质资源遗传多样性较低,各个地域收集的种质资源差别不大。如5、9、10(金粉1号)、11、13、16、18、30、31、32及34号,共11份种质资源无法用本实验的14条引物分开,说明它们之间的亲缘关系极近,很可能与粉蕉栽培种金粉1号同种异名或是其变异株。此外,在收集种质资源中发现64号是一个特殊的种质,其蕉果身披白粉,与银粉1号品种类似,雄花的颜色也接近粉蕉,但其植株的外观性状及蕉果的外形却与大蕉相同,因此,将其分类归为粉大蕉。在本次的聚类中,64号聚于大蕉及粉蕉之间,但更偏向于粉蕉,因此推断其基因组应属于ABB,但仍需进一步验证。
3 讨 论
研究表明,大多数植物的EST-SSR都是以三碱基重复为主,二碱基则次之[8-9]。而在二碱基重复的EST-SSR中,AG/TC重复单元最多,而GC/CG则最少,王静毅等[10]的研究表明,在香蕉的EST-SSRs中,二、三核苷酸重复单元的SSR占主导地位,而GA则是二核苷酸中的优势重复类型。ISSR分子标记是用锚定的微卫星DNA为引物,即在SSR引物的3'或5'端加上2~4个随机碱基,因此,ISSR同样应具有SSR引物类似的重复单元。刘绍钦等[11]从ISSR引物中筛选出了15条目标引物,其中二碱基重复的引物占80 %,其研究结果与SSR类似。本实验中,筛选出的13条引物有12条是二碱基重复,以AG、GA和AC二碱基重复为主,与前人的研究结果基本一致。
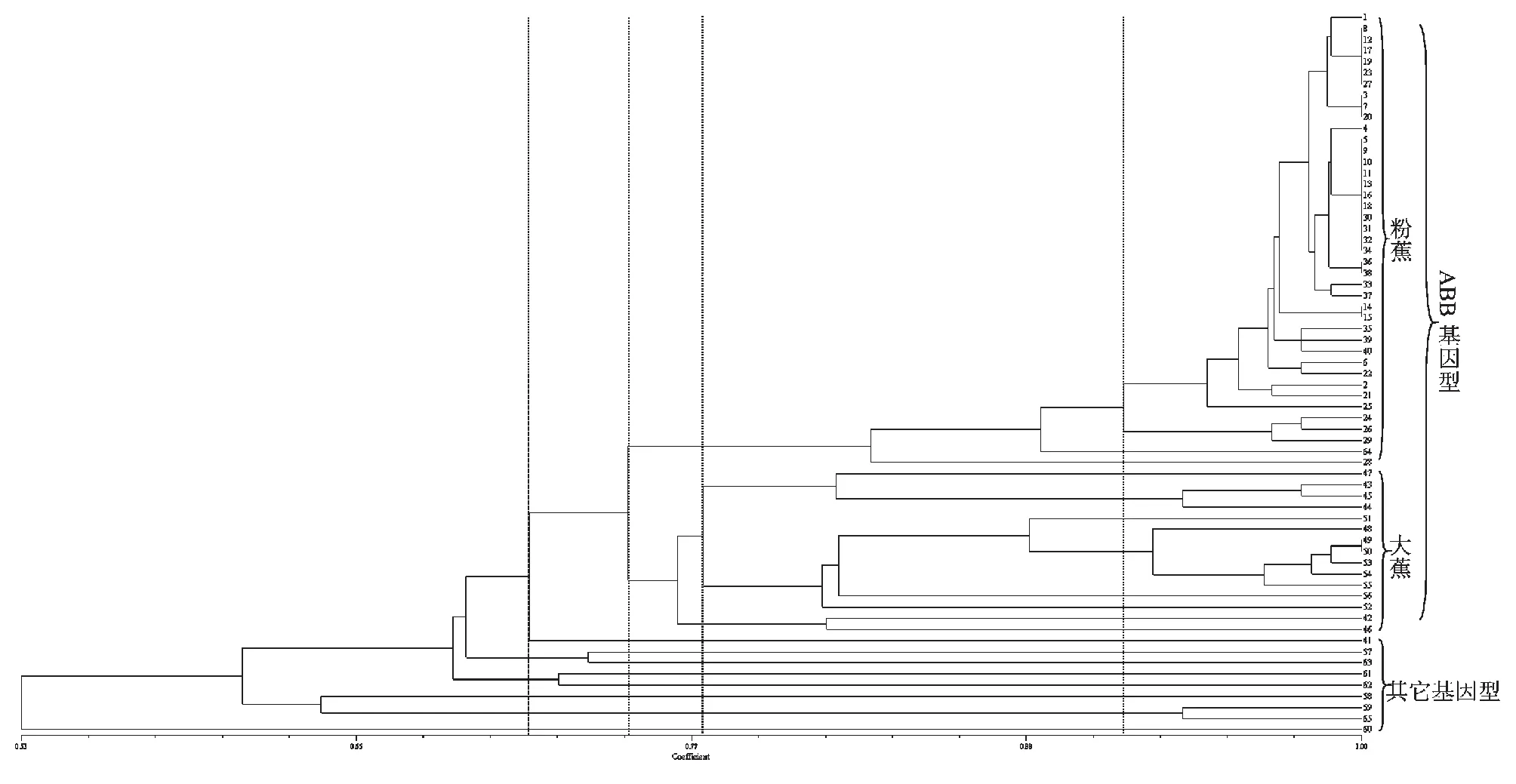
图4 65份蕉类种质资源的UPGMA聚类分析结果Fig.4 Dendrogram for 65 banana germplasm resources based on UPGMA analysis
据报道,香蕉种类多样,种质资源间的遗传多样性较为丰富[12-14]。在本研究中,收集到的特色蕉类种质资源也具有丰富的多样性,特别是野生蕉种与农家种或栽培种之间存在着极大的差异,如在龙州县收集的59号野生种与隆安县收集的46号农家大蕉品种之间遗传相似系数仅为0.479167。蕉类种质资源在遗传上的巨大差异,将为今后的优良基因的挖掘利用以及遗传育种提供巨大的基因库。
因为受到消费市场的限制,目前大蕉未能形成规模种植,仅作为农家种有零星分布,且多为本地的野生种驯化,传播范围不大,因此,不同地域收集到的大蕉种质资源亲缘关系差别较大,该结果将为大蕉品种的遗传改良提供理论依据。相对大蕉,粉蕉的遗传多样性则要小得多,可能是由于粉蕉由原产地传到广西后,其种群数较少,基因流动小。此外,近十几年来,粉蕉组培苗的大面积推广种植,也是粉蕉遗传多样性低的重要原因之一。
Amsellem等[15]的研究表明,由于外来种在新的生境中往往遭受瓶颈、建立者效应等多种因素的影响,在新生境中时间越长,其遗传多样性越丰富,因此,可以根据其遗传多样性来推断其传播路线[16]。粉蕉在广西又名西贡蕉或安南蕉。安南为越南古名,得名于唐代的安南都护府,而西贡则是越南胡志明市的旧称,因此粉蕉可能是由越南经边界线传入我国。在本研究中发现,在中越边境城市东兴市境内各镇收集到的粉蕉种质资源的遗传多样性最为丰富,在相似系数为0.92时聚类的4个的粉蕉分类中,有3类包含有东兴市收集的种质。龙州、凭祥、上思和百色等地的遗传多样性则较东兴的小,南宁再次之,玉林市收集的种质资源和广东选育的品种的遗传多样性最小。因此,推测东兴市可能是粉蕉进入我国定居的地区,然后经陆路向凭祥、龙州、上思和百色等地扩散,再经由河流或陆路传至南宁市,最后传到河流下游的玉林、广东等地。但因本实验样本数量有限,所以粉蕉的传播路线仅为初步判断,实际结果仍需进一步验证。
[1]张如莲,傅小霞,洪彩香,等.30个香蕉品种遗传多样性的ISSR分析[J]. 中国农学通报, 2006, 22(2):366-370.
[2]雷武逵.香蕉产业升级配套技术及对策研究[J].广西农业科学, 2008, 39(3):397-400.
[3]牟海飞,林贵美,邹 瑜,等.利用ISSR分子标记分析香蕉品种的遗传多样性[J].西南农业学报, 2010, 23(4):1206-1210.
[4]尧金燕,彭宏祥,秦献泉,等.广西蕉类种质资源概况及其育种创新利用前景[J]. 广西农业科学, 2008, 39(4):527-529.
[5]王钱洁,秦永华,陈厚彬,等.香蕉ISSR反应体系的建立[J].华南农业大学学报,2010,31(1):13-16.
[6]王贵花,张 欣,谢艺贤,等.几份新选育香蕉种质资源的ISSR分析[J].中国南方果树, 2015, 44(1):8-11.
[7]邹 瑜,林贵美,牟海飞,等.粉蕉新品种“金粉1号”的选育[J].中国南方果树,2011, 40(1):47-48.
[8]Cardle L, Ramsay L, Milbourne D, et al. Computational and experimental characteri-zation of physically clustered simple sequence repeats in plants [J]. Genetics, 2000, 156:847-854.
[9]Varshney R K, Thiel T, Stein N, et al. In silico analysis on frequency and distribution of microsa-tellites in ESTs of some cereal species [J]. Cell MolBiol Lett, 2002(7):537-546.
[10]王静毅, 陈业渊, 刘伟良,等.香蕉EST-SSRs标记的开发与应用[J].遗传,2008, 30(7):933-940.
[11]刘绍钦,黄上志,梁张慧,等.ISSR分子标记技术在香蕉分类上的应用[J].西南大学学报, 2007, 29(2):70-74.
[12]姚锦爱,蔡鸿娇,石妞妞,等.香蕉种质资源亲缘关系的ISSR分析[J]. 福建农业学报, 2012, 27(1):37-42.
[13]李雪霞,彭铁成,徐 芳,等.不同抗性香蕉品种遗传多样性的ISSR分析[J].广东农业科学, 2012(9):6-8.
[14]郭计华,李新国,李 丽,等.基于ISSR分析28份香蕉种质的基因组DNA多样性[J]. 基因组学与应用生物学, 2012, 31(5):492-497.
[15]Amsellem L, Noyer J L, Bourgeois T L, et al. Comparison of genetic diversity of the invasive weedRubusalceifoliusPoir. (Rosaceae) in its native range and in areas of introduction, using amplified fragment length polymorphism (AFLP) markers[J]. Molecular Ecology, 2000, 9(4):443-455.
[16]段 惠,强 胜,苏秀红,等.用AFLP技术分析紫茎泽兰的遗传多样性[J].生态学报, 2005, 25(8):2109-2114.
(责任编辑 王冠玉)
Genetic Diversity Analysis of Distinctive Banana Germplasm Resources in Guangxi by Using ISSR Markers
ZOU Yu1, HE Hai-wang1, ZHAO Ming1, LONG Fang1, WU Peng1, LIN Gui-mei2, LIN Qian1
(1. Bio-technology Research Institute,Guangxi Academy of Agricultural Sciences, Guangxi Nanning 530007, China;2. Guangxi Plant Tissue Culture Seedlings Limited Company, Guangxi Nanning 530007, China)
Genetic diversity of 65 distinctive banana germplasm resources in Guangxi Zhuang Autonomous Region were studied by using ISSR markers in research. The results showed that 35 ISSR primers were screened, and 13 primers with clear band, more band number and good repeatability were selected. The 13 primers amplified 96 bands, out of which 91 bands were polymorphic, and the percentage of polymorphic loci was 93.69 %. Genetic similarity coefficient of 65 banana germplasm resources changed from 0.479167 to 1.000000, with an average of 0.804726. Cluster analysis results indicated that ABB genotypes could be separated clearly from other genotypes at 0.71similarity level, and the plantain could be separated from dwarf bananas at 0.74. Then the plantain germplasm resources could be classified into three groups at 0.76 similarity level while dwarf bananas be four groups at 0.92.
Banana; Germplasm resources; ISSR; Genetic diversity
1001-4829(2016)10-2450-07
10.16213/j.cnki.scjas.2016.10.037
2016-05-08
现代农业产业技术体系项目(CARS-32-15);广西农业科学院基本科研业务专项(桂农科2015YT54);广西农业科学院科技发展基金项目(桂农科2016JZ03);广西农业科学院基本科研业务专项(桂农科2017YM29)
邹 瑜(1965-),男,广西容县人,研究员,研究方向为香蕉栽培与育种,E-mail:zy@gxaas.net。
S668.1
A

