肿瘤放射及化学治疗所致恶心呕吐的药物治疗研究现状
胡 钰,罗洁丽,黄艳芳,李 璐,吴柳婷
(武汉科技大学附属普仁医院药学部,湖北 武汉 430081)
肿瘤放射及化学治疗所致恶心呕吐的药物治疗研究现状
胡 钰,罗洁丽,黄艳芳,李 璐,吴柳婷
(武汉科技大学附属普仁医院药学部,湖北 武汉 430081)
目的 分析肿瘤放射及化学治疗后引起恶心呕吐的作用机制,并阐述各类止吐药物作用机制。方法 回顾性研究国内外相关临床试验和文献,对各类止吐药物的研究现状、临床应用和进展进行综述。结果 5-羟色胺3(5-HT3)受体拮抗剂和神经激肽-1(NK-1)受体拮抗剂对急性呕吐均有较好疗效,第2代5-HT3受体拮抗剂帕洛诺司琼和NK-1受体拮抗剂阿瑞吡坦对延迟性呕吐的效果更佳,且与皮质激素地塞米松联用可提高疗效。结论 5-HT3受体拮抗剂为临床主要使用的止吐药,对急性呕吐的疗效优于延迟性呕吐,联用NK-1受体拮抗剂和皮质激素类药物可加强其对延迟性呕吐的疗效。
肿瘤放化疗;恶心呕吐;止吐药物;合理用药
肿瘤放射及化学治疗(简称放化疗)引起的恶心呕吐是抗肿瘤治疗中最常见且最不易耐受的不良反应[1],不仅直接影响肿瘤患者的生活质量,也干扰抗肿瘤治疗的顺利进行,严重影响患者的治疗依从性[2]。合理预防和处理肿瘤放化疗引起的恶心呕吐,可为肿瘤治疗的顺利进行提供基本保障。由于肿瘤放化疗所致恶心呕吐的发病机制复杂,不同患者恶心呕吐的临床转归也复杂多样。故有必要根据临床具体情况选择合适的止吐药物。
1 致吐机制
1.1 化疗所致恶心呕吐(CINV)
CINV的发生机制一般为以下4个方面:1)化疗药物刺激胃肠道的嗜铬细胞产生5-羟色胺3(5-HT3)受体,导致迷走传入神经兴奋,由迷走神经和交感神经传导至延髓的呕吐中枢,引起呕吐反射。2)化疗药物及其代谢产物直接刺激催吐化学感受区(CTZ)引起呕吐。以上2个方面也是临床大量使用各种5-HT3受体拮抗剂的理论基础[3]。3)延迟性呕吐的传导介质则可能不是嗜铬细胞释放5-HT3,而是与P物质作用于神经激肽-1 (NK-1)有关[4]。4)心理、精神因子直接刺激大脑皮质导致呕吐反射。研究发现,女性、年龄小于50岁、有妊娠呕吐史、有化疗史的患者在化疗期间易发生CINV[5]。1.2 放疗所致恶心呕吐(RINV)
接受全身或上腹部放疗的患者极有可能发生恶心呕吐。胃肠道内(尤其是小肠)含有快速分化细胞,对放疗特别敏感,且放疗的剂量越大,受照射的组织越多,发生恶心呕吐的可能性就越大[6]。
2 主要止吐药物的作用机制和临床应用
2.1 5-HT3受体拮抗剂
5-HT3受体拮抗剂可能是通过拮抗中枢化学感受区及外周迷走神经末梢的5-HT3受体来抑制恶心、呕吐的发生。自第1代5-HT3受体拮抗剂昂丹司琼问世以来,先后开发出了一系列5-HT3受体拮抗剂衍生物,如格拉司琼、托烷司琼、帕洛诺司琼等。5-HT3受体拮抗剂的作用强弱主要与受体亲合力和血浆蛋白结合率有关,作用持续时间则与CYP450代谢酶系统和半衰期有关[7]。由表1可知,与第1代 5-HT3受体拮抗剂相比,第2代5-HT3受体拮抗剂帕洛诺司琼与5-HT3受体结合的能力强。在作用时间方面[8],帕洛诺司琼明显长于其他5-HT3受体拮抗剂,达40 h,而其他5-HT3受体拮抗剂基本相似,为3~9 h。5-HT3受体拮抗剂对5-HT3所致急性呕吐具有强效止吐作用,但对于迟发性呕吐,由于可能存在其他致吐机制,止吐效果不如急性呕吐。黄雄[9]报道指出,对于急性呕吐,第1代5-HT3受体拮抗剂具有相似的止吐活性和安全性,可互换,而帕洛诺司琼的高亲和力和较长的半衰期使得其在治疗恶心呕吐方面有着较大的优势。日本的一项随机双盲双模拟对照的预防CINV的Ⅲ期临床试验[10]也证实,帕洛诺司琼在急性期CINV控制中无明显优势,但对于延迟性CINV疗效明显,详见表1。

表1 5-HT3受体拮抗剂的药理作用和半衰期
2.2 NK-1受体拮抗剂
NK-1受体是P物质的结合位点。P物质能诱发CINV,主要存在于中枢神经系统和胃肠道,与NK-1受体结合力最强。NK-1受体拮抗剂阿瑞吡坦是目前NK-1受体拮抗剂中唯一获准应用于临床的品种。单用阿瑞吡坦治疗急性呕吐的效果与昂丹司琼相当[7]。一项AC化疗方案使用阿瑞吡坦和昂丹司琼的比较试验中[11],单用阿瑞吡坦可提高AC化疗方案延迟性呕吐的控制率。因此,阿瑞匹坦联合地塞米松可加强治疗中高度致吐化疗方案的延迟性呕吐。国外临床指南[12-13]均推荐,采用阿瑞吡坦联合地塞米松防治高度致吐风险化疗引起的延迟性呕吐。
2.3 皮质类固醇激素类
皮质类固醇激素(地塞米松等)作用机制不明,可能是通过干扰胶质细胞中前列腺素中介过程而起作用。该药可能通过抗炎降低外周神经损害,减轻延迟性呕吐;也可能是改变血液中5-HT3浓度,以减轻脑组织水肿[14]。单药使用效果不理想,与其他止吐药物联合使用时,效果非常好。
2.4 多巴胺受体阻断剂
其通过抑制中枢CTZ的多巴胺受体而提高CTZ的阈值,发挥中枢性镇吐作用。对于接受高致吐风险药物化疗的患者,这类止吐药不作为首选,仅用于无法耐受5-HT3受体拮抗剂、NK-1受体拮抗剂和地塞米松的患者,或是上述药物疗效不佳的患者,作为替代药物[15]。研究较多的是甲氧氯普胺,小剂量可阻滞D2受体,大剂量又可阻滞5-HT3受体。胡婷婷[16]的研究证实、增加剂量不增强效果,反而引起锥体外系症状,故对于接受高致吐风险药物的化疗患者,此类药物并非首选。
2.5 其他止吐药物
放化疗的致吐机制复杂多样,即使使用以上的止吐药物也不能完全缓解,因此根据患者具体情况还可选用其他作用机制的止吐药物。如抗精神病类的氟哌啶醇和劳拉西泮均有抗焦虑、镇静催眠作用;抗组胺药苯海拉明和异丙嗪也有镇吐作用。奥氮平作用于多种神经递质,尤其作用于D2和5-HT3受体表明其有明显的止吐特性。Ⅱ期临床试验[17]证明,其能有效缓解中高度致吐化疗方案的恶心和呕吐,但目前还局限于小型研究,缺乏大型Ⅲ期临床研究来确定其在止吐治疗中的地位。
2.6 联合用药
肿瘤放化疗所致恶心呕吐的发病机制复杂多样,没有单独的1种药物可完全阻滞多种致吐神经受体,因此临床一般建议联合用药。
NCCN止吐临床实践指南[12]和美国临床肿瘤学会(ASCO)止吐药物应用指南[13]均推荐根据不同致吐等级采用不同的止吐方案。由表2可见,对高致吐化疗方案都推荐同时连用3种5-HT3受体拮抗剂、地塞米松和阿瑞吡坦;而对于中等致吐化疗方案推荐联用2种5-HT3受体拮抗剂和地塞米松,而视患者具体情况加用阿瑞吡坦。止吐药物在化疗或放疗前使用,须贯穿呕吐风险期的始终。NCCN和ASCO还提出,在低致吐风险方案中的辅助止吐药物,劳拉西泮和苯海拉明有效但不提倡单独使用。
5-HT3受体拮抗剂+甲氧氯普胺+地塞米松适用于急性反应较重,且单用5-HT3受体拮抗剂疗效欠佳的情况,其中甲氧氯普胺促进胃肠蠕动,可缓解5-HT3受体拮抗剂引起的便秘。氟哌啶醇+苯海拉明+劳拉西泮+地塞米松也是很好的止吐方案,价格便宜,疗效不亚于单用5-HT3受体拮抗剂[18],止吐作用互相协同,而不良反应相互抵消。
3 市场现状与前景
随着肿瘤发病率的升高,止吐药物的销量也在不断升高,杜光等[19]分析了2008年至2010年武汉地区5-HT3受体拮抗剂使用情况,预测第2代5-HT3受体拮抗剂帕洛诺司琼因其对延迟性呕吐的良好控制,将会在临床广泛使用。陈丹等[20]通过分析5-HT3受体拮抗剂在全国医院的使用情况,认为虽然致吐风险极低的靶向抗肿瘤药物的使用必然会影响止吐药物市场,但目前仍以传统的化疗药物为主,建议研发质量更优、剂型更新的止吐药物。目前的止吐药物新剂型概述如下。
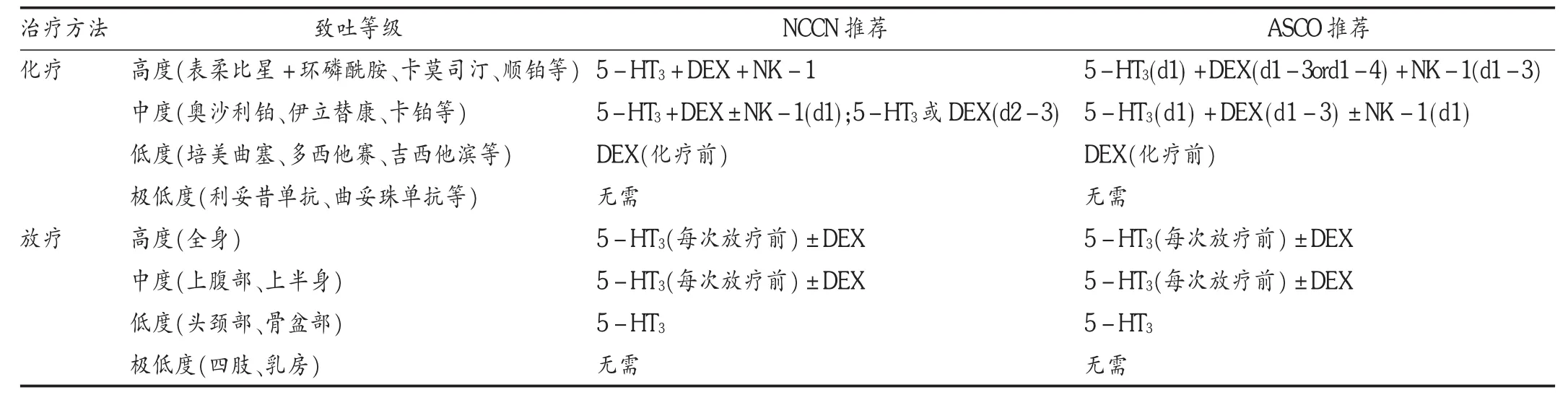
表2 2011年NCCN止吐指南、ASCO推荐止吐方案
昂丹司琼口服膜剂[21]:用于治疗成人和不小于6个月儿童患者放化疗引起的恶心和呕吐。将膜剂置口内后数秒内溶解,随后与唾液一起咽下,不需水送服。
格拉司琼透皮贴剂:美国食品药物管理局(FDA)批准上市,每片含格拉司琼34.3 mg。其每24 h可经皮肤释放3.1 mg格拉司琼,长达7 d,尤其适用于严重恶心呕吐或(和)吞咽困难的肿瘤患者[22]。一项随机、双盲双模拟、平行对照、多中心的Ⅲ期临床研究证实,格拉司琼透皮贴剂与口服制剂在治疗高致吐化疗方案所致恶心呕吐在疗效、安全性和耐受性上无显著统计学差异。因此,虽然在使用中存在一些问题[23],如皮肤不良反应、需在化疗前24 h使用、联合用药研究不深入等[24],但其具有血药浓度平稳、长效、使用方便、依从性佳、适用于迟发性呕吐的优点,为患者的止吐治疗提供了更多选择。
格拉司琼鼻腔喷雾剂:是北京军区总医院开发的具有自主知识产权的国家二类新药[25],理论基于格拉司琼鼻腔给药的药物动力学和药效学研究[26-28]。鼻腔给药用于全身系统疾病的治疗,具有起效快、无首过效应、无损伤、使用方便等特点[29]。相信随着该药的上市,能为肿瘤患者带来福音。
4 结语
尽管已有很多有效的止吐方案用于临床,且对放化疗所致恶心呕吐有较好疗效,但对于缓解延迟性呕吐效果仍不理想。因此,必须加快研究开发有更多治疗靶点的止吐新药,针对不同的致吐机制使用不同的药物联用,采用个体化治疗,实现临床合理用药。也希望国家尽快出台新的医疗政策,将靶向化疗药物纳入医保,使更多患者都能得到有效、低毒性的抗肿瘤治疗,减少恶心呕吐的发生,提高患者生存质量。
[1]Coates A,Abraham S,Kaye SB,et al.On the receiving end:patient perceptions of the side-effects of cancer chemotherapy[J].Eur J Clin Oncol,1983,19(2):203-208.
[2]赵忠斌,魏振平,芮 伟.化疗止吐临床治疗药物新进展[J].世界临床药物,2006,27(8):480-484.
[3]黄红兵,林桐榆.肿瘤治疗止吐药物临床应用研究进展[J].中华肿瘤防治杂志,2007,14(21):1 675-1 678.
[4]宋晓坤.5-羟色胺3受体拮抗药治疗化疗性呕吐的临床应用概述[J].中国药师,2012,15(4):562-567.
[5]Schwartzberg L.Chemotherapy-induced nausea and vomiting:state of the art in 2006[J].J Support Oncol,2006,4(2 Suppl 1):3.
[6]邹海燕 .NCCN止吐临床指引[J].循证医学,2006,2(6):54-64.
[7]施 亮,王 增,朴永锋,等.化疗所致恶心呕吐及其治疗药物的研究进展[J].中国药房,2010,21(38):3 633-3 636.
[8]陈 艳,丁莉坤,孟玲燕,等.盐酸帕洛诺司琼注射液人体药动学研究[J].中国新药,2007,16(10):806-809.
[9]黄 雄.盐酸帕洛诺司琼、格拉司琼、昂丹司琼预防化疗呕吐的比较[J].贵阳医学院学报,2010,6(35):296-299.
[10]Saito M,Aogi K,Sekine I,et al.Palonosetron plus dexamethasone versus granisetron plus dexamethasone for prevention of nausea and vomiting during chemotherapy:a double-blind,doubledummy,randomised,comparative phaseⅢ trial[J].Lancet Oncol,2009,10(2):115.
[11]方振威,翟所迪.阿瑞吡坦防治化疗致恶心呕吐的Meta分析[J].北京大学学报:医学版,2010,6(42):756-763.
[12]Carlson RW,Larsen JK,McClure J,et al.International adaptations of NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr CanC Netw,2014,12(5):643-648.
[13]Basch E,Prestrud AA,Hesketh PJ,et al.Antiemetics:American Society of Clinical Oncology Clinical Practice Guideline Update[J].J Clin Oncol,2011,29(31):4 189-4 198.
[14]陈文举,宋金森,方惠娟,等.肿瘤化疗中止吐药物的合理应用[J].中国药事,2013,2(27):209-214.
[15]王训强.肿瘤化疗所致恶心呕吐的药物治疗[J].世界临床药物,2008,29(6):362-365.
[16]胡婷婷.肿瘤辅助治疗中的止吐药研究进展[J].医学基础与药学研究,2008,3(21):82-85.
[17]Navari RM,Einhorn LH,Passik SD,et al.A phase II trial ofolanzapine for the prevention of chemotherapy-induced nausea and vomiting:a Hoosier Oneology Group study[J].Support Care Cancer,2005,13(7):529-534.
[18]王林海,柯 静,赵利军,等.肿瘤化疗常用止吐药物及注意事项[J].山西医药杂志,2010,10(39):947-949.
[19]杜 光,张程亮,夏 晨.武汉地区33家医院2008-2010年5-HT3受体拮抗药应用分析[J].药物流行病学杂志,2011,10(20):525-527.
[20]陈 丹,耿娓琴.5-HT受体拮抗剂止吐药市场分析[J].上海医药,2008,1(29):21-24.
[21]黄胜炎.国外新批准上市的药物新制剂新剂型[J].中国制药信息,2010,26(6):14-16.
[22]Duggan ST,Gurran MP.Transdermalgranisetron[J].Drugs,2009,69(18):2 597-2 605.
[23]张 亮,徐丽华,叶金翠.肿瘤化疗止吐剂格拉司琼透皮贴剂的研究进展[J].中国新药杂志,2012,21(13):1 443-1 447.
[24]Morrow T.Transdermal patch tailors antinausea treatment[J].Manag Care,2008,17(12):47-48.
[25]王东兴,钱秋玉,孙健绪,等.盐酸格拉司琼鼻腔喷雾剂的稳定性研究[J].中国药物应用与监测,2012,2(9):81-82.
[26]麦玉英,肖佳尚.盐酸格拉司琼鼻腔喷雾剂的制备及质量控制[J].中国药房,2009,20(34):2 693-2 695.
[27]乔建忠,袁淑兰,张振清,等.格拉司琼鼻喷雾剂在比格犬体内的相对生物利用度研究[J].中国临床药理学与治疗学,2006,11(3):270-272.
[28]Woo JS.Nasal absorption studies of granisetron in rats using a validated high-performance liquid chromatographic method with mass spectrometric detection[J].Arch Pharm Res,2007,30(6): 778-784.
[29]陆 燕,刘 华,王东兴.中药鼻腔给药的临床应用进展[J].中国药物应用与监测,2011,8(4):251-254.
Drug Treatment of Antiemetic in Cancer Chemotherapy Plus Radiotherapy
Hu Yu,Luo Jieli,Huang Yanfang,Li Lu,Wu Liuting
(Department of Pharmacy,Puren Hospital Affiliated to Wuhan University of Science and Technology,Wuhan,Hubei,China 430081)
Objective To analyze the mechanism of nausea and vomiting caused by cancer chemotherapy plus radiotherapy and review various antiemetic mechanism.Methods To conduct retrospective studies by clinical trials and literatures,and to review the current researches on various types of antiemetic drugs,clinical application and progress.Results 5-hydroxytryptamine-3(5-HT3)serotonin receptor antagonists and neurokinin-1 receptor antagonist had good curative effects on acute vomiting,palonosetron and aprepitant were much more better for delayed emesis and combined with dexamethasone could increase efficacy.Conclusion Currently 5-HT3receptor antagonist on acute vomiting is relatively positive,and if combined with NK-1 receptor antagonist and dexamethasone,can increase its efficacy.
cancer chemotherapy plus radiotherapy;nausea and vomiting;antiemetics;reasonable application
R969.3;R975+.3
A
1006-4931(2016)01-0010-04
2015-07-30)

