水稻矮秆基因iga-1的序列变异和表达分析
陈立凯,卢苏龙,刘永柱,王 慧,陈志强,郭 涛
(华南农业大学 国家植物航天育种工程技术研究中心,广州 510642)
水稻矮秆基因iga-1的序列变异和表达分析
陈立凯,卢苏龙,刘永柱,王慧,陈志强,郭涛*
(华南农业大学 国家植物航天育种工程技术研究中心,广州 510642)
摘要:该研究以水稻矮秆突变体cha-2为材料,对控制其表型性状的iga-1基因进行候选基因筛选,利用基因注释数据库对定位区间进行候选基因预测,通过ORF及其上下游调控区域的测序、序列比对及关键元件分析进行序列变异研究,半定量PCR检测目标基因的表达模式,明确其在基因序列、表达模式的变异,探讨其分子遗传调控机理。结果显示:(1)在隐性核基因iga-1精细定位基础上预测得到3个ORF,其中2个编码dnaJ分子伴侣(含有dnaJ结构域的蛋白),分别是LOC_Os05g26902和LOC_Os05g26926;另外1个为已克隆的水稻矮秆基因RGA1(LOC_Os05g26890)。(2)ORF序列分析表明矮秆突变体cha-2与野生型仅在RGA1基因座存在SNP变异,但未造成氨基酸编码的改变。(3)表达模式分析发现,矮秆突变体cha-2 的RGA1基因在种子萌发期、二叶期、四叶期和分蘖期等4个发育时期均不表达,且在‘中花11’、‘石狩白茅’的遗传背景下稳定遗传,均显现出失活状态,初步确定RGA1为iga-1的候选基因。(4)对RGA1基因上游和下游调控转录关键区进行测序结果表明,突变体cha-2存在865 bp的大片段缺失,包括第1外显子、部分第1内含子和转录起始上游区域。研究推断,突变体cha-2的矮秆基因iga-1正是没有活性的RGA1基因,其转录关键区域的大片段缺失,导致无法正常转录表达。
关键词:水稻;矮秆基因;缺失突变;G蛋白α亚基;iga-1
株高和分蘖是水稻株型结构中的两个重要农艺性状,也是影响产量的关键因素[1]。自然变异产生的半矮秆基因sd-1在水稻育种史上具有重要影响[2-3],利用sd-1系列矮源种质,中国在水稻矮化育种上取得重要进展,先后育成了大批高产、优质、抗倒伏的优良品种在生产上大面积应用。但是,单一矮源的广泛利用存在遗传脆弱性风险[4],限制了新品种生产潜力的进一步提高。
一般认为,水稻植株矮化是矮秆主基因表达作用的结果,同时也受到修饰基因或抑制基因的影响。矮秆基因能直接导致水稻植株形态学或细胞结构发生变化,如节间变短或细胞个数减少,从而使植株变矮[5]。迄今已登记的矮秆基因接近100多个,包括小粒矮秆(d1、d7、d11等)、畸形矮秆(d2、d6、d20等)、半矮秆(sd-1、sd-g、sd-t等)和多蘖矮秆(htd1、tdr1、tdr2等)[6]。多数新发现的矮秆突变体经常伴随其他不良性状,难以在生产上利用[7]。相对于自然突变,空间诱变是创新矮秆基因的潜在途径。目前,已通过空间诱变技术创造了一系列矮秆突变体,其中部分突变体应用于育种实践[8]。
本研究通过空间诱变获得矮秆突变体cha-2,该突变体株高降低、粒型短圆、着粒密度高,并将控制矮秆性状的突变基因iga-1精细定位于第5染色体约50 kb的范围内[6,9],但尚未实现候选基因筛选。本研究在前期工作基础上,通过序列检测和表达分析鉴定候选基因。研究结果有望进一步丰富水稻矮化基因分子调控机制,为株型育种提供理论指导。
1材料和方法
1.1供试材料
‘特籼占13’为野生型原种,是广东省佛山市农科所选育的籼型常规稻品种。‘惠阳珍珠早’为高秆品种,是广东省惠阳地区籼型常规稻。cha-2是由‘特籼占13’(TXZ13)干种子经卫星搭载后,在地面种植诱变后代筛选得到的矮秆突变体,经多世代观察,其矮秆性状稳定遗传(图1)。遗传分析表明其携带2个矮秆基因,基因型为sd1sd1iga-1iga-1。以‘惠阳珍珠早’(HYZZZ)为轮回亲本、cha-2为非轮回亲本,回交3次将iga-1导入‘惠阳珍珠早’,形成矮秆材料cha-2n(图1),矮秆基因型为SD-1SD-1iga-1iga-1。利用同样方法,将iga-1分别导入‘中花11’(ZH11)、‘石狩白茅’(SSBM),形成ZH11-iga-1、SSBM-iga-1矮秆株系。

A.灌浆期叶片;B.谷粒;C.灌浆期稻穗;D.灌浆期植株;每个图中从左到右依次为cha-2、cha-2n、特籼占13和矮脚南特

引物Primer正向引物Forwardprimer(5'→3')反向引物Reverseprimer(5'→3')扩增子长度Ampliconsize/bp备注RemarkP902CTAGTATATTGAAGGTTGAAGCATATTGCCAAAGCATTTTGTCCA2737扩增LOC_Os05g26902ORFAmplificationofLOC_Os05g26902ORFP926GTGGGTATCCAGCAAGTATTTCTGCATATTGCCAAAGCATTTTGTC2715扩增LOC_Os05g26926ORFAmplificationofLOC_Os05g26926ORFP890-1P890-2ATGTCCGTGCTTACCTGAGTGCACTTATCTAAGCACCTTGAGCGTTTGCAACTTATTGAAGGAACTGACTTACAACCTAGTCTTAGC22121584扩增LOC_Os05g26890ORFAmplificationofLOC_Os05g26890ORFP890-DTACAGGTTTGTCAAGAAGAAGTTGAGAAGAATACGGCAATAGGAT1364扩增LOC_Os05g26890下游序列AmplificationofLOC_Os05g26890downstreamP890-UAAGTGTCAATGCCAGTAGCCGTTGTTTCAGCCTCACTTAAAGA3635扩增LOC_Os05g26890上游序列AmplificationofLOC_Os05g26890upstream
1.2引物设计
根据前期定位结果,从NCBI网站和MUS数据库获得各预测ORF及其上下游碱基序列,用在线引物设计工具Primer 3 Plus进行引物设计(表1)。
1.3PCR扩增
参照王慧等[9]的方法提取水稻叶片基因组总DNA。取适量新鲜叶片放在2 mL离心管中加液氮捣碎,加入1 mL CTAB抽提液,摇匀;置于65 ℃水浴锅或恒温箱30~45 min后取出;加入氯仿-异戊醇(24∶1)至满管,上下剧烈摇动混匀;15 000 r/min离心10 min后吸取上清液至新的灭菌离心管中,加入600 μL预冷的异丙醇后-20 ℃放置20 min,使DNA充分沉淀后10 000 r/min瞬间离心,立即倒掉液体,加入720 μL 70%乙醇洗涤;待DNA干燥后加入100 μL 1×TE Buffer,溶解DNA;置于-20 ℃保存、备用。
采用适合长片段高保真扩增的KOD FxTaq酶(TOYOBO,上海),PCR扩增体系按照说明书配制。反应条件为:94 ℃预变性5 min;98 ℃变性30 s,57 ℃退火30 s,68 ℃延伸2~4.5 min,32~35个循环;68 ℃延伸10 min。扩增产物在1.2%琼脂糖凝胶中电泳检测。
1.4序列比对分析
使用TIANgel Midi Purification Kit(天根生化公司,#DP130419)对扩增产物进行回收纯化。具体操作参照试剂盒说明书。主要步骤:从琼脂糖凝胶上割下带有目的片段的凝胶块到一个2 mL离心管中,加入1×Buffer GC,置于55~60 ℃热板中约10 min直完全溶化。转移混合液至带收集管的吸附柱中离心。重复该步骤,直至剩余的混合液全部通过吸附柱。加入650 μL预热的DNA 洗涤缓冲液(wash buffer)至吸附柱中,60 ℃静置5 min。室温下,13 000 r/min离心30 s。重复此步骤。转移吸附柱至1.5 mL收集管中,加入30~50 μL预热的洗脱液(Elution buffer)至吸附柱中央,室温放置1 min,13 000 r/min离心1 min。
纯化PCR产物送至Invitrogen公司测序,利用正反向引物双向测序。测序碱基序列使用DNADynamo和CLC Sequence软件拼接,并进行序列比对分析。
1.5半定量RT-PCR
突变体和野生型各组织总RNA提取方法参考文献[10]。以第一链cDNA为模板,应用引物组合进行PCR扩增,琼脂糖凝胶电泳检测。PCR程序如下:94 ℃预变性2 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共30个循环,最后72 ℃延伸7 min。所用内参照基因为Actin1,所用引物为ActinF(5′-TCCTCTCTCTGTATGCCAGT-3′)和ActinR(5′-CGGAAACGCTCAGCACCAAT-3′),扩增片段长度为351 bp,PCR退火温度为58 ℃。
$result = socket_listen($sock,4)or die(“socket_listen()fail:”.socket_strerror(socket_last_error()).“/n”);
2结果与分析
2.1候选基因预测
根据前期研究结果,候选基因被定位于第5染色体标记DL18和DL19之间[6],通过MSU Rice Genome Annotation Project Database(http://rice.plantbiology.msu.edu/index.shtml)对定位区间进行候选基因预测(图2)。预测得到3个ORF,其中2个编码dnaJ分子伴侣(含有dnaJ结构域蛋白)LOC_Os05g26902和LOC_Os05g26926;另外1个为已克隆的水稻矮秆基因RGA1(LOC_Os05g26890)。
RGA1(D1,Dwarf1,DAIKOKUDWARF)基因是第一个克隆的水稻矮秆基因,编码GTP结合蛋白(G蛋白)的α亚基,参与赤霉素(gibberellic acid,GA)信号传导通路,影响糊粉层中α-淀粉酶的诱导和节间延长[11]。突变体材料HO541由于d1(dwarf1)基因的第1外显子和内含子部分碱基缺失,导致GTP结合蛋白表达受到抑制,赤霉素信号传导途径受阻,从而产生矮杆、谷粒小而圆等性状特征[3],与本研究cha-2突变表型高度相似,最有可能是候选基因。
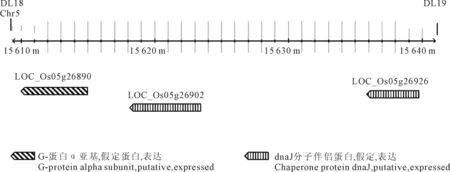
图2 iga-1定位区域的基因预测(http://rice.plantbiology.msu.edu)

位置Position区域RegionIR36日本晴Nipponbare特籼占13TXZ13cha-259外显子ExonACCA379内含子IntronAA-A1315内含子IntronGGCG1359内含子IntronAATA
以‘日本晴’基因组作为参考序列,针对定位区间的3个预测ORF设计引物进行扩增和测序。序列比对结果发现,突变体cha-2和野生型‘特籼占13’在LOC_Os05g26902和LOC_Os05g26926的ORF序列完全一致,而LOC_Os05g26890则发生一些点突变(表2)。与野生型‘特籼占13’相比,cha-2存在4个SNP,其中3个位于内含子区域(+379、+1 315和+1 359),另外存在1个SNP(+59)是位于外显子内。在+59这个碱基位点,IR 36与cha-2都是A,而‘日本晴’和‘特籼占13’都是C。通过编码序列分析,发现此突变属于同义突变,即密码子ACA(IR 36与cha-2)/ACC(‘日本晴’和‘特籼占13’)都编码苏氨酸。由此表明,iga-1的突变位点并非位于RGA1基因CDS区域。
2.2预测候选基因的表达模式
基因表达水平往往对基因的功能活性具有显著影响。前人研究表明,RGA1基因表达降低会产生矮秆性状,因此,进一步调查突变体cha-2该基因的表达模式。选取‘特籼占13’、cha-2、cha-2n种子萌发期、二叶期、四叶期和分蘖期等4个发育时期,利用半定量PCR分析RGA1基因表达模式。结果表明,‘特籼占13’的预测基因均正常表达,且在分蘖期表达水平较高;而cha-2、cha-2n预测基因在上述时期均不表达(图3)。上述结果表明,iga-1可能是RGA1表达缺陷型突变基因。
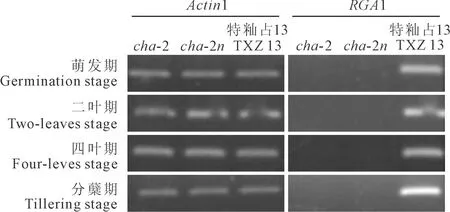
图3 cha-2、cha-2n、特籼占13
为进一步研究突变体预测候选基因iga-1在不同遗传背景下的表达情况,分别以‘中花11’和‘石狩白茅’作为轮回亲本,构建了iga-1的基因导入系ZH11-iga1、SSBM-iga1。表型观察发现,2个基因导入系均表现出矮化、叶色浓绿、圆小粒及直立紧凑小穗性状,与cha-2相似。进一步利用半定量PCR检测亲本及2个导入系RGA1基因表达水平(图4)。结果表明,‘中花11’、‘石狩白茅’均能检测到RGA1正常表达;而2个导入系与突变体cha-2则均无法扩增得到目的片段。说明突变基因iga-1在不同遗传背景中稳定遗传,且均表达缺失,进而引起植株的矮化等表型。
2.3候选基因RGA1序列分析
为了了解导致RGA1基因在突变体cha-2中表达缺失的原因,对候选基因RGA1 的上、下游区序列进行检测,分析是否其转录表达的调控序列发生突变。
通过检索NCBI数据库,下载已报道的IR36的RGA1序列(GenBank登录号L35844.1),扩增测序‘特籼占13’和cha-2的RGA1的上、下游区域。通过序列比对,发现三者基因下游约1 200 bp碱基序列完全一致,而在基因上游区域则发现cha-2存在大片段碱基缺失。以已克隆的IR36、H0541、‘日本晴’与‘特籼占13’、cha-2对RGA1的上游区域进行比对分析。结果(图5)显示,H0541(d1突变体)在第1外显子和内含子区域缺失了833 bp,导致基因表达受抑制;而突变体cha-2缺失了包括第1外显子整体、第1内含子部分以及转录起始上游区在内的865 bp。关键转录起始、调控位置大片段的缺失,理论上将导致基因表达失活,不具备正常功能。

图4 候选基因RGA1在不同遗传背景下的表型和表达情况
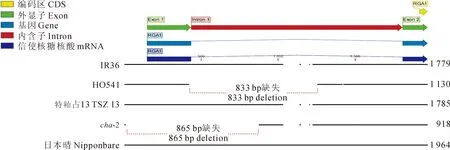
图5 水稻RGA1基因部分结构及cha-2突变位置示意图

方框序列分别表示CAAT-box和TATA-box;灰色背景方框序列表示转录起始位点;红色背景碱基表示SNP位点
对RGA1转录起始上游区的序列分析(图6)可以发现,该区域存在着TATA-Box及CAAT-Box等转录关键元件(基序)。前者功能在于结合RNA聚合酶,引导聚合酶准确识别转录的起始位点,而后者一般被认为控制着转录的起始频率。cha-2在RGA1的转录起始关键位置的大片段缺失对该基因的转录是致命的,将导致RGA1完全无法表达,这与表达分析的结果相一致。
RGA1编码GTP结合蛋白,是GA的传导途径的重要因子,对植株的正常生长和结实具有重要影响。由此判断,矮秆突变体cha-2的矮秆基因iga-1正是没有活性的RGA1基因,其转录关键区域的大片段缺失,导致无法正常转录表达,属于GA信号传导受阻型突变体。
3讨论
RGA1基因在1995年以 IR36为材料进行了cDNA克隆,序列分析表明RGA1基因含有14个外显子,编码380个氨基酸的GTP结合蛋白α亚基。到目前为止,至少发现鉴定了7个该位点的等位变异,包括d1[11-12]、dwarf89[13]、dwarf69[14]、d1C6PS[15]、d1-8、d1-4和Epi-d1[16]等。d1等位基因由于第1外显子和内含子的833 bp缺失造成GTP结合蛋白功能丧失,从而导致矮化。在植株生长正常的材料中,转入G蛋白(GTP结合蛋白)α亚基的反义cDNA,其单株表现为d1基因类似的生长特征。dwarf89编码区存在一个SNP(A-G),以致核苷酸编码发生突变(由苏氨酸突变为丙氨酸),亚基螺旋变短进而无法J结合GSP,导致基因失活。dwarf69的5′上游区存在大片段(1 076 bp)插入导致突变体RGA1的表达显著下降,从而造成植株矮化。EPI-d1的研究还发现了RGA1基因新的突变分子机制,启动子区域的组蛋白和DNA甲基化修饰变异显著地影响基因的表达造成植株株高的亚稳定状态。这些结果表明,新的d1等位基因的发现及研究会促进我们对G蛋白α构象的了解,从而揭示其与效应因子相互作用参与信号转导的精细机制[15]。
水稻突变体cha-2是籼稻品种‘特籼占13’的空间诱变后代中选育出来的遗传稳定的矮秆突变体,前人的研究将控制基因iga-1精细定位在约32 kb的区间内。定位区间的预测基因LOC_Os05g-26890.1(即RGA1)是编码GTP结合蛋白的相关基因,编码区序列比对表明cha-2并没有发生氨基酸编码的突变,排除了基因区突变引起矮秆的预测。基因表达差异筛选是另一有效鉴定基因突变的手段,因此,通过半定量PCR分析,意外发现野生型原种的RGA1正常表达,而cha-2、cha-2n的RGA1在4个发育阶段均为表达缺失。推测cha-2、cha-2n中因缺少或只携带无功能的G蛋白,导致GA信号传导受到抑制,从而出现株高的矮化。基因表达的缺失,说明转录受到了致命性的阻碍,通过调控区域的测序发现RGA1上游序列出现大片段的缺失,并且缺失的区域涵盖了转录起始、启动子和第一外显子等关键部位。分析表明,cha-2缺失了受RNA聚合酶识别活化的特异顺式元件,不能形成具有RNA聚合酶活性的转录起始复合体,也不存在特异的转录起始位点进行启动转录的过程。绝大多数矮化基因都是由于基因编码区出现碱基的插入、缺失和替换所引起的突变得到的,与cha-2植株矮化的分子机理存在明显不同。
GA信号传导途径对植物的生长是不可或缺的,cha-2能够生长和结实,说明GA信号传导在cha-2生物体内仍能够完成,暗示RGA1功能缺失的情况下应还有其他基因承担部分GA信号传导的功能,因此突变体cha-2是研究GA信号传导相关基因的特异材料。另一方面,G蛋白是调控动植物生长发育的重要信号传导蛋白,G-蛋白α能够与γ亚基互作,降低水稻营养生长期对氮的响应,增强氮的吸收和同化能力,进而提高收获指数和产量[17]。通过调节G蛋白的活性可以改变水稻的氮响应,可以在适当减少氮肥施用量的条件下获得水稻的高产。突变基因iga-1能够在后代稳定遗传,这些矮秆分离个体表现出来矮秆、叶片直立挺拔、茎杆粗壮、着粒密等优良性状,具有同时改良品种多个性状的潜力,能够间接应用于品种选育。
参考文献:
[1]KULKARNI K P,VISHWAKARMA C,SAHOO S P,etal.A substitution mutation in OsCCD7 cosegregates with dwarf and increased tillering phenotype in rice[J].JournalofGenetics,2014,93(2):389-401.
[2]KHUSH G S.Green revolution:preparing for the 21st century[J].Genome,1999,42(4):646-655.
[3]ASHIKARI M,WU J,YANO M,etal.Rice gibberellin-insensitive dwarf mutant geneDwarf1 encodes the alpha-subunit of GTP-binding protein[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1999,96(18):10 284-10 289.
[4]ASANO K,HIRANO K,UEGUCHI-TANAKA M,etal.Isolation and characterization of dominant dwarf mutants,Slr1-d,in rice[J].MolecularGeneticsandGenomics,2009,281(2):223-231.
[5]MONNA L,KITAZAWA N,YOSHINO R,etal.Positional cloning of rice semidwarfing gene,sd-1:rice “green revolution gene” encodes a mutant enzyme involved in gibberellin synthesis[J].DNAResearch,2002,9(1):11-17.
[6]郭涛,霍兴,饶得花,等.水稻半矮秆基因iga-1的鉴定及精细定位[J].作物学报.2011,37(6):955-964.
GUO T,HUO X,RAO D H,etal.Identification and fine mapping of a semidwarf geneiga-1 in rice[J].ActaAgronomicaSinica,2011,37(6):955-964.
[7]ARITE T,IWATA H,OHSHIMA K,etal.DWARF10,an RMS1/MAX4/DAD1 ortholog,controls lateral bud outgrowth in rice[J].PlantJournal,2007,51(6):1 019-1 029.
[8]陈志强,郭涛,刘永柱,等.水稻航天育种研究进展与展望[J].华南农业大学学报,2009,30(1):1-5.
CHEN Z Q,GUO T,LIU Y Z,etal.Achievements and perspective outlook of rice space induced mutation breeding in China[J].JournalofSouthChinaAgriculturalUniversity,2009,30(1):1-5.
[9]王慧,张书涛,郭涛,等.籼型矮杆突变体CHA-2的矮生性状遗传分析及基因初步定位[J].分子植物育种,2006,(S2):1-6.
WANG H,ZHANG S T,GUO T,etal.Genetic analysis and mutant gene mapping of space induced dwarf mutantCHA-2 of indica rice[J].MolecularPlantBreeding,2006,(S2):1-6.
[10]刘永柱,罗文龙,黄翠红,等.水稻花色素苷合成调节基因hrd1(t)的鉴定[J].中国农业科学,2013,46(19):3 955-3 964.
LIU Y ZH,LUO W L,HUANG C H,etal.Characterization of the regulatory genehrd1(t) involved in anthocyanin biosynthesis[J].ChinaAgricultureScience,2013,46(19):3 955-3 964.
[11]UEGUCHI-TANAKA M,FUJISAWA Y,KOBAYASHI M,etal.Rice dwarf mutantd1,which is defective in the alpha subunit of the heterotrimeric G protein,affects gibberellin signal transduction[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2000,97(21):11 638-11 643.
[12]ISHIKAWA A,TSUBOUCHI H,IWASAKI Y,etal.Molecular cloning and characterization of a cDNA for the alpha subunit of a G protein from rice[J].PlantandCellPhysiology,1995,36(2):353-359.
[13]YANG D,ZHENG X,CHENG C,etal.A dwarfing mutant caused by deactivation function of alpha subunit of the heterotrimeric G-protein in rice[J].Euphytica,2014,197(1):145-159.
[14]费小雯,邓晓东,王永胜,等.水稻矮化突变体G蛋白α亚基基因的结构和表达[J].中山大学学报(自然科学版),2004,43(1):70-74.
FEI X W,DENG X D,WANG Y SH,etal.Genetic analysis and molecular characterization of the GTP binding protein alpha-subunit gene from rice dwarf mutant dwarf 69[J].ActaScientiarumNaturaliumUniversitatisSunyatseni(Nat.Sci.Edi.),2004,43(1):70-74.
[15]陈华夏,周成博,邢永忠.水稻Dwarf1移码突变的新突变体鉴定[J].遗传,2011,33(4):397-403.
CHEN H X,ZHOU CH B,XING Y ZH.A new riceDwarf1 mutant caused by a frame-shift mutation[J].Hereditas,2011,33(4):397-403.
[16]MIURA K,AGETSUMA M,KITANO H,etal.A metastable DWARF1 epigenetic mutant affecting plant stature in rice[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2009,106(27):11 218-11 223.
[17]KUNIHIRO S,SAITO T,MATSUDA T,etal.Rice DEP1,encoding a highly cysteine-rich G protein gamma subunit,confers cadmium tolerance on yeast cells and plants[J].JournalofExperimentalBotany,2013,64(14):4 517-4 527.
(编辑:宋亚珍)
Sequence Variation and Expression Analysis of Dwarf Geneiga-1 in Rice (OryzasativaL.)
CHEN Likai,LU Sulong,LIU Yongzhu,WANG Hui,CHEN Zhiqiang,GUO Tao*
(National Engineering Research Centre of Plant Space Breeding,South China Agricultural University,Guangzhou 510642,China)
Abstract:In this study,we screened and confirmed the candidate gene of iga-1 in the fine mapping region,which controls the dwarf phenotype of mutation of cha-2,made clear the sequence variation and expression patterns of the gene,and explored its molecular mechanism of genetic regulation.Candidate gene in the mapping region was predicted using rice annotation database,and sequence variations of the ORF,upstream and downstream were analyzed based on sequencing and sequence alignment.Furthermore,meta-analysis of the crucial motif was performed.And expression pattern was investigated using semi-quantitative PCR.(1)On the basis of early studies of fine mapping of the nuclear genes iga-1,3 ORF were predicted in this study,including 2 dnaJ chaperones LOC_Os05g26902 and LOC_Os05g26926,and another one is the dwarf gene,RGA1( LOC_Os05g26890).(2)It is found that only several SNP were detected in the LOC_Os05g26890 in the mapping region between cha-2 and wild type by sequencing of ORFs,which appear to have no alteration of amino acid coding.(3)Expression analysis results show that RGA1 was unable to express in four developmental stages of cha-2 and was revealed inactivation in genetic background of ‘Zhonghua 11’ or ‘Shisoubaimao’ with genetic stability,which therefore was identified as candidate gene of iga-1.(4)The sequences in upstream and downstream of the RGA1 were examined,and 865 bp deletion was found in the upstream of RGA1 in cha-2,which was induced the whole exon 1,part of intron 1 and upstream region of transcription initiation.We concluded that the iga-1 in mutation of cha-2 was the inactivated RGA1 without normal expression,which was caused by a large fragment deletion in the key region of transcription.
Key words:rice (Oryza sativa L.);dwarf gene;deletion mutation;G protein α subunit;iga-1
中图分类号:Q754;Q789
文献标志码:A
作者简介:陈立凯(1986-),男,在读博士研究生,主要从事作物遗传育种研究。E-mail:leeking1113@163.com*通信作者:郭涛,博士,教授,硕士生导师,主要从事水稻分子育种研究。E-mail:guo.tao@vip.163.com
基金项目:国家自然科学基金(31200250);国家“863”计划(2012AA101201);广州市对外科技合作项目(2014J4500030);现代农业产业技术体系建设专项资金(CARS-01-12)
收稿日期:2015-09-09;修改稿收到日期:2015-11-16
文章编号:1000-4025(2016)01-0001-07
doi:10.7606/j.issn.1000-4025.2016.01.0001

