短波近红外光谱快速无损检测生鲜鸡肉胆固醇含量
王辉?田寒友?邹昊?刘飞?李家鹏?陈文华?狄艳全?乔晓玲
摘 要:采用短波近红外光谱对生鲜鸡肉中的胆固醇含量进行检测,使用便携式近红外光谱仪在近红外光谱短波区域采集236 份生鲜鸡肉的光谱信息,采用化学计量学法建立鸡肉胆固醇的偏最小二乘法定量预测模型。结果表明:最佳光谱预处理方法为标准化和基线校正,并通过剔除两次异常值对模型进行校正,所建定标模型的校正集相关系数Rc=0.801 1,校正标准差(sEC)=6.699 8,验证集相关系数Rp=0.803 4,预测标准差(sEP)=7.529 6,主因子数MF=4,sEP/sEC=1.12,说明模型可靠性、稳健性和预测效果较好。
关键词:便携式近红外光谱仪;短波近红外光谱;快速无损检测;生鲜鸡肉;胆固醇含量
Rapid Nondestructive Detection of Cholesterol Level of Fresh Chicken by Shortwave Near Infrared Spectroscopy
WANG Hui1, TIAN Hanyou1, ZOU Hao1, LIU Fei1, LI Jiapeng1, CHEN Wenhua1, DI Yanquan2, QIAO Xiaoling1,*
(1. Beijing Key Laboratory of Meat Processing Technology, China Meat Research Center, Beijing 100068, China;
2. Focused Photonics (Hangzhou) Co. Ltd., Hangzhou 310052, China)
Abstract: A portable near infrared spectrometer was applied to collect spectral information in the short-wave infrared region of 236 samples of fresh chicken to establish a quantitative model for predicting the cholesterol content of fresh chicken breast through partial least squares regression combined with chemometrics. The results showed that the optimal spectral pretreatment method was the combination of normalization and baseline correction. Model calibration was achieved by elimination of abnormal values performed twice. Parameters of the optimal prediction model developed were determined as follows: Rc (correlation coefficient for calibration set) = 0.801 1, sEC (standard error of calibration) = 6.699 8, Rp (correlation coefficient for prediction set) = 0.803 4, sEP (standard error of prediction) = 7.529 6, MF (number of main factors) = 4, and sEP/sEC = 1.12, which indicated the prediction model had better reliability, robustness and performance than other models.
Key words: portable near infrared spectrometer (NIR); short-wave NIR region; rapid nondestructive prediction; fresh chicken; cholesterol content
DOI:10.15922/j.cnki.rlyj.2016.03.007
中图分类号:O657.3 文献标志码:A 文章编号:1001-8123(2016)03-0029-04
王辉, 田寒友, 邹昊, 等. 短波近红外光谱快速无损检测生鲜鸡肉胆固醇含量[J]. 肉类研究, 2016, 30(3): 29-32. DOI:10.15922/j.cnki.rlyj.2016.03.007. http://rlyj.cbpt.cnki.net
WANG Hui, TIAN Hanyou, ZOU Hao, et al. Rapid nondestructive detection of cholesterol level of fresh chicken by shortwave near infrared spectroscopy[J]. Meat Research, 2016, 30(3): 29-32. (in Chinese with English abstract) DOI:10.15922/j.cnki.rlyj.2016.03.007. http://rlyj.cbpt.cnki.net
现代临床和流行病学证明,过多摄入高脂肪含量和高胆固醇含量的食品是导致“三高”等心脑血管疾病[1-2]、人体主要脏器的病变及激素代谢异常和紊乱等[3-6]的主要诱因。鸡肉是我国最主要的禽类食品之一,其胆固醇平均含量达到约114.4 mg/100 g[7]。随着人们生活水平的提高,社会大众对于高胆固醇食品的认识也逐渐深入,低胆固醇的功能性食品成为人们的首选。
根据国家标准的要求,目前检测肉及肉制品中胆固醇含量的主要方法是高效液相色谱法,由于其存在耗时、低效、繁琐、昂贵、样品损失、培训时间长等诸多问题,已无法满足现代企业生产过程对产品进行批量检测的需求。而近红外光谱技术(near infrared spectrometer,NIR)是近年来发展起来的一种高效快捷的检测分析手段,它所具有分析简便快捷、操作平台稳定、性价比高、人员无需培训及样品无损检测等优势,是传统方法无法比拟的,该项技术在诸多领域得到广泛应用[8-11]。到目前为止,国内研究已发表了诸多关于利用近红外技术对肉及肉制品的理化和感官指标进行检测分析的文章和专著[12-19],但目前关于对胆固醇进行的近红外光谱分析的报道较少。
本研究采用便携式近红外光谱仪对生鲜鸡肉中的胆固醇含量进行检测并建立预测模型,为肉及肉制品企业在品质控制和加工工艺上提供快速无损检测的理论依据和指导作用。
1 材料与方法
1.1 材料与试剂
鸡胸肉购于北京地区集贸市场、超市。样品购置后,沿肌肉纤维垂直方向将鸡胸肉较厚的一端切除1~1.5 cm,将内部肌肉纤维暴露出来,置于4 ℃条件下备检。
1.2 仪器与设备
SupNIR-1100型便携式近红外光谱分析仪 聚光科技(杭州)股份有限公司;TRACE 1310型气相色谱仪 美国Thermo Scientific公司。
1.3 方法
1.3.1 鸡肉近红外吸收光谱信息采集
在光谱采集过程中保持待测样品温度在4 ℃左右,环境温度和湿度基本一致。采集光谱信息前,除去样品检测面上的水。信息采集过程中,将鸡胸肉样品的横截面紧贴在检测探头上并避开含有筋膜的区域。光谱采集条件:扫描范围为600~1 099 nm,分辨率为10 nm,波长准确性为0.2 nm,波长重复性为±0.05 nm,吸光度噪声小于50 μA,光谱采集间隔为5 s,光谱循环扫描次数为10 次,每个样品连续采集2 次光谱信息,取其平均值作为该样品的原始光谱。
1.3.2 胆固醇含量的测定
按照国家标准GB/T 9695.24—2008《肉与肉制品胆固醇含量测定》的规定进行检测。
1.3.3 近红外光谱的波长选择
根据近红外光谱区的波长范围可将其划分为短波(700~1 100 nm)、中波(1 100~1 800 nm)和长波(1 800~2 500 nm)3 个区段,不同谱区承载了C—H、N—H、O—H等基团的倍频和合频。胆固醇所含C—H、N—H、O—H等基团的4 倍频分别位于900、800、740 nm左右,主要集中于短波近红外光谱区[20]。
1.3.4 建立和验证近红外光谱模型
将各样品胆固醇含量数据与光谱数据一一对应并进行关联,并按照3∶1的比例将其分为校正集和验证集。本实验使用便携式近红外光谱分析仪自带的RIMP化学计量学分析软件中标准化、求导、平滑、信号校正等11 种预处理方法处理光谱,采用偏最小二乘法(partial least squares method,PLS)建立模型,并在对模型进行优化时,根据软件中的学生残差验证剔除异常值。根据一般模型评价的规则,校正标准差(sEC)、交互验证标准差(sECV)、预测标准差(sEP)越小且相互间越接近越好,校正集相关系数(Rc)和验证集相关系数(Rp)越接近1越好,主因子数(MF)较少,sEP/sEC<1.2[20],以上述模型参数作为模型性能的评价指标,并依据相应参评指标的优劣筛选出最优光谱预处理方法和最优胆固醇预测模型。
2 结果与分析
2.1 鸡肉胆固醇参比值分析
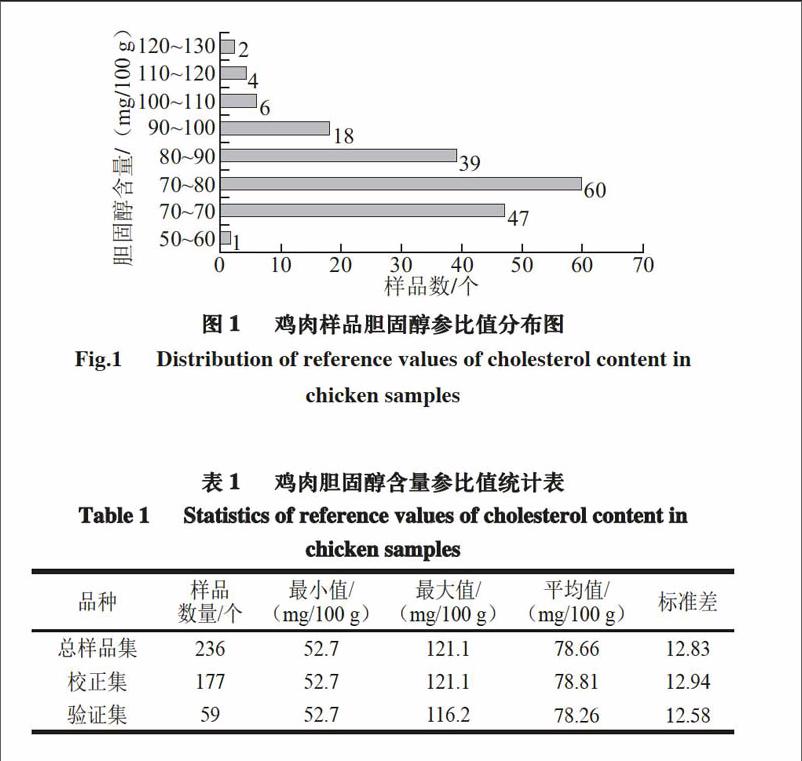
鸡肉胆固醇含量的参比值分布区见图1,其胆固醇参比值分布范围为52.7~121.1 mg/100 g,含量区间差异为68.4 mg/100 g,分布范围比较宽,各样品具有较好的代表性。
图2为对同一鸡肉样品进行2次扫描后所获取的光谱曲线,可看出两次扫描所获取的光谱基本重合,并以其平均光谱作为该样品光谱曲线。
由图3可知,近红外光谱图中不同胆固醇含量样品的光谱波形相近且不完全重合,这说明出样品光谱曲线在短波近红外谱区有着良好的重复性及差异性。
2.3 胆固醇预测模型的建立与优化
鸡肉属于不均一和背景复杂的多组分天然复杂物样品,其胆固醇有效信息基本都存在于近红外光谱的纵向差异上。在建模之前需对样品表观光谱中光谱背景造成的失真进行恢复,本研究通过选择可以校正基线漂移、减少系统和随机背景噪声、分辨信息叠加等干扰因素的一种或几种预处理方法的组合,对在短波区提取的鸡肉胆固醇光谱进行处理,使其复原以更加接近真实光谱,提高样品的光谱有效信息率并确定样品的真实光谱特征,以便表现出光谱之间和样品之间的差异,并采用偏最小二乘法建立胆固醇预测模型。
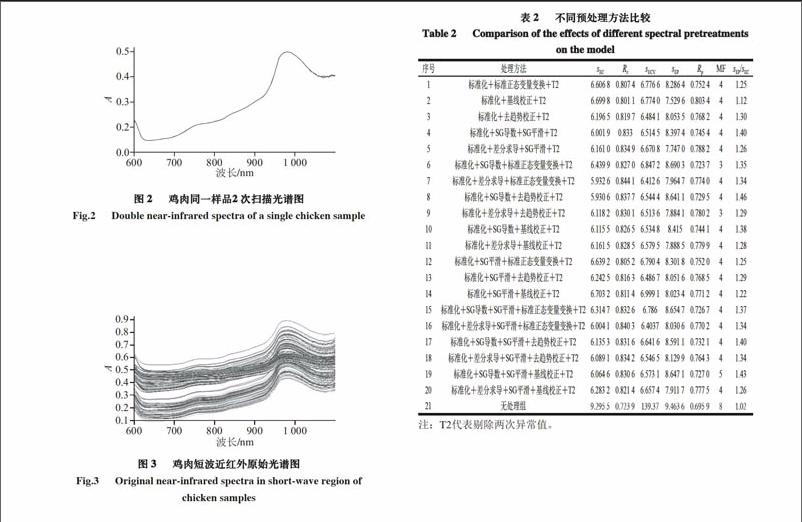
通过对11 种预处理方法进行排列组合对鸡肉的光谱信息进行校正,进行预建模以获得较好的预测模型。用标准化、SG一阶导数、差分求导、SG平滑、标准正态变量交换、去趋势校正及基线校正等预处理方法并剔除两次异常值后对模型的影响。通过综合评判各参评指标,筛选出鸡肉胆固醇优化模型见表2。
20个定标模型的Rc和Rp均发生明显提升,sEC、sEP、sECV和MF均明显降低,各相关参数均优于无处理组构建的定标模型,由此可看出,模型对于校正集中样品的预测值与鸡肉胆固醇的参比值具有高度线性相关关系,样品光谱与样品待测量在一定范围内的关联性较好,模型对于待测样品的预测性能也较好,内部和外部检验的误差也较小,sEC小于sECV且相互接近,sEP与sECV相互接近,这说明样品的代表性较好。但是经过两次异常值的剔除,模型适配范围缩小,容变性变弱,由此导致模型的稳健性降低,而2号模型的sEP/sEC=1.12<1.2,说明经过预处理并2次剔除异常值后,模型的适配范围仍然基本涵盖待测样品的光谱变动范围,其他模型的稳健性均大于1.2,但是可以通过向校正集中加入具有代表性的样本以提高模型的容变性,改善模型的预测效果。虽然除2号外的其他模型的Rc均高于2号模型,定标模型自身预测准确性较高,但是Rp均低于2号模型,由此可知即使自我预测准确性高,校正集的有效信息率也未必能满足对待测样品的预测。所有模型的MF都在3或4左右,说明建模时只需少数主因子即可包含建模所需的充分待测量信息。综上所述,通过对比表中各预处理方法对模型的影响及各模型参评参数之间的对比,可以看出2号模型的预处理方法——标准化和基线校正,为最佳预处理方法。处理后的光谱数据经剔除两次异常值后,采用偏最小二乘法建立的模型,Rc=0.801 1,sEC=6.699 8,Rp=0.803 4,sEP=7.529 6,sECV=6.774 0,MF为4,模型具有较好的预测准确性和稳健性。作为数学模型两大基本性能的可靠性和稳健性,是两种相对独立的性质,预测模型的建立和光谱背景的校正之间存在一定的平衡性,需通过调节二者之间的关系,来获得具有良好预测准确性和背景包容性的数学模型。
2.4 定标模型的内部交互验证和外部预测验证
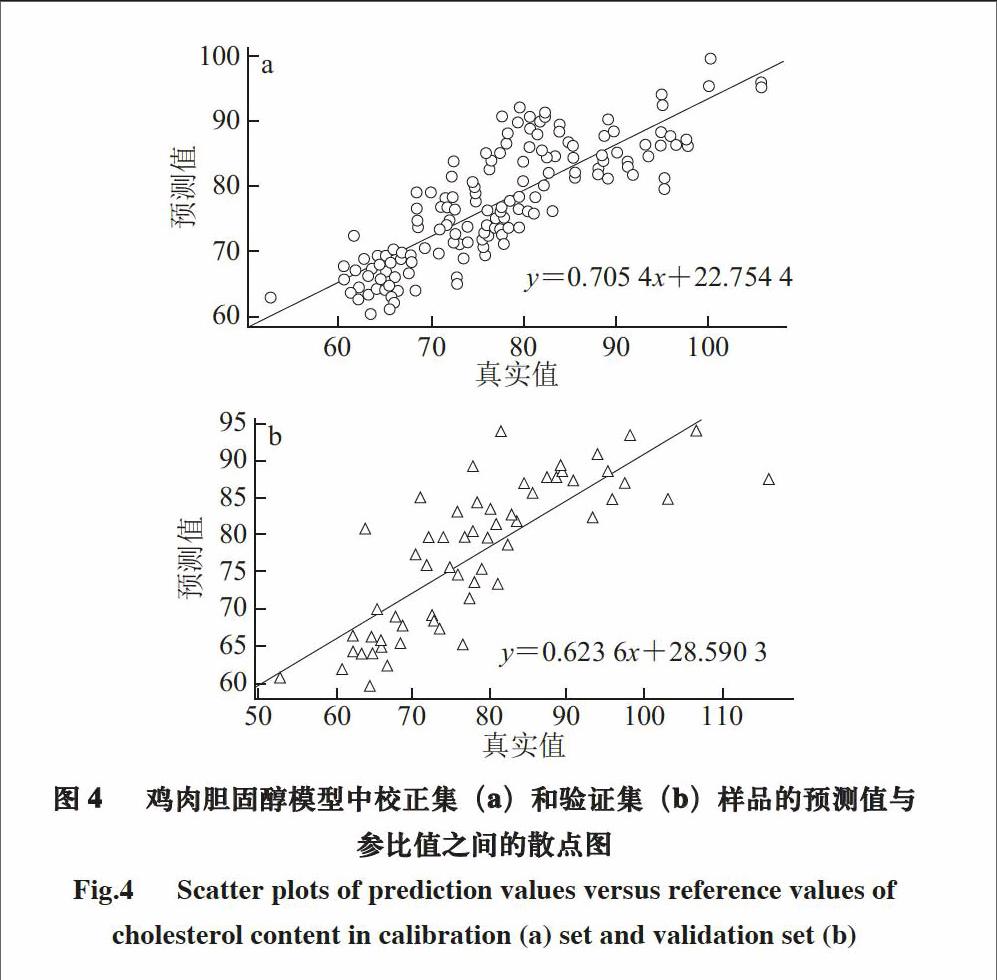
Fig.4 Scatter plots of prediction values versus reference values of cholesterol content in calibration (a) set and validation set (b)
图4a、b为剔除两次异常值后,剔除完毕后显示没有异常样本。校正集中的样品点分布于回归线的两侧,校正集相关系数(Rc)=0.801 1,校正标准差(sEC)=6.699 8,验证集中的样品点分布于回归线的两侧,验证集相关系数(Rp)=0.803 4,预测标准差
(sEP)=7.529 6,说明模型校正集和验证集的参比值与待测样品的预测值呈现强相关性。
3 结 论
本研究对鸡肉的胆固醇含量进行短波近红外检测,共采集样品236 份,其中校正集177 份和验证集59 份,用来建立定标模型,并对其模型性能进行分析和评估。鸡肉胆固醇最大含量为121.1 mg/100 g,最小含量为52.7 mg/100 g,含量差异为68.4 mg/100 g,分布范围比较宽,各样品具有较好的代表性。
在600~1 099 nm的短波近红外区,提取各样品光谱信息,采用标准化、SG一阶导数、差分求导、SG平滑、标准正态变量交换、去趋势校正及基线校正等预处理方法进行光谱背景的校正并进行模型优化,使用偏最小二乘法建立模型,通过效果比较,获得最佳预处理方法为标准化和基线校正并剔除两次异常值,所获模型参数为Rc=0.801 1,sEC=6.699 8,Rp=0.803 4,sEP=7.529 6,MF为4,sEP/sEC=1.12,证明该模型稳健性较好,预测准确性较高。
参考文献:
[1] 付明德. 胆固醇与心血管病问答[J]. 心血管病学进展, 1994, 2(2): 113-116.
[2] 苑聪, 吴洁. 高密度脂蛋白胆固醇与心血管剩余风险[J]. 中国动脉硬化杂志, 2012, 20(11): 1045-1050.
[3] 王浩, 张泽生, 张颖, 等. 高胆固醇膳食对大鼠和仓鼠肝脏HMG-CoA-R、LDL-R蛋白和基因表达的影响[J]. 食品研究与开发, 2011, 31(10): 192-195.
[4] 魏香兰, 方如塘, 冀爱云, 等. 高脂饲料中胆固醇含量对大鼠非酒精性脂肪肝动物模型建立的影响[J]. 西北药学杂志, 2012, 27(3): 233-236. DOI:10.3969/j.issn.1004-2407.2012.03.019.
[5] 王陵, 董蕾, 段炜, 等. 高胆固醇饮食对胃肠移行性复合运动及胃肠激素影响的实验研究[J]. 中华消化杂志, 2007, 27(5): 336-337. DOI:10.3760/j.issn:0254-1432.2007.05.016.
[6] 范平, 丁佑铭, 汪斌, 等. 高胆固醇饮食对妊娠豚鼠胆囊AQPsmRNA及雌性激素受体的影响[J]. 临床外科杂志, 2011, 19(12): 826-829.
[7] 祝加红, 孙克年. 鸡肉蛋产品中胆固醇含量的中草药调控[J]. 中国饲料添加剂, 2015, 156(4): 8-10.
[8] 相秉仁, 李睿, 吴拥军, 等. 近红外光谱分析技术在药学领域中的应用[J]. 计算机与应用化学, 1999, 16(5): 118-120. DOI:10.3969/j.issn.1001-4160.1999.05.003.
[9] 刘爱秋, 邓晓建, 王平荣, 等. 近红外光谱分析技术及其在农业领域的应用[J]. 西南农业学报, 2004, 16(2): 98-102. DOI:10.3969/j.issn.1001-4829.2003.02.025.
[10] 王凤霞, 张卓勇, 王亚敏, 等. 近红外光谱技术在医药领域应用的新进展[J]. 首都师范大学学报(自然科学版), 2005, 26(3): 53-59. DOI:10.3969/j.issn.1004-9398.2005.03.012.
[11] 许俐, 陈斌. 近红外光谱技术在食品和农产品领域中的应用[J]. 农业机械学报, 1997(增刊1): 184-187.
[12] 张玉华, 孟一, 张应龙, 等. 近红外光谱技术在食品安全领域应用研究进展[J]. 食品科技, 2012, 37(10): 283-286.
[13] 李静, 刘斌, 岳田利, 等. 近红外光谱分析技术及其在食品中的应用[J].
农产品加工(学刊), 2007, 3(3): 44-47. DOI:10.3969/j.issn.1671-9646-B.2007.03.013.
[14] 董文宾, 王顺民. 近红外光谱技术在食品分析中的应用[J].
食品研究与开发, 2004, 25(1): 113-115. DOI:10.3969/j.issn.1005-6521.2004.01.045.
[15] Prado N, Fernández-Ibá?ez V, González P, et al. On-site nir spectroscopy to control the shelf life of pork meat[J]. Food Analytical Methods, 2011, 4(4): 582-589. DOI:10.1007/s12161-011-9208-2.
[16] Kamruzzaman M, Elmasry G, Sun D W, et al. Non-destructive assessment of instrumental and sensory tenderness of lamb meat using NIR hyperspectral imaging[J]. Food Chemistry, 2013, 141(1): 389-396. DOI:10.1016/j.foodchem.2013.02.094.
[17] Uddin M, Okazaki E, Ahmad M U, et al. NIR spectroscopy: A non-destructive fast technique to verify heat treatment of fish-meat gel[J]. Food Control, 2006, 17(8): 660-664. DOI:10.1016/j.foodcont.2005.04.009.
[18] Prieto N, Ross D R, Roehe R. Predicting meat quality: the application of NIR spectroscopy[J]. Food Engineering and Ingredients, 2009, 34(4): 34-36.
[19] Elmasry G, Sun D W, Allen P. Non-destructive determination of water-holding capacity in fresh beef by using NIR hyperspectral imaging[J]. Food Research International, 2011, 44(9): 2624-2633. DOI:10.1016/j.foodres.2011.05.001.
[20] 严衍禄. 近红外光谱分析的原理、技术与应用[M]. 北京: 中国轻工业出版社, 2013: 23-25.

