改良剂对锰超富集植物短毛蓼锰吸收及抗氧化酶系统的影响①
叶攀骅,王 洋,刘可慧,周振明,3,陈孟林,3,刘 华,苏银萍,于方明,3*
(1 广西师范大学环境与资源学院,广西桂林 541004;2 桂林电子科技大学生命与环境科学学院,广西桂林 541004;3 珍稀濒危动植物生态与环境保护教育部重点实验室,广西桂林 541004)
改良剂对锰超富集植物短毛蓼锰吸收及抗氧化酶系统的影响①
叶攀骅1,王 洋1,刘可慧2,周振明1,3,陈孟林1,3,刘 华1,苏银萍1,于方明1,3*
(1 广西师范大学环境与资源学院,广西桂林 541004;2 桂林电子科技大学生命与环境科学学院,广西桂林 541004;3 珍稀濒危动植物生态与环境保护教育部重点实验室,广西桂林 541004)
摘 要:为了探究改良剂与超富集植物联合修复锰(Mn)污染土壤,采用温室土培的方法,研究了Mn污染土壤分别添加25、50 g/kg的海泡石(S2.5,S5)和沸石(Z2.5,Z5)对Mn超富集植物短毛蓼(Polygonum pubescens Blume)生长、Mn吸收及叶片抗氧化酶系统的影响。结果表明:改良剂添加显著增加了短毛蓼茎、叶中Mn的含量(P<0.05),但降低了株重、叶绿素a和叶绿素b含量。S2.5、Z5.0处理的株高比对照提高了15% 和16%,Z2.5与Z5.0处理分别比对照降低了40.05%、35.58%。沸石和海泡石添加显著提高了短毛蓼叶片中MDA含量及H2O2含量(P<0.05),表明短毛蓼受到了一定胁迫。超氧自由基含量在S2.5、S5.0、Z2.5处理时下降了4.69%、16.49%、21.01%。同时沸石和海泡石引起了短毛蓼抗氧化酶活性和非酶物质含量的改变。海泡石显著提高(P<0.05)短毛蓼叶片中超氧歧化酶(SOD)活性,在S2.5、S5.0处理下,SOD活性分别比对照提高了14% 和15%;POD、CAT活性也均有不同程度提高,在S2.5、S5.0处理下,POD分别是对照的4.63、4.23倍,Z2.5、Z5.0处理分别是对照的4.71、4.74倍;但显著降低了抗坏血酸过氧化物酶活性以及 -SH、GSH含量(P<0.05)。表明沸石和海泡石对短毛蓼抗氧化酶系统的影响不一。
关键词:锰;改良剂;短毛蓼;抗氧化酶
锰(Mn)是人类中枢神经系统和植物生长所必需营养元素,同时也是植物光合体系Ⅰ和Ⅱ中重要的微量元素之一[1-3]。但土壤中过量的Mn会加速植物体内活性氧化物质(reactive oxygen species,ROS)的生成,破坏植物细胞的质膜、蛋白质和DNA,造成膜脂过氧化,干扰细胞正常活动[4-5]。植物在逆境胁迫下通过提高抗氧化酶活性,包括SOD、CAT、POD 和APX等以及非酶物质GSH和-SH等减少或者消除ROS带来的伤害[6]。因此可以用植物体内抗氧化酶和非酶物质来指示植物对重金属胁迫的程度。
化学固定是在土壤中加入化学试剂或者化学材料,利用它们与重金属之间形成不溶性或者移动性差、毒性小的物质而降低其在土壤中的生物有效性,减少其向水体和植物及其他环境单元的迁移,从而实现土壤修复。天然沸石因巨大的比表面积、良好的离子交换能力而具有很好的吸附能力,是修复重金属土壤的改良剂之一。有研究表明添加天然沸石和海泡石均能降低土壤可交换态Cd、Pb、Zn含量,从而降低植物对Cd、Pb、Zn的吸收[7-10]。Mn作为一种多变价态的化学元素,其在良好交换能力和吸附能力的沸石和海泡石作用下,是否与土壤中的Cd、Pb、Zn变化相似,值得深入研究。因此,本研究通过在Mn污染土壤中添加不同配比的海泡石、沸石,探讨Mn超富集植物——短毛蓼对Mn吸收以及Mn对短毛蓼生长的影响,旨在揭示改良剂与超富集植物联合修复Mn污染土壤的可行性,为超富集植物-改良剂联合作用修复Mn污染土壤提供参考。
1 材料与方法
1.1 供试材料
土壤样品采集自广西壮族自治区桂林市平乐县二塘镇某Mn矿尾矿区。除去0~2 cm表层土壤,采集2~20 cm土层土壤带回实验室,在自然状态下风干,磨细过10目筛备用。土壤理化性质见表1。

表1 供试土壤基本理化性质Table 1 Basic physical and chemical properties of soil tested
短毛蓼(Polygonum pubescens Blume)采集自广西壮族自治区桂林市全州某Mn矿区,选择生长一致的8 cm高的短毛蓼,用蒸馏水冲洗根部3次后备用。
海泡石、沸石购自于桂林灵川县金山思达新型材料厂,过100目筛以备用。
1.2 盆栽试验
盆栽试验设6个处理:不添加改良剂对照(CK-1,CK-2,分别对照海泡石和沸石处理)、25 g/kg海泡石(S2.5)、50 g/kg海泡石(S5.0)、25 g/kg沸石(Z2.5)、50 g/kg沸石(Z5.0),每个处理重复3次。称取改良剂和土壤样品均匀混合,放置于黑色盆(34 cm × 22 cm × 11 cm)中,每盆土壤样品与改良剂之和为500 ± 0.5 g。盆栽土壤浇入蒸馏水,在室温条件下平衡30天,每隔一天采用称重法保持土壤含水率维持在田间最大含水率的70%。30天后将短毛蓼移栽至土壤中,每盆中栽种一株短毛蓼。在广西师范大学环境与资源学院大棚中进行维护,每日通过称重法浇水,植物生长75 天后收获。
1.3 测定项目及方法
1)生物量。植物样品先用自来水冲净,再将短毛蓼浸入20 mmol/L的EDTA-Na2溶液中交换20 min以去除根系表面吸附的金属离子,最后用去离子水洗净,用吸水纸将水分吸干,用卷尺测量株高、用天平称量株重。之后,将短毛蓼叶片一分为二,一部分存于自封袋中放入-20℃冰箱保存用于抗氧化酶系统指标的测定,另一部分叶与茎、根在105℃烘箱中杀青30 min,70℃下烘48 h至恒重。烘干的植物样品用不锈钢粉碎机磨碎,过60目尼龙网筛用于重金属含量的测定。
2)酶活性。称取0.20 g去叶脉剪碎叶片于预冷的研钵中,加1.00 ml预冷的0.1 mmol/L的磷酸缓冲液(pH 7.0,内含0.1 μmol/L的EDTA,1% 的聚乙烯吡咯烷酮(PVP))在冰浴上研磨成匀浆,加缓冲液使最终体积为8.00 ml。在4℃条件下10 000 r/min离心15 min,得上清液,即为酶粗提取液[11],用于测定SOD、CAT、POD、APX活性。SOD、CAT、POD活性测定参照王学奎等[12]的方法;APX活性测定采用Cao等[13]的方法。
3)叶绿素、MDA、·O2-、H2O2、-SH及PCs、GSH含量。叶绿素采用95% 的乙醇提取方法[12];·O2-采用陈贵[14]的方法测定;MDA含量参照中国科学院上海植物生理研究所的方法[15];H2O2含量测定参照邹琦[16]介绍的方法;-SH含量测定参照吴灵琼等[17]介绍的方法;PCs和GSH含量测定参照文献[27]的方法。
4)Mn含量。称取0.250 0 g烘干且过筛后的植物样品于消解管中,加入5 ml HNO3-HClO4(4︰1)消煮至澄清,用去离子水定容后采用ICP-OES(Varian 715-ES Series)测定各植物样品中的Mn含量。
以上所有的测定至少重复3次,所有图表用Microsoft Excel 2013处理,并用SPSS13.0软件进行差异显著性检验及相关性分析。
2 结果与分析
2.1 改良剂对短毛蓼生物量及Mn含量的影响
从图1可知,S2.5、Z5.0处理的株高高于对照,分别为对照的1.15倍和1.16倍,但与对照无显著性差异(P>0.05)。改良剂添加显著降低了短毛蓼株重(P<0.05),S5.0处理时株重降低最为明显,仅为对照的48.31%,Z2.5与Z5.0处理分别比对照降低了40.1%、35.6%(图2)。从图3可知,改良剂添加显著增加了短毛蓼茎、叶中Mn含量(P<0.05),在Z2.5处理时短毛蓼叶片中的Mn含量达到最大值,为12 091 mg/kg,是对照的2.91倍;在S2.5处理时短毛蓼根、茎Mn含量达到最大值,分别为1 114 mg/kg和1 392 mg/kg,分别比对照提高了156% 和252%。

图1 改良剂对短毛蓼株高的影响Fig.1 Effects of mineral amendments on heights of P.pubescens

图2 改良剂对短毛蓼株重的影响Fig.2 Effects of mineral amendments on weights of P.pubescens
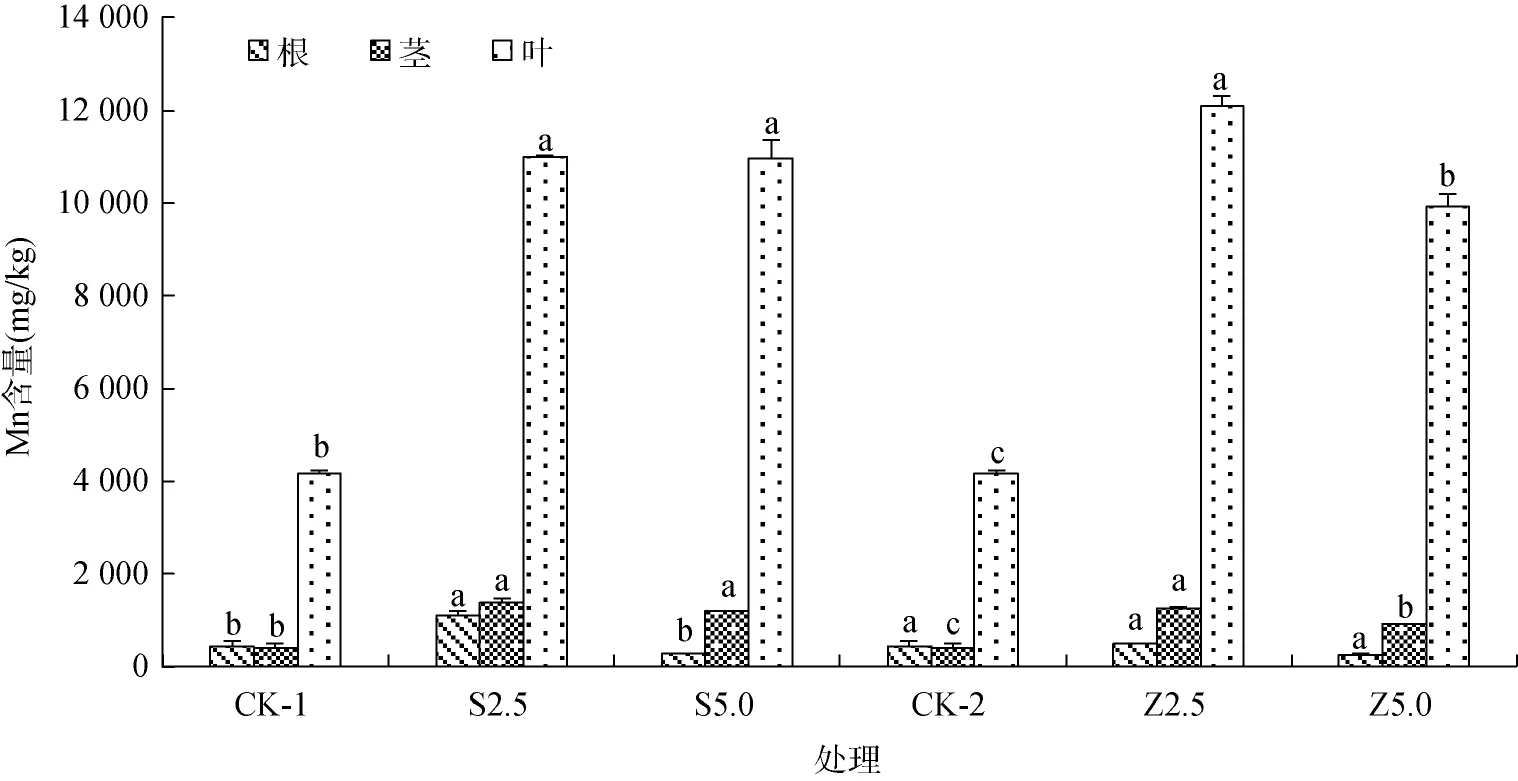
图3 改良剂处理对短毛蓼根茎、叶、中Mn含量的影响Fig.3 Effects of mineral amendments on Mn contents in the leaves,stems and roots of P.pubescens
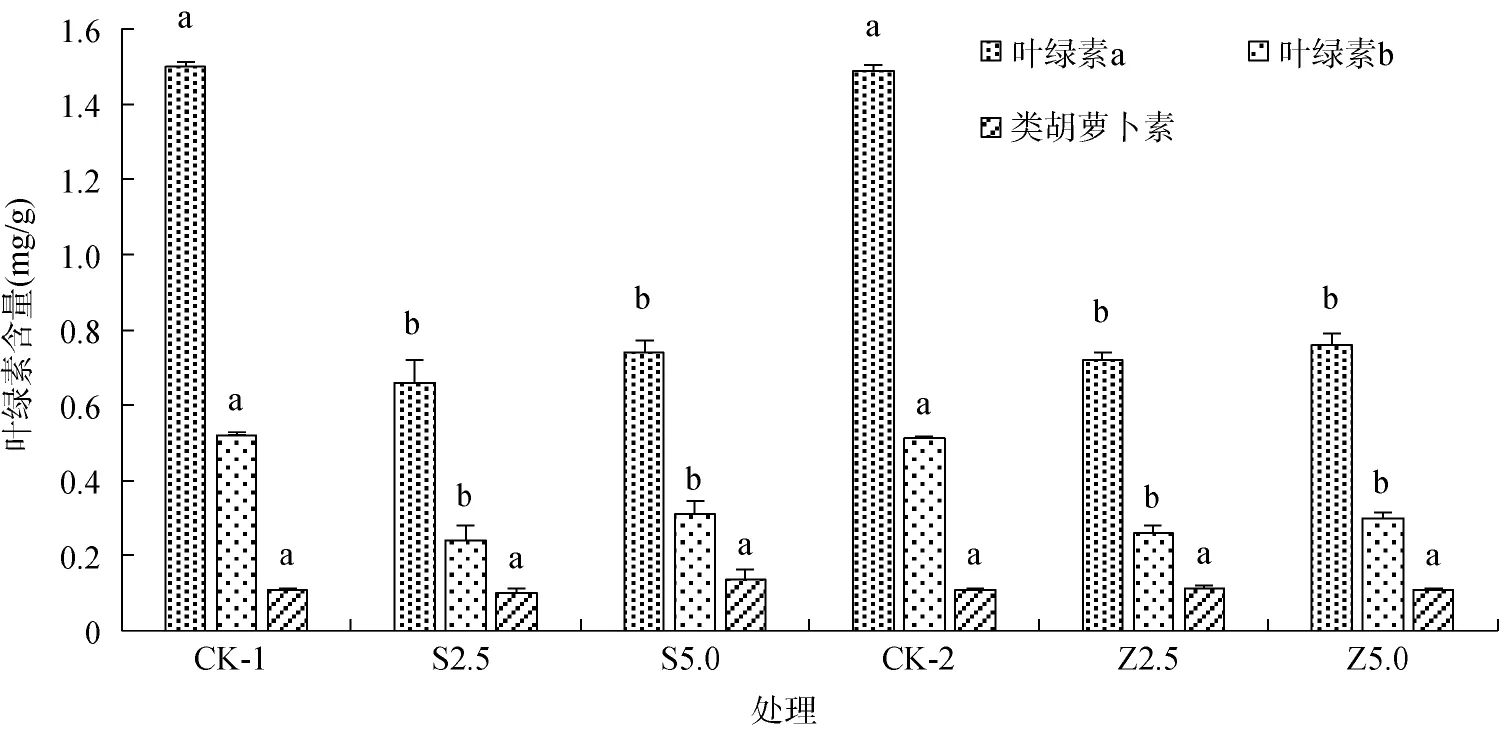
图4 改良剂对短毛蓼叶绿素含量的影响Fig.4 Effects of mineral amendment on contents of chlorophyll in leaves of P.pubescens
2.2 改良剂对短毛蓼叶绿素、H2O2和含量的影响
由图4可知,改良剂添加显著降低了短毛蓼叶片中的叶绿素a和叶绿素b含量(P<0.05),在S2.5和S5.0处理时叶绿素a和叶绿素b分别比对照下降了56.0%、53.9% 和50.7%、40.4%;在Z2.5和Z5.0处理时叶绿素a和叶绿素b分别比对照下降了51.7%、49.0% 和49.0%、41.2%,但对类胡萝卜素影响不显著(P<0.05),表明了改良剂抑制了叶绿素a和叶绿素b的合成。由图5、图6可知,改良剂的添加引起了短毛蓼叶片中活性氧物质H2O2和的变化。海泡石和沸石不同程度地提高了短毛蓼叶片中H2O2的含量,在S2.5处理时H2O2含量是对照的1.49倍,而S5.0处理时则与对照的差异不显著,Z2.5、Z5.0处理时分别是对照的1.76、1.65倍。海泡石添加显著降低了短毛蓼叶片中含量,在S2.5、S5.0处理时含量较对照下降了4.69%、16.49%;Z2.5处理时含量较对照下降了21.01%。
2.3 改良剂对短毛蓼叶片抗氧化酶及MDA含量的影响
改良剂添加对短毛蓼叶片抗氧化酶系统产生了一定的影响。从图7A可知海泡石添加能显著提高短毛蓼叶片中SOD含量(P<0.05),S2.5、S5.0处理分别是对照的1.14、1.15倍,沸石添加则对叶片中SOD活性影响不显著(P>0.05)。改良剂添加显著增加了POD活性(P<0.05)(图7B),S2.5、S5.0处理分别是对照的4.63、4.23倍,Z2.5、Z5.0处理分别是对照的4.71、4.74倍。从图7C中可以看出,改良剂添加提高了短毛蓼叶片中CAT活性,S5.0处理时CAT活性达到最大值,为256.59 U/(g·min)。与SOD、POD、CAT活性不同,改良剂添加显著降低短毛蓼叶片中APX活性,S2.5、S5.0处理时分别比对照降低了55.73%、66.19%,Z2.5、Z5.5处理时分别比对照降低了82.60%、85.59%(图7D)。由图7E可知,沸石和海泡石添加显著提高了短毛蓼叶片中MDA含量(P<0.05),说明叶片受到Mn的胁迫,造成膜脂过氧化。
2.4 改良剂对短毛蓼叶片-SH、PCs、GSH含量的影响
从图8中可以看出,沸石添加显著降低了短毛蓼叶片中-SH含量(P<0.05),Z2.5、Z5.0处理时分别比对照降低了13.95%、11.41%,海泡石的添加则对短毛蓼叶片中-SH含量无显著影响(P>0.05)。改良剂添加对短毛蓼叶片中PCs含量无显著性影响(P>0.05),却显著降低了短毛蓼叶片中GSH含量(P<0.05)。

图5 改良剂对短毛蓼叶片中的影响Fig.5 Effects of mineral amendments oncontents in leaves of P.pubescens
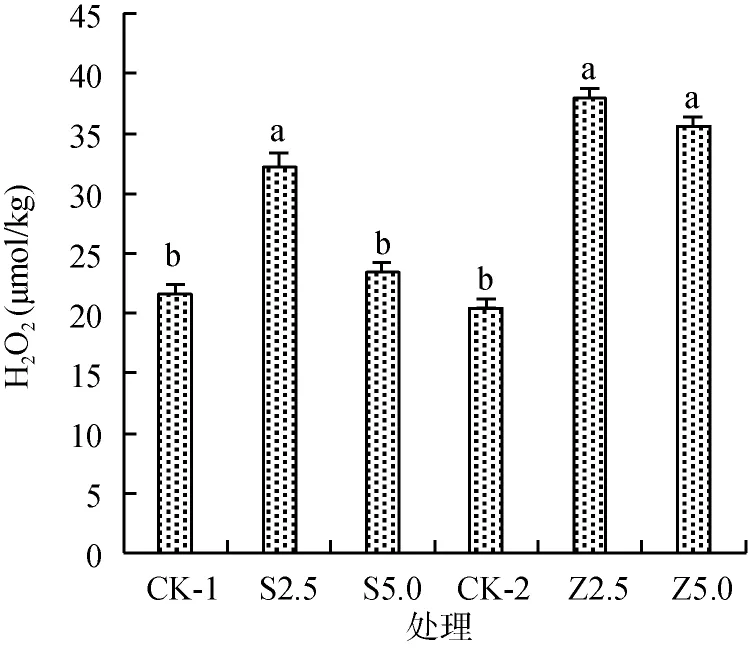
图6 改良剂对短毛蓼叶片中H2O2的影响Fig.6 Effects of mineral amendments on H2O2contents in leaves of P.pubescens
3 讨论
本研究中试供土壤为以Mn污染为主、以Cd污染为辅的多金属复合污染土壤。有研究表明,重金属污染土壤添加海泡石和沸石能提高土壤pH,使土壤中重金属有效态含量降低[18-19],从而使植物体内重金属含量降低。本试验研究表明,添加改良剂能显著提高短毛蓼茎和叶中的Mn含量(P<0.05),而短毛蓼地下部分Mn含量与对照间差异不显著,这与改良剂对土壤Cd、Pb、Zn等重金属的结果相反[20-21],其中原因值得深入研究。植物叶片中Mn含量过高将导致叶绿素合成必需元素Mg、Fe等的吸收受到抑制,致使叶绿素合成受阻[22-23],本实验中改良剂添加显著降低了短毛蓼叶片中的叶绿素a和叶绿素b(P<0.05),这可能与Mn元素含量过高导致这些元素下降有关。叶绿素含量下降将影响植物的光合作用,影响植株的生物量,虽然改良剂的添加增加了短毛蓼的株高,但降低了短毛蓼的株重。同时改良剂添加可能在短期内吸附了土壤中的磷等营养元素,降低了有效磷的含量,从而影响了短毛蓼生长[24]。
在正常生长条件下,植物体内的活性氧物质的产生和清除处于平衡状态,但是植物在受到土壤中过量重金属胁迫后,这种平衡可能被打破,产生H2O2、·OH等活性氧类物质(ROS)抑制植物的生长,从而引起植物自由基的累积和膜脂过氧化,影响植物的生理和生化过程[25]。本实验结果表明,改良剂添加不同程度地提高了短毛蓼叶片中H2O2的含量,显著提高了短毛蓼叶片中的MDA含量(P<0.05),这与彭喜旭等[26]研究Mn污染对玉米MDA含量的变化规律一致,证实了短毛蓼受到Mn的胁迫。土壤含有过量Cd元素,短毛蓼在25 mg/L Cd浓度水培条件下生长没有显著变化[27],同时土壤中有效态Cd含量较低,因此短毛蓼生长不受Cd的胁迫。此时,植物将通过体内抗氧化酶(SOD、CAT等)与非酶物质(-SH,GSH 等)来消除过量的自由基[28]。SOD是植物清除逆境中产生的的第一步,SOD可以催化植物体内的产生H2O2[29]。本研究结果表明,海泡石处理SOD含量增加显著(P<0.05),而显著降低了含量(P<0.05),这与王意锟等[30]对改良剂的添加对豇豆植株中 SOD活性影响的结果相同,说明添加海泡石能激活短毛蓼叶片中SOD酶活性,加速催化了向H2O2的转变。SOD对催化产生的H2O2可以通过在CAT、APX、 POD等抗氧化酶以及非酶物质GSH等共同作用下转化成H2O和O2而排出体外[28]。改良剂的添加不同程度地提高了短毛蓼叶片中POD、CAT活性,这与吴娟等[31]研究钙对菹草无菌苗体内的POD和CAT含量的变化规律一致。植物除了通过抗氧化酶系统来清除逆境胁迫产生的活性氧物质,还可以通过非酶物质来协同抗氧化酶清除过量的活性氧物质。本研究结果表明,短毛蓼叶片中GSH呈下降的变化趋势,且APX活性也呈下降趋势,其含量的下降可能与GSH和抗坏血酸形成的AsA-GSH循环代谢(Halliwell-Asada途径)参与H2O2的清除有关。

图7 改良剂对短毛蓼叶片中抗氧化酶活性及MDA的影响Fig.7 Effects of mineral amendments on antioxidant enzyme activities and MDAs in leaves of P.pubescens

图8 改良剂处理对短毛蓼叶片中 -SH、PCs和GSH的影响Fig.8 Effects of mineral amendments on contents of -SH、PCs and GSH in leaves of P.pubescens
4 结论
海泡石与沸石的添加显著增加了短毛蓼茎和叶中的Mn含量(P<0.05),使得短毛蓼叶片中H2O2含量增加,同时启动了短毛蓼的抗氧化酶系统,短毛蓼通过提高SOD、POD、CAT活性来消除H2O2对短毛蓼的影响,但叶片中MDA含量显著高于对照(P<0.05),表明短毛蓼受到了Mn的胁迫,导致了叶绿素a和叶绿素b含量的降低,株重显著低于对照(P<0.05)。
参考文献:
[1]Roels H A,Bowler R M,Kim Y,et al.Manganese exposure and cognitive deficits:a growing concern for manganese neurotoxicity[J].Neurotoxicology,2012,33(4):872-880
[2]Milner M J,Seamon J,Craft E,et al.Transport properties of members of the ZIP family in plants and their role in Zn and Mn homeostasis[J].Journal of Experimental Botany,2013,64(1):369-381
[3]Millaleo R,Reyes-Díaz M,Alberdi M,et al.Excess manganese differentially inhibits photosystem I versus II in Arabidopsis thaliana[J].Journal of Experimental Botany,2013,64(1):343-354
[4]于方明,仇荣亮,胡鹏杰,等.不同 Cd 水平对小白菜叶片抗氧化酶系统的影响[J].农业环境科学学报,2007,26(3):950-954
[5]Gao Y,Miao C,Xia J,Luo C Y,et al.Effect of citric acid on phytoextraction and antioxidative defense in Solanum nigrum L.as a hyperaccumulator under Cd and Pb combined pollution[J].Environmental Earth Sciences,2012,65(7):1 923-1 932
[6]周利强,吴龙华,骆永明,等.有机物料对低积累水稻品种始穗期抗氧化酶活性和重金属积累的影响[J].土壤,2013,45(3):506-512
[7]周歆,周航,曾敏,等.石灰石和海泡石组配对水稻糙米重金属积累的影响[J].土壤学报,2014,51(3):555-563
[8]Sun Y,Wu Q T,Lee C C C,et al.Cadmium sorption characteristics of soil amendments and its relationship with the cadmium uptake by hyperaccumulator and normal plants in amended soils[J].International Journal of Phytoremediation,2014,16(5):496-508
[9]Zhu Q H,Huang D Y,Liu S L,et al.Flooding-enhanced immobilization effect of sepiolite on cadmium in paddy soil[J].Journal of Soils and Sediments,2012,12(2):169-177
[10]Sun Y B,Sun G H,Xu Y M,et al.Assessment of sepiolite for immobilization of cadmium-contaminated soils[J].Geoderma,2013,193:149-155
[11]Mishra S,Srivastava S,Tripathi R D,et al.Phytochelatin synthesis and response of antioxidants during cadmium stress in Bacopa monnieri L.[J].Plant Physiology and Biochemistry,2006,44(1):25-37
[12]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006
[13]Cao X,Ma L Q,Tu C.Antioxidative responses to arsenic in the arsenic-hyperaccumulator Chinese brake fern(Pterisvittata L.)[J].Environmental Pollution,2004,128(3):317-325
[14]陈贵.应用羟胺测定植物材料中·O-2的方法[J].沈阳农业大学学报,1998,29(1):94-95
[15]中国科学院上海植物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999
[16]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000
[17]吴灵琼,成水平,杨立华,等.Cd2+和Cu2+对美人蕉的氧化胁迫及抗性机理研究[J].农业环境科学学报,2007,26(4):1 365-1 369
[18]王立群,罗磊,马义兵,等.不同钝化剂和培养时间对Cd污染土壤中可交换态Cd的影响[J].农业环境科学学报,2009,28(6):1 098-1 105
[19]王林,徐应明,孙国红,等.海泡石和磷酸盐对镉铅污染稻田土壤的钝化修复效应与机理研究[J].生态环境学报,2012,21(2):314-320
[20]李明遥,张妍,杜立宇,等.生物炭与沸石混施对土壤Cd 形态转化的影响[J].水土保持学报,2014,28(3):248-252
[21]孙晓铧,黄益宗,伍文,等.改良剂对土壤 Pb,Zn 赋存形态的影响[J].环境化学,2013,32(5):881-885
[22]Hauck M,Paul A,Gross S,et al.Manganese toxicity in epiphytic lichens:chlorophyll degradation and interaction with iron and phosphorus[J].Environmental and Experimental Botany,2003,49(2):181-191
[23]Le Bot J,Goss M J,Carvalho M J G P R,et al.The significance of the magnesium to manganese ratio in plant tissues for growth and alleviation of manganese toxicity in tomato(Lycopersicon esculentum)and wheat(Triticum aestivum)plants[J].Plant and Soil,1990,124(2):205-210
[24]Weng X Y,Zhao L L,Zheng C J,et al.Characteristics of the hyperaccumulator plant Phytolacca acinosa(Phytolaccaceae)in response to excess manganese[J].Journal of Plant Nutrition,2013,36(9):1 355-1 365
[25]韩君,梁学峰,徐应明,等.黏土矿物原位修复镉污染稻田及其对土壤氮磷和酶活性的影响[J].环境科学学报,2014,(11):2 853-2 860
[26]彭喜旭,冯涛,严明理,等.外源水杨酸对锰污染红壤中玉米的生长与抗氧化酶活性的调节作用[J].农业环境科学学报,2009,28(5):972-977
[27]邓华,李明顺,陈英旭,等.短毛蓼对Cd的富集特性研究[J].安徽农业科学,2010,38(10):5 284-5 286
[28]Najeeb U,Xu L,Ali S,et al.Citric acid enhances the phytoextraction of manganese and plant growth by alleviating the ultrastructural damages in Juncus effuses L.[J].Journal of Hazardous Materials,2009,170(2):1 156-1 163
[29]于方明,汤叶涛,仇荣亮,等.Cd 胁迫下超富集植物圆锥南芥抗氧化机理[J].环境科学学报,2010,30(2):409-414
[30]王意锟,郝秀珍,周东美,等.改良剂施用对重金属污染土壤溶液化学性质及豇豆生理特性的影响研究[J].土壤,2011,43(1):89-94
[31]吴娟,施国新,夏海威,等.外源钙对汞胁迫下菹草(Potamogeton crispus L.)叶片抗氧化系统及脯氨酸代谢的调节效应[J].生态学杂志,2014,33(2):380-387
Effects of Mineral Amendment on Manganese Absorption and Antioxidant Enzymes Activities in Hyperaccumulator Polygonum pubescens Blume
YE Panhua1,WANG Yang1,LIU Kehui2,ZHOU Zhenming1,3,CHEN Menglin1,3,LIU Hua1,SU Yinping1,YU Fangming1,3*
(1 School of Environment and Resource,Guangxi Normal University,Guilin,Guangxi 541004,China; 2 School of Life and Environmental Science,Guilin University of Electronic Technology,Guilin,Guangxi 541004,China; 3 Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection(Guangxi Normal University),Ministry of Education,Guilin,Guangxi 541004,China)
Abstract:The main objective of the present study was to investigate the amendments to remediate manganese pollution soil combined hyperaccumulator plants.By using soil incubation experiment,2.5% and 5% of sepiolite(S2.5,S5.0)and zeolite(Z2.5,Z5.0)were added to study the effects on Mn hyperaccumulator Polygonum pubescens Blume’s growth,Mn absorption and antioxidant enzyme activities.The results showed that sepiolite and zeolite significantly increased Mn in the leaves of P.pubescens(P<0.05).However,sepiolite and zeolite also decreased the plant weight,the contents of chlorophyll a and b in the leaves of P.pubescens.S2.5 and Z5.0 treatments increased the height of P.pubescens by 15% and 16%,respectively,compared to the control group,while Z2.5 and Z5.0 decreased the height of P.pubescens by 40.05% and 35.58% respectively.In addition,sepiolite and zeolite significantly increased the contents of MDA and H2O2(P<0.05)indicating the P.pubescens was under surpress.The content of superoxide radical(·O2-)decreased 4.69%,16.49% and 21.01% in S2.5,S5.0 and Z2.5 treatments,respectively.Furthermore,sepiolite and zeolite changed the activities of the antioxidant enzymes and the content of non-enzymes antioxidant.Sepiolite significantly increased the activity of superoxide dismutase(SOD)in the leaves,as indicated by the results that S2.5 and S5.0 treatments increased SOD activity by 14% and 15% respectively.The activities of peroxidase(POD)and catalase(CAT)also increased.The activities of POD were 4.63 and 4.23 times of the control in the S2.5 and S5.0 groups respectively.Z2.5 and Z5.0 treatments increased POD activities by 4.71 times and 4.74 times of the controls.However,both sepiolite and zeolite decreased the activity of ascorbate peroxidase(APX),-SH and GSH(P<0.05).These results demonstrate that sepiolite and zeolite have different impacts on the antioxidant enzymes in P.pubescens.
Key words:Manganese; Amendment; Polygonum pubescens Blume; Antioxidant enzymes
作者简介:叶攀骅(1990—),男,安徽合肥人,硕士研究生,研究方向为环境生态与生物修复。E-mail:leaf592952962@163.com
* 通讯作者(fmyu1215@163.com)
基金项目:①国家自然科学基金项目(41161057),广西自然科学基金项目(2014GXNSFAA118303),广西科学研究与技术开发项目重大专项计划(桂科重1298002-6;桂科转14122008-2),广西教育厅项目(2013HZ003)和广西研究生教育创新计划项目(YCSZ2015094)资助。
DOI:10.13758/j.cnki.tr.2016.01.017
中图分类号:X53

