磁性酶联免疫吸附法检测玉米中黄曲霉毒素B1
管笛,亢子佳,贾迪,武会娟,*(1.北京市理化分析测试中心,北京100089;2.北京市基因测序与功能分析工程技术研究中心,北京100089;3.北京市食品安全分析测试工程技术研究中心,北京100089)
磁性酶联免疫吸附法检测玉米中黄曲霉毒素B1
管笛1,2,3,亢子佳1,2,3,贾迪1,2,3,武会娟1,2,3,*
(1.北京市理化分析测试中心,北京100089;2.北京市基因测序与功能分析工程技术研究中心,北京100089;3.北京市食品安全分析测试工程技术研究中心,北京100089)
摘要:本研究将磁微粒替代酶标板作为固定相,用于酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测玉米中的黄曲霉毒素B1(Aflatoxin B1,AFB1)。我们进行了两类比较:第一类是以单克隆抗体为基础的间接竞争法,2.8 μm磁微粒的引入,使检测限较常规方法低近5倍,为0.028 ng/mL;第二类是以单克隆抗体为基础的直接竞争法,分别利用200 nm、2.8 μm粒径的羧基磁微粒与抗体偶联,经测定,2.8 μm磁微粒较常规ELISA法检测限低4.3倍,为0.012ng/mL。玉米样品中AFB1回收率范围在84.2%~125.9%之间,相对标准偏差小于12.3%。
关键词:磁微粒;黄曲霉毒素;酶联免疫吸附法;玉米
*通信作者
黄曲霉毒素主要是由黄曲霉菌(Aspergillusflavs)、寄生曲霉菌(Aspergillusparasiticus)和集蜂曲霉(Aspergillusnonius)产生的一组结构类似的次生代谢产物,广泛存在于农产品、食品、及饲料中,对人类和动物表现出很高的毒性和强致癌性[1-4]。目前,已经分离出的黄曲霉毒素及其衍生物的种类有20多种,其中18种的化学结构已经明确[5],黄曲霉毒素B1、B2、G1、G2、M1、M2为最常见的6种黄曲霉毒素。黄曲霉毒素中黄曲霉毒素B1的毒性、致癌性与污染频率最强,对人类危害最大。AFB1被世界卫生组织癌症研究机构列为I类致癌物质[6],基于此世界上已有100多个国家对食品及农产品中AFB1的含量进行严格限量[7]。因此迫切需要有效的检测技术来保障公众的消费安全及农产品进出口贸易顺畅。
目前检测AFB1的方法主要有仪器分析法和免疫学分析法。仪器分析法测定具有准确度高,抗干扰能力好的优点,主要用于检测部门的确证性分析[8-12];免疫学方法检测快速、样本处理简单、对技术人员要求不高、检测成本低、可同时检测大批量样本等优点,适用于大量样本快速定量筛查[13]。酶联免疫吸附法(enzymelinked immunosorbent assay,ELISA)作为免疫学方法之一已经广泛应用于AFB1检测过程中[14-16]。
本研究将超顺磁微粒应用到ELISA法中,替代酶标板作为固相载体,使免疫反应从二维到三维立体反应,以期提高检测灵敏度,促进AFB1检测技术的发展,对控制黄曲霉毒素的污染具有重要意义。
1 材料与方法
1.1试剂
AFB1标准溶液,牛血清白蛋白(Bovine Serum Albumin,BSA),AFB1-BSA,Tween-20,2-(N-吗啡啉)乙磺酸(MES),EDC(1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐),羊抗鼠IgG-HRP酶标二抗,3,3′,5,5′-四甲基联苯胺:均购于美国Sigma-Aldrich公司;N-羟基琥珀酰亚胺(NHS):购于PIERCE公司;AFB1-HRP偶联物:购于美国Beacon公司;2.8 μm粒径磁微粒:购于Invitrogen公司;200 nm羧基磁微粒:购于美国Quantum量子科学仪器公司;96孔可拆卸酶标板:购于Corning公司;氯化钾,氯化钠,磷酸氢二钾,磷酸二氢钠,甲醇:购于国药集团化学试剂有限公司;试验用水均为超纯水。
1.2方法
1.2.1AFB1-BSA磁微粒偶联物的制备
取2.8 μm粒径磁微粒165 μL,用pH=9.5硼酸缓冲液洗涤两次,弃去溶液;加入100 μL质量浓度为1 mg/mL的AFB1-BSA,加pH=9.5硼酸缓冲液至终体积为150 μL,旋涡轻轻混匀,再加入100 μL含3 mol/L硫酸铵的pH=9.5硼酸缓冲液,摇床210r/min,37℃反应18h;用磁铁吸附磁微粒,弃去反应溶液,加入1mL 含0.5 %BSA的PBS缓冲液,摇床210r/min,37℃反应1 h;利用磁铁吸附,弃去溶液;用含0.5 % BSA的PBS缓冲液洗涤两次,加入330 μL 0.5 % BSA、0.05 %硫柳汞的PBS缓冲液,4℃保存待用。
1.2.2AFB1单克隆抗体磁微粒偶联物的制备
AFB1单克隆抗体分别与两种不同粒径的磁微粒偶联。
AFB1单克隆抗体与2.8 μm粒径磁微粒的偶联。取165 μL 2.8 μm粒径磁微粒,用pH=9.5硼酸缓冲液洗涤两次,弃去溶液;加入50 μL质量浓度为2 mg/mL 的AFB1单克隆抗体,加pH=9.5硼酸缓冲液至终体积为150 μL,旋涡轻轻混匀,再加入100 μL含3 mol/L硫酸铵的pH=9.5硼酸缓冲液,摇床210r/min,37℃反应18h;用磁铁吸附磁微粒,弃去反应溶液,加入1 mL 含0.5 % BSA的PBS缓冲液,摇床210r/min,37℃反应1 h;利用磁铁吸附,弃去溶液;用含0.5 % BSA的PBS缓冲液洗涤两次,加入330 μL 0.5 % BSA、0.05 %硫柳汞的PBS缓冲液,4℃保存待用。
AFB1单克隆抗体与200 nm粒径磁微粒的偶联。以pH4.7,0.1 mol/L的MES溶液(称取1.066 g MES,0.45 g NaCl溶于50 mL纯水,调pH至4.7)作为活化缓冲溶液,取100μL磁微粒溶液于2mL离心管中,利用磁铁吸附,待完全吸附后,弃去液体,加入500μL活化缓冲溶液,漩涡振荡器上混匀;磁铁吸附,待完全吸附后,弃去液体,重复洗涤两遍后,向磁微粒中加入0.96mg EDC、1.15 mg NHS和200 μL活化缓冲溶液,37℃,120r/min,摇床振荡30min;用活化缓冲溶液洗涤两遍,除去未反应的活化剂,并更换新的2 mL离心管。将pH8.5,浓度为50mmol/L的硼酸缓冲液作为偶联缓冲液。用500 μL的偶联缓冲液洗涤磁珠两遍,加入100 μg AFB1单克隆抗体至偶联缓冲液终体积为400 μL,37℃,120r/min,摇床振荡3 h。
封闭加入100 μL的BSA溶液(BSA事先溶解在偶联缓冲液中)至BSA终浓度为5 mg/mL,对免疫磁微粒表面没有偶联抗体的活化基团进行封闭,并且通过BSA的物理吸附,封闭其它空间位点,降低在之后实验中可能发生的非特异性吸附。37℃,120r/min,摇床振荡30min。利用磁铁吸附,弃去溶液;用含0.5 % BSA的PBS缓冲液洗涤两次,加入330 μL 0.5 % BSA、0.05 %硫柳汞的PBS缓冲液,4℃保存待用。
1.2.3AFB1间接竞争ELISA方法
将AFB1-BSA溶于pH=9.5的碳酸盐缓冲液中至质量浓度为0.5 μg/mL,加入酶标板中,100 μL/孔,4℃过夜。PBST溶液洗板3次后,每孔加入200 μL 1.5 % BSA封闭液,37℃孵育2 h。PBST溶液洗板3次后,每孔加入50 μL样品/标准品溶液,50 μL羊抗鼠IgG-HRP酶标二抗,50 μL AFB1抗体溶液,37℃反应15min。PBST溶液洗板5次后,每孔加入100 μL显色液,37℃反应10min后,每孔加入50 μL 2 mol/L硫酸终止反应,450 nm下测定吸收值。
1.2.4AFB1直接竞争ELISA方法
AFB1直接竞争ELISA法分别采用两种抗体,单克隆抗体与多克隆抗体。
单克隆抗体直接竞争反应为将羊抗鼠抗体溶于pH=9.5的碳酸盐缓冲液中至质量浓度为30 μg/mL,加入酶标板中,100 μL/孔,4℃过夜。PBST溶液洗板3次后,每孔加入200 μL 1.5 % BSA封闭液,37℃孵育2 h。PBST溶液洗板3次后,每孔加入50 μL样品/标准品溶液,50 μL AFB1-HRP偶联物,50 μL AFB1单克隆抗体溶液,37℃反应15min。PBST溶液洗板5次后,每孔加入100 μL显色液,37℃反应10min后,每孔加入50 μL 2 mol/L硫酸终止反应,450 nm下测定吸收值。
1.2.5基于AFB1磁微粒的间接竞争ELISA法
向96孔板每孔中加入200 μL 1.5 % BSA溶液,37℃孵育2 h。PBST溶液洗板3次后,每孔加入50 μL样品/标准品溶液,50 μL羊抗鼠IgG-HRP酶标二抗,15 μg AFB1-BSA磁微粒偶联物,50 μL AFB1抗体溶液,放入摇床中,37℃,150r/min,反应15min。然后清洗磁微粒,清洗方法同文献[17]。每孔加入100 μL显色液,放入摇床中,37℃,150r/min,反应10min后,每孔加入50 μL 2 mol/L硫酸终止反应,450 nm下测定吸收值。
1.2.6基于AFB1磁微粒的直接竞争ELISA法
基于AFB1单克隆抗体的ELISA法应用两种磁微粒,分别是200 nm和2.8 μm羧基磁微粒。向96孔板每孔中加入200 μL 1.5 % BSA溶液,37℃孵育2 h。PBST溶液洗板3次后,每孔加入50 μL样品/标准品溶液,50 μL AFB1-HRP偶联物,15 μg AFB1单克隆抗体-200 nm磁微粒偶联物(2.8 μm磁微粒偶联物使用量为20 μg),放入摇床中,37℃,150r/min,反应15min。然后清洗磁微粒,清洗方法同文献[17]。每孔加入100 μL显色液,放入摇床中,37℃,150r/min,反应10min后,每孔加入50 μL 2 mol/L硫酸终止反应,450 nm下测定吸收值。
1.2.7标准曲线建立与数据处理
取AFB1标准品溶液进行梯度稀释,利用以上方法分别建立标准曲线。溶液吸收值通过酶标仪在450nm下测定,并作图。横坐标为AFB1质量浓度,纵坐标用抑制率表示(B/B0%,其中B为含有AFB1时的吸光度值,B0是质量浓度为0 μg/mL时的吸光度值)。测定结果用非线性四参数逻辑斯蒂拟合。方法的检出限定义为90 %抑制率时所对应AFB1质量浓度。检测的线性范围定义为抑制率在80 %~20 %之间所对应的AFB1质量浓度。
1.2.8玉米样品中AFB1回收率的测定
以不同质量浓度AFB1添加于空白玉米粉样品中,称取50 g样品,并量取100 mL 80 %甲醇水溶液至一具塞三角瓶中。剧烈震荡3min,静置3min,待样品沉淀。用玻璃纤维滤纸过滤萃取液,并收集,用蒸馏水稀释5倍,取50 μL上样定量检测。
2 结果与分析
2.1间接竞争ELISA法的比较
将2.8 μm磁微粒作为承载体,包被AFB1-BSA,取代酶标板引入ELISA中,建立标准曲线,与常规间接竞争ELISA进行比较,结果见图1。
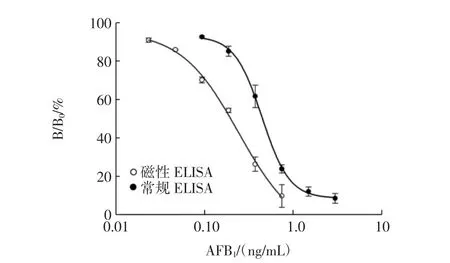
图1 间接竞争ELISA法标准曲线Fig.1 The standard curves of indirect competitive ELISA
两种方法的标准曲线均表现出好的拟合度,R2值分别为0.997(磁性),0.999(常规)。
进一步比较二者的检出限,定量限,线性范围,结果见表1。

表1 间接竞争ELISA法参数Table 1 The data of indirect competitive ELISA ng/mL
通过比较发现,以磁微粒作为载体的间接竞争ELISA法具有更低的检测出限,磁微粒的引入,较常规ELISA法可以降低检出限,本节研究检出限仅为常规方法的20.39 %。与酶标板相比,磁微粒作为固定相比表面积更大,提供的结合位点更多,在溶液中较为分散均一,磁微粒表面结合的AFB1-BSA在溶液中暴露充分,降低了抗原与抗体结合的空间位阻。酶标板包被法中,抗体通过分子布朗运动和扩散运动到酶标板的速度较慢,而磁微粒可均匀分布在溶液中,在液相中呈三维立体反应,更易于接近抗体,从而加快抗原抗体结合速度。综上,与酶标板相比,在相同时间内,磁微粒的引入可使免疫反应更彻底,从而获得更低的检测限。
2.2以单克隆抗体为基础的直接竞争ELISA法比较
将200 nm磁微粒、2.8 μm磁微粒分别作为承载体,偶联AFB1单克隆抗体,取代酶标板引入ELISA中,建立标准曲线,与常规直接竞争ELISA法进行比较,结果见图2。

图2 单抗直接竞争ELISA法标准曲线Fig.2 The standard curves of direct competitive ELISA based on monoclonal antibody
3种方法的标准曲线均表现出好的拟合度,R2值分别为0.992(200 nm磁性),0.999(2.8 μm磁性),0.990(常规)。
进一步比较三者的检出限,定量限,线性范围,结果见表2。

表2 单抗直接竞争ELISA法参数Table 2 The data of direct competitive ELISA based on monoclonal antibody ng/mL
通过比较发现,以2.8μm磁微粒作为载体的间接竞争ELISA法具有更低的检测出限,磁微粒的引入,较常规直接ELISA法检出限可以降低76.9 %。
2.3玉米样品中AFB1添加回收率的测定
向空白玉米样品中添加一定量的AFB1标准品,使终质量浓度为0.1、0.2 ng/mL和0.4 ng/mL。经过提取回收,利用以AFB1单克隆抗体为基础的磁微粒间接竞争模式和直接竞争模式方法分别测定并比较。结果见表3。

表3 玉米样品中AFB1添加回收率测定Table 3 Recoveries of AFB1 in corn samples
2.8μm磁微粒间接竞争ELISA法的回收率范围在90.8 %~106.4 %之间,200 nm磁微粒直接竞争ELISA法的回收率范围在84.2 %~125.9 %之间,2.8 μm磁微粒直接竞争ELISA法的回收率范围在84.5 %~91.3 %之间。通过3种不同质量浓度AFB1玉米样品的应用研究,得到了很好的回收率,进一步证明磁微粒作为承载体能够应用于玉米样品中AFB1的ELISA检测。
3 结论
本研究中,我们进行了两类比较:(1)以AFB1单克隆抗体为基础的间接竞争ELISA法,2.8μm磁微粒的引入,使检测限较常规ELISA低近5倍(为0.028ng/mL),回收率范围在90.8 %~106.4 %之间;(2)以AFB1单克隆抗体为基础的直接竞争ELISA法,分别利用200 nm、2.8 μm粒径的羧基磁微粒与抗体偶联,经测定,2.8 μm磁微粒较常规ELISA法检测限低4.3倍(0.012 ng/mL),回收率范围在84.5 %~91.3 %之间,200 nm磁微粒的检出限为0.025 ng/mL,回收率范围在84.2 %~125.9 %之间。综上,磁微粒的引入可提供更大比表面积,更好的流动性从而使灵敏度得到提升。本研究成功建立了一种检测玉米中AFB1的磁性ELISA方法。
参考文献:
[1] Creepy E E.Update of survey,regulation and toxiceffects of mycotoxins in Europe[J].Toxicology Letters,2002,127(1/3):19-28
[2] Sweeney M,Dobson A.Mycotoxin production by Aspergillus,Fusariumand Penicilliumspecies[J].International Journal of Food Microbiology,1998,43(3):141-158
[3] Aycicek H,Aksoy A,Saygi S.Determination of aflatoxinlevels in some dairy and food products which consumed inAnkara,Turkey[J].Food Control,2005,16(3):263-266
[4] Ehrlich K C,Kobbeman K,Montalbano B G,et al.Aflatoxin-producing Aspergillusspecies from Thailand[J].International Journal of Food Microbiology,2007,114(2):153-159
[5] Asao T,B chi G,Abdel-Kader M,et al.The structures of aflatoxins B and G1.Journal of the American Chemical Society,1965,87(4):882-886
[6] IARC-WHO.Some naturally occurring substances:Food items and constituents,heterocyclic aromatic amines,and mycotoxins[C].Lyon France: IARC Monographs on the Evaluation of Carcinogenic Risks to Humans,1993:245-362
[7] Van Egmond Hans P,Schothorst Ronald C,Jonker Marco A.Regulations relating to mycotoxins in food:perspectives in a global and European context[J].Analytical andbioanalytical chemistry, 2007, 389 (1):147-157
[8] Alcaide-Molina M,Ruiz-Jiménez J,Mata-Granados J M,et al.Highthrough-put aflatoxin determination in plant material by automated solid-phase extraction on-line coupled to laser-induced fluorescence screening and determination by liquid chromatography-triple quadrupole mass spectrometry[J].Journal of Chromatography A,2009, 1216(7):1115-1125
[9] Cervino C,Asam S,Knopp D,et al .Use of isotope - labeled aflatoxins for LC-MS/MS stable isotope dilution analysis of foods [J].Journal of agricultural and food chemistry,2008,56 (6):1873 - 1879
[10] Xavier JJ M,Scussel V M.Development of an LC-MS/MS method for the determination of aflatoxins B1,B2,G1,and G2in Brazil nut.International Journal of Environmental Analytical Chemistry,2008,88 (6): 425
[11]马良,张宇昊,李培武.LIF—HPCE法检测食品中的黄曲霉毒素B1[J].食品科学,2009,30(10):135-139
[12]张丽,朱姝,张文海.高效液相柱后衍生法测定食品中的黄曲霉毒素B1[J].中国卫生检验杂志,2006,16(1):70-71
[13] Peiwu Li, Qi Zhang, Wen Zhang.Immunoassays for aflatoxin [J].Trends in Analytical Chemistry,2009,28(9):1115-1126
[14] Peiwu Li,Qi Zhang,Wen Zhang,et al.Development of a class-specific monoclonal antibody based ELISA for aflatoxins in peanut[J].Food Chemistry,2009,115(1):313-317
[15] Daohong Zhang,Peiwu Li,Qi Zhang,et al.Production of ultrasensitive generic monoclonal antibodies against major aflatoxins using a modified two-step screening procedure[J].Analytica chimica acta, 2009, 636(1):63-69
[16] Kolosova A Y,Shim W B,Yang Z.Y,et al.Direct competitive ELISA based on a monoclonal antibody for detection of aflatoxin B1.Stabilization of ELISA kit components and application to grain samples [J].Analytical and bioanalytical chemistry,2006,384(1):286-294
[17]管笛,潘灿平,王文,等.磁微粒酶联免疫吸附法测定玉米中的伏马毒素B1[J].食品科学,2014,35(8):208-211
Development of a Magnetic Particles Enzyme-linked Immunosorbent Assay for Determination of Aflatoxin B1in Corn
GUAN Di1,2,3,KANG Zi-jia1,2,3,JIA Di1,2,3,WU Hui-juan1,2,3,*
(1.Beijing Centre for Physical and Chemical Analysis,Beijing 100089,China;2.Beijing Engineering Technique Research Center for Gene Sequencing & Function Analysis,Beijing 100089,China;3.Beijing Engineering Research Centre of Food Safety Analysis,Beijing 100089,China)
Abstract:Magnetic particles(MPs)were using assupport to replace enzyme-linked immunosorbent assay plates for determination AFB1in corn.We compared two formats for AFB1ELISA methods.First of all,indirect competitive ELISA was developed with monoclonal antibody(MAb).The LOD of 2.8 μm MPs ELISA was 0.028 ng/mL,which was 5 times lower than conventional ELISA.Secondly,direct competitive ELISA was developed with MAb.200 nm and 2.8 μm carboxyl-MPS were coated with AFB1MAb.And The LOD of 2.8 μm MPs ELISA was 0.012 ng/mL,which was 4.3 times lower than conventional ELISA.The recoveries were from 84.2 % to 125.9 %,and the variations were less than 12.3 %.
Key words:magnetic particles;aflatoxins;enzyme linked immunosorbent assay;corn;
DOI:10.3969/j.issn.1005-6521.2016.05.024
基金项目:北京市市级财政项目(PXM2013_178305_000002);北京市科学技术研究院青年骨干计划(201415)
作者简介:管笛(1983—),男(汉),助理研究员,博士,研究方向:食品安全与检测技术。
收稿日期:2014-11-28

