点击化学在分子影像学中的应用和进展
张晓 兰晓莉 胡帆 张永学
430022武汉,华中科技大学同济医学院附属协和医院核医学科,湖北省分子影像重点实验室
点击化学在分子影像学中的应用和进展
张晓 兰晓莉 胡帆 张永学
430022武汉,华中科技大学同济医学院附属协和医院核医学科,湖北省分子影像重点实验室
点击化学基于其快速高效、高选择性、生物正交反应等特点,在现代化学发展及放射性药物化学合成中发挥着日益重要的作用。此外,点击化学在放射性探针制备及分子显像预定位技术方面也具有广泛的应用前景。笔者就点击化学在分子影像方面的进展综述如下。
点击化学;分子影像;分子探针
Fund program:The General Program of National Natural Science Foundation of China(81271623)
1 点击化学的基本概念
2001年诺贝尔化学奖得主,美国化学家Sharpless第一次提出“click chemistry”[1],即“点击化学”或“链接化学”。点击化学具有以下优势:反应条件温和、操作简单,对氧和水不敏感;反应产率高;产物去除简易;反应起始原料和反应试剂均较易获得;高效、高选择性;适用范围广[2]。基于以上优势,点击化学一经提出便广受关注,迅速在化学、生物医学等多个学科得到应用,为功能材料、药物开发、功能聚合物、表面修饰及生物标记等发展提供了新的启发点,成为目前具有发展前景的合成理念之一[3-5]。
点击化学在分子影像学中应用较为广泛的有铜催化的叠氮和端炔的环加成反应(Cu-catalyzed azide-acetylene cycloaddition,CuAAC)、无铜的[3+2]叠氮-炔烃环加成反应(strain-promoted azidealkyne cycloaddition,SPAAC)、基于巯基的点击反应和Diels-Alder(D-A)反应[6-8]。其中CuAAC是最经典也是最早应用到生物标记和分子影像学中的。相对于CuAAC,其余3种均为无金属催化(Cufree)的点击化学。点击化学的简便性及特异性使其与生物小分子或生物大分子的修饰结合得到极大的发展,其在分子影像探针合成中的应用取得了瞩目的成绩[9]。本文就点击化学在分子影像学中的应用与发展作一综述。
2 点击化学的应用
2.1 铜催化的环加成反应
CuAAC是由丹麦的Meldal实验组与美国的Sharpless实验组分别独立发现,是由一价铜催化叠氮和端炔环加成反应生成1,4-二取代1,2,3-三唑的Huisgen偶极环加成反应,极大提高了以往环加成反应的速率[10-11]。一价铜催化的点击反应具有温和、迅速、高效、有一定的化学选择性且通常不需要保护基或纯化步骤等优点。该反应中的叠氮和炔烃基团均难与生物分子发生不良反应,并且在水中稳定性良好,可以在铜催化下在水中快速地进行配体交换,使得该反应可以很好地应用于生物标记物合成、分离和活性表达谱分析等方面。
基于CuAAC反应高效简便的特性,其在分子影像中的应用广泛,尤其是18F标记的PET显像探针研究越来越受到关注[12]。传统的18F标记方法主要包括亲电取代、无水条件下的亲核取代及金属络合[13](18F标记辅基法、固相标记法、18F-AlF络合标记法、18F-19F同位素交换法等),而这几种标记方法对大多数生物活性分子标记合成步骤繁琐,反应时间长,放射化学产率较低,易降低生物大分子活性,严重制约了18F标记生物大分子显像探针的应用范围[14]。
应用CuAAC技术引入18F,首先要形成click合成子,即带有叠氮基或带有端炔基的18F-click合成子,然后分别与修饰上端炔基或叠氮基的待标记的化合物进行CuAAC反应。常见的合成子有18F-氟化炔烃衍生物(18F-fluoroalkynes)(图1中A)、2-18F-氟叠氮乙烷(2-18F-fluoroethylazide,18F-FEA)(图1中B)[15]、含聚乙二醇(polyethylene glycol,PEG)类18F-click合成子(图1中C)[16]、含苯环类的18F-click合成子(图1中D~E)[17]、糖类18F-click合成子(图1中F)[18]及吡啶类的18F-click合成子(图1中G)[19]。前两种纯化多采用蒸馏纯化,多对小分子化合物或分子质量相对较小的多肽进行标记,标记大分子时较难分离。含PEG类的合成子水溶性较好,合成时间短,标记率高,挥发性差,有相对较好的生物兼容性[20]。18F连接在苯环上较为稳定,因此含苯环类的合成子难以挥发、不易发生体内脱氟,且在紫外线下也有吸收,使其较易于通过高效液相色谱进行分析。借助于糖类的18F-click合成子标记后亲水性和生物兼容性的改变,使得多肽和蛋白质类物质的生物动力学和清除效率均得到改善。吡啶类合成子目前主要是2-位18F取代的端炔类合成子,也易于合成,在体内不易脱氟,稳定性好。
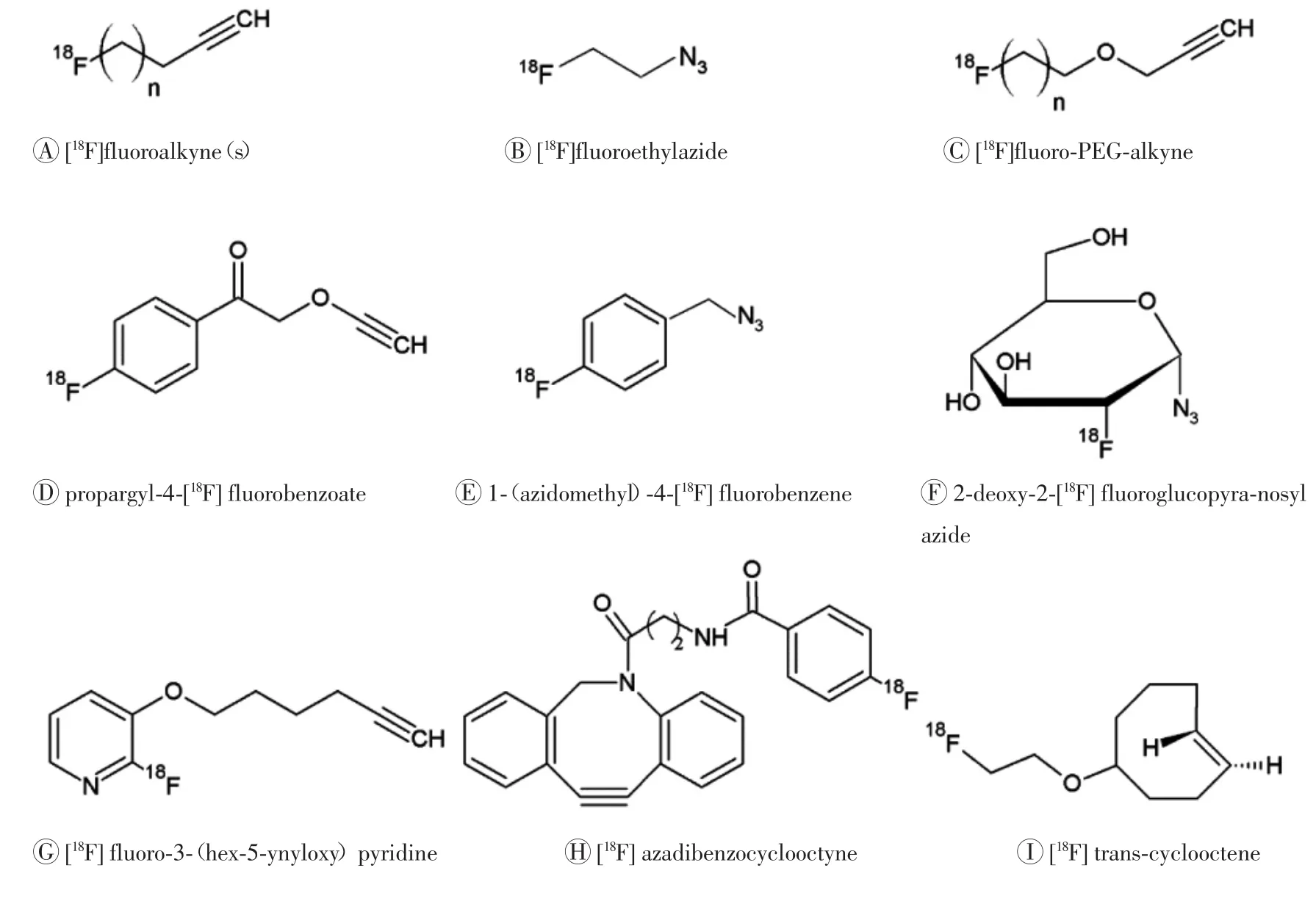
图1 常见的18F-click合成子结构Fig.1 Structure of[18F]-prosthetic groups
细胞凋亡蛋白酶通过破坏修复DNA蛋白、信号传导及细胞形态等途径激活细胞凋亡。近来,Waldmann等[21]使用2-[18F]氟叠氮乙烷标记5-(1-磺酰吡咯烷)-7-氮杂靛红(5-[1-pyrrolidinylsulfonyl]-7-azaisatin),靶向细胞凋亡蛋白酶 3和 7。应用CuAAC反应使该显像剂亲水性增强,比以往基于靛红为基础的放射性显像剂有更好的清除率,因而其更适合应用于PET显像研究。Mirfeizi等[22]将含PEG类18F-click合成子(18F-PEGylated alkyne)与4-羟基咔唑叠氮乙基化衍生物进行CuAAC反应合成显像探针18F-(fluoromethoxy)ethoxy)methyl)-1H-1,2, 3-triazol-1-yl)propan-2-ol(18F-FPTC),靶向神经组织的β-肾上腺素受体。其中click合成子放化产率为74%~89%,总的合成时间为55 min。该显像剂较为适宜的脂溶性使其能够穿透血脑屏障,注射后2 min颅内即可达到摄取的最大值。Daumar等[23]基于实体肿瘤演变发展和转移产生酸性环境的原理,设计合成了吡啶类的18F-click合成子2-乙炔基吡啶(6-[18F]fluoro-2-ethynylpyridine),在Cu(I)催化下对能够插入低pH值环境的肽类(pHLIP)(N端由叠氮基己酸修饰,37个氨基酸组成)进行18F标记,其中18F-click合成子放化产率为(27.5±6.6)%,放化纯度≥98%,最终产物放化产率为5%~20%,总反应时间为85 min。该显像剂的生物学分布和小动物PET显像提示,其可以对实体瘤进行显像,在肿瘤组织滞留且具有较高的浓聚,在非靶向组织具有较高的清除率,是十分具有潜力的PET显像剂。
CuAAC反应在核素标记应用研究方面前景广阔,使得核素分子影像功能代谢显像得到更大的发展。
2.2 无铜催化的点击反应
虽然CuAAC反应应用最早、最为广泛,应用CuAAC反应合成的新型分子影像探针也有较多的报道,但由于该反应使用Cu(I)作为催化剂带来一定的生物毒性,包括细胞毒性及诱导病毒或寡核苷酸的降解,这一缺点限制了其在分子影像探针中的应用,尤其是其在预定位技术方面的应用。Codelli等[24]在无铜存在条件下,利用环张力促进[3+2]叠氮-炔烃环加成方法,避免铜带来的生物毒性。其中应用最广泛的是氮杂二苯并环辛炔(azadibenzocyclooctyne,ADIBO)衍生物与叠氮类化学物进行反应。Campbell-Verduyn等[25]将13个氨基酸组成的蛙皮素与ADIBO连接后与18F标记的叠氮类化合物进行反应,该反应在室温条件下仅需10~15 min,与前列腺癌细胞上的胃泌素释放肽受体具有较高的亲和力。Bouvet等[26]用18F标记ADIBO(图1中G),其与低浓度的叠氮化合物即可进行反应,且具有较好的生成产率。
2.2.1 D-A反应
D-A反应是由富电子的双烯体与缺电子的亲双烯体进行[4+2]环加成反应形成稳定的六元环化合物的反应,故又称双烯合成反应,主要是环戊二烯和呋喃衍生物与马来酰亚胺(MI)衍生物的反应[7]。当双烯体连接上吸电子基团,亲双烯体连接上供电子体基团进行反应时称为逆电子需求的D-A反应(the inverse electron demand diels-aldercycloaddition,IEDDA),如1,2,4,5-四嗪(tetrazines,TTA)和不饱和烯烃进行[4+2]环加成反应。该反应具有高选择性、高产率、生物正交性及生物相容性,是应用到生物药物、高分子材料以及表面修饰等领域的成功范例。
18F标记的反式环辛烷(trans-cyclooctene,18FTCO,图1中I)是基于D-A反应基础上应用最早的18F-click合成子,该标记条件较温和,放化产率高达70%[27]。18F-TCO与Tetrazine-Cys40-exendin-4室温反应5 min,生成18F-TTCO-Cys40-exendin-4靶向胰高血糖素样肽受体1(glucagonlike peptide-1 receptor,GLP-1R),该探针在肾脏的摄取较低,可作为临床上观察胰岛细胞移植后的潜在显像探针[28]。11C成功标记TTA形成click合成子,放化产率为33%,将其与TCO进行点击反应仅需20 s[29]。此外,将人类表皮生长因子受体2(human epidermalgrowth factor receptor-2,HER2)的特异性单克隆抗体曲妥珠单抗烯烃化,然后分别与修饰过的TTA的1,4,7,10-tetraazacyclo-dodecane-1,4,7,10-tetraacetic acid(DOTA)和desferrioxamine(DFO)进行反应,最后再分别与64Cu、89Zr反应,生成的终产物具有较高的放化纯度,其在HER2阳性乳腺癌的裸鼠小动物PET显像中的特异性及选择性均较高[30]。D-A反应较快的反应效率以及生物正交性使其广泛的体内靶向显像应用成为可能。
2.2.2 基于巯基的点击反应
巯基和烯烃反应形成稳定的硫醇键也是应用广泛的无铜点击反应。由于巯基-双键反应快速、温和以及极强的官能团适应性等特点,近年来在生物化学和材料科学等领域对聚合物进行功能化己经得到广泛应用。2-氰基苯并噻唑(2-cyanobenzothiazole,CBT)和D-半胱氨酸(D-cysteine,D-Cys)进行CBT-Cys点击反应是基于巯基的点击反应中的一种,具有高效、生物兼容性好等特点。18F标记6-羟基-2-氰基苯并噻唑(6-hydroxyl-2-CBT,HCBT)与二聚cRGD上N端Cys发生缩合形成18F-CBTRGD2,该反应在温和的条件下即可得到92%放射化学产率,该方法提供了标记不同的含N端Cys的肽链、蛋白及抗体等物质的可能性[31]。Casp3/7特异的多肽序列L-Asp-Glu-Val-Asp-D-Cys[DEVD-(D-Cys)]在Casp3/7的作用下解离D-Cys与CBT反应形成D-荧光素,并可在激活Casp3/7酶的FVB-luc+小鼠体内观察到强烈的生物自发光成像信号[32]。基于Furin酶特异性底物RVRR多肽(Arg-Val-Arg-Arg)合成的包含Gd3+的智能分子探针可在高表达Furin酶的肿瘤细胞作用下暴露出1,2-氨基巯基基团,随后该基团可与另一个单体的6-氨基-2-氰基苯并噻唑(6-amino-2-CBT,NCBT)缩合生成环化的多聚体,即进行自组装,该缩合产物在肿瘤靶组织MR信号增强[33]。此外该反应在光声成像中也有应用[34]。基于巯基的点击化学为智能探针进行核素成像或治疗研究提供了一种新型方法。
2.3 点击反应在预定位技术中的应用
由于放射免疫显像使用较大分子量的抗体,其缓慢的药代动力学使得放射靶向药物不可避免地产生高本底、增加辐射及较大的不良反应等,于是预靶向成像和治疗成为可能的解决方案之一。预定位在20世纪80年代中期即被提出,又称两步法,即先注射可以和目的组织靶向结合的特异性分子或药物,然后再注射可以和特异性分子或药物特异性结合的放射性标记化合物。生物素-亲和素系统在预定位中应用较早,其中亲和素可以特异性地结合4个生物素,从而产生放大效应,但由于亲和素相对分子质量较大、内源性的生物素及生物素酶的干扰,使其在分子影像中的应用受到局限[35]。CuAAC反应存在催化剂的生物毒性,SPAAC反应有一定的疏水性且其环辛炔前体合成较为复杂,成为两者作为预定位的难点。于是由于IEDDA药代动力学反应较快、生成产物稳定、高选择性及高亲和力,成为分子影像学中应用预定位技术的新选择[36]。
2010年,Rossin等[37]将点击化学技术用于预定位,先注射靶向TAG72的抗体CC49与TCO相连的结合物CC49-TCO后,再注射111In标记的四嗪类化合物,在体内进行点击反应,靶与非靶比值增加,为预定位放射靶向治疗和显像提供了较好的策略。Garcia等[38]同样采用CC49-TCO预定位,与99Tcm-HYNIC(6-肼基烟酰基,hydrazinonictinamide)-tetrazine体内反应,以上两种显像剂显示出预定位技术在SPECT显像中具有极大的应用前景。Evans等[39]和Nichols等[40]分别将表皮生长因子受体单克隆抗体、AC33抗体与TCO相连进行预定位,四嗪类化学物与DOTA、二乙烯三胺五乙酸相连后与68Ga反应再次注射,该方法为68Ga生物标记大分子抗体进行预定位提供了可能。四嗪类的18F-click合成子较易水解,成为应用的难点。Devaraj等[41]将18F与聚合物修饰后的四嗪类化合物反应形成click合成子,其可与预先注射的TCO-CD45单克隆抗体进行点击反应,为肿瘤细胞预定位PET显像的应用提供了可行性。
3 小结
点击化学虽需多步合成click合成子,但其在标记生物大分子和预定位技术方面仍具有广泛的应用前景。总之,随着点击反应技术的日趋进步,点击化学将在靶向分子影像探针合成方面做出更多的贡献,在影像学诊断与治疗上发挥日益显著的作用。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 张晓、胡帆负责论文起草和撰写;兰晓莉、张永学负责最终版本修订。
[1]Best MD.Click chemistry and bioorthogonal reactions:unprecedented selectivity in the labeling of biological molecules[J].Biochemistry,2009,48(28):6571-6584.DOI:10.1021/bi9007726.
[2]Yuan YE,Liang GL.A biocompatible,highly efficient click reaction and its applications[J].Org Biomol Chem,2014,12(6):865-871.DOI:10.1039/c3ob41241e.
[3]Lutz JF,Nanotechnology for Life Science Research Group.1,3-dipolar cycloadditions of azides and alkynes:a Universal ligation tool in polymer and materials science[J].Angew Chem Int Engl, 2007,46(7):1018-1025.
[4]Del Amo DS,Wang W,Jiang H,et al.Biocompatible Copper(I)catalysts for in vivo imaging of glycans[J].J Am Chem Soc,2010,132(47):16893-16899.DOI:10.1021/ja106553e.
[5]赵正达,袁伟忠,顾书英,等.点击化学及其在生物医学领域的应用[J].化学进展,2010,22(2):417-426.DOI:1005-281X(2010)02/3-0417-10.Zhao ZD,Yuan WZ,Gu SY,et al.“Click chemistry”and its growing applications in biomedical field[J].Prog Chem,2010,22(2):417-426.
[6]Ledin PA,Friscourt F,Guo J,et al.Convergent assembly and surface modification of multifunctional dendrimers by three consecutive click reactions[J].Chemistr,2011,17(3):839-846.DOI:10. 1002/chem.201002052.
[7]Wiessler M,Waldeck W,Kliem C,et al.The Diels-Alder-reaction with inverse-electron-demand,a very efficient versatile click-reaction concept for proper ligation of variable molecular partners[J].Int J Med Sci,2009,7(1):19-28.
[8]Yang Y,Huo F,Yin C,et al.Thiol-chromene click chemistry:a coumarin-based derivative and its use as regenerablethiol probe and in bioimagingapplications[J].BiosensBioelectron,2013,47(2):300-360.DOI:10.1016/j.bios.2013.03.007.
[9]Zeng DX,Zeglis BM,Lewis JS,et al.The growing impact of bioorthogonal click chemistry on the development of radiopharmaceuticals[J].J Nucl Med,2013,54(6):829-832.DOI:10.2967/ jnumed.112.115550.
[10]Tornoe CW,Christensen C,Meldal M.Peptidotriazoles on solid phase:[1,2,3]-triazoles by regiospecific Copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides[J].J Org Chem, 2002,67(9):3057-3064.DOI:10.1021/jo011148j.
[11]Rostovtsev VV,Green LG,Fokin VV,et al.A stepwise huisgencycloaddition process:copper(I)-catalyzed regioselective"ligation"of azides and terminal alkynes[J].Angew Chem Int Ed Engl,2002, 41(14):2596-2599.
[12]张宝石,周乃康,王卉,等.18F-FP-peptide用于化疗后肿瘤细胞凋亡显像[J].中华核医学与分子影像杂志,2012,32(2):84-89. DOI:10.3760/cma.j.issn.2095-2848.2012.02.002. Zhang BS,Zhou NK,Wang H,et al.Imaging of apoptosis with18FFP-peptide focused on the evaluation of tumor response to chemotherapy[J].Chin J Nucl Med Mol Imaging,2012,32(2):84-89.DOI:10.3760/cma.j.issn.2095-2848.2012.02.002.
[13]Bejot R,Carroll L,Bhakoo K,et al.Afluorous and click approach for screening potential PET probes:Evaluation of potential hypoxia biomarkers[J].Bioorg Med Chem,2012,20(1):324-329.DOI:10.1016/j.bmc.2011.10.084.
[14]贾丽娜.基于点击化学的分子影像探针制备研究[D].上海:中国科学院研究生院(上海应用物理研究所),2014. Jia LN.The researchof molecular imaging probesvia click chemistry[D].Shanghai:Chinese Academy of Sciences(Shanghai Institute of Applied Physics),2014.
[15]Glaser M,ArstadE."Click labeling"with 2-[18F]fluoroethylazide for positron emission tomography[J].Bioconj Chem,2007,18(3):989-993.
[16]Michel K,Buether K,Law MP,et al.Development and evaluation of endothelin-A receptor(radio)ligands for positron emission tomography[J].J Med Chem,2011,54(4):939-948.DOI:10.1021/ jm101110w.
[17]Kuboyama T,Nakahara M,Yoshino M,et al.Stoichiometry-focused F-18-labeling of alkyne-substituted oligodeoxynucleotides using azido([F-18]fluoromethyl)benzenes by Cu-catalyzed Huisgen reaction[J].Bioorg Med Chem,2011,19(1):249-255.DOI:10.1016/j. bmc.2010.11.033.
[18]Maschauer S,Michel K,Tripal P,et al.Synthesis and in vivo evaluation of an(18)F-labeled glycoconjugate of PD156707 for imaging ETA receptor expression in thyroid carcinoma by positron emission tomography[J].Am J Nucl Med Mol Imaging,2013,3(5):425-436.
[19]Arksey N,Hadizad T,Ismail B,et al.Synthesis and evaluation of the novel 2-[18F]fluoro-3-propoxy-triazole-pyridine-substituted losartan for imaging AT1receptors[J].Bioorg Med Chem,2014,22(15):3931-3937.DOI:10.1016/j.bmc.2014.06.011.
[20]Sirion U,Kim HJ,Lee JH,et al.An efficient F-18 labeling method for PET study:Huisgen 1,3-dipolar cycloaddition of bioactive substances and F-18-labeled compounds[J].Tetrahedron Lett,2007,48(23):3953-3957.DOI:10.1016/j.tetlet.2007.04.048.
[21]Waldmann CM,Hermann S,Faust AA,et al.Novel fluorine-18 labeled 5-(1-pyrrolidinylsulfonyl)-7-azaisatin derivatives as potential PET tracers for in vivo imaging of activated caspases in apoptosis[J].Bioorg Med Chem,2015,23(17):5734-5739.DOI:10. 1016/j.bmc.2015.07.014.
[22]Mirfeizi L,Rybczynska AA,Van Waarde AA,et al.[18F]-(fluoromethoxy)ethoxy)methyl)-1H-1,2,3-triazol-1-yl)propan-2-ol18FFPTC)a novel PET-ligand for cerebral beta-adrenoceptors[J].Nucl Med Biol,2014,41(2):203-209.DOI:10.1016/j.nucmedbio. 2013.10.011.
[23]Daumar P,Wanger-Baumann CA,Pillarsetty N,et al.Efficient18F-labeling of large 37-amino-acid pHLIP peptide analogues and their biological evaluation[J].Bioconjug Chem,2012,23(8):1557-1566.
[24]Codelli JA,Baskin JM,Agard NJ,et al.Second-generation difluorinatedcyclooctynes for copper-free click chemistry[J].J Am Chem Soc,2008,130(34):11486-11493.
[25]Campbell-Verduyn LS,Mirfeizi L,Schoonen AK,et al.Strain-promoted copper-free"click"chemistry for18F radiolabeling of bombesin[J].Angew Chem Int Ed Engl,2011,50(47):11117-11120.DOI:10.1002/anie.201105547.
[26]Bouvet V,Wuest M,WuestF.Copper-free click chemistry with the short-lived positron emitter fluorine-18[J].Org Biomol Chem,2011, 9(21):7393-7399.DOI:10.1039/c1ob06034a.
[27]Li Z,Cai H,Hassink M,et al.Tetrazine-trans-cyclooctene ligation for the rapid construction of18F labeled probes[J].Chem Commun(Camb),2010,46(42):8043-8045.
[28]Wu Z,Liu S,Hassink M,et al.Development and evaluation of18FTTCO-Cys40-Exendin-4:a PET probe for imaging transplanted islets[J].J Nucl Med,2013,54(2):244-251.DOI:10.2967/ jnumed.112.109694.
[29]Herth MM,Andersen VL,Lehel SA,et al.Development of a11C-labeled tetrazine for rapid tetrazine-trans-cyclooctene ligation[J]. Chem Commun(Camb),2013,49(36):3805-3807.DOI:10. 1039/c3cc41027g.
[30]Zeglis BM,Mohindra P,Weissmann GI,et al.Modular strategy for the construction of radiometalated antibodies for positron emission tomography based on inverse electron demand Diels-Alder click chemistry[J].Bioconjug Chem,2011,22(10):2048-2059.DOI:10.1021/bc200288d.
[31]Jeon J,Shen B,Xiong L,et al.Efficient method for site-specific F-18-labeling of biomolecules using the rapid condensation reaction between 2-cyanobenzothiazole and cysteine[J].Bioconjug Chem, 2012,23(9):1902-1908.DOI:10.1021/bc300273m.
[32]Godinat A,Park HM,Miller SC,et al.A biocompatible in vivo ligation reaction and its application for noninvasive bioluminescent imaging of protease activity in living mice[J].ACS Chem Biol, 2013,8(5):987-999.DOI:10.1021/cb3007314.
[33]Cao CY,Shen YY,Wang JD,et al.Controlled intracellular self-assembly of gadolinium nanoparticles as smart molecular MR contrast agents[J].Sci Rep,2013,3:1024.DOI:10.1038/srep01024.
[34]Dragulescu-Andrasi A,Kothapalli SR,Tikhomirov GA,et al.Activatableoligomerizable imaging agents for photoacoustic imaging of furin-like activity in living subjects[J].J Am Chem Soc,2013,135(30):11015-11022.
[35]Knight JC,Cornelissen B.Bioorthogonal chemistry:implications for pretargetednuclear(PET/SPECT)imaging and therapy[J].Am J Nucl Med Mol Imaging,2014,4(2):96-113.
[36]Rossin R,Van Den Bosch SM,Ten Hoeve WA,et al.Highly reactive trans-Cyclooctene Tags with improved stability for Diels-Alder chemistry in living systems[J].Bioconjug Chem,2013,24(7):1210-1217.DOI:10.1021/bc400153y.
[37]Rossin R,Verkerk PR,Van Den Bosch SM,et al.In vivo chemistry for pretargeted tumor imaging in live mice[J].Angew Chem Int EdEngl,2010,49(19):3375-3378.DOI:10.1002/anie.200906294.
[38]Garcia MF,Zhang X,Shah M,et al.Tc-99m-bioorthogonal click chemistry reagent for in vivo pretargeted imaging[J].Bioorg Med Chem,2016,24(6):1209-1215.DOI:10.1016/j.bmc.2016.01. 046.
[39]Evans HL,Quang-De Nguyen QD,Carroll LS,et al.Abioorthogonal Ga-68-labelling strategy for rapid in vivo imaging[J].Chem Commun,2014,50(67):9557-9560.DOI:10.1039/c4cc03903c.
[40]Nichols B,Qin Z,Yang J,et al.68Ga chelating bioorthogonaltetrazine polymers for the multistep labeling of cancer biomarkers[J]. Chem Commun(Camb),2014,50(40):5215-5217.
[41]Devaraj NK,Thurber GM,Keliher EJ,et al.Reactive polymer enables efficient in vivo bioorthogonal chemistry[J].Proc Natl Acad Sci USA,2012,109(13):4762-4767.DOI:10.1073/pnas. 1113466109.
Applications and advances of click chemistry in molecular imaging
Zhang Xiao,Lan Xiaoli,Hu Fan,Zhang Yongxue
Department of Nuclear Medicine,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Hubei Province Key Laboratory of Molecular Imaging,Wuhan 430022,China
Zhang Yongxue,Email:zhyx1229@163.com
Click reaction plays an important role in the development of modern chemistry and radiopharmaceutical synthesis because of its rapid,highly selective,and bioorthogonal characteristics. Furthermore,new radiotracers are beginning to have tremendous utilities of the reactions and a novel pretargeting strategy.The present review focuses on the potential applications of various click chemistry ligations in molecular imaging.
Click chemistry;Molecular imaging;Molecular probe
张永学,Email:zhyx1229@163.com
10.3760/cma.j.issn.1673-4114.2016.03.008
国家自然科学基金面上项目(81271623)
2016-02-19)

