神经内分泌肿瘤肝转移介入治疗进展*
刘航 综述 杨继金 审校
(上海第二军医大学长海医院介入科, 上海 200433)
·综述·
神经内分泌肿瘤肝转移介入治疗进展*
刘航 综述杨继金 审校
(上海第二军医大学长海医院介入科, 上海 200433)
【摘要】肝转移(liver metastases,LTs)是影响神经内分泌肿瘤(neuroendocrine tumor,NET)患者预后的重要因素。虽然根治性手术是一种可能治愈疾病的治疗方式,但大多数患者确诊肝转移时已经错过了根治性切除的最佳时机。对于不可切除的神经内分泌瘤肝转移患者,现常用的方法有姑息性减瘤手术、射频消融、TACE/TAI/TAE、静脉化疗、放射性核素治疗,虽然治疗方法很多,但最佳的治疗方法尚有争议。近年来,有文献证实TACE/TAI/TAE治疗肝脏转移肿瘤是有效并且安全的。本文就神经内分泌肿瘤肝转移经动脉介入治疗进展与不足进行综述。
【关键词】神经内分泌肿瘤; 肝转移; 经肝动脉化疗栓塞/灌注
神经内分泌肿瘤(neuroendocrine tumor, NET)是起源于神经内分泌组织的一大类肿瘤,具有不同的形态学和生物学表现。在2010年新的WHO分类中将神经内分泌瘤被分为三类[1,2]:①G1:核分裂象<2个/HPF,Ki-67<2%。②G2:核分裂象>2个/HPF,Ki-67:3%~20%。③G3:核分裂象>20%,Ki-67>20%。全球每年神经内分泌肿瘤发病率大约为1.3~35/万人[3,4]。其中胃肠胰腺神经内分泌肿瘤最常见[5],中国北京协和医院的一项住院患者数据统计结果有相似的结论[6]。肝脏是神经内分泌肿瘤最常见的远处转移部位,50%~75%的神经内分泌瘤患者可能发生肝转移[7],甚至在一份研究中[8]显示大约84.7%神经内分泌肿瘤病例在首诊时中即存在肝转移。肝转移因为肝内肿瘤负荷和激素分泌症状,严重影响患者的生活质量和预后。有文献报道称[9]存在肝转移的结直肠神经内分泌瘤的5年生存率仅约30%,而不存在肝转移的患者,5年生存率可高达88%。针对神经内分泌肿瘤肝转移常用的临床手段[10]包括:手术切除、肝移植、经动脉介入(如TACE/TAE/TAI)、局部消融、生长抑素类似物、放射性核素治疗及一些新型的靶向药物。虽然外科根治性切除术被认为是一项可能治愈的方式,但确诊时适合行根治性切除治疗的患者仅占5%~10%[11,12]。对于不可切除的肝转移患者,目前尚无具有明显优势的治疗方案。有数项系统综述和meta分析[13,14]正在对手术及非手术治疗方案中的一些争议问题进行分析,目前尚未完成,相信在将来可以带来些有价值的指导意见。
采用经动脉介入(包括TAI/TAE/TACE)方法治疗神经内分泌肿瘤肝转移已有了一些报道。从目前的数据结果来看,经动脉介入治疗可以很好的缓解患者激素相关的临床症状、控制肿瘤生长,并且手术创伤小、并发症少、可重复进行。但由于相对低的发病率及较低的化疗药物敏感性,总体上神经内分泌肿瘤肝转移的介入治疗还不普及。本文从手术原理、适应证、禁忌证、疗效、并发症几个方面进行阐述,期望能够提高临床医师对经动脉介入治疗神经内分泌肿瘤的认识。
1治疗原理
神经内分泌肿瘤的肝转移病灶与肝细胞肝癌血供类似,大多是富血供肿瘤,主要供血来源于肝动脉,约占全部供血的90%;而正常肝脏主要血供来源于门静脉,占全部血供的70~80%[15-17],该解剖特点是经动脉介入治疗的基础。经动脉介入治疗常用的栓塞剂有碘油、明胶海绵、PVA等,常用的化疗药物有蒽环类、丝裂霉素、铂类、氟尿嘧啶等。通常将药物粉剂于碘油混合后经导管注入,可使肿瘤局部化疗药物浓度达到静脉化疗药物浓度的20倍[18]。利用药物毒性和(或)栓塞致肿瘤局部缺血缺氧,杀灭肿瘤细胞,控制肿瘤生长,缓解患者症状,延长患者生存期。
2适应证及禁忌证
由于疾病的低发生率、复杂的功能活性及较惰性的生长方式,导致目前没有明确的治疗指证[19]。目前大多研究认为:经动脉介入治疗可以应用于肝内转移不能行根治性手术并以肝内病情为主(liver-predominant disease)的患者,能够缓解症状、控制肿瘤生长;虽然有文献[20,21]认为肝外转移或是不可切除的原发灶并不妨碍进行经动脉介入治疗,但符合原发肿瘤已完全切除、肝转移病灶<5cm、接受4次及以上介入治疗这些条件的患者预后通常较好[19]。绝对禁忌证包括:门静脉主干闭塞、肝衰竭、大量腹水。相对禁忌证包括:造影剂过敏、肾功能不全、凝血功能异常、周围血管疾病。因为缺少大规模前瞻性的临床研究数据,禁忌症大多是参考其他肿瘤肝转移的经动脉介入治疗经验及各单位的临床实践。相比根治性切除和肝移植严格的适应症,经动脉介入治疗的适应症可能相对宽泛,有可能导致部分患者接受经动脉介入治疗后疗效较差。虽然有研究提出依据肝转移分类[22]采取不同的治疗方法,但该分类中,经动脉介入治疗技术覆盖面仍十分宽泛,并不能有效筛选病人。未来需前瞻性随机对照实验来明确哪类患者接受动脉介入治疗能获得最大受益和无明显收益的患者。
3疗效评价
神经内分泌瘤肝转移是影响患者预后的重要因素[23-25]主要是:①肝内多发的或是巨大的肿瘤占位,挤压正常肝实质,损害患者肝功能。②肿瘤分泌大量激素,患者表现为发热、便秘、恶性、腹泻、心率失常、类癌综合征等,严重影响生活质量。故治疗的目的主要是缓解临床症状、控制肝内肿瘤进展。本文综合部分经动脉介入治疗后患者肝内病灶的研究文献,从影像学缓解情况、临床症状缓解情况及中位生存期和5年生存率这几方面进行总结,见表1。
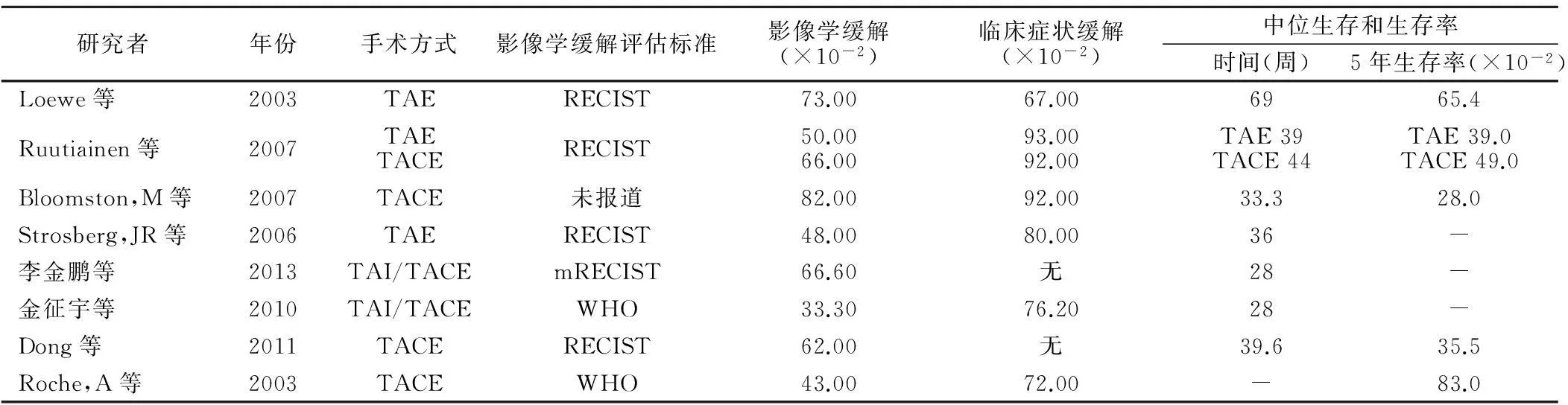
表1 文献中经动脉介入治疗的疗效参数
3.1影像学缓解率有研究[26]认为神经内分泌瘤肝转移患者最常见的死因是肝内肿瘤进展导致的肝衰竭。因此,评估术后肿瘤影像学改变情况,有助于评估疗效。总体上,患者的肝内病灶影像学缓解率在33.3%~82%。在采用RECIST评估标准的研究中,患者的影像学缓解率为48~73%。经动脉介入治疗对肿瘤生长的抑制作用是明确的,可以很好的抑制肿瘤进展,保证足够的肝功能见表1。
但笔者在收集文献时发现各研究者采用的影像学评估标准略有不同。虽然大家均将患者肝内病灶获得完全缓解(CR)和部分缓解(PR)的总数作为有效缓解,但部分作者[27-30]使用RECIST标准[31],部分作者[18,32]采用WHO标准[33],另有一位作者[34]采用mRECIST标准[35],还有一位作者[36]的并未在文章明确说明他所采用的评估标准。例如Bloomston,M等[36]报道的影像学缓解率最高(82%),但他未在文中阐述评估时所采用的标准,仅在文中将影像学缓解定义为肝内病灶体积、数目下降或是病灶内出现明显钙化,有理由认为82%的缓解率中包含了部分可能未达到PR(按WHO标准或RECIST标准)的情况;而国内学者金征宇等[32]报道的影像学缓解率最低33.3%,但他和国外学者Roche,A等[18]的研究中采用的是WHO标准,这可能是导致他们影像学缓解率的数据要小于其他各研究者的原因。因为在WHO标准中,PR定义为肿块面积缩小>50%,而在RECIST标准中,PR定义为肿块最大径缩小>30%,这可能会影响各研究间的疗效结果。
3.2症状缓解率具有分泌功能的神经内分泌瘤患者患者常常出现激素相关的临床症状包括发热、面色潮红、便秘、腹泻、心律失常、类癌综合征等。激素相关临床症状严重影像患者生活质量,并影响患者生存期。本文收集的数据显示,经动脉介入治疗后,患者症状缓解率为67%~93%(见表1),大部分患者存在的内分泌症状均得到了有效的缓解,提示经动脉介入治疗可以作为一项控制患者临床症状、改善患者生活质量的有效手段。生长抑素类似物能有效的控制激素相关症状,但是这类药物抗肿瘤生长效果并不明显且容易产生耐药[37,38]。并且已有研究[39]指出,经动脉介入相比于生长抑素类似物拥有更优的缓解率。遗憾的是,各文章均未明确提及他们采用的评估患者临床症状的标准,更多还是依赖于患者和临床医生的自我感觉,这导致文章间症状缓解率的变异较大。
3.3生存情况总体上,患者的中位生存时间为28~69个月;5年生存率28%~65.4%(见表1)。在Bloomstom[36]的研究中发现术后出现临床症状缓解的患者预后更好,症状有缓解的患者和症状无缓解的患者的中位生存期分别为40.7个月和7.6个月,这个观点有助于术后评估,判断是否有必要反复接受经动脉介入治疗;在Strosberg[29]的研究中,部分患者在经动脉介入治疗后额外接受了全身静脉化疗,化疗药物为多柔比星、达卡巴嗪、链脲霉素、5-Fu,但发现额外接受全身静脉化疗后,生存情况并未得到改善,经动脉介入治疗介入治疗患者和额外加全身静脉化疗患者的中位生存时间分别为44个月和38个月。这个结果同Kuike等[40]的研究结果是相类似的,可能是因为静脉化疗药物毒性,导致皮疹、血小板减少、感染等并发症发病率增加,影响患者生活质量和预后。
4并发症
介入治疗相比传统外科治疗具有创伤小、术后并发症少的特点。在本文总结的文献中显示,栓塞后并发症是常见的。包括发热、恶心、呕吐、上腹疼痛、转氨酶增高,但这些症状大多是暂时的,对症处理后均能在短时间内好转;少见的严重并发症有坏死性胆囊炎、肝脓肿、类癌危象。坏死性胆囊炎多由于术中异位栓塞胆囊动脉引起,因此超选肿瘤供血动脉是必要的。肝脓肿是因为栓塞血管后肿瘤组织坏死并继发感染,细菌可以来自体外或是体内。术中严格无菌,注入栓塞剂/药物适量,是主要的预防手段。虽然在Strosberg[29]的文章中,所有接受经动脉介入治疗的患者均预防性应用抗生素左氧氟沙星+甲硝唑1周,但最新研究[41,42]认为术前、术后预防性应用抗生素对预防TACE术后肝脓肿形成无显著效果,仅对术前存在高危因素的患者才选择性的应用。一旦发生肝脓肿,除了大剂量抗生素以为,及早行经皮脓肿引流,可以有效提高预后。
类癌危象是类癌综合征患者的严重并发症,既往有过报道[43]发生在类癌肝转移行细针穿刺活检时。类癌危象常表现为短时间内出现低血压或者高血压、哮喘、意识模糊甚至昏迷等临床表现,多因在精神紧张、手术操作或是化疗药物刺激等因素诱发[44]。在TACE/TAE治疗过程中,类癌危象发生率不高,在Bloomston[36]的研究中提到了3例TACE术中发生类癌危象的情况,Strosberg[29]的文章中也出现了11例在手术开始时出现严重高血压(收缩压>180mmHg)的情况,可能也属类癌危象。作为介入科医师,在处理神经内分泌瘤肝转移时,应该对类癌危象有所了解,做到预防为主,早发现、早处理。
生长抑素类似物(奥曲肽)用于外科或经动脉介入术前、术中预防类癌危象[45]。在本文列举多篇文章[18,29,30,36]中均提到进行经动脉介入治疗的术前、术中常规应用奥曲肽预防类癌危象,但国内的两篇文章[32,34]中并未提到有类似处理措施。术中若发生类癌危象,首选奥曲肽50ug静注,必要时追加50~100ug/h维持,可以很快缓解症状。因此在介入治疗具有激素症状的神经内分泌肿瘤患者,预备奥曲肽是十分必要的,在关键时刻或许可以挽救患者性命[46]。同时,在处理低血压表现的类癌危象时,要注意避免应用儿茶酚胺类药物,这可能会加重低血压症状[43]。术后类癌危象仍有可能因栓塞后上腹疼痛诱发,故术后仍应密切观察患者情况,良好的止痛可以在一定程度上避免类癌危象发生,但镇痛药的选择需要慎重,首选芬太尼,应避开常规使用的杜冷丁或吗啡。
5小结与展望
神经内分泌肿瘤肝转移的治疗一直是临床上的难题,严重影响患者的预后。大部分患者在初次诊断或者治疗过程中出现肝转移。虽然手术根治性切除、肝移植被认为是具有治愈可能的治疗方法,但严格的适应症及较高的复发率限制了上述方案的应用。针对不可切除的肝转移患者,目前可以采用的方法包括经动脉介入(包括TAI/TAE/TACE)、内科静脉化疗化疗、消融治疗、放射性核素治疗等。经动脉介入治疗在原发性肝癌、结直肠癌肝转移方面积累着丰富的经验,应用于神经内分泌瘤伴不可切除肝转移的优势显而易见。现有的证据说明经动脉介入治疗可以有效缓解患者激素症状、控制肿瘤生长、挽救肝功能,达到提高患者生活质量,延长患者生存期的目的。另外,经动脉介入治疗在安全性方面也有自身的优势。比如:手术创伤小、术后并发症少、住院时间短。虽然大多数患者在接受治疗后会出现发热、恶心、上腹疼痛等栓塞后并发症,但大多是自限的。严重并发症少见,术前注意水化、术中注意超选、严格控制药物剂量,可以有效降低肾衰、坏死性胆囊炎、肝脓肿的风险。但类癌危象作为一种少见但有致死可能的并发症,需要引起介入医师的重视,做的早预防、早发现、早治疗,必要时应当及时请求内分泌科医师会诊。
现有的系统评价[47]认为根据患者实际情况,选择TAE/TACE术作为一种姑息治疗方案是可行并且安全的。目前姑息性减瘤外科切除术也被用于不可行R0切除的肝转移患者。虽然尚没有足够的证据[48]证明减瘤手术与经动脉介入术相比远期疗效优劣,但经动脉介入治疗有自身微创的优势,而且笔者认为现有的经动脉介入治疗的临床适应症过于宽泛,可能导致部分患者接受经动脉介入治疗后效果欠佳。树立更加严格的经动脉介入治疗适应征,对于患者预后和介入医师未来的发展都是有利的。在未来,进行前瞻性、大样本、多中心的随机对照实验是有必要的,这可以更好的明确经动脉介入治疗技术在神经内分泌肿瘤肝转移患者的治疗方面的地位。
【参考文献】
[1]Luttges J.[What′s new The 2010 WHO classification for tumours of the pancreas][J]. Der Pathologe,2011, 32(2): 332-336.
[2]中国胃肠胰神经内分泌肿瘤病理诊断共识专家组. 中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J]. 中华病理学杂志,2013, 42: 691-694.
[3]Yao JC, Hassan M, Phan A,etal. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J]. Journal of clinical oncology: official journal of the American Society of Clinical Oncology,2008, 26: 3063-3072.
[4]Lawrence B, Gustafsson BI, Chan A,etal. The epidemiology of gastroenteropancreatic neuroendocrine tumors[J]. Endocrinology and metabolism clinics of North America,2011, 40: 1-18, vii.
[5]Fraenkel M, Kim M, Faggiano A,etal. Incidence of gastroenteropancreatic neuroendocrine tumours: a systematic review of the literature[J]. Endocrine-related cancer,2014, 21: R153-163.
[6]应红艳, 丛雪晶, 赵林,等.胃肠胰腺神经内分泌肿瘤分类和分期进展[J]. 癌症进展,2011: 507-514.
[7]Moertel CG. Karnofsky memorial lecture. An odyssey in the land of small tumors[J]. Journal of clinical oncology: official journal of the American Society of Clinical Oncology,1987, 5: 1502-1522.
[8]Pape UF, Berndt U, Muller-Nordhorn J,etal. Prognostic factors of long-term outcome in gastroenteropancreatic neuroendocrine tumours[J]. Endocrine-related cancer,2008, 15: 1083-1097.
[9]Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors[J]. Cancer,2003, 97: 934-959.
[10] Frilling A, Clift AK. Therapeutic strategies for neuroendocrine liver metastases[J]. Cancer,2015, 121: 1172-1186.
[11] Hung JS, Chang MC, Lee PH,etal. Is surgery indicated for patients with symptomatic nonfunctioning pancreatic neuroendocrine tumor and unresectable hepatic metastases[J]. World journal of surgery,2007, 31: 2392-2397.
[12] 王化冰, 王连鹏. 直肠神经内分泌肿瘤的临床病理特点分析[J]. 中华医学杂志,2010, 90: 1686-1689.
[13] Stump R, Haueis S, Kalt N,etal. Transplantation and surgical strategies in patients with neuroendocrine liver metastases: protocol of four systematic reviews[J]. JMIR research protocols,2013, 2: 58.
[14] Limani P, Tschuor C, Gort L,etal. Nonsurgical Strategies in Patients With NET Liver Metastases: A Protocol of Four Systematic Reviews[J]. JMIR research protocols,2014, 3: 9.
[15] Vogl TJ, Naguib NN, Zangos S,etal. Liver metastases of neuroendocrine carcinomas: interventional treatment via transarterial embolization, chemoembolization and thermal ablation[J]. European journal of radiology,2009, 72: 517-528.
[16] Venook AP. Embolization and chemoembolization therapy for neuroendocrine tumors[J]. Current opinion in oncology,1999, 11: 38-41.
[17] Proye C. Natural history of liver metastasis of gastroenteropancreatic neuroendocrine tumors: place for chemoembolization[J]. World journal of surgery,2001, 25: 685-688.
[18] Roche A, Girish BV, de Baere T,etal. Trans-catheter arterial chemoembolization as first-line treatment for hepatic metastases from endocrine tumors[J]. European radiology,2003, 13: 136-140.
[19] Yao KA, Talamonti MS, Nemcek A,etal. Indications and results of liver resection and hepatic chemoembolization for metastatic gastrointestinal neuroendocrine tumors[J]. Surgery,2001, 130: 677-682; 682-675.
[20] Ho AS, Picus J, Darcy MD,etal. Long-term outcome after chemoembolization and embolization of hepatic metastatic lesions from neuroendocrine tumors[J]. AJR American journal of roentgenology,2007, 188: 1201-1207.
[21] Arrese D, McNally ME, Chokshi R,etal. Extrahepatic disease should not preclude transarterial chemoembolization for metastatic neuroendocrine carcinoma[J]. Annals of surgical oncology,2013, 20: 1114-1120.
[22] Frilling A, Li J, Malamutmann E,etal. Treatment of liver metastases from neuroendocrine tumours in relation to the extent of hepatic disease[J]. The British journal of surgery,2009, 96: 175-184.
[23] Touzios JG, Kiely JM, Pitt SC,etal. Neuroendocrine hepatic metastases: does aggressive management improve survival[J]. Annals of surgery,2005, 241: 776-783; 783-775.
[24] Chamberlain RS, Canes D, Brown KT,etal. Hepatic neuroendocrine metastases: does intervention alter outcomes[J]. Journal of the American College of Surgeons,2000, 190: 432-445.
[25] Moertel CG, Sauer WG, Dockerty MB,etal. Life history of the carcinoid tumor of the small intestine[J]. Cancer,1961, 14: 901-912.
[26] Eriksson B, Skogseid B, Lundqvist G,etal. Medical treatment and long-term survival in a prospective study of 84 patients with endocrine pancreatic tumors[J]. Cancer,1990, 65: 1883-1890.
[27] Ruutiainen AT, Soulen MC, Tuite CM,etal. Chemoembolization and bland embolization of neuroendocrine tumor metastases to the liver[J]. Journal of vascular and interventional radiology : JVIR,2007, 18: 847-855.
[28] Loewe C, Schindl M, Cejna M,etal. Permanent transarterial embolization of neuroendocrine metastases of the liver using cyanoacrylate and lipiodol: assessment of mid- and long-term results[J]. AJR American journal of roentgenology,2003, 180: 1379-1384.
[29] Strosberg JR, Choi J, Cantor AB,etal. Selective hepatic artery embolization for treatment of patients with metastatic carcinoid and pancreatic endocrine tumors[J]. Cancer control : journal of the Moffitt Cancer Center,2006, 13: 72-78.
[30] Dong XD, Carr BI. Hepatic artery chemoembolization for the treatment of liver metastases from neuroendocrine tumors: a long-term follow-up in 123 patients[J]. Medical oncology,2011, 28(1): S286-290.
[31] Therasse P, Arbuck SG, Eisenhauer EA,etal. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada[J]. Journal of the National Cancer Institute,2000, 92: 205-216.
[32] 李晓光, 金征宇, 潘 杰,等.肝动脉化疗或栓塞治疗胰腺神经内分泌肿瘤肝转移的疗效分析[J]. 介入放射学杂志,2010, 19: 442-446.
[33] Lokich JJ. Determination of response in treatment of hepatic neoplasia[J]. Seminars in oncology,1983, 10: 228-237.
[34] 秦立东, 李金鹏. 肝动脉化疗或栓塞治疗神经内分泌肿瘤肝转移的疗效分析[J]. 临床肿瘤学杂志,2013, 18: 445-448.
[35] Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J]. Seminars in liver disease,2010, 30: 52-60.
[36] Bloomston M, Al-Saif O, Klemanski D,etal. Hepatic artery chemoembolization in 122 patients with metastatic carcinoid tumor: lessons learned[J]. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract,2007, 11: 264-271.
[37] Saltz L, Trochanowski B, Buckley M,etal. Octreotide as an antineoplastic agent in the treatment of functional and nonfunctional neuroendocrine tumors[J]. Cancer,1993, 72: 244-248.
[38] Oberg K. Chemotherapy and biotherapy in the treatment of neuroendocrine tumours[J]. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO,2001, 12(2): 111-114.
[39] Skinazi F, Zins M, Menu Y,etal. Liver metastases of digestive endocrine tumours: natural history and response to medical treatment[J]. European journal of gastroenterology & hepatology,1996, 8: 673-678.
[40] Kulke MH, Stuart K, Enzinger PC,etal. Phase II study of temozolomide and thalidomide in patients with metastatic neuroendocrine tumors[J]. Journal of clinical oncology: official journal of the American Society of Clinical Oncology,2006, 24: 401-406.
[41] 赵利锋, 王钢, 朱海林,等.预防性肝动脉栓塞化疗对提高肝癌切除术后患者生存率的意义[J]. 当代医学,2015, 21: 71.
[42] 刘纪营, 马南, 管生,等.预防性应用抗生素的不同方法对介入治疗并发肝脓肿的影响[J]. 介入放射学杂志,2013, 22: 474-477.
[43] Bissonnette RT, Gibney RG, Berry BR,etal. Fatal carcinoid crisis after percutaneous fine-needle biopsy of hepatic metastasis: case report and literature review[J]. Radiology,1990, 174: 751-752.
[44] Janssen M, Salm EF, Breburda CS,etal. Carcinoid crisis during transesophageal echocardiography[J]. Intensive care medicine,2000, 26: 254.
[45] Ahlman H, Ahlund L, Dahlstrom A,etal. Use of a somatostatin analogue in association with surgery and hepatic arterial embolisation in the treatment of the carcinoid syndrome[J]. British journal of cancer,1987, 56: 840-842.
[46] Kvols LK, Martin JK, Marsh HM,etal. Rapid reversal of carcinoid crisis with a somatostatin analogue[J]. The New England journal of medicine,1985, 313: 1229-1230.
[47] Yang TX, Chua TC, Morris DL. Radioembolization and chemoembolization for unresectable neuroendocrine liver metastases - a systematic review[J]. Surgical oncology,2012, 21: 299-308.
[48] Gurusamy KS, Pamecha V, Sharma D,etal. Palliative cytoreductive surgery versus other palliative treatments in patients with unresectable liver metastases from gastro-entero-pancreatic neuroendocrine tumours[J]. The Cochrane database of systematic reviews,2009,007118.
Advance in transvascular interventional therapy of liver metastases in patients with neuroendocrine tumors
LIU Hang reviewingYAN Jijin checking
(DepartmentofInterventionalRadiology,ChanghaiHospital,TheSecondMilitaryMedicalUniversity,Shanghai200433,China)
【Abstract】Liver metastases in patients with neuroendocrine tumors is a poor factor influencing prognosis. Radical surgery can get favorite outcome,however, at the time of diagnosis, the majority of patient cannot be completely resected. Management of patients with unresected liver metastases is various, such as palliative cytoreductive surgery, ablation, TACE/TAE/TAI, intravenous chemotherapy,peptide receptor radionuclide therapy. But the effect is controversial. In recent years, some literatures confirm TACE/TAE/TAI is safe and effective. This review makes a summary of main relevant articles, then expounds the advantages and disadvantages of transvascular interventional therapy of liver metastases in patients with neuroendocrine tumors.
【Key words】Neuroendocrine tumors; Liver metastases; Transarterial chemoembolization/infusion
(收稿日期:2015-12-15; 编辑: 陈舟贵)
【中图分类号】R 736; R 735.7
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.04.037
通讯作者:杨继金 E-mail:jijinyang@sina.com
基金项目:上海市科委科研课题(14411960300)

