per1,per2 3′UTR双荧光素酶报告基因重组质粒的构建
王艳利,吕 柯,陈海龙,冀国华,王婷梅,张永亮,毕 蕾,钟 萍,李莹辉,,曲丽娜
(1.西北工业大学生命学院,陕西 西安 710072;2.中国航天员科研训练中心航天医学基础与应用国家重点实验室,北京 100094)
per1,per2 3′UTR双荧光素酶报告基因重组质粒的构建
王艳利1,吕柯2,陈海龙2,冀国华2,王婷梅1,张永亮1,毕蕾2,钟萍2,李莹辉1,2,曲丽娜2
(1.西北工业大学生命学院,陕西 西安 710072;2.中国航天员科研训练中心航天医学基础与应用国家重点实验室,北京 100094)
摘要:构建了包含目的片段小鼠节律基因per1,per2 3′UTR全长的重组质粒,为初步分析转录后可能调控per1,per2基因的miRNAs提供了有效手段。用反转录试剂盒将从小鼠肝脏组织提取的RNA反转录得到cDNA,以获得的cDNA为模板PCR扩增per1,per2 3′UTR全长,经回收纯化、酶切后将目的片段定向克隆到PGL3-promoter质粒上,再经转化扩增挑取克隆进行菌落PCR,对获得的阳性克隆进行酶切鉴定并测序。PCR产物鉴定结果表明,目的片段per1,per2 3′UTR序列扩增成功;菌落PCR及单酶切鉴定结果表明,per1,per2 3′UTR已插入PGL3-promoter载体中;测序结果表明,per1,per2 3′UTR插入序列,插入方向正确。per1,per2 3′UTR双荧光素酶报告基因重组质粒的成功构建为进一步研究节律基因转录后的调控机制奠定了基础。
关键词:生物节律;per1基因;per2基因;双荧光素酶报告基因
生物节律是所有生命活动内源性存在的、按照一定规律运行的周期性生命活动现象[1]。生物节律是调控人体生理及行为表型的重要因素之一,不仅调控核心体温、血压、激素分泌(包括褪黑素以及生长激素的夜间分泌),还调控免疫系统、睡眠习性及代谢水平等[2-5]。因其参与功能的广泛,生物节律的研究受到越来越多的关注。在这一过程中除转录和翻译调控外,转录后调控也发挥着重要作用。
研究表明,哺乳动物的昼夜节律主要受控于下丘脑前部的视交叉上核(suprachiasmaticnucleus,SCN),SCN中周期性表达的Clock、bmal1、per1、per2、cry1及cry2等节律基因的转录和转录后调控所形成的分子振荡是近日节律产生和维持的分子基础[6-7]。SCN通过神经网络、激素分泌等协同外周器官形成了机体的节律性生理及行为表型[8-10]。per1和per2作为负反馈环路重要分子在SCN与外周节律的形成过程中发挥着重要作用[11]。
miRNAs作为信号调节分子在机体的生长、发育、代谢、衰老、炎症、损伤、修复,细胞的增殖、迁移、凋亡、再生,基因的表达、转录、修饰、变异,疾病的发生、发展和防治中发挥极其重要的作用[12-13]。它们不仅是人体各种生理功能的生物标记物,也是各种疾病发生、发展和防治的标记物,是人体防治疾病新的重要靶标和药物发现的新途径。
作者所在课题组通过小鼠SCN芯片与生物信息学分析,预测出了与per1,per2 3′UTR区相结合的多个miRNAs,在此拟构建包含per1,per2 3′UTR全长的双荧光素酶报告基因重组质粒,为后续研究miRNAs对节律基因的转录后调控奠定基础。
1实验
1.1材料
1.1.1试剂与仪器
Trizol试剂,Invitrogen公司;反转录试剂、牛小肠碱性磷酸酶,宝生物工程大连有限公司;KOD酶,Toyobo公司;2×ExTaqMix酶、快速DNA产物回收试剂盒、胶回收试剂盒、质粒小提试剂盒、无内毒素质粒中提试剂盒,北京康为试剂有限公司;xbαI酶、T4DNA连接酶,NEB公司。
PCR仪,美国PE公司;微量紫外分光光度计,美国Quawell公司。
1.1.2载体与菌株
PGL3-promoter质粒,自行保存;大肠杆菌DH5α感受态细胞,北京康为试剂有限公司。
1.1.3引物
根据NCBI中小鼠per1和per2 3′UTR序列,用PrimerPremier5.0软件设计引物,引物5′端加入酶切位点TCTAGA与保护性碱基GC,引物由北京三博远志有限公司合成。引物序列如下:
Senseper1 3′UTR:5′-GCTCTAGACATTTTG-GGGCCGCTTA-3′
Antisenseper1 3′UTR:5′-GCTCTAGATGGT-TTTTCATTTTGTCATTTTG-3′(593bp)
Senseper2 3′UTR:5′-GCTCTAGAGACATTA-GACGGTGCTCGG-3′
Antisenseper2 3′UTR:5′-GCTCTAGATTTC-TAAAAGGCAAAAAAGTCAT-3′(1 832bp)
1.2方法
1.2.1cDNA及载体获得
按Trizol试剂说明书进行C57BL/6J小鼠肝脏组织中总RNA的提取,用微量紫外分光光度计测定RNA纯度及浓度。参照Takara Prime Script RT Reagent Kit with gDNA Eraser试剂盒说明书进行基因组DNA去除反应及cDNA合成。PGL3-promoter菌种摇菌12 h后,用无内毒素质粒中提试剂盒提取质粒用于后续实验。
1.2.2小鼠per1,per2 3′UTR扩增
以上述得到的cDNA为模板进行扩增,模板终浓度为50 ng·μL-1。
per1 3′UTR PCR扩增反应体系:2×Ex Taq Mix 10 μL;PCR forward primer 1 μL(10 μmol·L-1);PCR reverse primer 1 μL(10 μmol·L-1);模板5 μL;总体积20 μL。反应条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃终延伸2 min。
per2 3′UTR PCR扩增反应体系:10×PCR buffer 5 μL;2 mmol·L-1dNTP 5 μL;25 mmol·L-1MgSO42 μL;KOD plus 1 μL;PCR forward primer 1.5 μL(10 μmol·L-1);PCR reverse primer 1.5 μL(10 μmol·L-1);模板5 μL;总体积50 μL。反应条件:94 ℃预变性2 min;94 ℃变性15 s,60 ℃退火30 s,68 ℃延伸3 min,35个循环;72 ℃终延伸10 min。
1.2.3小鼠per1,per2 3′UTR目的片段回收、酶切与PGL3-promoter质粒酶切
先用1%琼脂糖凝胶电泳确定目的片段是否正确后再进行胶回收纯化。PCR回收纯化产物、提取的PGL3-promoter质粒分别根据xbαI酶说明书配制酶切体系,37 ℃下酶切过夜。次日酶切产物胶回收纯化。
1.2.4PGL3-promoter质粒酶切产物5′去磷酸化
为防止载体自连,PGL3-promoter酶切回收纯化后根据牛小肠碱性磷酸酶说明书配制反应体系进行5′去磷酸化。
1.2.5PGL3-promoter 5′去磷酸化产物与PCR产物酶切纯化后连接
目的片段酶切回收纯化产物与PGL3-promoter 5′去磷酸化回收纯化产物按物质的量比10∶1通过T4DNA连接酶连接,将目的片段克隆于PGL3-promoter载体中构建PGL3-promoter-3′UTR重组载体。16 ℃下连接过夜,得连接产物。
1.2.6转化
将连接产物转化E.coliDH5α并均匀涂布至含有1‰氨苄青霉素(100 mg·mL-1)的LB平板,37 ℃孵箱培养12~16 h。
1.2.7菌落PCR
用10 μL无菌枪头挑取单个菌落划线至含有1‰氨苄青霉素(100 mg·mL-1)的LB平板后,在配制好的PCR反应体系中反复吸打,以单个菌落为模板,采用带有限制性内切酶作用位点及保护性碱基的引物,通过菌落PCR初步鉴定为阳性克隆。
1.2.8酶切鉴定
将初步鉴定为阳性克隆的菌落加到装有5 mL LB液体培养基[含1 ‰氨苄青霉素(100 mg·mL-1)]的离心管中,37 ℃、200 r·min-1培养12~16 h。用质粒小提试剂盒提取质粒进行酶切鉴定。
1.2.9测序鉴定
选取酶切鉴定的阳性克隆送生工生物工程(上海)股份有限公司进行RVP4引物(5′-GACGATAGTCATGCCCCGCG-3′)反向测序鉴定,通过DNAMAN与Chromas软件分析插入片段序列及方向是否正确。
2结果与讨论
2.1目的片段获取
研究发现,小鼠per1 3′UTR长度为593 bp,per2 3′UTR 长度为1 832 bp。利用1%琼脂糖凝胶电泳分析PCR产物,结果见图1。
从图1可看出,per1,per2基因3′UTR扩增产物符合预期目的序列长度。
2.2菌落PCR鉴定
以随机挑取的多个单克隆菌落为模板,采用带有限制性内切酶作用位点及保护性碱基的引物,用2×Taq酶进行菌落PCR扩增,利用1%琼脂糖凝胶电泳鉴定菌落PCR产物,结果见图2。

DL.DNA Lander 1,1′.PCR Amplification with template 5 μL

DL.DNA Lander 1~10,1′~16′.PCR Products
将图2中条带位置与593 bp(per1 3′UTR)、1 832 bp(per2 3′UTR)长度相符的初步鉴定为阳性克隆。
2.3单酶切鉴定
将初步鉴定为阳性克隆的菌落扩增提取质粒,抽提的质粒经xbαI酶单酶切4 h后进行1%琼脂糖凝胶电泳鉴定,结果见图3。
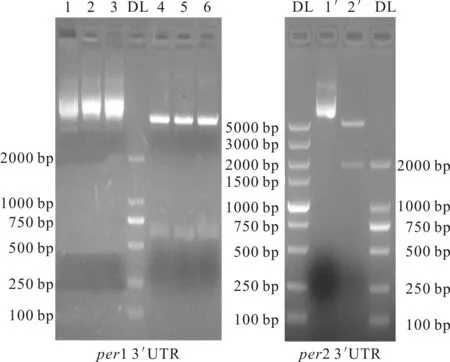
DL.DNA Lander 1~3,1′~2′.Recombinant plasmid
从图3可看出,单酶切后可见质粒片段与目的片段的大小与理论计算值相符。表明,per1,per2 3′UTR已成功插入PGL3-promoter载体中。
2.4测序鉴定
单酶切插入存在插入方向的双向性。为确定插入方向及插入序列有无突变,将单酶切鉴定为阳性的质粒送生工生物工程(上海)股份有限公司测序,结果见图4。将测序结果反向互补与NCBI中查找的小鼠per1,per2 3′UTR序列进行比对,结果发现,重组质粒所含的per1,per2 3′UTR序列同源性为100%。表明小鼠per1,per2 3′UTR序列成功克隆。
2.5讨论
per1与per2基因是生物节律调控过程中的核心钟基因。per1突变及表达缺失的小鼠对光照所诱导的生物节律调节作用消失,生物节奏周期变短[14];per1及per2同时表达缺失的小鼠不能表现出生物节律[15]。其中,per1的表达是per2节律性表达必不可少的;per1能够通过蛋白结合相互作用的方式在转录后调控per2的表达水平,per1表达缺失的小鼠的per2和cry1表达水平均明显下降[16]。表明per1和per2在维持和调节生物节律中发挥重要作用。除了调节机体生物节律,per1与per2在调控细胞周期、DNA损伤修复、肿瘤发生发展过程中也发挥着重要作用[17]。

TCTAGA:Sequence of xbα I enzyme Outside the box sequences represent of PGL3-promoter and
miRNAs参与调控PER的表达已有报道。miR-192/194群与per基因的3′UTR相结合负向调控PER1、PER2、PER3的表达,过表达miR-192/194缩短bmal1 mRNA的节律周期[18]。A549细胞中miR-29a/b/c能够直接与per1基因的3′UTR相互作用,miR-29a/b/c的过表达会下调per1 mRNA及PER1蛋白的表达[19]。
不仅在体外细胞中,小鼠SCN中miRNA于转录后调控节律基因的表达。Cheng等[20]研究表明,脑特异性miRNA miR-132和miR-219的表达具有节律性,miR-132参与生物节律的光调控环节,抑制光诱导产生的时相延迟作用,从而发挥节律同步因子作用;miR-219靶向CLOCK-BMAL1异二聚体发挥节律传输因子的作用,miR-219敲除导致小鼠的昼夜周期延长;小鼠SCN中,miR-142-3p节律性表达,细胞实验表明miR-142-3p与bmal1基因的3′UTR相互作用调控BMAL1的表达[21]。
3结论
为进一步研究per1、per2 mRNA上游的miRNAs,通过PCR扩增小鼠per1,per2 3′UTR区,连接至双荧光素酶报告载体PGL3-promoter中,并测序鉴定PGL3-promoter-per1/per2 3′UTR双荧光素酶报告基因重组质粒是否构建成功。通过PCR扩增、菌落PCR鉴定、酶切鉴定证实,小鼠per1,per2 3′UTR目的片段已克隆至载体;测序结果显示,per1与per2 3′UTR全长100%吻合。重组质粒的成功构建为研究SCN中调控per1,per2基因的miRNAs提供了实验手段。
参考文献:
[1]王正荣,陈善广,冀治鸿,等.时间生物学研究进展[J].航天医学与医学工程,2006,19(4):309-312.
[2]BOLLINGER T,SCHIBLER U.Circadian rhythms-from genes to physiology and disease[J].Swiss Medical Weekly,2014,144:w13984.
[3]LABRECQUE N,CERMAKIAN N.Circadian clocks in the immune system[J].Journal of Biological Rhythms,2015,30(4):277-290.
[4]ABBOTT S M,SOCA R,ZEE P C.Circadian rhythm sleep-wake disorders[J].Psychiatric Clinics of North America,2015,38(4):805-823.
[5]FERRELL J M,CHIANG J Y.Circadian rhythms in liver metabolism and disease[J].Acta Pharmaceutica Sinica B,2015,5(2):113-122.
[6]MARC H,HEINZ K,DIDIER G.Effect of network architecture on synchronization and entrainment properties of the circadian oscillations in the suprachiasmatic nucleus[J].PLoS Computational Biology,2012,8(3):e1002419.
[7]STAIGER D,KOSTER T.Spotlight on post-transcriptional control in the circadian system[J].Cellular and Molecular Life Sciences,2011,68(1):71-83.
[8]MENAKER M,MURPHY Z C,SELLIX M.Central control of peripheral circadian oscillators[J].Current Opinion in Neurobiology,2013,23(5):1-6.
[9]HUSSE J,LELIAVSKI A,OSTER H.Biological role and clinical relevance of central and peripheral circadian clocks[J].Deutsche Medizinische Wochenschrift,2013,138(10):493-496.
[10]ATISH M,AHMAD K,MANOHAR D,et al.Shifting eating to the circadian rest phase misaligns the peripheral clocks with the master SCN clock and leads to a metabolic syndrome[J].Proceedings of the National Academy of Sciences,2015,112(48):E6691-E6698.
[11]KUDO T,BLOCK G D,COLWELL C S.The circadian clock genePeriod1 connects the molecular clock to neural activity in the suprachiasmatic nucleus[J].ASN Neuro,2015,7(6):1-14.
[12]LAI E C.microRNAs are complementary to 3′UTR sequence motifs that mediate negative post-transcriptional regulation[J].Nature Genetics,2002,30(4):363-364.
[13]WANG X,TIAN G,LI Z,et al.The crosstalk between miRNA and mammalian circadian clock[J].Current Medicinal Chemistry,2015,22(13):1582-1588.
[14]CERMAKIAN N,MONACO L,PANDO M P,et al.Altered behavioral rhythms and clock gene expression in mice with a targeted mutation in thePeriod1 gene[J].EMBO Journal,2001,20(15):3967-3974.
[15]ZHENG B,ALBRECHT U,KAASIK K,et al.Nonredundant r-oles of themPer1 andmPer2 genes in the mammalian circadian clock[J].Cell,2001,105(5):683-694.
[16]OSTER H,BAERISWYL S,van der HORST G T J,et al.Loss of circadian rhythmicity in agingmPer1-/-mCry2-/-mutant mice[J].Genes & Development,2003,17(11):1366-1379.
[17]LEE C C.Tumor suppression by the mammalianPeriodgenes[J].Cancer Causes & Control,2006,17(4):525-530.
[18]NAGEL R,CLIJSTERS L,AGAMI R.The miRNA-192/194 cluster regulates thePeriodgene family and the circadian clock[J].FEBS Journal,2009,276(19):5447-5455.
[19]ZHAO X Y,ZHU X Q,CHENG S T,et al.miR-29a/b/c regulate human circadian genehPER1 expression by targeting its 3′UTR[J].Acta Biochimica Et Biophysica Sinica,2014,46(4):313-317.
[20]CHENG H Y,PAPP J W,VARLAMOVA O,et al.microRNA modulation of circadian-clock period and entrainment[J].Neuron,2007,54(5):813-829.
[21]SHENDE V R,NEUENDORFF N,EARNEST D J.Role of miR-142-3p in the post-transcriptional regulation of the clock geneBmal1 in the mouse SCN[J].PLoS One,2013,8(6):e65300.
Construction ofper1,per2 3′UTR Dual-Luciferase Reporter Gene Recombinant Plasmid
WANG Yan-li1,LÜ Ke2,CHEN Hai-long2,JI Guo-hua2,WANG Ting-mei1,ZHANG Yong-liang1,BI Lei2,ZHONG Ping2,LI Ying-hui1,2,QU Li-na2
(1.SchoolofLifeSciences,NorthwesternPolytechnicalUniversity,Xi′an710072,China;2.StateKeyLaboratoryofSpaceMedicineFundamentalsandApplication,ChinaAstronautResearchandTrainingCenter,Beijing100094,China)
Abstract:To analyze the miRNAs regulated per1,per2 expression at post-transcriptional level,per1,per2 3′UTR dual-luciferase reporter gene recombinant plasmid was constructed.The 3′UTR sequence of mouse per1,per2 genes with the template cDNA reversed from RNA of mouse liver tissue was amplified by PCR,and then cloned into a PGL3-promoter plasmid after recovery,purification and enzyme digestion.The positive clone was selected and further identified by sequencing to ensure the authenticity and direction of the inserted per1,per2 3′UTR.PCR Product identification results suggested that the target fragment per1,per2 3′UTR sequence was amplified successfully.Single colony PCR and restriction enzyme analysis results concluded that per1,per2 3′UTR had been inserted into PGL3-promoter vector.DNA Sequence results showed that per1,per2 3′UTR was cloned into PGL3-promoter dual-luciferase reporter gene vector with right direction.The per1,per2 3′UTR dual-luciferase reporter gene recombinant plasmid was successfully constructed,which might lay the foundation for a further study of post-transcriptional regulation mechanism of circadian genes.
Keywords:circadian rhythms;per1 gene;per2 gene;dual-luciferase reporter gene
中图分类号:Q 786
文献标识码:A
文章编号:1672-5425(2016)04-0028-05
doi:10.3969/j.issn.1672-5425.2016.04.008
作者简介:王艳利(1987-),女,北京人,博士研究生,研究方向:空间时间生物学,E-mail:1987wangyanli@163.com;通讯作者:曲丽娜,研究员,E-mail:linaqu@263.net;李莹辉,研究员,E-mail:yinghuidd@vip.sina.com。
收稿日期:2016-01-04
基金项目:国家重大科学仪器设备开发专项(2013YQ19046706,2012YQ0401400901),中国航天员科研训练中心航天医学基础与应用国家重点实验室自主项目(SMFA13B02)

