不同药剂处理对食用鲜木薯块根贮藏特性的影响
林立铭 徐缓 简纯平 陈常女 张振文


摘 要 以食用鲜木薯块根为研究对象,研究不同药剂处理后在10 ℃和85%相对湿度条件下贮藏,块根主要生理生化特性的变化,探究主要抗氧化酶在贮藏过程的差异。结果表明:采后7 d是块根迅速失水期,其干物率和淀粉含量呈上升趋势,3个处理均可以一定程度延缓失水速度;贮藏前期(0~30 d)NaCl和Na2S2O5溶液处理可以提高SOD和APX酶活性,抑制POD和CAT酶活性,但到了贮藏后期(30~60 d)各处理基本一致。可见98 ℃、10 g/L的NaCl热水和抗氧化剂Na2S2O5处理在短期内可延缓褐变发生。方差统计分析发现,各6项指标均在贮藏时期分别达极显著差异,各处理对SOD酶活性的影响不显著,对其他5项指标的影响达显著或极显著水平。
关键词 木薯;块根;抗氧化剂;采后生理;方差分析
中图分类号 S533.04 文献标识码 A
Abstract The fresh edible cassava tuberous roots were subjected to analyze the difference characteristic of post-harvest physiological reaction on antioxidant enzymes during storage under 10 ℃ and 85% relative humility conditions. It showed that the dried matter and starch contents increased quickly 7 days later after harvesting and the water losing was also delayed by three treatments. The activities of superoxide dismutase(SOD)and ascorbate peroxidase(APX)enzymes of physiological indices were enhanced at the former storage state(0-30 days)by sodium chloride(NaCl)and sodium metabisulfite(Na2S2O5)solution, but the peroxidase(POD)and catalase(CAT)were reduced by these treatments. While they were the same level after storage more than 30 days at the later stage. 1% NaCl(v/v)solution and antioxidant Na2S2O5 solution could keep browning reaction delaying at former storage stage. We also made a further analysis of Anova based SAS8.0 software. It showed the all the six indices were affected most significantly after storage, and more obviously affected by different treatments during the whole storage, except the SOD enzyme activities.
Key words Cassava; Antioxidant; Post-harvest Physiology; Anova analysis
doi 10.3969/j.issn.1000-2561.2016.05.021
木薯(Manihot esculenta Crantz)是三大薯类之一,是世界第六大粮食种类、全球约8亿人口的主粮[1-2]。然而,木薯块根不耐储藏,采后2~3 d内由块根内部的多酚类物质发生了酶促和非酶促氧化的生理生化变化而引起褐变,并开始变质腐烂[3]。块根采后变质过程包括水分代谢、呼吸代谢和能量代谢等复杂的生理生化代谢变化,这些变化贯穿块根生长发育的整个过程,受品种自身基因的表达水平差异和外界环境以及机械伤害等因素的影响[4-15]。研究发现,在块根收获后,苯丙氨酸解氨酶(PAL)、葡聚糖酶、蛋白酶、过氧化物酶(POD)和多酚氧化酶(PPO)是延缓采后腐烂的关键酶[16],而通过沙藏或封蜡来减少或杜绝与外界空气的接触,可以降低其生理活动[17],减少活性氧的迅速积累[18],从而有效地延缓块根采后变质腐烂。类似的,使用外源抗氧化剂(如绿茶提取液)处理采后木薯块根并用薄膜包装,可以显著延长其贮藏期[19],说明木薯块根采后的氧化胁迫是其腐烂的主要因素之一。然而这些处理方式操作不方便,成本较高,只适用于小规模的生产,且将给后期木薯块根的食品化利用带来污染,增加处理成本,也不适合木薯块根的规模化、产业化的加工利用[20]。于是,更为方便有效的外源抗氧剂的应用研究成为木薯块根采后处理研究领域的重点。
焦亚硫酸钠(Na2S2O5)是一种广泛应用于作物和果蔬采后保鲜的保鲜剂,具有抗氧化功能,能够保护果实中的多酚,有效抑制酚酶的活性[21];而抗坏血酸溶液、氯化钠(NaCl)溶液和热水处理同样可以抑制果蔬采后多酚酶活,延缓褐变进程[22-24]。
因此,本研究以食用鲜木薯块根为研究对象,通过不同药剂和热水处理,研究块根低温贮藏过程生理生化变化规律,探索采后处理保鲜技术,推动木薯块根食品化利用进程。
1 材料与方法
1.1 试验材料
试验材料来源于中国热带农业科学院热带作物品种资源研究所国家薯类加工技术研发分中心,使用种植10个月的华南9号木薯块根。
1.2 方法
1.2.1 处理方法 鲜木薯块根收获后,随机选取无腐烂的薯块,洗净剥皮;在表1所列溶液中浸泡;在湿度85%、温度10 ℃的培养箱中分别贮藏0、7、10、20、30、60 d;取样分析,每个处理设3次重复。
1.2.2 测定指标及方法 干物质含量测定采用烘干法测定;淀粉含量测定采用氯化钙-旋光法(GB/T 5514-2008)[25];过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性采用南京建成生物工程研究所试剂盒测定;抗坏血酸过氧化物酶(APX)活性测定采用索莱宝公司提供的试剂盒。
1.3 数据处理
利用Sigmaplot 10.0制作图表,显著性和相关性分析采用SAS8.1软件分析。
2 结果与分析
2.1 块根干物质含量变化
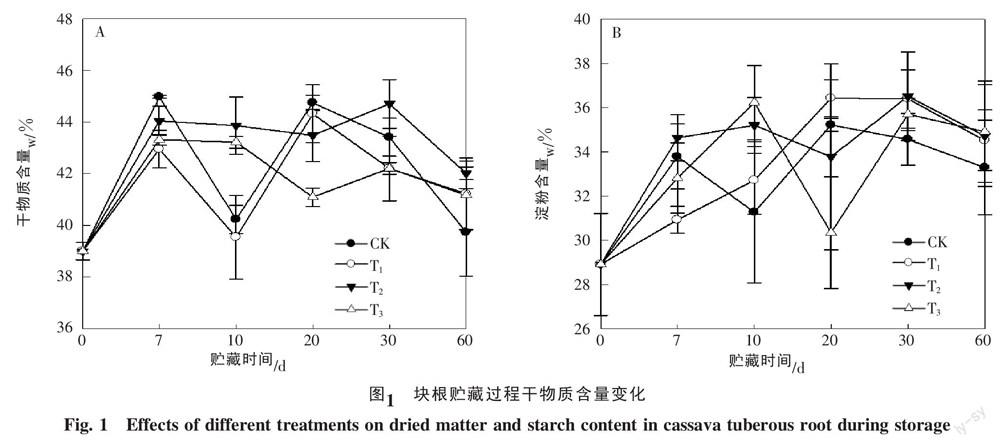
木薯块根DMC是块根品质的重要指标。试验结果表明,CK和T1的干物含量变化趋势类似,贮藏7 d及20 d时含量最高,但在贮藏10 d时最低(图1-A)。这可能是贮藏7 d内块根失水最快,然后因为开始腐烂变质并吸收水分而使块根含水量增加,干物含量降低。从T2和T3的变化情况看,两者变化趋势相似,在7 d时DMC最高,但略低于CK、略高于T1。总的来看,块根贮藏7 d内是块根迅速失水期,从而使DMC相对提高;贮藏60 d后,各处理的DMC均高于对照,以T2的DMC含量最高,达42.02%。说明贮藏60 d后块根开始腐烂,微生物降解块根的组织,释放出相应的结合水或束缚水,导致DMC增加。
在贮藏7 d时,CK和T3的淀粉含量变化趋势基本一致,其中CK在贮藏7 d和20 d淀粉含量出现高峰,而T3相应推迟,分别在贮藏10 d和30 d时出现高峰(图1-B)。相应地,T1和T2的淀粉含量随着贮藏时间的延长而不断增加,并在贮藏30 d时达最高值36.40%和36.52%,然后迅速下降,收获后30 d至60 d仅下降1~2个百分点,不能算迅速下降。推测前期淀粉含量差异较大是由各块根不同程度的失水引起的。贮藏过程,淀粉含量呈上升趋势,其中贮藏10 d时CK淀粉含量最低,贮藏60 d时CK的淀粉含量低于各药剂处理;这是因为贮藏后期CK和各处理均发生腐烂,块根失水或纤维等多糖降解引起。
为了进一步分析贮藏期和处理方式对各指标的影响,利用SAS8.0对各不同指标进行方差分析,结果如表2所示。从表2的数值可知,贮藏期对各DMC和SC的影响达极显著,而不同处理方式对SC的影响不显著,对DMC的影响达显著水平。
2.2 相关酶活性的变化
块根贮藏过程中,SOD酶活性均呈上升后迅速下降的趋势(图2-A),并在贮藏30 d后其活性分别达最高值358.53、347.53和366.88 U/mg prot.。在贮藏7 d时,T2的SOD酶活力略低于CK及其它处理,可能是前期高温预处理抑制了SOD酶的活力[26]。在贮藏10 d时,CK的SOD酶活力低于药剂处理,而后各药剂处理和CK无明显差异,可能是药剂处理主要功效体现在贮藏前10 d。方差统计分析表明,不同贮藏期SOD酶活性达极显著差异,但不同药剂处理间的差异不显著。从数据来看,块根经外源抗氧化剂T3处理后,贮藏过程SOD活性均保持大于其他处理以及CK,说明Na2S2O5和NaCl对SOD活性有一定的保护作用[27]。
图2-B中,CK及各药剂处理后的POD活力基本表现出平缓上升,在贮藏20 d时达最高,而后迅速下降。其中,T2在贮藏过程的POD活性均处于最小,可能是NaCl对POD酶有一定的抑制作用[23,27];而其他2个处理的POD活力与CK差别不大,活力大小顺序依次为CK>T3>T1>T2,说明各药剂处理都在一定程度上抑制了POD活力的上升,尤其以短时高温处理的抑制效果最好。
在整个贮藏期过程,CK和各处理的CAT酶差异较大,在贮藏60 d时基本一致(图3-A)。其中,CK的CAT酶活性呈循环上升、下降的趋势,在贮藏7 d时达最大值;T2的CAT酶活性在贮藏7 d时出现最高值,达到7.95 U,而后迅速下降;T1和T3的酶活性均处于持续下降的趋势。可见热水NaCl溶液处理可以在短期内(7 d)提高该酶的活性,而低浓度的NaS2O5溶液对CAT酶有一定的抑制作用。方差统计分析也发现(表3),不同贮藏期和处理均达到极显著的差异,说明CAT与外界贮藏环境和处理方式关系密切。
对于APX酶,CK和处理T3的APX酶活性同样呈上升后下降的趋势(图3-B)。其中CK和T3在贮藏7 d时活性最高,T2的活性出现在贮藏10 d时,而T1无明显的变化。整个贮藏过程,CK的APX酶活性较高,但在贮藏10 d时低于T2。可见,高温处理(T2)延缓了APX活性高峰的来临,与CK相比,可以相应地提高APX活性。进一步方差统计分析表明(表3),APX酶在不同贮藏期和处理间均达到极显著的差异。
3 讨论与结论
木薯块根采后腐烂,是受伤害胁迫和微生物入侵产生侵填物而引起肉质部分腐烂的一种现象[28-30]。木薯块根收获时不可避免受到不同程度的伤害,微生物的感染也随之而来。因此,采用有效的技术手段预防或阻止微生物入侵,将很大可能延缓木薯采后腐烂发生的进程甚至是腐烂的发生,而外源抗氧化剂的使用是延缓采后腐烂的重要措施之一[27]。
在采后贮藏生理研究中,减少活体果蔬水分散失和降低呼吸强度等生理活动的方法,有化学方法和物理方法。化学方法主要是通过外源生理活性抑制剂(1-MCP、壳聚糖、水杨酸和钙等)来调节其生理活性[21,31-35],而物理方法有预热处理、微波和紫外线等[36-40]。这些方法主要针对活体且机械伤害不明显的果蔬,处理效果才明显。本研究研究对象为经脱皮后木薯块根的肉质部分,具有较明显的机械伤害,于是采用物理和化学兼用进行贮藏试验。结果表明,经NaCl和Na2S2O5溶液处理后,贮藏前10 d SOD酶活性高于CK,可能是Na2S2O5参与胁迫反应,从而引起SOD活力升高[41-44];然而,热水预处理后在短期(7 d)内却不利于SOD活力的提高,说明热处理虽然能提高SOD活力,但同时也一定程度损伤了抗氧化系统。另外,预热处理对不同作物和不同组织的POD活力影响不尽相同,这是由于POD在活性氧代谢中有双重功能,既具备清除活性氧能力,也会在酶促反应中产生活性氧提高抗病性,从而延缓褐变的发生[38,43-44]。本试验发现,预热处理后延缓了POD活性的提高,在贮藏期内均低于CK,且贮藏前期不断上升,并在贮藏20 d时达最大值,这说明短时高温预处理可以延缓褐变发生[24,44]。虽然预热结合NaCl处理不仅能够有效延缓褐变,且在贮藏结束后,干物含量和相对淀粉含量维持在较高水准,但高温预热处理使得薯块表面被烫熟,淀粉发生糊化,在贮藏10 d后薯块表面开始出现酸味,说明薯块表面因微生物的发酵作用,产生酸味,从而影响了贮藏品质。因此,高温预热处理的时间和方法有待进一步研究。此外,本试验还探讨了化学处理对贮藏过程APX和CAT活性的影响,结果发现,预热处理在贮藏前期(10 d)可以提高或保护APX酶和CAT酶活力,而Na2S2O5处理可以延缓CAT活性的降低速度,与李英丽[45]的研究结果基本一致,同样也存在对时间响应的问题。
植物采后生理是个复杂的生理生化过程,涉及果蔬品种特征特性、生长发育与成熟中品质形成及采后品质变化与控制,与生物体的基因和蛋白质以及代谢的表达与调控密切相关[46],特别是果蔬贮藏过程中激素水平对抗氧酶系统的调节是贮藏保鲜的关键[47]。本试验的研究对象是木薯块根的肉质部分,块根已经受到严重伤害,这种伤害加速了组织的衰老和腐败,因为机械伤害可以刺激信号分子的产生、运转、感知、接受和转导,而有效的外源生长调节剂可以诱发鲜切果蔬整体协调产生防御反应,有效抑制微生物对受伤部位的侵染[47],从而减轻机械损伤对木薯块根品质的影响。为此,在今后木薯块根采后贮藏研究中,在食品安全卫生标准范围内,考虑通过外源生长调节剂、抗氧化剂或涂膜的方法或手段进行研究[48],并重点探讨木薯块根贮藏过程激素水平的影响。另一方面,本文仅从抗氧化酶的角度来分析外源抗氧化剂对木薯块根采后贮藏特性的影响,还需要从外观评价和分子水平上(如相关酶的表达情况)来进一步验证外源抗氧化剂的时效性,才能更为全面和可靠地评价其贮藏特性。
参考文献
[1] FAO/IFAD. The World Cassava Economy: Facts, Trends and Outlooks[C]. Rome, Italy: Food and Agriculture Organization of the United Nations and International Fund for Agricultural Development, 2000.
[2] Lebot V. Tropical Root and Tuber Crops: Cassava, Sweet Potato, Yams and Aroids[M]. Wallingford, UK: CABI, 2009.
[3] Ferrar P H, Walker J R L. Inhibition of diphenol oxidases: a comparative study[J]. Journal of Food Biochemistry, 1996, 20(6): 15-30.
[4] Uritani I. Biochemistry on postharvest metabolism and deterioration of some tropical tuberous crops[J]. Botanical Bulletin of Academia Sinica, 1999, 40(3): 177-183.
[5] Morante N, Sánchez T, Ceballos H, et al. Tolerance to postharvest physiological deterioration in cassava roots[J]. Crop Science, 2010, 50(4): 1 333-1 338.
[6] Sánchez T, Chávez AL, Ceballos H, et al. Reduction or delay of post-harvest physiological deterioration in cassava roots with higher carotenoid content[J]. Journal Science Food Agriculture, 2006, 86(4): 634-639.
[7] Van Oirschot, QEA, O'Brien GM, et al. The effect of pre-harvest pruning of cassava upon root deterioration and quality characteristics[J]. Journal of the Science of Food and Agriculture, 2000, 80(13): 1 866-1 873.
[8] 张振文, 许瑞丽, 叶剑秋, 等. 木薯块根生长特性研究[J]. 江西农业学报, 2009, 21(1): 10-12, 16.
[9] Indira P, Kurian T. A study on the comparative anatomy changes undergoing tuberization in roots of cassava and sweet potato[J]. Journal Root Crops, 1977, 3(1): 29-32.
[10] Fogaca C M, Finger FL, Otoni W C, et al. In vitro tuberization in genotypes of cassava[J]. Gene Conserve, 2008, 7(29): 543-549.
[11] Ravi V, Naskar S, Makeshkumar T, et al. Molecular physiology of storage root formation and development in sweet potato[Ipomoea batatas(L.)Lam.][J]. Journal of Root Crops, 2009, 35(1): 1-27.
[12] 罗兴录. 木薯块根淀粉积累过程生理生化特性研究[D]. 福州: 福建农林大学, 2003.
[13] Bomfim NN, Graciano-Ribeiro D, Nassar NMA. Genetic diversity of root anatomy in wild and cultivated Manihot species[J]. Genetics and Molecular Research, 2011, 10(2): 544-551.
[14] Peterson C A, Murrmann M, Steudle E. Location of the major barriers to water and ion movement in young roots of Zea mays L[J]. Planta, 1993, 190(1): 127-136.
[15] Rickard J E. Physiological deterioration of cassava roots[J]. Journal of the Science of Food and Agriculture, 1985, 36(3): 167-176.
[16] Suresh Iyer D, Scott M, John K F. Study of the early events leading to cassava root postharvest deterioration[J]. Tropical plant biology, 2010, 3(3): 151-165.
[17] 尹秀华, 刘 婷, 古 碧, 等. 木薯贮藏期呼吸强度及其主要品质变化[J]. 广西轻工业, 2011(4): 68-69.
[18] Beeching J R, Reilly K, Gómez-Vásquez R, et al. Postharvest physiological deterioration of cassava[M].// Nakatani M, Komaki K. 12th Symposium of the International Society for Tropical Root Crops: Potential of Root Crops for Food and Industrial Resources. Tsukuba: Cultio, 2002: 60-66.
[19] Ka′tya Karine Nery Carneiro Lins Perazzo, Anderson Carlos de Vasconcelos Conceica~o, Juliana Caribe′Pires dos Santos, et al. Properties and Antioxidant Action of Actives Cassava Starch Films Incorporated with Green Tea and Palm Oil Extracts[J]. PLOS ONE, 2014, 9(9): e105 199.
[20] 张振文, 李开绵. 木薯块根采后腐烂及贮藏方法研究进展[J]. 热带作物学报, 2012, 33(7): 1 326-1 331.
[21] 王良艳, 张有林, 张润光, 等. 1-甲基环丙烯复合焦亚硫酸钠处理对厚皮甜瓜的保鲜效果[J]. 食品科学, 2012, 33(12): 294-298.
[22] 卜智斌, 唐道邦, 徐玉娟, 等. 不同护色剂对龙眼原浆色泽和多酚含量的影响[J]. 食品科学, 2013, 34(24): 289-293.
[23] 邵远志, 李 雯. 温度、 抗坏血酸、 柠檬酸和氯化钠对采后红毛丹果实几种生理指标与品质的影响[J]. 植物生理学通讯, 2006, 42(2): 203-206.
[24] 彭永宏, 成 文, 施和平. 热水结合浸酸处理对荔枝果皮色素含量及酶活性的影响[J]. 果树科学, 1999, 16(2): 92-97.
[25] 全国粮油标准化技术委员会. GB/T5514-2008粮油检验粮食、油料中淀粉含量测定[S]. 北京: 中国标准出版社, 2008.
[26] 王 毅, 陈蕤坤, 朱勋路, 等. 不同热激处理对菊花抗氧化相关酶活性的影[J]. 北方园艺, 2010(9): 98-101.
[27] 王文举, 王振平. 外源抗氧化剂对高温胁迫下红地球葡萄果皮组织CAT、 APX和SOD酶活性的影响[J]. 中外葡萄与葡萄酒, 2013(3): 8-10.
[28] Lozano J C, Corkjh, Castanoj. New development in cassava storage[C]. // Brekelbaum T, Bellotii A, Lozano J C. Proceedings of the Cassava Protection Workshop. Cali, Colombia: CIAT Series, 1978: 135-141.
[29] Sun Q, Rost T L, Matthews M A. Pruning-induced tylose development in stems of current-year shoots of Vitis vinifera (Vitaceae)[J]. American Journal of Botany, 2006, 93(11): 1 567-1 576.
[30] Canny M J. Tylose and maintenance transpiration[J]. Annals of Botany, 1997, 80(4): 565-570.
[31] 王俊宁, 邓冬梅, 李洪波, 等. 1-MCP二次处理对番木瓜采后生理生化及贮藏品质的影响[J]. 南方农业学报, 2011, 42(7): 719-723.
[32] 林 玲, 陈金印. 壳聚糖处理对 ‘杨小-2, 6 南丰蜜桔果实采后生理及贮藏效果的影响[J]. 江西农业大学学报, 2010, 32(1): 45-50.
[33] 林 玲, 陈金印. 水杨酸处理对 ‘杨小-2, 6 南丰蜜桔果实采后生理及贮藏效果的影响[J]. 食品与发酵工业, 2009, 135(19): 194-197.
[34] 朱广慧, 唐 蓉, 邓 波, 等. 赤霉素对东方百合延缓衰老及采后生理的影响[J]. 江苏农业科学, 2011, 39(5): 385-386.
[35] 毛桂莲, 许 兴, 田 叶, 等. 外源钙对枸杞采后成熟衰老的影响研究[J]. 农业科学研究, 2011, 23(1): 35-38.
[36] 钱玉梅, 高丽萍, 张玉琼, 等. 采后预温处理对草莓果实贮藏保鲜效果的影响[J]. 生物学杂志, 2006, 23(2): 50-54.
[37] 肖红梅, 周光宏. 热处理对冷藏番茄活性氧代谢的调节[J]. 食品科学, 2004, 25(10): 331-335.
[38] 毛晓英, 吴庆智, 张 建, 等. 热处理对新疆哈密瓜采后贮藏特性的影响[J]. 食品科学, 2007, 28(12): 491-493.
[39] 陈蔚辉, 林泳丽. 微波辐射对茼蒿采后生理的影响[J]. 广东农业科学, 2011, (10): 86-88.
[40] 李 宁, 阎瑞香, 关文强. 短波紫外线处理对冬枣贮藏期生理衰老和抗病性的影响[J], 西北农业学报, 2013, 22(1): 104-108.
[41] Tseng M J, Liu C W, Yiu J C. Enhanced tolerance to sulfur dioxide and salt stress of transgenic Chinese cabbage plants expressing both superoxide dismutase and catalase in chloroplasts[J]. Plant Physiology and Biochemistry, 2007, 45(10/11): 822-833.
[42] 陈洪国, 陈 中. 硫处理技术在果蔬贮藏保鲜中的研究和应用[J]. 广东林业科技, 2001, 17(1): 45-49.
[43] Polle A. Defense against photo oxidative damage in plants. In J Scandalios, ed, Oxidative Stress and the Molecular Biology of antioxidant defenses[J]. Cold Spring Harbor Laboratory Press, 785-813.
[44] Peng L T, Jiang Y M. Effects of heat treatment on the quality of fresh-cut Chinese water chestnut[J]. International Journal of Food Science and Technology, 2004, 39: 143-148.
[45] 李英丽. 温度与光照强度对鸭梨果实抗氧化能力的影响及其机理研究[D]. 保定: 河北农业大学, 2013.
[46] 宋江峰, 刘春泉, 李大婧. 代谢组学在果蔬采后品质研究中的应用[J]. 江苏农业科学, 2015, 43(6): 253-255.
[47] 闫媛媛, 胡文忠, 姜爱丽, 等. 鲜切果蔬机械伤害刺激信号分子转导及防御反应的研究进展[J]. 食品安全质量检测学报, 2015, 6(7): 2 439-2 444.
[48] 李 磊, 牛 坤, 马 庆. 果蔬贮藏中失水的控制与涂膜[J]. 中国食品学报, 2007, 7(6): 89-86.

