紫薯花色苷的提取及抗氧化活性研究
何传波 米聪 魏好程 熊何健

摘 要 以紫薯‘济黑为原料,酸化乙醇为溶剂提取其中的花色苷成分,单因素实验探讨不同因素对提取效果的影响,并通过响应面法建立二次多项数学模型,确定紫薯花色苷最佳浸提条件为:乙醇浓度60%、浸提时间127 min、液料比18 ∶ 1,该条件下紫薯花色苷实际浸提值为2.680 mg/g。以VC作为对照,从DPPH自由基、超氧阴离子自由基(O2·- )、羟自由基(·OH)清除率及总抗氧化活性4个方面考察了紫薯花色苷的体外抗氧化能力,结果表明,紫薯花色苷粗提物对DPPH、O2·- 和·OH均有较好的清除活性,其IC50值分别为1.245、332.291和70.830 mg/L,均小于VC的IC50值,紫薯花色苷粗提物的总抗氧化能力为101.38 U/mg,具有较强的抗氧化活性。
关键词 紫薯;花色苷;提取;抗氧化活性
中图分类号 TS20 文献标识码 A
Abstract The anthocyanins were extracted from purple sweet potato‘Jiheiusing acidic ethanol as the solvent. The effects of different extracting conditions on the yield of anthocyanins were investigated in the single factor experiment. The optimal conditions of extraction obtained by response surface method(RSM)were as follows: alcohol concentration 60%, extraction time 127 min, liquid to ratio of solid 18. The actual extraction yield was 2.680 mg/g. The purple sweet potato anthocyanins exhibited obvious scavenging activities against DPPH radicals, O2·- radicals and ·OH radicals, the IC50 value respectively were 1.245, 332.291 and 70.830 mg/L. The total antioxidant capacity was 101.38 U/mg, which suggested the purple sweet potato anthocyanins having very excellent antioxidant activity.
Key words Purple sweet potato; Anthocyanins; Extraction; Antioxidant activity
doi 10.3969/j.issn.1000-2561.2016.05.022
近年来,随着一系列如“苏丹红”、“染色馒头”等涉及食品安全事件的曝光,人们的目光聚焦在了色素安全性的问题上。花色苷作为一种天然色素,广泛存在于蓝莓、葡萄等水果,紫甘蓝、紫薯等蔬菜,紫玉米、黑豆等粮食作物以及其他植物的根、茎、叶、花、果实中[1]。具有来源广泛、毒副作用小的优点,在食品添加剂领域的应用前景十分广阔,我国已经批准一些天然花色苷色素应用于果酱、腌制品、饮料、葡萄酒、冰淇淋、糖果等食品中[2]。此外,利用其生物活性功能如抗氧化、调节血脂、改善血糖水平、提高视力等也开发出了一些新型保健食品[3-4]。
紫薯(Solanum tuberdsm),又名黑紫薯、紫肉甘薯、紫心甘薯,是旋花科(Convolvulaceae)甘薯属(Ipomoe)一年生或多年生双子叶植物。紫薯的营养价值远高于普通红薯,尤其是抗癌物质碘、硒的含量比其他红薯高出20倍以上[5]。紫薯还含有丰富的花色苷色素,孙荣琴等[6]测定了7个不同紫薯品种块根中花色苷的含量,最高达到107.22 mg/100 g,远高于一般红薯。而且紫薯中的花色苷酰基化程度高[7],水溶性和稳定性良好,因此可以替代目前工业中常用的浆果类作为获取花色苷的原材料,具有很高的实际生产应用价值。
紫薯花色苷的提取方法包括溶剂提取、超声、微波辅助提取以及酶解辅助提取等方法,由于成本、设备等原因,目前工厂大多仍采用传统的溶剂浸提法,但是,由于不同的品种和产地会使得花色苷提取率有较大差异。虽然目前已有多篇甘薯花色苷提取的文献报道,但是针对其提取物自由基清除活性的报道尚不够系统。本研究以紫薯‘济黑为实验材料,在单因素实验基础上,采用响应面法对紫薯中花色苷的提取工艺进行优化,旨在改善提取工艺、降低成本,通过DPPH自由基、超氧阴离子自由基(O2·- )、羟自由基(·OH)清除率及总抗氧化能力4个方面综合考察紫薯花色苷的体外抗氧化能力,以期为紫薯花色苷的大规模工业化生产与应用提供依据。
1 材料与方法
1.1 材料
紫薯‘济黑,购于安徽,清洗去除表皮,切条冷冻干燥,粉碎过80目筛,密封保存于4 ℃冰箱。
二苯基苦味酰基苯肼(DPPH),色谱纯,美国Sigma公司;羟自由基测试盒、超氧阴离子自由基测试盒、总抗氧化能力(T-AOC)测试盒,均购于南京建成生物工程研究所;抗坏血酸、盐酸、乙醇、氯化钾、三水合乙酸钠等均为分析纯试剂,购于国药集团化学试剂有限公司。
ZD-85气浴恒温振荡器(常州市国立试验设备研究所);WK-200B高速药物粉碎机(青州市精诚机械有限公司);UV-8000紫外可见分光光度计(上海元析仪器有限公司);BS/BT电子天平(德国赛多利斯股份公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);JDG-0.2T真空冻干机(兰州科近真空冻干技术有限公司);TDL-5离心机(上海安亭科学仪器厂);Sigma 3K3D 高速冷冻离心机(德国Sigma公司); MSI微型漩涡振荡器(广州科技实验室技术有限公司);pH211台式酸度测定仪(北京哈纳科技有限公司)。
1.2 方法
1.2.1 紫薯花色苷的提取工艺 精确称取3 g紫薯冻干粉末,以酸化乙醇溶液为溶剂,于25 ℃恒温摇床(110 r/min)中浸提一定时间,离心(4 500 r/min,15 min),取上清液定容至100 mL。取浸提液分别加入一定体积的pH1.0、pH4.5缓冲液稀释一定的倍数,在700 nm和λmax处测定其吸光值,计算样品中花色苷的含量。
1.2.2 花色苷含量的测定方法 pH示差法:在不同的pH条件下,花色苷的结构会有不同的表现形式,通过紫外-可见光谱的扫描,其最大吸光值也会发生变化。当pH1.0时花色苷以有颜色的黄烊盐正离子存在,pH4.5时则以无色的半酮缩醛型存在,二者的吸光度有很大差别但结构都相对稳定[8-9]。根据下式计算样液中花色苷的浓度C(mg/L):
MW为相对分子质量;DF为样品稀释倍数;Aλmax为紫薯浸提液在最大吸收波长下的吸光度;ε为摩尔消光系数,当ε未知或样品成分未知,则将矢车菊素-3-葡萄糖苷作为标准物,此时MW=449.2,ε=26 900。
花色苷含量m(mg/g DW)按下式计算:
m=C×V/m0
其中,DW为样品为干重状态;V为浸提液体积(L);m0为样品干重时的质量(g)。
1.2.3 DPPH自由基清除率测定方法 称取20 mg的DPPH用无水乙醇溶解定容于500 mL容量瓶中。试验分为样品组、对照组和空白组。不同的样品液充分混匀,静置30 min后在517 nm处测定吸光度[10]。DPPH自由基清除率由下面计算式计算:
DPPH自由基清除率=[1-(A2-A1)/A0]×100%
式中:A0为2 mL DPPH溶液+2 mL溶剂的吸光度值;A1为2 mL乙醇+2 mL样品溶液的吸光度值;A2为2 mL DPPH溶液+2 mL样品溶液的吸光度值。
1.2.4 超氧阴离子自由基(O2·- )清除率测定方法
实验所用的试剂盒模拟机体内黄嘌呤与其氧化酶的反应系统,产生O2·- ,加入电子传递物质及gress氏显色剂后,产生紫红色,在可见光550 nm处具有特征吸收,且吸光值与O2·- 的含量成线性关系。当被测物中含有超氧阴离子自由基抑制剂时,反应体系颜色变浅,吸光值降低。
严格按照试剂盒说明操作,下列两个公式分别用来计算Vc及紫薯花色苷样液不同浓度下的O2·- 自由基清除率。
式中:Aj为测定管在550 nm下的吸光度;Ai为对照管在550 nm下的吸光度;Ab为测定空白管在550 nm下的吸光度。
1.2.5 羟自由基(·OH)清除率测定方法 实验所使用的试剂盒是根据Fenton反应所产生的·OH量与H2O2的量成正比,当给予电子受体后,用griess试剂显色,形成红色物质,其呈色与·OH的多少成正比关系。
严格按照试剂盒说明操作,计算公式同1.2.4。
1.2.6 总抗氧化能力测定方法 抗氧化物质可以使Fe3+还原成Fe2+,后者与菲啉类物质形成稳固的络合物,通过比色可测定其抗氧化能力(U/mL)的高低。
式中:Aj为测定管在520 nm下的吸光度;Ai为对照管在520 nm下的吸光度;V为反应液总体积,3.7 mL;V0为被测样液的取样体积,0.1 mL;N为样品测试前的稀释倍数。
一个总抗氧化活力单位:37 ℃时,每分钟每毫升样品使反应体系的吸光值增加0.01。
2 结果与分析
2.1 紫薯花色苷提取的单因素实验
2.1.1 乙醇浓度对花色苷提取效果的影响 鉴于花色苷具有较强的极性,且在碱性环境中的不稳定性,实验选用酸化乙醇为浸提溶剂。固定溶剂中盐酸浓度为0.1%,乙醇浓度分别为0%、20%、40%、60%、80%、95%,按15 ∶ 1(mL ∶ g)的料液比与紫薯粉混合,25 ℃浸提2 h,乙醇浓度对浸提效果的影响如图1所示。由图1可知,当乙醇浓度达到60%时,所提取的花色苷含量达到最大,随着浓度的进一步提高,其含量反而下降,可能因为花色苷属于较强极性的物质,乙醇浓度的增大引发溶液极性变弱,提取效果变差。因此,选取60%乙醇溶液作为浸提溶剂进行后续试验。
2.1.2 盐酸浓度对花色苷提取效果的影响 在60%乙醇溶液中添加盐酸,使其质量分数分别为0、0.02%、0.05%、0.10%、0.50%、0.80%,浸提结果如图2所示。根据图2的曲线趋势可知,随着酸浓度的提高,花色苷的含量逐渐增大,但是当浓度超过0.10%时,花色苷的浸出含量增加缓慢,考虑到酸含量过高可能会导致花色苷的糖苷键水解,因此选用0.10%的盐酸添加量。
2.1.3 液料比对花色苷提取效果的影响 由图3可知,原料质量不变的情况下,浸提溶液体积的增加,有利于花色苷的浸出,但超出一定范围,其含量的增加变得不太明显,而且液料比过大会导致溶剂的浪费增加实验成本同时也会增加后期实验浓缩冻干的能耗,不利于实际生产操作。鉴于上述考虑,宜选择18 ∶ 1作为浸提液料比例。
2.1.4 浸提时间对花色苷提取效果的影响 由图4可知,浸提时间的延长在一定范围内会使花色苷的浸出含量显著增加,但超过这个期限增加缓慢,而且过长的浸提时间有可能会导致其他成分的浸出,影响花色苷的纯度,同时也会延长整个实验过程,造成不必要的消耗,因此选取120 min作为浸提时间较为合适。
2.2 紫薯花色苷提取的响应面优化实验
在单因素实验基础上,固定盐酸浓度0.10%,选择对提取效果影响较大的3个因素乙醇浓度(A)、浸提时间(B)和液料比(C)为自变量,以浸提液中花色苷含量(Y)为响应值,根据响应面Box-Behnken中心组合试验设计原理,得到紫薯花色苷提取的响应面实验方案和结果如表1所示。
利用Design Expert 8.0.6软件对表1所得数据进行回归分析,以提取液中花色苷含量Y为目标函数,得到Y与A、B、C 3个因素的二次多项回归方程:
Y=2.69-0.014A+0.041B+0.02C-5.997×10-3AB+0.014AC-0.012BC-0.23A2-0.091B2-0.06C2
在该方程中,负的二次项系数表明会有极大值点的出现,可以对所建立的模型进行优化。对该模型进行方差分析,以找出对花色苷含量有显著影响的因素(表2)。由表2可见,回归模型F检验高度显著(p<0.01),模型的拟合度R2=0.998 0,表明预测值与实验值差异较小,可以较好的预测实验值。失拟项检验达到15.18,在α=0.05水平上不显著,存在6.24%的失拟可能是由噪声引起的。校正拟合度Adj R2=0.9945和预测拟合度Pred R2=0.969 8相差较小,进一步说明了该模型可以很好的模拟各因素与响应值之间的关系。
在整个模型中,AB、BC交互作用影响不显著,A和AC项影响显著,B、C、A2、B2、C2对结果有高度显著影响。由此可以判断影响紫薯花色苷浸出含量因素的主次顺序是:浸提时间(B)>液料比(C)>乙醇浓度(A)。
利用Design Expert 8.0.6软件得到的响应面图见图5。这些图可以较为直观的反映各个因素及因素交互作用对响应值的影响。一般而言,响应曲面越陡峭,响应值对外界变异的适应性越差;而等高线图越圆则说明两因素之间的交互作用越不显著,若是椭圆的话,交互作用显著。由图5可判断,在3个交互项中,AC的交互作用对响应值的影响最显著,其次为BC的交互作用,AC的交互作用对响应值影响最不显著,这与表2结果相符。
由软件确定的紫薯花色苷最优提取工艺为:乙醇浓度为59.42%,浸提时间为127.34 min,液料比为18.40 ∶ 1,提取液中的花色苷理论含量值为2.692 mg/g DW。鉴于实际操作的可行性,在验证实验中采用乙醇浓度60%,浸提时间127 min,液料比18 ∶ 1,3次重复实验平均值是2.680 mg/g DW,标准偏差0.008 3,相对标准偏差为0.003 1,说明验证实验的重复性和精密度良好。而实验平均值与模型预测值相差0.4%,具有良好的拟合性,也证实了模型的有效性。
2.3 紫薯花色苷抗氧化活性分析
2.3.1 紫薯花色苷对DPPH自由基的清除能力
紫薯花色苷浸提液经大孔吸附树脂纯化后,浓缩,冻干,得到花色苷粗品。以此为原料,配制不同浓度的紫薯花色苷溶液,进行后续的抗氧化活性实验。不同浓度的紫薯花色苷溶液及相应浓度的VC溶液对DPPH的清除能力见图6。由图6可知,在所选浓度范围内,紫薯花色苷溶液的DPPH清除能力远高于VC,且与剂量呈一定的量效关系。当花色苷浓度在0~3 mg/L时,其清除率急剧上升,之后增长缓慢,在5 mg/L时达到最大值92.26%。VC在该浓度范围内的最大清除率只有30.12%。通过对两条清除率曲线进行回归计算,得到薯花色苷和VC对DPPH清除率的IC50值分别为1.245和10.074 mg/L。
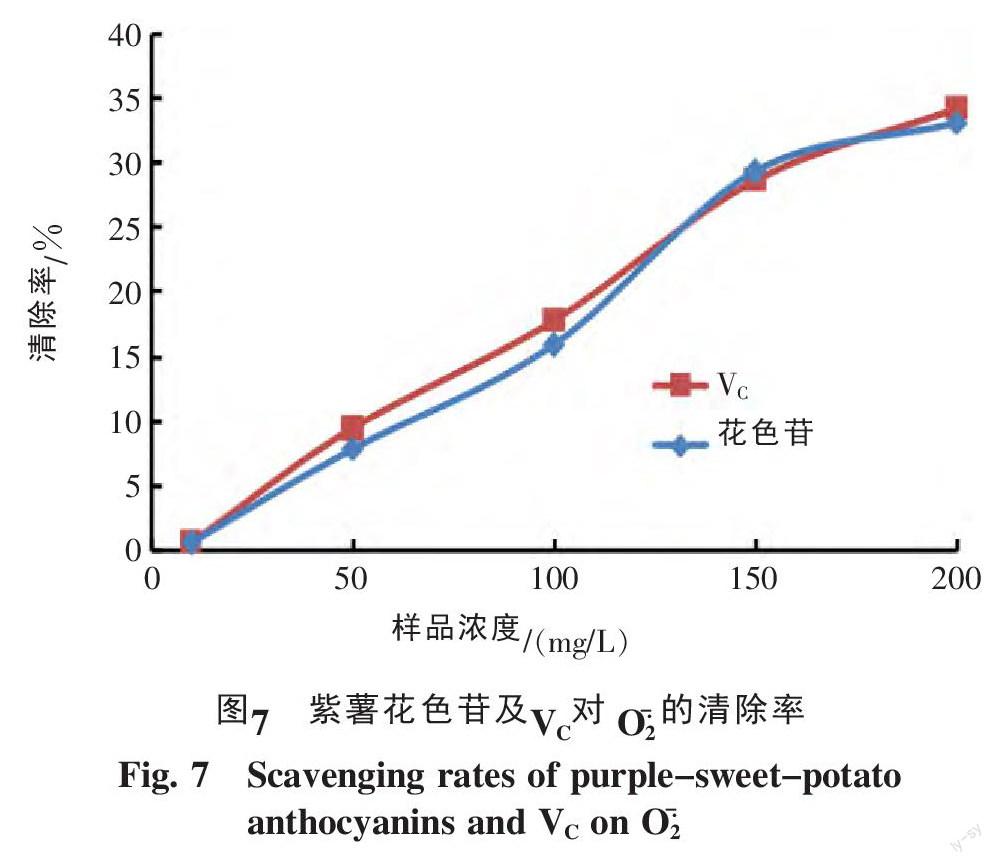
2.3.2 紫薯花色苷对超氧阴离子自由基(O2·- )清除能力 不同浓度的紫薯花色苷溶液及相应的VC溶液对O2·- 的清除能力见图7。由图7可知,紫薯花色苷与VC在选定浓度范围内对O2·- 的清除率都不是很好,最大清除率在35%左右,而且随浓度增大有逐渐增高的趋势,在实验浓度范围内,两个样品对O2·- 清除能力基本相当。计算得到的紫薯花色苷和VC对O2·- 清除率的IC50值分别是332.291 mg/L和311.621 mg/L。有文献报道,黑大豆种皮花色苷对O2·- 清除率的IC50值是40.6 mg/L[11],与其相比紫薯花色苷对O2·- 的清除率稍弱。
2.3.3 紫薯花色苷对羟自由基(·OH)的清除能力
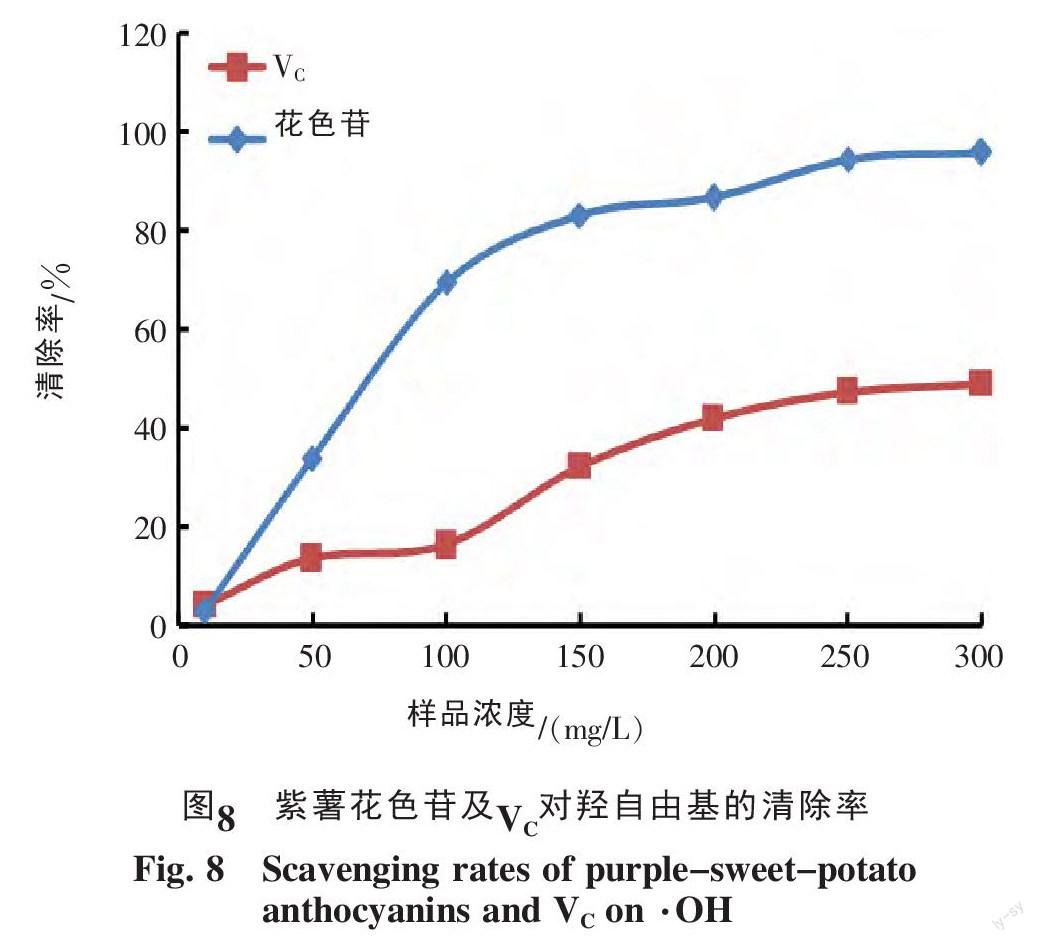
不同浓度的紫薯花色苷溶液及相应的VC溶液对·OH的清除能力如图8所示。由图8可见,紫薯花色苷的·OH清除能力明显高于相同浓度的Vc。当浓度大于200 mg/L时,清除能力基本饱和,VC的最大清除率只有49.28%,而紫薯花色苷的最大清除率达到95.86%。文献报道,浓度为200 mg/L的蓝靛果、黑豆、笃斯越橘对羟自由基的抑制率分别为88.6%、85.8%和93.4%[12],均比同浓度下紫薯花色苷的清除能力弱。计算得到的紫薯花色苷及VC对羟自由基清除率的IC50值分别为70.830和1 176.278 mg/L。
2.3.4 紫薯花色苷的总抗氧化活力 相同浓度(200 mg/L)下紫薯花色苷溶液及相应的VC溶液的总抗氧化能力见表3。由表3可知,相同浓度下紫薯花色苷总抗氧化能力强于VC,二者的平均值分别是101.38、62.20 U/mg。而3组实验的标准偏差分别是3.71、1.70,相对标准偏差为3.66%、2.74%,说明实验的重现性和精密度良好,数据有一定的有效性。
3 讨论与结论
本研究采用酸化乙醇溶剂浸提紫薯中的花色苷组分,通过单因素试验和响应面分析法得到了紫薯花色苷提取的较优条件,利用Design Expert 软件优化了提取工艺,并建立二次多项式回归模型,通过方差分析、响应面分析和验证试验表明该模型可靠,可以较准确地预测提取液中紫薯花色苷的含量。
单因素实验探讨了乙醇浓度、盐酸浓度、料液比和浸提时间对浸提效果的影响。提取液花色苷含量随乙醇浓度先增后减,推测可能是溶剂极性减弱导致,这与李颖畅[13]对蓝莓花色苷提取的研究报道相一致。由于紫薯样品中铁等金属离子含量较大, 花色苷在中性条件下与金属离子发生络合沉淀, 沉积在纤维中不利于提取。通过酸化处理才能断裂花色苷与蛋白质、多糖及本身离子间的氢键和疏水键, 及金属离子络合键, 提高提取率[14]。本实验中,紫薯花色苷含量随着盐酸浓度增加而上升。通常在一定范围内,紫薯花色苷得率会随液料比增大而增大;但当其超过一定范围,紫薯花色苷浓度平缓,可能是因为此时花色苷分子间作用力减弱,稳定性降低,导致总花色苷得率降低。
响应曲面法不仅克服了单因素忽视因素间互作关系的缺点,并且能够弥补其他一些试验不能在给出的整个区内找到因素和响应值之间明确回归方程的缺点[15]。响应面实验的方差分析判断出影响紫薯花色苷浸出含量因素的主次顺序是:浸提时间>液料比>乙醇浓度。最佳提取条件:乙醇浓度60%,盐酸浓度0.10%,浸提时间127 min,液料比18 ∶ 1。该条件下提取液中花色苷含量为2.680 mg/g。该得率明显高于施鹏飞等[16]以用柠檬酸水溶液为提取剂得到的1.59 mg/g的浸提效果,但要小于张慢等[17]以酸化乙醇为溶剂,采用酶-超声波辅助提取紫薯花青素的得率3.581 mg/g,浸提时间上也比本实验结果大大缩短,只要33 min,说明传统溶剂浸提法仍有较大的提升空间。
生物体中自由基导致的氧化作用会引发一系列的疾病如癌症、冠心病、风湿性关节炎等[18-20]。近些年来,已经有许多关于各种来源的花色苷抗氧化功能的报道。江岩等[21]的研究结果表明,药桑葚花色苷对于超氧阴离子清除率、DPPH自由基清除率均高于VC和芦丁。本研究以VC作为对照,主要从DPPH自由基、超氧阴离子自由基(O2·- )、羟自由基(·OH)清除率及总抗氧化活力4个方面来评价紫薯花色苷的体外抗氧化能力。结果表明:紫薯花色苷具有较强的抗氧化活性,体外抗氧化能力高于同浓度下的VC,其对DPPH·、O2·- 和·OH均有较好的清除活性,IC50值分别为1.245、332.291和70.830 mg/L,紫薯花色苷粗提物的总抗氧化能力为101.38 U/mg。罗春丽等[22]报道,紫薯花青素对·OH清除率可达91.93%,对O2·- 的清除率为47.25%。田喜强等[23]的研究结果表明0.1 mg/mL的花青素清除羟基自由基达到50%,且低浓度下花青素清除羟基自由基的效率明显优于抗坏血酸。陈小婕等[24]的研究也表明,紫薯花色苷的清除O2·- 能力高于VC和VE,花色苷的总抗氧化能力略低于VC,但明显高于VE。这都说明了紫薯花色苷具有良好的体外抗氧化效果,是一种值得研究开发的功能因子。
参考文献
[1] Duen A S, Perez-alonso J J, Santos-buelga C, et al. Anthocyanin composition in fig[J]. Journal of Food Composition and Analysis, 2008, 21(2): 107-115.
[2] 中华人民共和国卫生部. GB 2760-2011食品添加剂使用标准[S]. 北京: 中国标准出版社, 2011.
[3] 杨 巍, 黄洁琼, 陈 英, 等. 紫薯的营养价值与产品开发[J]. 农产品加工·学刊, 2011(8): 41-43.
[4] 陈梅香, 魏俊杰, 贾春凤. 紫薯的营养保健功能及发展趋势[J]. 食品研究与开发, 2012, 33(8): 199-201.
[5] 孙金辉, 王 微, 董 楠. 紫薯花色苷的研究进展[J]. 粮食与饲料工业, 2011(1): 38-44.
[6] 孙荣琴, 郭华春. 七个紫甘薯品种块根花色苷含量的比较[J]. 作物杂志, 2008(6): 56-59.
[7] Goda Y, Shimizu T, KatoY, et al. Two acylated anthocyanins from purple sweet potato[J]. Phytochemistry, 1997, 44(1): 183-186.
[8] Sukwattanasinit T, Burana-Osot J, Sotanaphun U. Spectrophotometric method for quantitative determination of total anthocyanins and quality characteristics of roselle[J]. Planta Medica, 2007, 73(14): 1 517-1 522.
[9] Lee J, Durst R W, Wrolstad R E. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: collaborative study[J]. Journal of AOAC International, 2005, 88(5): 1 269-1 278.
[10] Om P S, Tej K B. DPPH antioxidant assay revisited[J]. Food Chemistry, 2008, 113(4): 1 202-1 205.
[11] 徐金瑞, 张名位, 刘兴华, 等. 黑大豆种皮花色苷的提取及其抗氧化作用研究[J]. 农业工程学报, 2005, 21(8): 161-164.
[12] 田 福. 三种野生浆果花色苷的提取、纯化及抗氧化活性研究[D]. 哈尔滨: 东北林业大学, 2008.
[13] 李颖畅. 蓝莓花色苷提取纯化及生理功能研究[D]. 沈阳: 沈阳农业大学, 2008.
[14] 陈炼红, 伍 红, 李明珠. 紫薯花青素提取工艺优化研究[J]. 西南民族大学学报: 自然科学版, 2012, 38(3): 396-400.
[15] 孟蕲翾, 吴友根, 崔孟媛, 等. 响应曲面法优化超声波辅助提取诺丽果多酚工艺研究[J]. 热带作物学报, 2015, 36(9): 1 672-1 679.
[16] 施鹏飞, 肖海峻, 罗红霞, 等. 响应面分析法优化紫薯花青素提取工艺[J]. 食品工业科技, 2014, 35(20): 322-326.
[17] 张 慢, 潘丽军, 姜绍通, 等. 响应面法优化酶-超声波辅助同步提取紫薯花青素工艺[J]. 食品科学, 2014, 35(10): 23-28.
[18] Marnett L J. Oxyradicals and DNA damage[J]. Carcinogenesis, 2000, 21(1): 361-370.
[19] Zhao J, Lahiri C M, Sharma Y, et al. Inhibitory effect of a flavonoid antioxidant silymarin on benzoyl peroxide-induced tumor promotion,oxidative stress and inflammatory responses in sencar mouse skin[J]. Carcinogenesis, 2000, 21(3): 811-816.
[20] Stanner S, Hughes J, Kelly C, et al. A review of the epidemiological evidence for the antioxidant hypothesis[J]. Public Health Nutrition, 2004, 7(3): 407-422.
[21] 江 岩, 郑 力, 克热木江·吐尔逊江. 药桑葚花色苷的体外抗氧化作用[J]. 食品科学, 2011, 32(13): 45-48.
[22] 罗春丽, 王 林, 李 杏, 等. 紫薯花青素体外抗氧化及对H2O2诱导HepG2细胞损伤的保护作用[J]. 食品科学, 2015, 36(17): 225-230.
[23] 田喜强, 董艳萍. 超声波辅助提取紫薯花青素及抗氧化性研究[J]. 中国酿造, 2014, 33(1): 77-80.
[24] 陈小婕, 曾画艳, 张晓娇, 等. 紫薯花色苷提取的响应曲面优化及抗氧化作用[J]. 食品科技, 2013, 38(9): 179-184.

