钙负荷诱导骨骼肌细胞收缩的实验模型建立
曾玮娓 刘红星 唐晖
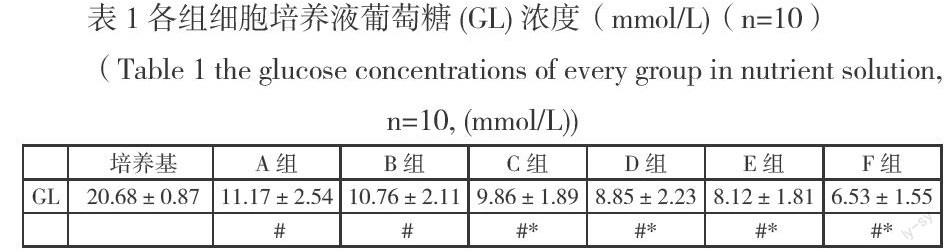
【摘要】:目的:建立骨骼肌细胞收缩模型。方法:以C2C12细胞株为实验对象,以不同浓度钙负荷(0uM、10uM、25uM、50uM、75uM、100uM)为刺激条件,通过电镜观察和检测培养液葡萄糖浓度来确定骨骼肌细胞收缩。结果: 不同浓度钙负荷诱导骨骼肌细胞收缩的程度不同。与A组(0uM,不加钙)相比,B(10uM)组的葡萄糖浓度没有显著性差异(P>0.05),C(25uM)、D(50uM)、E(75uM)、F(100uM)组均显著降低(P<0.05),显微镜观察也发现B组出现轻度收缩反应,C组出现较明显收缩反应,D、E组出现明显收缩反应,F组出现较强收缩反应。结论:100uM钙符负荷可引起明顯的骨骼肌收缩反应,因此可以此浓度建立钙负荷诱导骨骼肌细胞收缩模型。
【关键词】:钙负荷;骨骼肌细胞;收缩;模型
骨骼肌收缩是运动的基础和前提。然而,运动人体科学工作者在研究人体对运动的反应和适应规律时,绝大部分都是处于在体状态。人们很难从根本上研究骨骼肌在收缩时的机能变化情况。因此,建立骨骼肌细胞收缩模型就成为运动人体科学亟待解决的问题之一。
自从1997年Thelen[1]等人首先报到采用低频电刺激诱导培养的肌管收缩以来,国内外已有较多的文献也利用此方式进行各自的研究[2-5]。然而,这种刺激方式并不太符合肌肉收缩的规律。众所周知,人体的骨骼肌收缩是神经兴奋传到神经肌肉接头,通过化学递质将兴奋传到肌细胞,引起肌浆网钙离子释放,最终导致肌肉收缩。并且,较多的研究表明,细胞内外的钙例子稳态对于肌细胞的机能具有重要的影响[6-8]。因此,本课题组拟建立外源性钙负荷导致骨骼肌细胞收缩的模型,从另一个角度诱导肌细胞收缩,为人们能够更加深刻地认识骨骼肌收缩的机能变化奠定基础。
1 材料与方法
C2C12小鼠成肌细胞系购自湖南远泰生物技术有限公司。培养基为DMEM高糖培养基(Invitrogen,Carlsbad,CA),并加入10%胎牛血清(Sigma-Aldrich, St.louis, MO)和抗生素(100U/ml青霉素和0.1mg/ml链霉素)。37℃下置于5%CO2培养箱中。待细胞融合至80%时,用0.25%胰酶消化传代后接种(细胞密度5 ×l04)于培养瓶或孔板,待细胞融合至约70%后用于正式实验。
1.2 实验分组
根据各组细胞培养液中的钙离子浓度不同(氯化钙溶液),分为对照组,A组(0uM,不加钙)和实验组B组(10uM)、C组(25uM)、D组(50uM)、E组(75uM)和F组(100uM)。每组十个培养瓶。
1.1 细胞培养
项目资助:由湖南省教育厅青年项目(编号:13B025)资助。
1.3 培养液中葡萄糖浓度测定
采用葡萄糖氧化酶-过氧化物酶法。24h前后测定培养液葡萄糖浓度。
1.4 显微镜观察
加入外源性钙,细胞收缩反应很快,照相时间如下:加钙之前拍照,固定该细胞视野不变,加钙后约5秒左右拍照,此时即可看到细胞收缩反应出现,实验组加入不同浓度钙,对照组加入的是蒸馏水,也是参照加钙的拍照时间,加入蒸馏水5秒后拍照即可,每组均采集1套图片。
1.5 统计学分析
采用Sigmaplot12.3软件进行分析。实验结果以“平均值±标准差”表示。组间差异采用单因素方差分析。显著性水平为0.05。
2.结果与分析
2.1 各组细胞培养液葡萄糖浓度(mmol/L)
2.2 显微镜观察
通过实验得出:A组没有出现收缩反应,B组出现轻度收缩反应,C组出现较明显收缩反应,D、E组出现明显收缩反应,F组出现较强收缩反应。
3.讨论
运动生理学的主要任务是探讨急性运动对人体的适应和慢性运动(训练)对人体的适应规律。作为运动器官,骨骼肌在运动时的机能变化就成为首先要解决的问题之一。但是在整体状况下,机能功能的改变很难分清是骨骼肌的影响,还是其他器官的作用。因此,骨骼肌细胞的收缩模型的建立就成为运动人体科学亟待解决的问题之一。
目前,采用低频电刺激诱导培养的骨骼肌细胞收缩是最主要的方式[1-5]。本文根据肌肉收缩触发的关键因素是钙离子和肌钙蛋白结合的原理,考虑从钙负荷的角度来诱导骨骼肌收缩。下面首先阐述建立该模型的理论考虑和依据。
Ca2+是细胞内最普通而且重要的信号转导成分之一。静息状态下,细胞内游离的Ca2+约为细胞外的1/200000。细胞在激动时,细胞内游离的Ca2+呈双相升高,其来源为内储的Ca2+释放和胞外Ca2+内流[9]。在体状态下,骨骼肌收缩的激发主要是由于内质网Ca2+的释放,而心肌细胞的收缩则在很大程度上依赖于胞外Ca2+的内流。本课题组采用的外源性钙负荷诱导骨骼肌细胞收缩虽然和在体状态时不太一样,但是当Ca2+和肌钙蛋白结合后,后面的机能变化应该不会有什么差异。而之所以这么考虑,是因为外源性钙负荷比较简单,而要触发内质网Ca2+释放则比较麻烦,其控制性也较差。
在肌细胞中,胞外Ca2+内流主要依赖电压依赖性钙离子通道(Voltage dependent calcium channel, VDCC),目前钙通道分为6型,骨骼肌细胞中主要的是L型,其特点是激活后,开放时间长,失活慢。VDCC的激活由诸如环核苷酸、脂类衍生物或Ca2+本身等介质所调节,这些介质或者使Ca2+通道由静息状态转化为活化状态,或者在接受兴奋性电刺激后调整Ca2+通道的活性[10-11]。除了VDCC以外,钙池耗竭依赖性钙离子内流(store-depletion dependent calcium channel, SDDCC)也是胞外钙离子内流的途径之一,通常所说的受体介导钙离子内流属于这种类型。该通道引起的钙离子内流是通过钙池耗竭而诱发的,在质膜Ca2+内流通道与内质网耗竭的钙池间有某种信号联系起来。
因此,从理论上来说,外源性钙负荷很有可能通过Ca2+本身而触发VDCC,从而诱发培养的骨骼肌细胞收缩。当然,这仅是理论上的假设。本课题组对建立外源性钙负荷诱导骨骼肌细胞收缩模型的后续工作之一就是探讨外源性钙负荷时骨骼肌细胞的Ca2+信号通道。
本文的研究结果表明,100uM钙负荷时,培养肌细胞出现较强的收缩反应,同时,与对照组相比,24h后,培养液葡萄糖浓度显著降低。这又从另一个方面证明100uM钙负荷确实导致培养的骨骼肌细胞收缩了。因为骨骼肌收缩比安静时需要更多的能量。因此,综合显微镜观察和葡萄糖浓度检测的结果,本课题组可以确定该模型的建立。遗憾的是,本文没有检测此时的钙离子信号通道的变化情况,这需要下一步的实验去验证。
4 结论
100uM钙负荷可以诱导骨骼肌细胞出现较强的收缩反应。通过显微镜观察和葡萄糖浓度检测结果表明,本文通过外源性钙负荷诱导骨骼肌收缩模型的建立是成功的。
参考文献:
[1]THELEN M H, SIMONIDES W S, VAN HARDEVELD C. Electrical stimulation of C2C12 myotubes induces contractions and represses thyroid-hormone-dependent transcription of the fast-type sarcoplasmic-reticulum Ca2+-ATPase gene[J]. Biochem J, 1997, 321 ( Pt 3):845-848.
[2] MAROTTA M, BRAGOS R, GOMEZ-FOIX A M. Design and performance of an electrical stimulator for long-term contraction of cultured muscle cells[J]. Biotechniques, 2004, 36(1):68-73.
[3]TAKAYAMA Y, WAGATSUMA A, HOSHINO T, et al. Simple micropatterning method for enhancing fusion efficiency and responsiveness to electrical stimulation of C2C12 myotubes[J]. Biotechnol Prog, 2015, 31(1):220-225.
[4]邱国荣, 徐晓阳, 謝敏豪. 电刺激引起C2C12肌管IL-6蛋白及IL-6 GLUT4基因表达的变化[J]. 中国运动医学杂志, 2012, 31(9): 806-810.
[5]欧娜, 刘刚, 姜帆, 等. 慢性电刺激对成肌分化的C2C12细胞肌型转换的影响[J]. 第三军医大学学报, 2012, 34(8): 710-714.
[6]TOTH A, FODOR J, VINCZE J, et al. The Effect of SERCA1b Silencing on the Differentiation and Calcium Homeostasis of C2C12 Skeletal Muscle Cells[J]. PLoS One, 2015, 10(4):e0123583.

