阿扎霉素F5a抗南方根结线虫和香蕉枯萎病菌活性研究
罗少娥 解修超 曾庆飞 雒丹丹 申张鹏
摘 要 为寻找抗线虫和香蕉枯萎病菌的天然产物。从链霉菌211726的发酵液中分离纯化出阿扎霉素F5a,以南方根结线虫(Meloidogyne incognita)为供试线虫,采用击倒实验,测定阿扎霉素F5a高(1.0%)、中(0.1%)、低(0.01%)3个浓度的抗线虫活性;同时以尖孢镰刀菌(Fusarium oxysporum f. sp. cubense)为供试菌株,采用牛津杯琼脂平板法,对阿扎霉素F5a的抗香蕉枯萎病活性进行研究。结果表明:1.0%的阿扎霉素F5a溶液在24 h内对供试线虫2龄幼虫的平均校正击倒率和平均校正死亡率分别为86.1%和84.5%;0.01%的阿扎霉素F5a溶液对供试线虫2龄幼虫平均校正击倒率和平均校正死亡率分别为57.2%和54.7%,20 mg/mL的阿扎霉素F5a对尖孢镰刀菌的抑菌圈直径为2.93 cm。说明阿扎霉素F5a对南方根结线虫2龄幼虫(J2)具有显著的毒杀作用,同时对香蕉枯萎病菌具有显著抑制作用,显示阿扎霉素F5a在生物农药方面具有良好的研究和开发价值。
关键词 阿扎霉素F5a ;根结线虫 ;香蕉枯萎病 ;尖孢镰刀菌
分类号 S432.4 Doi:10.12008/j.issn.1009-2196.2016.03.008
Abstract To find the natural products with resistance to banana wilt and nematode. Azalomycin F5a was isolated and purified from the fermentation broth of Streptomyces sp. 211726. Meloidogyne incognita were used as the tested nematodes, using knockout experiments to measure azalomycin F5a with resistance to Meloidogyne incognita at three concentrations of high (1.0%), medium (0.1%), low (0.01%); while against a reference strain Fusarium oxysporum f. sp. cubense and the Oxford Cup agar method were conducted to study the anti-banana fusarium wilt activity of azalomycin F5a. In 24 h, the average revised knock-down rate and the average corrected mortality rate of 1% bioactive substances water solution with activity against J2 were 86.1% and 84.5%, while the average revised knock-down rate and the average corrected mortality rate of 0.01% bioactive substances water solution still reached 57.2% and 54.7%. The inhibition zone diameter of 20 mg/mL of azalomycin F5a against Fusarium is 2.93 cm; The result indicated that azalomycin F5a has significant toxicity against 2nd instar larval (J2) survival of Meloidogyne incognita, while has a significant antagonistic effect against the banana fusarium wilt disease. These results demonstrated azalomycin F5a has shown good price in the research and development of biological pesticides.
Keywords Azalomycin F5a ; Meloidogyne ; banana fusarium wilt ; Fusarium oxysporum
根结线虫属于侧尾腺口纲(Secernentea)垫刃目(Tylenchida)异皮总科(Heteroderidae)根结线虫属(Meloidogyne)。根结线虫病主要由南方根结线虫(M. incognita)、花生根结线虫(M. arenaria)、爪哇根结线虫(M. javanica)、象耳豆根结线虫(M. enterolobii)和北方根结线虫(M. hapla)造成。它是一类固定型内寄生病原线虫,在世界范围内广泛分布,可以寄生 2 000多种植物[1]。南方根结线虫是能够引起严重植物病害的重要病原线虫之一,可以寄生单子叶和双子叶植物,寄主范围广泛,在世界各地均有分布,是热带、亚热带和温带地区最重要的植物病原线虫[2]。根结线虫病目前尚缺乏有效的防治办法,其防治已成为世界性难题。目前应用较多的还是化学防治。但化学防治存在毒性大,对环境不友好等问题,所以根结线虫的生物防治是目前重点关注的方向之一。
香蕉枯萎病又名香蕉巴拿马病、黄叶病,其病原菌为尖孢镰刀菌(Fusarium oxysporum f. sp. cubense),在世界各地都有发生,是香蕉生产中的一种毁灭性病害,摧毁了全世界近万公顷的蕉园[3]。目前尚无有效防治香蕉枯萎病的化学药剂,采用种植抗病品种、与水生作物轮作和生物防治是当前防治香蕉枯萎病比较有效的途径。其中,生物防治日益受到重视,国内外关于香蕉枯萎病的生物防治主要集中在香蕉枯萎病拮抗菌的筛选及室内防治上,而筛选到具有抗香蕉枯萎病的化合物很少报道。
阿扎霉素F5a为多种链霉菌所产的代谢产物,属于大环内酯类化合物,具有广谱的抗菌作用,包括多种真菌、细菌,其中含有耐甲氧西林金黄色葡萄球菌等耐药性菌株,同时对人结肠肿瘤细胞HCT-116有中等毒性[4-5]。本研究从链霉菌211726发酵液中分离纯化出阿扎霉素F5a[5],对阿扎霉素F5a抗南方根结线虫和香蕉枯萎病菌活性进行研究,以期发现该类农作物病害的生物防治新药物。
1 材料与方法
1.1 材料
1.1.1 供试材料及培养基
链霉菌211726 (Streptomyces sp.211726),由江西农业大学生物科学与工程学院袁干军博士课题组提供;香蕉枯萎病病原菌尖孢镰刀菌(Fusarium oxysporum f. sp. cubense),由中国热带农业科学院环境与植物保护研究所提供。供试线虫,纯种的南方根结线虫(M. incognita)经温室盆栽保存。
YE培养基[5]:酵母粉4 g,麦芽浸膏粉10 g,葡萄糖4 g,氯化钠3 g,去离子水1 000 mL,起始pH 7.2~7.4;
发酵培养基[5]:葡萄糖10 g、可溶性淀粉35 g、酵母粉2 g、干酪素4 g,氯化钠18 g,去离子水1 000 mL,起始pH 7.2。
1.1.2 仪器与设备
C18填料(大曹DAISOGEL ODS反相填料);硅胶薄层层析板GF254,硅胶200-300目(青岛海洋化工);甲醇和乙腈,色谱纯;其它试剂为国产分析纯。手提式压力蒸汽灭菌器XFS280(浙江新丰医疗器械有限公司);pHS-3C酸度计(彭州市中亚嘉华电器厂);桌上式(垂直送风)超净工作台VD-850型[1](苏州智净净化设备有限公司);高效液相色谱仪(岛津LC-10AD型);RE-201C 旋转蒸发仪(巩义市英峪予华仪器厂);SCIENTZ-10N冷冻干燥机(宁波新芝生物科技股份有限公司);恒温培养振荡器(上海智城分析仪器制造有限公司)。
1.2 方法
1.2.1 试验设计
1.2.1 .1 色谱条件
色谱柱:依利特SinoChrom ODS-BP (4.6 mm×250 mm,5 μm):流动相:乙腈-0.05 mol/L pH 7.2的磷酸缓冲液(60∶40,体积比);流速:0.8 mL/min;检测波长:223 nm;进样量:20 μL;柱温:室温。
阿扎霉素F5a保留时间为6.5 min,计算含量方法:归一化法。
1.2.1.2 种子培养
将菌株链霉菌211726用YE琼脂平板活化,接种于装有400 mL YE培养基的2 000 mL三角瓶中,于30℃下,190 r/min的摇床上培养3~4 d,作为种子液。
1.2.1.3 发酵
将种子液以15%的接种量,接种到含有l L培养基的5 L锥形瓶中,在30℃下,190 r/min的摇床上摇瓶培养,发酵11 d时收获发酵液。
1.2.1.4 化合物的分离纯化
链霉菌211726的发酵液,加入4倍体积的90%甲醇,室温浸提3次,每次4 h,得提取液。减压浓缩至不含甲醇,冻干,得冻干粉。取冻干粉100 g,上硅胶柱,依次用氯仿:甲醇溶剂系统(100∶0,90∶10,80∶20,75∶25,0∶100)洗脱,经HPLC(高效液相色谱)检测,合并得目标产物组分,将该部分减压浓缩,取5 g用80%甲醇溶解,上反相C18柱层析,先用20%的甲醇洗下极性大的杂质,再用70%的甲醇进行洗脱,洗脱速度为1~2滴/s,分管收集洗脱液,经HPLC检测,将目标化合物纯度大于95%的洗脱液合并。减压浓缩至不含甲醇,冻干得供试样品。
1.2.1.5 供试溶液的制备
将经鉴定为纯种的南方根结线虫的单块卵囊孵化出2龄幼虫(J2)水溶液,接种于用灭菌土培育的盆栽番茄苗根部,在温度为25℃~28℃的温室内繁殖保存。需要靶标线虫时,从感染根部挑取新鲜卵囊,用0.4%NaClO消毒3 min,再用无菌水清洗3次后置于浅盘滤纸上恒温遮光孵化,制备2龄幼虫液,每隔24 h换水1次,保证每次选用的2龄幼虫新鲜且活力一致。
尖孢镰刀菌测试用培养基为PDA培养基,取马铃薯200 g煮沸30 min,4层纱布过滤,向滤液中加入葡萄糖20 g,琼脂20 g,加水至1 000 mL。
抗线虫测试用供试品溶液的制备:用无菌水将阿扎霉素F5a分别配制成浓度为1.0%、0.1%、0.01%的混悬水溶液,pH 7.0~8.0。
抗香蕉枯萎病菌测试用供试品溶液的制备:精密称取适量阿扎霉素F5a样品,溶于二甲基亚砜,定容,混匀,配制成浓度为20 mg/mL的供试品溶液。
1.2.2 项目测定
1.2.2.1 抗根结线虫活性测定
取0.2 mL(约200条J2)的南方根结线虫液于24孔细胞培养板中,将配制成的1.0%、0.1%和0.01%阿扎霉素F5a水溶液,各取1 mL加入盛有线虫液的培养孔内,混匀。每个化合物浓度为1个处理,每个处理做3次重复,并设立无菌水处理作为对照。在25~28℃静置24 h后于倒置显微镜下观察,僵直不动的虫体视作被击倒,计算校正击倒率;将被击倒的线虫吸入清水中24 h后镜检,不能复活的算作死亡,计算线虫校正死亡率。试验结果的计算方法如下:
击倒率(%)=(击倒线虫数/处理线虫数)×100
校正击倒率(%)=[(处理击倒率-对照击倒率)/(1-对照击倒率)]×100
死亡率(%)=(死亡线虫数/处理线虫数)×100
校正死亡率(%)=[(处理死亡率-对照死亡率)/(1-对照死亡率)]×100
1.2.2.2 抗香蕉枯萎病菌活性测定
将活化的香蕉枯萎病菌孢子悬液(孢子浓度为1.0×107 CFU/mL)100 μL加入冷却至50℃左右的15 mL PDA培养基中轻轻摇动,待培养基冷却后在培养基中央放置一无菌的牛津杯,再将100 μL化合物溶液注入牛津杯中,以100 μL二甲基亚砜做对照,重复3次,28℃培养3 d观察并测量化合物的抑菌圈直径大小。
1.2.3 数据分析及处理
采用excel进行数据处理,SPSS软件进行均值和方差计算,邓肯氏新复极差法进行多重比较。
2 结果与分析
2.1 阿扎霉素F5a的发酵与分离制备
菌株链霉菌211726的发酵液经过浸提分离纯化后,所得的供试样品阿扎霉素F5a通过HPLC检测,采用归一化法,计算其纯度为96.8%。
2.2 阿扎霉素F5a抗根结线虫的活性
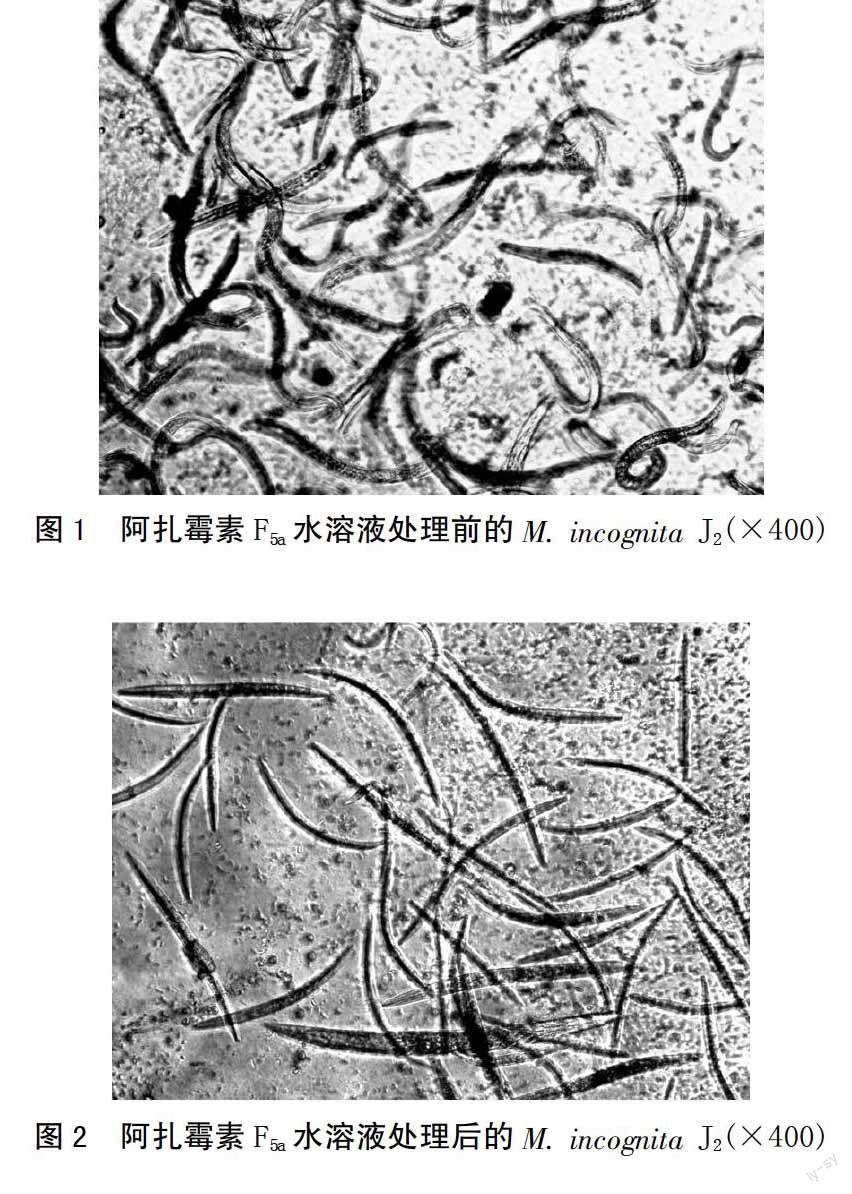
阿扎霉素F5a水溶液处理M. incognita J2 24 h后,存活状态发生了很大变化。由图1可知,靶标线虫液处理前可观察到J2线虫弯曲能动;由图2可知,靶标线虫液处理24 h后,J2线虫僵直不动。
由此表明,阿扎霉素F5a水溶液对M. incognita J2具显著的毒杀效果,且不同浓度其毒杀效果程度不同(表1)。随着阿扎霉素F5a水溶液浓度的提高,其毒杀效果增强。在24 h内,处理浓度为1.0%的阿扎霉素F5a水溶液的平均校正击倒率和平均校正死亡率分别为86.1%和84.5%,处理浓度为0.01%的阿扎霉素F5a水溶液的平均校正击倒率和平均校正死亡率都在50%以上,这说明阿扎霉素F5a具有较强的杀线虫活性。
2.3 阿扎霉素F5a抗香蕉枯萎病活性
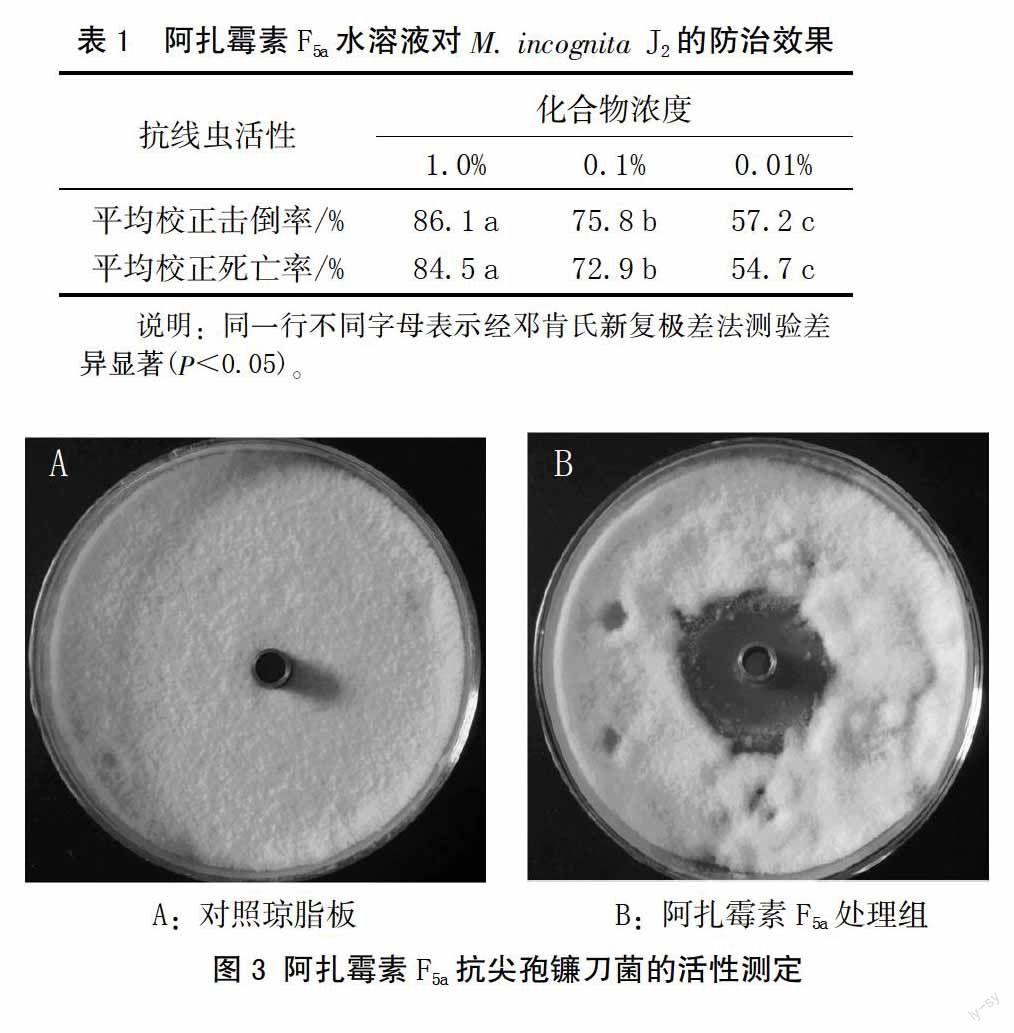
20 mg/mL的阿扎霉素F5a抗尖孢镰刀菌的活性测定结果如图3,其抑菌圈直径为(2.93±0.04)cm。由此表明,阿扎霉素F5a具有显著的抗尖孢镰刀菌活性,显示其抗香蕉枯萎病病的潜在前景。
3 讨论
根结线虫病已经严重地影响到了国民经济的发展。近年来,国内外也非常重视寻找合适的高效防治方法,有报道通过化学药剂来控制根结线虫危害,其中有吕和平等[6]研究4种无机盐对南方根结线虫卵囊、卵孵化及其幼虫存活的影响,收到了一定的效果。也有报道从植物中来寻找解决的途径,银胶菊叶和花提取物、草酸、巴豆酸等植物源物质对其均有较好的控制作用[7-8],其中迟玉成等[9]利用蓖麻叶水提取液对花生根结线虫的防治也收到一定效果。国外也有不少学者从植物中提取成分来防治南方根结线虫病害,Satoshi Taba等[10]报道了用乙醇和水从野生植物中提取的活性物质对J2的生存活力及流动性具有一定的影响。报道从微生物方面来寻找防治方法的研究主要集中在微生物发酵液方面,其中王波等[11]利用淡紫拟青霉孢子液和放线菌发酵上清液组合复配菌剂处理对根结线虫的卵孵化制率和二龄幼虫杀死率分别可达到66.6%和78.0%;李玲玉等[12]发现,放线菌Snea 253活性物质对南方根结线虫卵孵化的相对抑制率为84.95%;唐佳频等[13]发现,恶臭假单胞菌可以分泌某些活性成分直接抗南方根结线虫;焦俊等[14]发现,4株木霉发酵滤液均能显著降低南方根结线虫卵的孵化和2龄幼虫(J2)的活性。本研究通过从吸水链霉菌中分离出的菌株,经过发酵获得阿扎霉素F5a,对其进行活性测定,发现其具有显著的抗根结线虫活性,为防治根结线虫提供新药物,为进一步在微生物发酵产物方面寻找防治途径提供指导。
香蕉枯萎病的生物防治是近年来的研究热点。其中刘昌燕等[15]通过对峙试验测定表明3株拮抗菌对香蕉枯萎病病原菌都有显著抑制作用,对峙培养7 d,抑制率均在55%以上。徐刚等[16]从土壤中筛选出4株对香蕉枯萎病具有高效拮抗作用的细菌,且当4种拮抗菌发酵滤液浓度达到70%时,其在高度抑制水平上的抑制率分别为46%、57%和50%。Monteiro等[17]发现迷迭香,百里香,锡兰肉桂和丁香的植物提取物和挥发性精油在不同的浓度对英美香蕉枯萎病病原菌的菌丝生长、孢子萌发均有抑制作用,可以有效地避免枯萎病菌的传播。刘小玉等[18]从土壤的分离和筛选出链霉菌菌株1-g-59,盆栽试验结果表明,菌株1-g-59发酵液对香蕉枯萎病具有较强的防治作用,防治效果达64.9%。孙建波等[19]从香蕉根部土样中分离到枯萎病拮抗芽孢杆菌XY-10,拮抗试验表明,菌株XY-10不同浓度的发酵滤液均可抑制病原菌孢子萌发和生长。Cubense Jun Yuan等[20]发现,解淀粉芽孢杆菌NJN-6产生的挥发性化合物可以抑制枯萎病菌的生长和孢子萌发。R.Akila等[21]发现,植物制剂和生物防治剂的联合应用可以非常有效地降低香蕉枯萎病的发病率。俞鲁等[22]从香蕉根际土壤中分离筛选出芽孢杆菌属拮抗菌株YL-19,用YL-19二次发酵的生物有机肥对香蕉枯萎病的防治效果达到74%,且对香蕉苗有明显的促生效果。生物防治相比于抗病品种的选育,具有省时、资金花费少等优点;与化学防治相比,又具有绿色环保的优势。吸水链霉菌发酵产生的阿扎霉素F5a具有显著的抗尖孢镰刀菌活性,本研究结果对香蕉种植过程中香蕉枯萎病生物防治的选择,提供了一个理论数据和实践指导。
本研究利用链霉菌211726发酵,并分离纯化出阿扎霉素F5a,发现其对南方根结线虫2龄幼虫(J2)具有显著的毒杀作用,同时对香蕉枯萎病病原菌具有显著拮抗作用,显示阿扎霉素F5a在生物农药方面具有良好的研究和开发价值,可应用于实际生防药剂。
致 谢 本研究得到江西农业大学生物科学与工程学院袁干军博士,武汉大学药学院洪葵教授的帮助与指导,谨致谢意。
参考文献
[1] Mulet K, Fargette M, Richaud M, et al. Isolation of microsatellites from an enriched genomic library of the plant-parasitic nematode Meloidogyne incognita and their detection in other root-knot nematode species[J]. European Journal of Plant Pathology, 2011, 129(4): 501-505.
[2] 段玉玺.植物线虫学[M]. 北京:科学出版社,2011:140-144.
[3] 孙嘉曼,韦 弟,覃柳燕,等. 高通量测序技术在香蕉抗枯萎病研究中的应用[J]. 南方农业学报,2014,45(11):1 921-1 925.
[4] 袁干军,李沛波,陈善军,等. 阿扎霉素F3个主要成分的抗耐甲氧西林金黄色葡萄球菌活性研究[J]. 中国药学杂志,2014(8):644-648.
[5] Ganjun Yuan, Haipeng Lin, Cheng Wang, et al. 1H and 13C assignments of two new macrocyclic lactones isolated from Streptomyces sp.211726 and revised assignments of Azalomycins F3a, F4a and F5a[J]. Magnetic Resonance in Chemistry, 2011(1): 30-37.
[6] 吕和平,漆永红,曹素芳,等. 四种无机盐对南方根结线虫卵囊、卵孵化及其幼虫存活的影响[J]. 植物保护学报,2012,39(5):449-455.
[7] 苏秀荣,谢 宁,张纪龙,等. 银胶菊叶和花提取物对南方根结线虫的毒杀活性比较[J]. 植物资源与环境学报,2012,21(1):77-82.
[8] 刘丹丹,段玉玺,陈立杰,等. 6种植物源化合物对南方根结线虫的毒性和温室防效研究[J]. 河南农业科学,2011,40(5):111-113.
[9] 迟玉成,徐曼琳,牟 山,等. 蓖麻叶水提取液对花生根结线虫的防治作用研究[J]. 花生学报,2012,41(4):42-44.
[10] Taba S, Sawada J, Moromizato Z I. Nematicidal activity of Okinawa Island plants on the root-knot nematode Meloidogyne incognita (Kofoid and White) Chitwood[J]. Plant & Soil, 2008, 303(1-2): 207-216.
[11] 张家家,李世东,郭荣君,等. 淡紫紫孢菌YES和粉红螺旋聚孢霉67-1组合对黄瓜根结线虫病的防效评价[J]. 中国生物防治学报,2014(6):787-794.
[12] 李玲玉,赵 迪,刘晓宇,等. 放线菌Snea253代谢产物及寡糖对南方根结线虫活性的影响[J]. 天然产物研究与开发,2014(1):117-122.
[13] 唐佳频,邵宗泽,张智涛,等. 南极土壤来源的恶臭假单胞菌1A00316抗南方根结线虫的机制[J]. 应用与环境生物学报,2014(6):1 046-1 051.
[14] 焦 俊,韩冰洁,王媛媛,等. 毒杀南方根结线虫的木霉种类鉴定及活性研究[J]. 植物保护,2015,41(2):64-69.
(下转第48页)

