番石榴叶总三萜改善糖尿病周围神经病变
叶开和, 王小康, 吕艳青, 魏崧丞, 李秀存, 张晓琦, 叶春玲*
(1.暨南大学药学院药理学教研室,广东广州510632;2.暨南大学中药及天然药物研究所,广东广州510632)
番石榴叶总三萜改善糖尿病周围神经病变
叶开和1, 王小康1, 吕艳青1, 魏崧丞1, 李秀存1, 张晓琦2, 叶春玲1*
(1.暨南大学药学院药理学教研室,广东广州510632;2.暨南大学中药及天然药物研究所,广东广州510632)
摘要:目的 观察番石榴叶总三萜(TTPGL)对糖尿病大鼠周围神经病变(DPN)的改善作用,并探讨其作用机制。方法 采用高脂饮食加腹腔注射链脲佐菌素(STZ)建立糖尿病大鼠模型。将糖尿病大鼠随机分为6组,石榴叶总三萜低、中、高剂量组[30、60、120 mg/(kg·d)],正常组,模型组和罗格列酮组。测定坐骨神经运动传导速度(MCV)并对组织HE染色;利用RT-PCR检测坐骨神经组织肿瘤坏死因子-α(Tnfa),白细胞介素-6(Il6)和一氧化氮合酶(iNOS)mRNA的表达量;印迹法检测蛋白激酶B(AKT)、核转录因子κB激酶抑制因子IKKα、p65及其各自磷酸化蛋白表达。结果 与模型组比较,石榴叶总三萜(120 mg/kg)组显著地改善了坐骨神经的神经病变(p<0.05);石榴叶总三萜显著性抑制各炎症因子mRNA的表达(p<0.05),并显著下调p-AKT/AKT、p-IKKα/ IKKα、p-p65/p65的表达(p<0.01或p<0.05)。结论 石榴叶总三萜具有显著改善DPN的作用,其机制可能通过下调NF-κB介导的信号通路,从而减少炎症介质产生。
关键词:番石榴叶总三萜;糖尿病周围神经病变;炎性介质;NF-κB通路
KEY WORDS:total triterpenoids from psidium guajava leaves;diabetic peripheral neuropathy;inflammatory mediator;NF-κB pathway
糖尿病周围神经病变(DPN)是糖尿病最常见的并发症之一[1]。现如今,炎症对神经退行性变化的研究已为人们熟知,其导致周围神经的损伤性病理生理过程源于炎症介质产生的复杂路径[2-3]。番石榴叶提取物(主要包含总三萜),作为“消渴降糖胶囊”的原料药,在前期研究中发现其具有一定的抗血糖和肾脏保护作用[4-5],也有之前的文献报道了其抗炎作用[6-7]。为进一步探究TTPGL对糖尿病周围神经病变的作用,本实验建立了糖尿病大鼠模型,观察其对糖尿病大鼠周围神经病变的影响并探讨其作用机制。
1 材料
1.1 动物 雄性SD大鼠,体质量120~130 g,广东省医学实验动物中心提供,许可证号SCXK2012-0002。
1.2 药物与试剂 番石榴叶总三萜(TTPGL)提取自番石榴叶(psidium guajava L.)。番石榴叶产地为广东化州,经《中国植物志》特征对比后确定其种属为桃金娘科番石榴。番石榴叶总三萜经过95%乙醇渗漉提取,过柱,再经过50%、80%和95%乙醇溶液梯度洗脱,浸膏用甲醇溶解,过硅胶柱,氯仿-甲醇梯度洗脱,除色素后经过制备型高效液相(HPLC)反复纯化为淡黄色粉末,溶剂法纯化工艺提取,收率4.0%,由暨南大学天然药物化学研究所提供。高脂饲料:猪油10%,蔗糖15%,蛋黄5%,基础饲料70%,由广东省医学实验动物中心提供;STZ(98%,批号8110047)、罗格列酮(批号13245247)均购于美国Sigma公司;游离脂肪酸(NEFA)、甘油三酯(TG)、总胆固醇(TCH)试剂盒均购于南京建成生物工程研究所;甘油三酯测定试剂盒、总胆固醇测定试剂盒购自温州东瓯津玛生物科技有限公司;多聚甲醛(批号20120522)购自天津市北联精细化学品开发有限公司;Trizol(批号15596-026)购自美国加州Invitrogen Life Technologies公司;DNA引物由美国Invitrogen Biotechnology中国公司合成;逆转录酶RT-PCR试剂盒(批号K1622)购自美国Thermo公司;荧光定量qPCR试剂盒(批号04913914001)购自美国Roche公司;β-Actin antibody、Anti-IKKα antibody、NF-κB-p65 antibody、Anti-AKT(phospho S473)antibody均购自美国Cell Signaling Technology公司。
1.3 主要仪器 One touch稳豪型血糖仪配套试纸(批号PWE005007P,美国强生公司);Model 680酶标仪(美国BIO-RAD公司);低温离心机购自美国Sigma公司;LAC-110.4型电子分析天平购自赛多利斯公司;BL-410生物机能换能系统(成都泰盟科技有限公司研制);光学显微镜(奥林巴斯BX51,日本);WO-9413B型凝胶成像系统,购自北京六一仪器厂;POWER BC数控电泳仪,购自上海申能博彩生物科技有限公司。
2 方法
2.1 动物建模及分组 雄性SD大鼠90只,分为正常组动物12只和糖尿病建模动物78只,正常组动物给予基础饲料,建模动物给予高脂饲料。喂养4周后,禁食12 h,腹腔注射2%STZ溶液45 mg/kg,1周后测大鼠2 h糖耐量(禁食12 h,灌胃2 g/kg的葡萄糖,测2 h的血糖),筛选血糖值大于11.1 mmol/L的大鼠确定为糖尿病大鼠。模型稳定1周后,将成模的糖尿病大鼠60只按照血糖分层随机分为5组,即番石榴叶总三萜低(30 mg/kg)、中(60 mg/kg)、高(120 mg/kg)剂量组,罗格列酮组(3 mg/kg),模型组,每组各12只。
2.2 给药方式 给药组每天灌胃给予不同剂量的番石榴叶总三萜或罗格列酮,模型组和正常组则灌胃给予同体积的生理盐水,1次/d,连续给药8周。每周末称量大鼠体质量,各组饲料给予同“2.1”项。
2.3 观测指标及方法
2.3.1 血糖血脂测定 给药8周结束后取大鼠血清,按试剂盒说明书进行操作,采用葡萄糖氧化酶法测定空腹血糖值(FBG),GPO-PAP法测定TG,酶联免疫吸附法测定NEFA、TCH。
2.3.2 坐骨神经运动神经传导速度的测定 采用BL-410生物机能换能系统测定。运动神经传导速度(MCV)测定是在坐骨神经干两个不同端点刺激神经,在其支配肌肉记录运动反应,测定两个刺激点引出的运动反应潜伏期差与通过该两点间的距离之比即为MCV。
2.3.3 炎症介质基因表达测定 取各组大鼠的右腿坐骨神经,研磨组织样品成胶冻状后,用Trizol提取组织的RNA,溶于无核糖核酸酶(RNase)水中。然后开始在RT-PCR仪上进行目的基因(Tnfa,Il6和iNOS)的定量分析。RT-PCR仪进行逆转录构建cDNA模板,逆转录反应条件参照试剂盒说明。Tnfa正向引物为5'-TCAAGGGACAA-3',反向引物为5'-GGTATGAAATGGCAAATCGGCT-3',PCR产物为80 bp;Il6正向引物为5'-CCAGGTTCTCTTTGCCTTCTTGGGACTGATGT-3',反向引物为5'-TACTGGTCTGTTGTGGGTGGT-3',PCR产物为101 bp;iNOS正向引物为5'-TCAGCACAGAGGGCTCAAAG-3',反向引物为5'-ACATCGCCACAAACATAAAGGT-3',PCR产物为255 bp;β-actin正向引物为5'-TGCTATGTTGCCCTAGACTTCG-3',反向引物为5'-GTTGGCATAG AGGTCTTTACGG-3',PCR产物为240 bp。实时荧光定量PCR仪扩增条件:95℃预变性10 min,95℃变性15 s,60℃退火1 min,40个循环。每只动物检测一式3份,以β-actin为管家基因,采用2-ΔΔCt法计算基因表达的相对变化,其中ΔΔCt=(Ct未知样品-Ct未知样品内参)-(Ct基准样品-Ct基准样品内参)。
2.3.4 坐骨神经HE染色 收集处死后大鼠左腿的坐骨神经,利用多聚甲醛固定并保持神经条平直,经常规脱水、包埋,按实验室标准将组织切成厚度为4~5 μm,组织切片再经脱蜡、苏木素-伊红染色、脱水、透明、封固,即得HE染色切片。最后用光学显微镜检测各组织切片中组织形态学的变化。每个标本随机分析15个视角。
2.3.5 Western blot检测 利用研磨器研磨组织后,取样加入1%Triton X-100、150 mmol/L NaCl、1 mmol/L乙二胺四乙酸(EDTA)、2.5 mmol/L焦磷酸钠、1 mmol/L β-甘油磷酸酯、1 mmol/L Na3VO4、1 μg/mL亮肽素、1 μg/mL抑肽酶和20 mmol/L Tris(pH 7.5),得蛋白裂解液,用Lowry法测定蛋白质含有量。以牛血清白蛋白(BSA)为标准品,将蛋白浓度调为一致,用10% 的SDS-PAGE分离蛋白质,每个泳道蛋白上样量为40 μg[SDS-PAGE凝胶电泳,转硝酸纤维素膜,TBS冲洗、封闭,TBST冲洗,将膜放入Ⅰ抗中4℃过夜,TBST冲洗,加辣根过氧化物酶(HRP)(1∶1 000)标记的抗兔免疫球蛋白G(IgG)二抗孵育1 h,前后分别TBST洗3次,ECL发光液A 和B 1∶1混合后泡膜,暗室中感光]。Quantity One软件分析条带,得出光密度(D)值。
2.4 数据处理 数据均采用SPSS 19.0统计软件进行统计分析,计量资料用均数±标准差(±s)表示,两组间数据比较采用t检验,多组间均数比较采用单因素方差分析。以p<0.05为差异有显著性。
3 结果
3.1 TTPGL对糖尿病大鼠体质量及生化指标的影响 给药前,各建模组体质量与对照组比较,差异无统计学意义(p>0.05),而空腹血糖明显升高(p<0.01)。正常组体质量为(490.62± 10.98)g,且空腹血糖稳定在正常水平,低于7.0 mmol/L(表中FBG值由血糖仪测得值乘以18而得);模型组大鼠体质量和正常组比较显著降低,且血糖显著高于正常组(p<0.01),并一直维持在高于15.0 mmol/L的高血糖状态。与模型组比较,番石榴叶总三萜给药组以及罗格列酮组大鼠的NEFA、TG及TCH显著降低(p<0.05)。详见表1。
表1 TTPGL对糖尿病大鼠体质量及生化指标的影响(±s,n=12)Tab.1 Effects of TTPGL on body weight and biochem ical indices in diabetic rats(±s,n=12)

表1 TTPGL对糖尿病大鼠体质量及生化指标的影响(±s,n=12)Tab.1 Effects of TTPGL on body weight and biochem ical indices in diabetic rats(±s,n=12)
注:与正常组比较,##p<0.01;与模型组比较,*p<0.05
组别 剂量/ (mg·kg-1)给药前(建模后1周)(n =15) 给药8周后(n =10)体质量/g FBG/(mg·dL-1) 体质量/g FBG/(mg·dL-1)NEFA/ (μmol·L-1)TG/ (mmol·L-1)TCH/ (mmol·L-1)正常组 — 325.35±10.98 82.16±18.17 490.62±10.98 108.95±18.98 183.16±18.17 0.74±0.08 1.86±0.13模型组 — 322.25±14.36 396.72±28.64##323.00±16.86##399.03±21.18##454.31±44.26## 5.00±0.48## 6.32±0.61##TTPGL低剂量组 30 320.83±11.67 379.98±28.34##390.11±28.86 369.74±11.67 283.01±15.71 3.94±0.41 4.70±0.53 TTPGL中剂量组 60 327.05±22.41 390.96±27.46##314.10±16.85 286.28±19.21*237.73±13.29* 2.54±0.18* 3.58±0.17*TTPGL高剂量组 120 329.53±20.25 390.60±27.69##455.71±16.37*287.02±14.72*229.88±12.69* 2.69±0.34* 3.02±0.32*罗格列酮组 3 319.58±26.07 374.58±25.44##451.00±17.13*260.81±26.39*198.36±18.43* 2.43±0.37* 2.60±0.47*
3.2 TTPGL对糖尿病大鼠坐骨神经MCV的影响
本次实验,分别在第4周和第8周对各组大鼠的坐骨神经传导速度进行了测定。如表2,与正常组比较,经过STZ诱导的持续性高血糖影响,模型组大鼠坐骨神经在第8周的传导速度减慢明显(p<0.01);和模型组传导速度相比,TTPGL (120 mg/kg)、罗格列酮组在第8周速度测定值中出现显著性改善作用(p<0.05)。
表2 坐骨神经MCV值(±s,n=12)Tab.2 Sciatic nerve's MCV values(±s,n=12)

表2 坐骨神经MCV值(±s,n=12)Tab.2 Sciatic nerve's MCV values(±s,n=12)
注:与正常组比较,##p<0.01;与模型组比较,*p<0.05
组别 剂量/ (mg·kg-1)运动神经传导速度/(m·s-1)第4周 第8周正常组 —61.18±1.01 60.87±0.74模型组 — 58.82±1.24 52.07±1.19##TTPGL低剂量组 30 58.13±1.25 56.33±1.28 TTPGL中剂量组 60 60.51±1.45 54.88±0.74 TTPGL高剂量组 120 59.81±2.27 57.63±1.18*罗格列酮组 3 61.78±1.65 57.56±1.10*
3.3 TTPGL对糖尿病大鼠坐骨神经炎症基因表达的影响 如图1,A、B和C分别是Tnfa,Il6和iNOS基因表达的柱状图。和正常组比较,模型组在各炎症介质基因的表达上均有显著性的增加(p<0.05)。和模型组比较,TTPGL组和罗格列酮组在各炎症介质基因的表达上,有不同程度的改善作用(p<0.05)。

注:与正常组比较,#p<0.05;与模型组比较,*p<0.05图1 Tnfa,Il6和iNOS基因表达(±s,n=12)Fig.1 Gene expressions of Tnfa,Il6 and iNOS(±s,n=12)
3.4 TTPGL对糖尿病大鼠坐骨神经组织形态学的影响 正常组大鼠坐骨神经排列有序,髓鞘清晰,组织间致密无水肿且无游离细胞产生。模型组大鼠坐骨神经结构排列紊乱,髓鞘脱落,组织间水肿并游离细胞较多。和模型组相比,TTPGL对神经组织结构的影响,随剂量增加,神经结构排列、组织细胞间的致密度得到不同程度的改善。详见图2。

注:粗箭头表示髓鞘退化,箭头表示水肿,细箭头表示游离细胞图2 TTPGL对糖尿病大鼠坐骨神经组织形态学改变的影响(HE,×400,n=6),Fig.2 Effect of TTPGL on histological alteration in sciatic nerve in diabetic rats(HE,×400,n=6)
3.5 TTPGL对糖尿病大鼠坐骨神经NF-κB介导的信号通路蛋白的影响 图3为各蛋白表达条带,图4为定量分析各蛋白磷酸化与非磷酸化的比值图。与正常组比较,模型组大鼠p-AKT/AKT,p-IKKα/ IKKα,p-p65/p65值显著性增加(p<0.01),即NF-κB介导的信号通路蛋白磷酸化活性增强。给药后,番石榴叶总三萜和罗格列酮可显著降低各蛋白磷酸化活性在糖尿病大鼠坐骨神经组织中的表达,与模型组相比,差异具有统计学意义(p<0.05或p<0.01)。

图3 信号通路蛋白表达Fig.3 Protein expressions of signal pathways
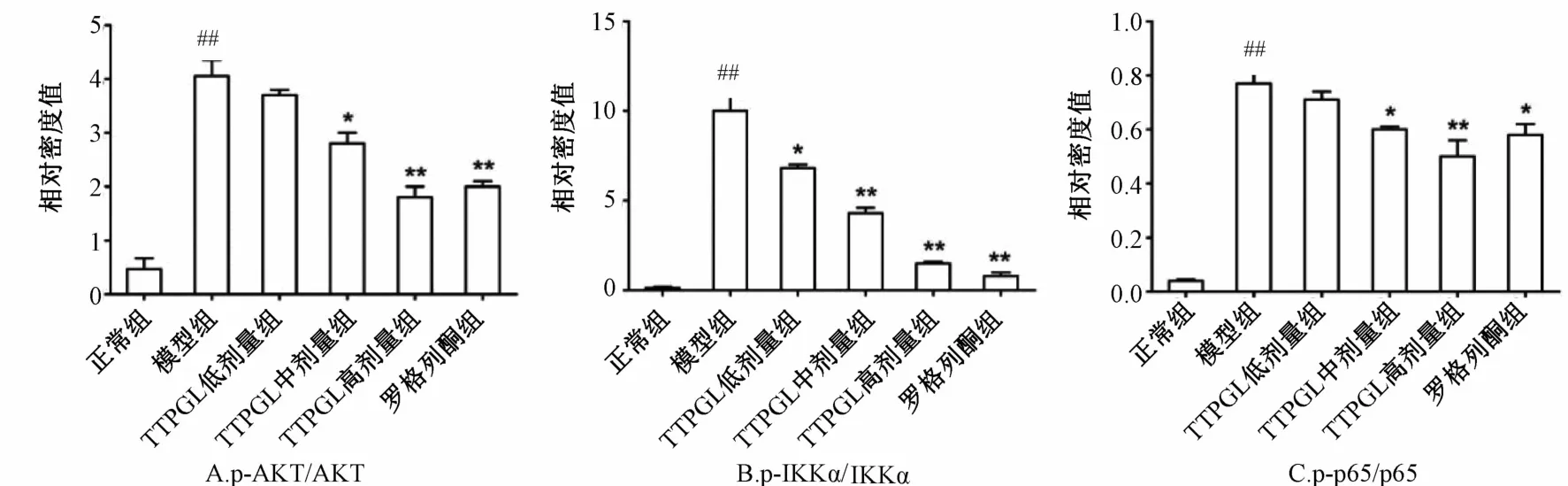
注:与正常组比较,##p<0.01;与模型组比较,*p<0.05,**p<0.01图4 p-AKT/AKT,p-IKKα/IKKα,p-p65/p65定量分析(±s,n=6)Fig.4 Quantitative analyses of p-AKT/AKT,p-IKKα/IKKαand p-p65/p65(±s,n=6)
4 讨论
本课题组在前期研究中首次发现番石榴叶总三萜是番石榴叶降血糖的有效部位,其富含特征性的高度氧化的五环三萜酸类化合物如:积雪草酸、乌苏酸、番石榴酸以及齐墩果酸等[7-9]。糖尿病周围神经病变确定机制较为复杂,2005年美国神经学研究会、电诊断医学协会以及物理康复医学协会将临床上DPN的诊断主要包含有:神经性症状、体征以及异常性电诊断[10]。本实验模型组体质量下降明显,持续性的高血糖(表1)以及传导速度的异常(表2)等,从而确定模型组动物被STZ诱导8周之后,产生了神经性病变。
持续性的高血糖将会导致核转录因子NF-κB介导作用[11]。炎性因子TNF-α,介质IL-6以及炎性酶iNOS都能被NF-κB调控且相互间引起神经炎症的恶性循环[12],其中iNOS调控的NO是产生神经髓鞘退化的直接原因。而以上由NF-κB介导的炎症因子在雪旺细胞或者神经元中可表现出对巨噬细胞的募集作用,并能最终导致神经再生性损伤[13]。因此,将高血糖诱发的神经炎症机制归结于对NF-κB介导的信号通路探究。本实验结果中的模型组,提示炎性因子表达对神经组织结构的损伤性变化;给药后,各组炎症因子对神经的损伤情况随着给药剂量增加而得到缓解。证实了之前文献报道中番石榴叶提取物所具有的抗炎功效[14]。
TNF作为在T1DM和T2DM两型糖尿病中作用最普遍的炎性因子[15-16],在本次试验中,我们将其引起的PI3K酪氨酸磷酸化,激活PI3K/Akt介导的路径[17-18]作为探究对象。在活性体内,Akt是一种60 kD的丝/苏氨酸蛋白激酶,为PI3K重要的下游组成部分,IKKα(Thr23)磷酸化的募集激活NF-κB RelA(p65)[19],并最终导致炎性介质产生、神经组织损伤的恶性循环。实验结果可知,番石榴叶总三萜通过下调p-AKT/AKT、p-IKKα/ IKKα、p-p65/p65值,减少了由NF-κB-p-p65介导的炎症介质的产生,并进一步缓解神经组织损伤,达到改善周围神经病变的效果。
综上所述,本实验探究番石榴叶提取物TTPGL对DPN的作用及其机制,其结果显示,TTPGL改善坐骨神经的传导速度、减少坐骨神经炎症介质的产生和神经结构的损伤,并可能通过抑制NF-κB产生的信号通路蛋白磷酸化活性而达到减少炎症产生的效果。
参考文献:
[1] 侯瑞芳,汤正义,宁 光.糖尿病周围神经病变的检查方法及其诊断效率[J].国际内分泌代谢杂志,2006,26(4):270-272.
[2] Edwards JL,Vincent A M,Cheng H T,et al.Diabetic neuropathy:mechanisms to management[J].pharmacol Ther,2008,120(1):1-34.
[3] Cameron N E,Cotter M A.Pro-inflammatorymechanisms in diabetic neuropathy:focus on the nuclear factor kappa B pathway [J].Curr Drug Targets,2008,9(1):60-67.
[4] 王婧茹,赵晶晶,叶春玲,等.番石榴叶总三萜对2型糖尿病大鼠的降血糖和血脂作用[J].中国病理生理杂志,2012,28(6):1109-1113.
[5] 匡乔婷,赵晶晶,叶春玲,等.番石榴叶总三萜对2型糖尿病大鼠肾损伤的保护作用[J].中药材,2012,35(1):74-97.
[6] Kawakami Y,Nakamura T,Hosokawa T,et al.Antiproliferative activity of guava leaf extract via inhibition of prostaglandin endoperoxide H synthase isoforms[J].p rostaglandins LeuKot Essent Fatty Acids,2009,80(5-6):239-245.
[7] Shao M,Wang Y,Huang X J,et al.Four new triterpenoids from the leaves of psidium guajava[J].JAsian Nat p rod Res,2012,14(4):348-354.
[8] Begum S,Hassan S I,Siddiqui B S,et al.Triterpenoids from the leaves of psidium guajava[J].phytochemistry,2002,61 (4):399-403.
[9] 郭翔宇,刘铜华,朱寅荻,等.番石榴叶化学成分及其治疗2型糖尿病研究进展[J].世界科学技术:中医药现代化,2014,16(5):619-628.
[10] Albers JW,Pop-Busui R.Diabetic neuropathy:mechanisms,emerging treatments,and subtypes[J].Curr Neurol Neurosci ReP,2014,14(8):473.
[11] Brownlee M.Biochemistry and molecular cell biology of diabetic complication[J].Nature,2001,414(6865):813-820.
[12] Kim YW,Zhao R J,Park S J,etal.Anti-inflammatory effects of liquiritigenin as a consequence of the inhibition of NF-kappa B-dependent iNOS and proinflammatory cytokines production [J].Br J pharmacol,2008,154(1):165-173.
[13] Conti G,Scarpini E,Baron P,et al.Macrophage infiltration and death in the nerve during the early phases of experimental diabetic neuropathy:a process concomitantwith endoneurial induction of IL-beta and p75NTR[J].J Neurol Sci,2002,195 (1):35-40.
[14] Gutierrez R M P,Mitchell S,Solis R V.psidium guajava:a review of its traditional uses,phytochemistry and pharmacology [J].JEthnoPharmacol,2008,117(1):1-27.
[15] Gomes M B,Piccirillo L J,Nogueira V G,et al.Acute-phase proteins among patients with type 1 diabetes[J].Diabetes Metab,2003,29(4):405-411.
[16] Gonzalez-Clemente JM,Mauricio D,Richart C,etal.Diabetic neuropathy is associated with activation of the TNF-alpha system in subjects with type 1 diabetes mellitus[J].Clin Endocrinol (Oxf),2005,63(5):525-529.
[17] Romashkova JA,Makarov S S.NF-kappaB is a target of AKT in anti-apoptotic PDGF signalling[J].Nature,1999,401 (6748):86-90.
[18] Kane L P,Shapiro V S,Stokoe D,et al.Induction of NF-kappaB by the Akt/PKB kinase[J].Curr Biol,1999,9(11):601-604.
[19] Ozes O N,Mayo L D,Gustin JA,etal.NF-kappaB activation by tumour necrosis factor requires the Akt serine-threonine kinase[J].Nature,1999,401(6748):82-85.
Ameliorative effect of total triterpenoids from psidium guajava leaves on diabetic peripheral neuropathy
YE Kai-he1, WANG Xiao-kang1, LÜYan-qing1, WEISong-cheng1, LIXiu-cun1, ZHANG Xiaoqi2, YE Chun-ling1*
(1.DePartment of pharmacology,pharmacy College of Jinan University,Guangzhou 510632,China;2.Institute of Traditional ChineseMedicine and Natural Medicine,Jinan University,Guangzhou 510632,China)
ABSTRACT:AIM To investigate the ameliorative effect of total triterpenoids from psidium guajava leaves (TTPGL)on diabetic peripheral neuropathy(DPN)in rats and to explore the underlying mechanism. M ETHODS Rats models for diabetic were induced by high-fat feeding and STZ injection.These rats were randomized into six groups,TTPGL-30,60 and 120 groups[30,60 and 120 mg/(kg·d)],control group,model group and positive control rosiglitazone group[3 mg/(kg·d)].Nerve conduction velocity(MCV)and histopathological staining were performed on sciatic nerves.mRNA expressions of pro-inflammatory molecules (Tnfa,Il6 and iNOS)and tissue proteins(AKT,IKKαand p65)were also estimated by RT-PCR and Western blot,respectively.RESULTS Compared with themodel group,TTPGL(120 mg/kg)group significantly ameliorated DPN nerve deficits(p<0.05).It significantly inhibited Tnfa,Il6 and iNOS mRNA expressions (p<0.05),and significantly down-regulated p-AKT/AKT,p-IKKα/IKKαand p-p65/p65(p<0.01 or p< 0.05).CONCLUSION TTPGL can markedly improve DPN symptom,whosemechanism may be related to the down-regulation of NF-κB-mediated signal pathway,and then decrease the expressions of inflammatorymediators.
*通信作者:叶春玲(1963—),女,博士,教授,从事神经内分泌方向研究。Tel:(020)85223843,E-mail:yechunling2005@163.com
作者简介:叶开和(1970—),男,硕士,讲师,研究方向为内分泌药理学。Tel:(020)85220261,E-mail:rightye33@163.com
基金项目:广东省高等学校科技创新重点项目(cxzd1111);国家自然科学基金(81373935);广东省重大科技专项(2013A022100028)
收稿日期:2015-10-29
doi:10.3969/j.issn.1001-1528.2016.05.001
中图分类号:R285.5
文献标志码:A
文章编号:1001-1528(2016)05-0961-06

