EPHB6缺失突变del915-917对非小细胞肺癌体内转移的影响*
西安医学院第二附属医院中心实验室(西安 710038)
于 军 铁 茹 张学策 常 盼 赵 鸽△ 陈宝莹▲
EPHB6缺失突变del915-917对非小细胞肺癌体内转移的影响*
西安医学院第二附属医院中心实验室(西安 710038)
于军铁茹张学策常盼赵鸽△陈宝莹▲
摘要目的:探讨EPHB6缺失突变del915-917对非小细胞肺癌(NSCLC)体内转移的作用。方法:定点突变EPHB6的表达载体pcDNA4-EPHB6-wt获得突变载体pcDNA4-EPHB6-del915-917,转染肺腺癌细胞A549,进而将细胞接种于NOD/SCID小鼠体内,通过转移灶计数、HE染色评价转移情况。结果:表达EPHB6-del915-917的NSCLC细胞体内转移显著强于表达野生型EPHB6-wt的细胞。结论:EPHB6的缺失突变del915-917促发NSCLC体内转移。
主题词癌,非小细胞肺肿瘤转移移码突变 @EPHB6
非小细胞肺癌(Non-small cell lung cancer,NSCLC)是肺癌中主要的病理类型,包括鳞癌、腺癌、大细胞癌。约75%的NSCLC患者发现时已处于中晚期,5年生存率很低。NSCLC转移造成的术后易复发以及放、化疗失败,是患者存活率、治愈率得不到提高的根本原因[1]。生促红素人肝细胞(Erythropoiet in-producing hepatoma cell line,EPH)受体家族,与其配体Ephrin之间的信号传递介导了许多重要的生理和病理过程:如胚胎形成、神经发育、肿瘤的发生与转移等[2]。EPHB6是EPH家族的成员之一,以往的研究表明EPHB6与乳腺癌、神经母细胞瘤、前列腺癌等多种肿瘤的转移呈负相关。最近,我们通过基因测序技术,筛查EPHB6编码区的序列,发现了EPHB6的一个新的突变位点del915-917,该突变造成EPHB6分子缺失3个氨基酸。生物信息学分析表明,该突变可能会损害EPHB6的功能[3]。本研究拟在前期研究的基础之上,采用NOD/SCID小鼠,评价EPHB6-del915-917对于NSCLC细胞体内转移的作用,明确该突变的功能,为临床NSCLC的诊断和治疗提供新的切入点。
材料和方法
1EPHB6突变表达载体的获得将人EPHB6的cDNA编码区(base 833-3853 NCBI Accession No. NM_004445)克隆进入pcDNA4 To/myc/hisA表达载体(Invitrogen,Carlsbad,CA,USA)。采用QuickChange XL定点突变试剂盒(Stratagene,La Jolla,CA,USA)对EPHB6的编码区进行缺失突变。突变反应以pcDNA4-EPHB6作为模板,上游引物为:5’- AGGCTGGCGGGGAAAGGCCTTCCCAGG,下游引物为:5’- CCTGGGAAGGCCTTTCCCCGCCAGCCT。
2细胞培养与转染A549细胞系采用含10 %胎牛血清的DMEM培养基(美国Invitrogen公司),于37℃、5 % CO2的孵箱中培养。细胞转染采用转染试剂Nanofectin(PAA, Austria),操作按照说明书进行。pcDNA4(空载体)、野生型EPHB6表达载体(pcDNA4-EPHB6-wt)或突变性EPHB6表达载体与EGFP的表达载体(pcDNA3.1-GFP,表达绿色荧光蛋白EGFP)共转染。为了得到稳定转染的细胞,用700 μg/ml的G418(Sigma,St.Louis,MO,USA)和400 μg/ml的Zeocin(Invitrogen,Carlsbad,CA,USA)进行筛选。并且,利用流式细胞仪FACS对EGFP表达阳性的细胞进行分选。对得到的稳定转染细胞采用Western blotting对于EPHB6的表达水平进行确认。
3Western blot按照我们以往报道的方法进行[4]。蛋白检测:一抗采用兔抗人 EPHB6 (1μg/ml,Santa Cruz,USA),内参照actin检测采用小鼠抗人β-actin(40 ng/ml,Sigma,USA)。采用辣根过氧化物酶(HRP)耦联二抗, ECL法显色。
4体内迁移实验采用8~10周龄的NOD/SCID小鼠(第四军医大学实验动物中心)。在接种肿瘤细胞1 d之前,22只NOD/SCID小鼠,经过3.5 Gy的钴60照射1次。接种时,分别将3×105稳定转染的肿瘤细胞悬浮于200 μl PBS,经过尾静脉注射。接种后4周,处死小鼠,检测肺部的转移灶。通过检测肺部的肿瘤结节来判定转移的形成。并将小鼠的肺脏用4 %的多聚甲醛固定,HE染色观察。
5统计学方法利用SPSS 15.0软件进行数据处理,实验数据表示为均数±标准差,多组间两均数比较采用方差分析,两独立样本均数比较采用t检验,P<0.05为差异有统计学意义。
结果
1EPHB6-wt组、EPHB6- del915-917在肺腺癌细胞系A549中的表达以pcDNA4为空载体对照,分别构建EPHB6-WT和EPHB6-del915-917表达载体,转染A549肺腺癌细胞,筛选得到稳定表达的细胞。Western blotting结果显示,EPHB6-del915-917和EPHB6-WT的表达水平稳定(图1)。将稳定转染的细胞用于后续的体内实验。

图1野生型(EPHB6-wt)和突变型(EPHB6-mut)
EPHB6在A549细胞中的表达
2EPHB6-del915-917促进A549细胞在NOD/SCID小鼠体内转移于NOD/SCID小鼠尾静脉分别注射EPHB6-wt的A549细胞(n=10)、EPHB6-del915-917的A549细胞(n=10)或空载体对照细胞(n=2)。在接种后1周,EPHB6-wt和EPHB6-del915-917组分别有1只小鼠死亡。因此,接种后4周,检查肺部的转移病灶时,EPHB6-wt和EPHB6-del915-917组分别只有9只小鼠。如图2所示,表达EPHB6-wt的细胞在小鼠体内形成的转移灶数目显著少于对照组或EPHB6-mutant组(P<0.05)。其中,EPHB6-WT组中,1只小鼠未发生转移;2只小鼠转移灶数为1;2只小鼠转移灶数为3; 3只小鼠转移灶数分别为4、5、8;仅有1只小鼠有30个转移灶。而EPHB6-mutant组中,多达4只小鼠分别产生了30个转移灶。图2A中横线为对应散点数据的中位数,从中位数的比较也可看出表达EPHB6-mutant的A549细胞的体内转移能力显著强于表达EPHB6-wt的A549细胞。大体解剖(图2B)和HE染色(图2C)的结构进一步证实了上述结论。
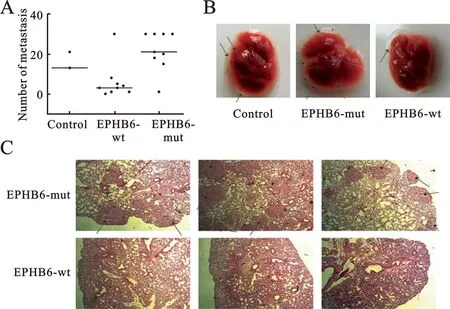
(A)NOD/SCID小鼠肺部肿瘤病灶数目;(B)NOD/SCID小鼠肺的照片,箭头指示为肿瘤病灶; (C)NOD/SCID小鼠肺的HE染色(×40)
图2NOD/SCID小鼠体内A549细胞的转移
讨论
本研究采用的非肥胖糖尿病/严重联合免疫缺陷(non-obese diabetes-SCID mice,NOD/SCID)小鼠作为肿瘤体内转移研究的模型。NOD/SCID小鼠具有T、B淋巴细胞联合免疫缺陷,且NK细胞活性低下、无循环补体、巨噬细胞和抗原提呈细胞功能损害等特性。NOD/SCID小鼠在肿瘤研究领域具有广阔的应用前景。本研究首次报道了EPHB6-del915-917促发NSCLC的体内转移。这一实验结果为明确EPHB6在NSCLC中的作用,特别是EPHB6突变的功能提供了直接的实验证据。
以往,我们报道EPHB6受体型酪氨酸蛋白激酶抑制非小细胞肺癌转移[4]。本研究发现,EPHB6的缺失突变,不但造成EPHB6分子在结构上缺失3个氨基酸,更重要的是造成EPHB6野生型分子原有的肿瘤转移抑制效应消失,而且EPHB6-del915-917还促发NSCLC细胞体内转移。推测,其机制可能为:①EPHB6-del915-917对于野生型EPHB6产生竞争性抑制,从而削弱EPHB6的转移抑制效应;②与野生型EPHB6不同,EPHB6-del915-917可能激活了促进肿瘤细胞转移的细胞信号转导通路。但这还需要实验验证。
许多基因的“质”和“量”与肿瘤的发生、发展、转移和预后关系密切。所谓“量”,就是基因的表达水平,所谓“质”就是该基因表达产物的结构和功能是否正常。我们以往在NSCLC的临床标本和细胞系中检测均发现,NSCLC中EPHB6表达水平降低,这与其启动子区的高甲基化水平有关[5-6]。即NSCLC中EPHB6发生“量”的降低;本研究中,EPHB6的突变造成其氨基酸序列的变化,也就是其结构,即“质”的异常,进而影响到其功能。我们课题组针对EPHB6开展的系列研究,一直是紧扣基因的 “质”和 “量”这两条主线而展开,并逐步深入的。筛查功能明确的EPHB6的突变有可能成为临床NSCLC早期诊断、判断预后,以及治疗方案制定的重要指标。但其临床应用价值,从很大程度上取决于该突变的发生频率,突变频率越高,其临床应用价值越大。因此,在本研究动物实验的基础之上,课题组将进一步筛查该突变在NSCLC患者标本中的发生频率,并与NSCLC的转移做相关性分析。
参考文献
[1]Serke M,Schönfeld N.Diagnosis and staging of lung cancer[J].Dtsch Med Wochenschr,2007,132(21):1165-1169.
[2]Eph Nomenclature Committee (1997) Unified nomenclature for Eph family receptors and their ligands. The ephrins[J].Cell,1997,90:403-404.
[3]于军,铁茹,赵鸽,等.非小细胞肺癌中EPHB6基因突变的筛选和功能预测[J].山西医科大学学报,2014,45(7):557-560.
[4]铁茹,胡浩,谷仲平,等.EPHB6受体型酪氨酸蛋白激酶抑制非小细胞肺癌转移[J].陕西医学杂志,2011,40(6):650-652.
[5]铁茹,胡浩,谷仲平,等.EPHB6受体型酪氨酸蛋白激酶在非小细胞肺癌中高甲基化失活[J].山西医科大学学报,2011,42(3):194-198.
[6]Müller-Tidow C,Diederichs S,Bulk E,etal.Identification of metastasis-associated receptor tyrosine kinases in non-small cell lung cancer[J].Cancer Res,2010,65:1778-1782.
(收稿:2015-09-17)
Del915-917,the deletion mutation of the EPHB6, promotes in vivo metastasis of non-small cell lung cancer in NOD/SCID mice
Experimental Center, Second Affiliated Hospital, Xi’an Medical University(Xi’an 710038)
Yu JunTie RuZhang Xueceet al
ABSTRACTObjective:To clarify the effects of del915-917, a deletion mutation of EPHB6, on the in vivo metastasis of NSCLC (non-small cell lung cancer) in NOD/SCID mice.Methods:Site-directed mutagenesis was performed from pcDNA4-EPHB6-wt to pcDNA4-EPHB6-del915-917, which was transfected into A549 lung adenocarcinoma cells. The cells were then injected into NOD/SCID mice. The metastatic status were evaluated by metastasis counting and HE staining.Results:Cells expressing EPHB6-del915-917 demonstrated significant higher levels of metastasis, compared with cells expressing EPHB6-WT. Conclusion:The deletion mutation del915-917 increased the metastatic capability of NSCLC cells in NOD/SCID mice.
KEY WORDSCarcinoma,non-small-cell lungNeoplasm metastasis Frameshift mutation@EPHB6
通讯作者:▲第四军医大学唐都医院放射科
【中图分类号】R734.1
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.02.002
*国家自然科学基金资助项目(30801385)
卫生部肿瘤个体化治疗分子诊断专项课题(W2013FZ20)
陕西省社会发展攻关课题(2014K11-01-01-07)
陕西省教育厅基础研究专项课题(14JK1616)
△西安交通大学第一附属医院麻醉科

