穗花杉双黄酮抑制人脐静脉内皮细胞血管形成的实验研究*
张金丽 ,曹文娟 ,熊喜峰 ,戴丽冰 ,刘志河
(广州市红十字会医院∥暨南大学医学院附属广州红十字会医院创伤外科研究所,广东 广州510220)
穗花杉双黄酮抑制人脐静脉内皮细胞血管形成的实验研究*
张金丽 ,曹文娟 ,熊喜峰 ,戴丽冰 ,刘志河
(广州市红十字会医院∥暨南大学医学院附属广州红十字会医院创伤外科研究所,广东 广州510220)
为探讨穗花杉双黄酮(Amentoflame, AF)对人脐静脉内皮细胞ECV304血管形成及机制的影响,从而为穗花杉双黄酮治疗肿瘤及其他血管增生性疾病提供理论基础,采用 MTS检测AF对ECV304血管内皮细胞增殖的作用,细胞划痕实验观察AF对ECV304细胞迁移的影响,体外血管形成实验观察AF对ECV304血管形成的影响,Western blot 检测AF对ECV304细胞血管形成相关信号通路及蛋白如磷酸化AKT(p-AKT)、金属基质蛋白酶9(Matrix metalloproteinase-9, MMP-9)、促血管生成素2 ( angiopoietin 2,Ang 2 )表达影响。结果表明AF能够抑制ECV304细胞的增殖作用,并呈梯度依赖性;AF具有抑制ECV304细胞迁移的作用,并且能够抑制ECV304体外血管样结构的形成;Western blot结果显示100 μmol/L 的AF能够降低ECV304细胞p-AKT、MMP-9、Ang-2的蛋白表达。
血管生成; 内皮细胞 ;穗花杉双黄酮
血管生成(Angiogenesis)是指源于已存在的毛细血管和毛细血管后微静脉的新的毛细血管性血管的生长。肿瘤血管生成是一个极其复杂的过程,一般包括包括血管内皮基质降解、内皮细胞移行、内皮细胞增殖、内皮细胞管道化分支形成血管环和形成新的基底膜等步骤[1]。在这个复杂而有序的过程中,多种生物分子发挥关键作用。例如: 血管生成素( angiopoietin,Ang) ,包括Ang-1和Ang-2,血管内皮生长因子( vascular endothelial growth factor,VEGF) 、血管内皮生长因子受体(vascular endothelial growth factor receptors,VEGFR),此外还有基质金属蛋白酶(matrix metalloproteinases,MMPs) 和缺氧诱导因子( hypoxia inducible factor,HIF) 等。血管生成在肿瘤的发展转移过程中起到重要作用,抑制这一过程将能明显阻止肿瘤组织的发展和扩散转移。中药文化是我们国家的珍贵资源宝库,特别是经过提纯加工的中药单体,已经发现了它们在许多疾病治疗中的药理机制[2-4]。在治疗肿瘤血管形成方面,目前研究较多的有人参皂苷、姜黄素等。潘子民等[3]建立小鼠卵巢癌模型,通过免疫组织化学检测CD34和VEGF的表达,发现人参皂苷Rg3 可抑制卵巢癌组织微血管密度的表达,并降低VEGF 的表达水平。王力强等[5]采用藻酸盐实验检测脂质体姜黄素的抗血管生成作用,证实姜黄素能抑制血管生成。穗花杉双黄酮是来源于卷柏科植物卷柏的一种双黄酮类物质,在传统医学中卷柏曾用来治疗多种疾病,现代医学研究证明穗花杉双黄酮还具有抗炎、抗氧化、抗肿瘤等多种作用[6]。但关于穗花杉双黄酮对血管内皮细胞及血管生成方面的研究还不是很多,因此,本文将穗花杉双黄酮作用于人脐静脉内皮细胞,以观察其对血管生成的影响及机制,从而为穗花杉双黄酮防治肿瘤或其他血管增生疾病提供理论基础。
1 材料与方法
1.1 实验材料与仪器
人脐静脉内皮细胞ECV304细胞株由本实验室保存。高糖DMEM、胎牛血清、胰酶及青链霉素均购于Gibco公司,穗花杉双黄酮购自于上海融禾医药科技发展有限公司,二甲基亚砜(DMSO)及丝裂霉素C购自Sigma公司,MTS购于美国Promega公司,兔单克隆抗体Angiopoietin-2、兔多克隆抗体MMP-9购自于Abcam公司,兔单克隆抗体p-AKT购自于CST公司,兔GAPDH多克隆抗体购自上海依科赛生物制品有限公司, Matrigel 购自美国Coring,Bio-Rad化学发光凝胶成像系统,OLYMPUS倒置相差显微镜,ZEISS荧光显微镜,Thermo 二氧化碳培养箱。
1.2 方法
1.2.1 细胞培养 在37 ℃,φ=5%CO2培养箱中,用含φ=l0%胎牛血清的高糖DMEM完全培养基(含2 mmol /L谷氨酰胺、100 U/mL青霉素和100 μg /mL链霉素)培养ECV304,每3天更换培养基,至细胞融合70%~80%对细胞进行消化、传代。
1.2.2 MTS检测穗花杉双黄酮对ECV304细胞活力的影响 取ECV304细胞以3 × 103/孔接种于96孔板中,贴壁过夜后分别加入含0、25、50、75 、100、150 μmol/L穗花杉双黄酮的高糖DMEM完全培养基,每个浓度组设6个复孔,作用48 h后MTS法检测比较不同浓度穗花杉双黄酮对细胞生长的影响。
1.2.3 细胞划痕检测穗花杉双黄酮对ECV304细胞迁移的影响 将细胞接种于六孔板中,待细胞完全融合,加入10 μg/mL丝裂霉素C处理4 h使细胞灭活,采用200 μL枪头分别在六孔板孔中划一“十”字划痕,然后PBS洗3次,一孔加入φ=4%多聚甲醛固定作为0 h对照,其余分别加入不含或含有50、100 μmol/L穗花杉双黄酮DMEM完全培养基,继续培养16 h后,将细胞用φ=4%多聚甲醛固定,并于显微镜下测量计算细胞迁移距离,细胞迁移距离= 0 h划痕宽度-16 h划痕宽度。
1.2.4 血管形成实验 将融化的matrigel铺于冰上预冷的24孔板中,每孔加入100 μL,然后放入37 ℃培养箱30 min,待matrigel完全凝固后,加入不含或含50、100 μmol/L穗花杉双黄酮DMEM完全培养基的细胞悬液,每孔细胞数约1 × 104个,培养16 h后,采用φ=4%多聚甲醛固定,并置显微镜下拍照观察血管状结构形成情况。
1.2.5 Western blot检测穗花杉双黄酮对ECV304细胞血管形成相关蛋白表达的影响 细胞接种于培养皿中,加入不含或含50、100 μmol/L穗花杉双黄酮的DMEM完全培养基作用48 h后,弃上清,PBS洗3次,加入RIPA细胞蛋白裂解液冰上裂解30 min,离心后收集上清测定蛋白浓度,SDS-PAGE电泳分离蛋白,半干转膜仪转膜,w=3%BSA封闭2 h,分别加入一抗p-AKT(1∶1 000)、Angiopoietin -2(1∶1 000)、MMP-9(1∶1 000),4 ℃冰箱摇床孵育过夜,次日TBST洗3次,分别加入相应二抗,室温孵育1 h,TBST洗3次后加入ECL发光液,放入化学发光凝胶成像仪显影拍照。
1.2.6 统计学处理 实验结果采用(x±s表示,采用SPSS 16.0 统计软件进行单因素方差分析,组间两两比较采用t检验,以P< 0.05 表示统计学上有显著差异。
2 结 果
2.1 穗花杉双黄酮对ECV304细胞活力的影响
从图1我们可以看出,当穗花杉双黄酮浓度为50 μmol/L时,与对照组(0 μmol/L)相比,有统计学差异(P< 0.05),随着浓度的升高,其抑制细胞活力的作用增强,当浓度超过100 μmol/L时,提高穗花杉双黄酮的浓度,对ECV304细胞活力的抑制作用也不再增加。
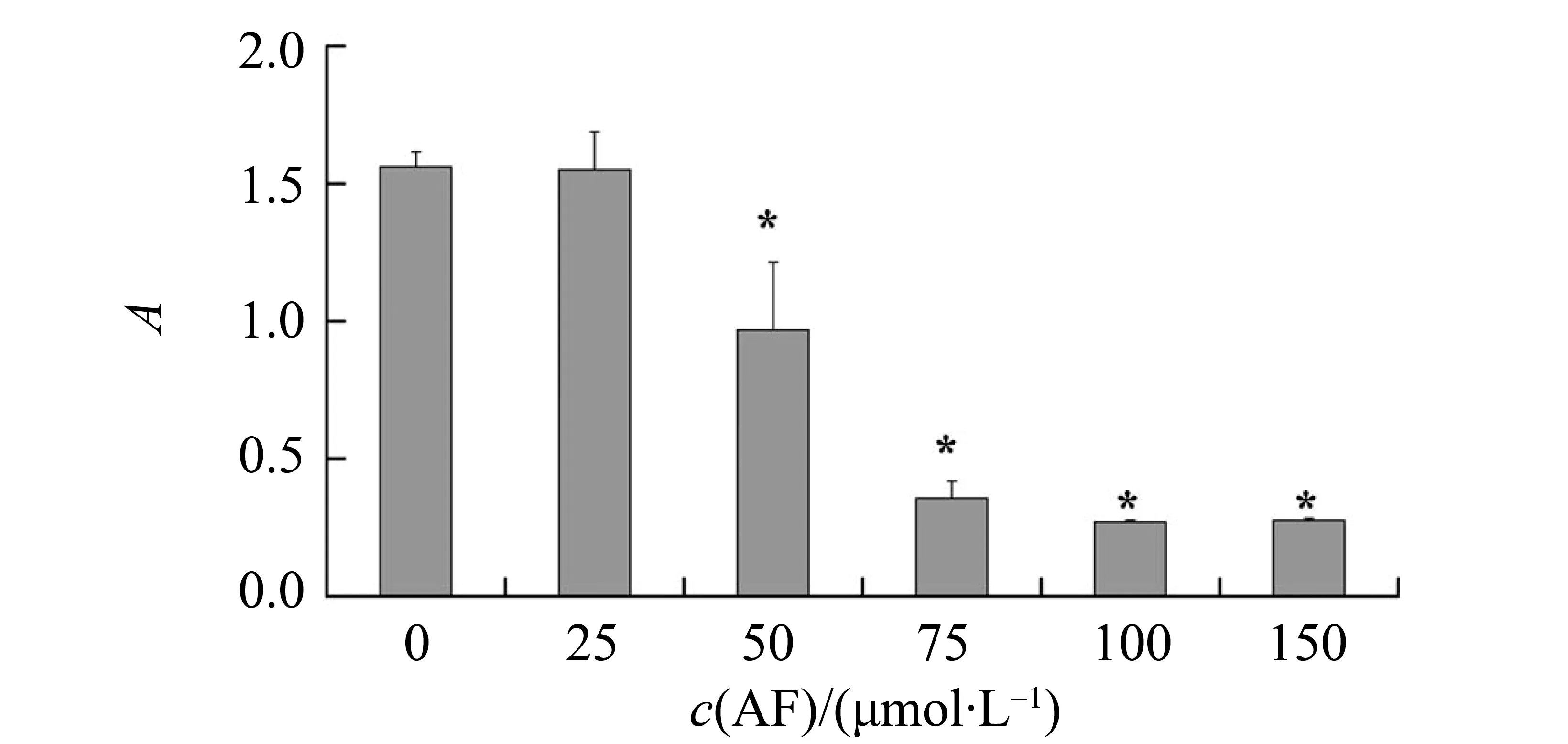
图1 不同浓度穗花杉双黄酮对ECV304细胞增殖的影响Fig.1 The effects of different concentration amentoflame(AF) on ECV304 cell proliferation
2.2 细胞划痕显示穗花杉双黄酮抑制ECV304 细胞迁移
如图2所示, 经显微镜下测量, 0 h细胞划痕宽度约(112.00±6.17) μm(图2Aa),经过16 h的细胞迁移,对照组划痕宽度缩短到(29.00±3.28) μm(图2Ab),而50 μmol/L和100 μmol/L穗花杉双黄酮组划痕宽度分别为(80.44±2.00) μm (图2Ac)和(110.77±4.00) μm (图2Ad),由此可推算出对照组及50 μmol/L和100 μmol/L穗花杉双黄酮组迁移距离分别为(83.00+3.28)、(31.56+2.00)、(1.67+3.38) μm,经统计学分析,各组间有统计学差异(P< 0.05)。
2.3 穗花杉双黄酮抑制ECV304细胞体外血管形成
在Matirgel 体外管样结构形成模型中,对照组可以观察到完整的血管样结构,50 μmol/L AF组仅见个别细胞突触连接,而100 μmol/L AF基本上无细胞连接。由此可表明穗花杉双黄酮对ECV304成管样结构形成的抑制作用,且此抑制作用具有浓度依赖性,即穗花杉双黄酮浓度越高,其对ECV304成管样结构形成的抑制作用就越强如(图3所示)。
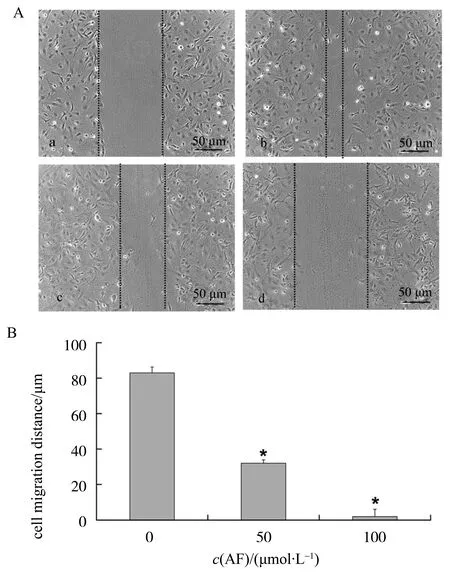
图2 AF对ECV304细胞迁移的影响Fig.2 The effect of AF on ECV304 cell migration
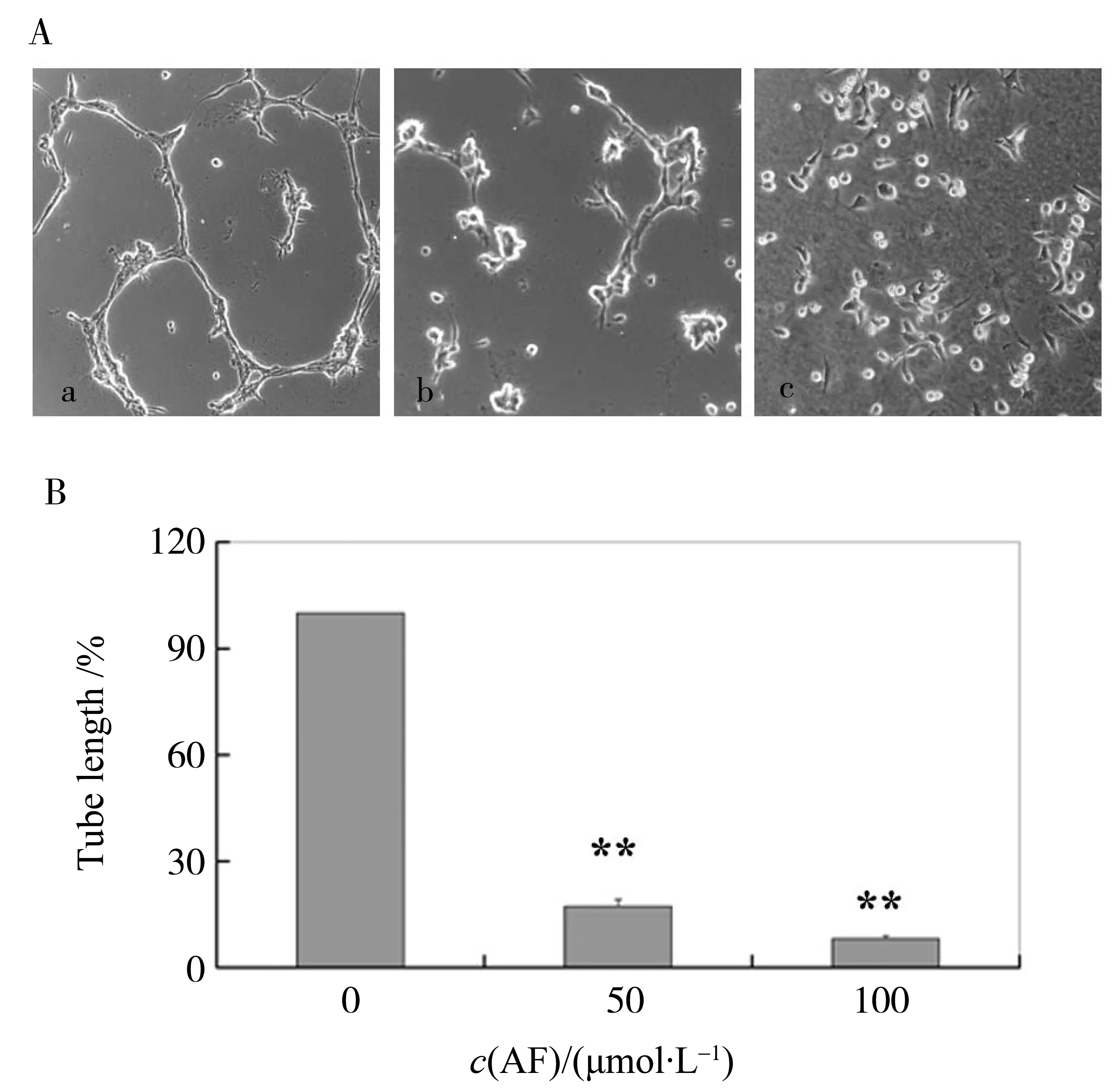
图3 AF对ECV304细胞体外血管样结构形成的影响Fig.3 The effects of AF on ECV304 cell tube formation
2.4 穗花杉双黄酮对ECV304细胞血管形成相关蛋白表达的影响
通过Western blotw我们对ECV304细胞血管形成相关蛋白的表达进行了检测,发现在100 μmol/L穗花杉双黄酮的作用下,一些对血管形成有利的蛋白如促血管生成素2(Angiopoietin-2)、MMP-9表达下降,而且能够抑制与细胞生长、分化、迁移密切相关的PI3K/AKT通路中关键蛋白AKT的磷酸化,但50 μmol/L浓度组作用不明显(如图4所示)。
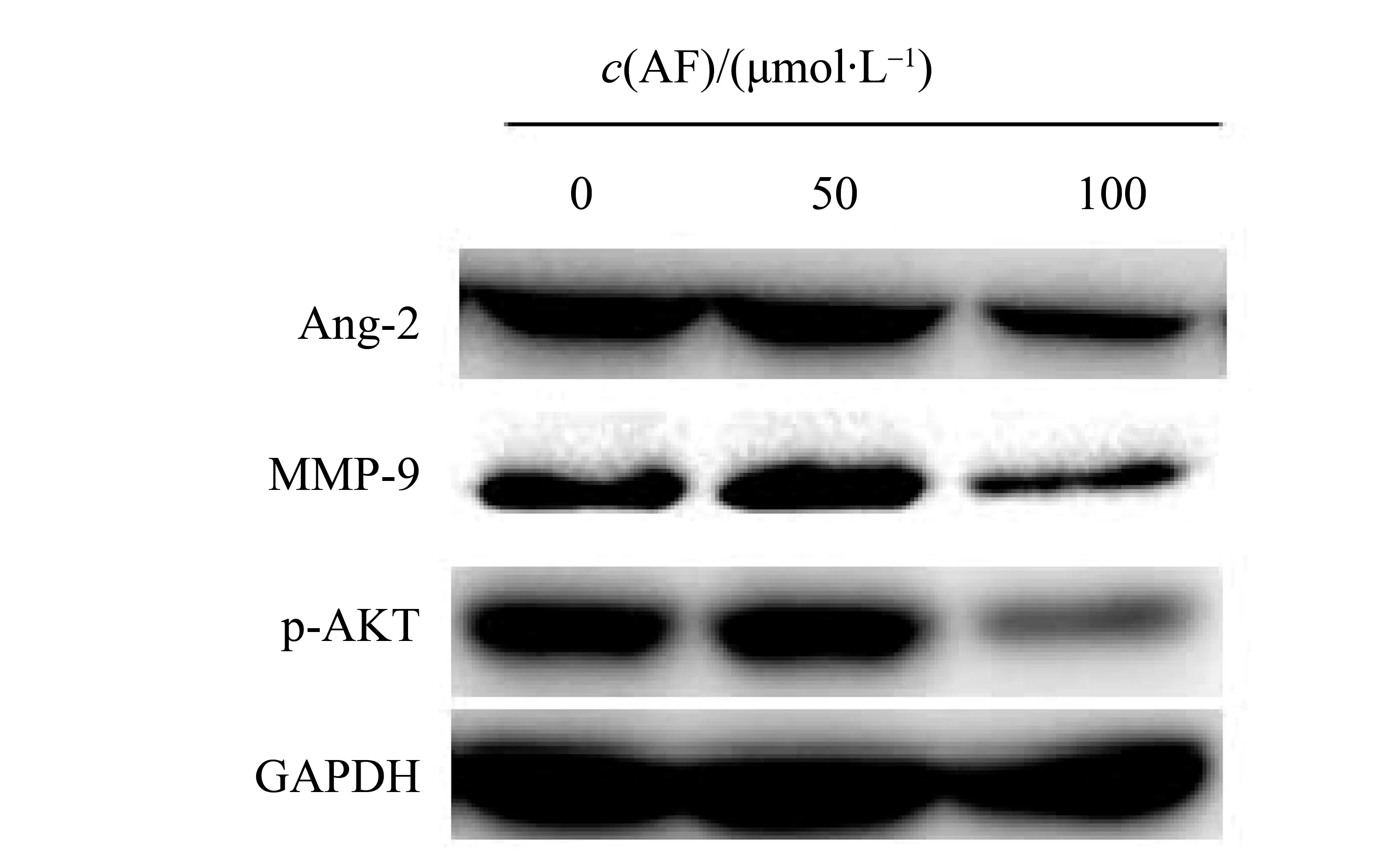
图4 Western blot 检测AF对ECV304细胞p-AKT, Ang-2,MMP-9蛋白表达情况Fig.4 Western blot assay the expression of AF on ECV304 p-AKT, Ang-2 and MMP-9 protein
3 讨 论
肿瘤血管是肿瘤赖以生长和转移的基础,当既存血管提供的营养和氧不能满足肿瘤的迅速生长和侵袭时, 肿瘤会产生血管生成相关因子, 并改变局部微环境, 形成新生血管。在芽生过程中, 血管内皮细胞迁移、增殖、建立结点, 最终形成稳定的基底膜[7]。
穗花杉双黄酮是一种黄酮类中药单体,研究发现具有诱导肿瘤细胞凋亡的作用[8-9],在本文我们发现AF还具有抑制人脐静脉血管内皮细胞增殖的作用。内皮细胞增殖是血管形成的基础,除此之外,内皮细胞的迁移也是血管形成的关键,细胞迁移是一个多步骤的动态过程,在促进血管生成和抑制血管生成的各种因子之间平衡精密调控下,血管内皮细胞持续生长迁移, 延伸新生血管的顶端[7,10]。我们通过划痕实验发现,在采用丝裂霉素C处理后,在排除细胞增殖对细胞迁移距离的影响下,AF还是能够明显表现出对ECV304细胞迁移的抑制作用。最后,体外血管形成实验利用3D细胞基质模型模拟体内血管生成,也验证AF抑制血管内皮细胞形成血管的作用。
关于血管形成的影响因素很多,本研究中选取了几个与细胞生长、迁移关系比较密切的因素初步探讨了AF抑制血管内皮细胞血管形成的机制。PI3K/AKT信号途径,不仅在细胞凋亡、增殖、迁移、极化、代谢中具有重要作用,也在肌肉和心肌纤维收缩、血管生成、干细胞自我更新中发挥重要功能[11-12],非正常激活状态的Akt 与多种疾病具有广泛的联系,尤其是肿瘤,Akt 的生物活性的全面激活需要S473 和T308 两个位点的磷酸化[13], 本研究发现AF能够抑制S473位点的磷酸化,由此我们推测AF抑制ECV304细胞的生长和迁移可能与AF抑制了AKT S473的磷酸化有关。基质金属蛋白酶(Matrix metalloproteinase, MMPs)是一种内源性蛋白水解酶,MMP-9属于明胶酶,在降解细胞外基质各种成分中,最为重要的是降解Ⅳ型胶原,血管基膜的主要成分为Ⅳ型胶原,因此其在诱导新生血管的生成和重塑,促进肿瘤浸润和转移方面起很重要的作用[14]。促血管生成素2 ( angiopoietin 2,Ang2) 由血管内皮细胞产生,属于血管生成素家族,该家族包括Ang-1,2,3,4 四个成员,Ang-1有助于促进血管成熟,维持血管稳定,而Ang-2在生长的血管中表达,通过与Tie-2受体相结合,竞争性的抑制Ang-1的作用,改变血管的稳定性,并增加内皮细胞对VEGF 等血管增殖因素的敏感性,诱导内皮细胞分裂增殖、萌芽、迁移,从而促进血管生成和肿瘤生长的作用,与肿瘤血管生成的数目和密度、肿瘤大小、肿瘤侵袭及转移密切相关[15]。在本研究中,我们发现100 μmol/LAF能够抑制血管内皮细胞细胞MMP-9及Ang-2的表达,因此我们推测这可能是AF抑制ECV304细胞迁移、增殖及血管形成的机制之一,但本实验中50 μmol/L AF对MMP-9和Ang-2的作用却不是很确定,我们分析一方面可能与药物浓度有关,在不同的药物浓度下,药物的作用效果不一定成线性关系,另一方面可能还有其他因素参与而在本实验中没有检测。
[1] FOLKMAN J. Angiogenesis in cancer,vascular,rheumatoid and other disease [J]. Nat Med,1995,1(1):27-31.
[2] 王永刚,谭沛,李沛波,等. 田基黄总黄酮抗胆管结扎所致大鼠肝纤维化的研究[J]. 中山大学学报(自然科学版), 2016, 55(1): 12-15.
[3] 潘子民,叶大风,谢幸,等. 人参皂甙Rg3 对荷卵巢癌的严重联合免疫缺陷鼠的抗肿瘤血管生成作用的研究[J]. 中华妇产科杂志,2002,37(4) : 202-204.
[4] 辛颖,姜新,崔俊生,等.人参皂苷Rg3抑制B16黑色素瘤新生血管生成及其机制的探讨[J].中华肿瘤防治杂志,2010,17(8):590-593.
[5] 王力强,石华山,王永生.脂质体姜黄素在Lewis 肺癌中的抗肿瘤和抗血管作用[J]. 四川大学学报(医学版),2013,44 (1) :46-68.
[6] 张震,王峰. 穗花杉双黄酮的生物活性研究进展[J].中国新药杂志,2013,22(23):2775-2778.
[7] GEUDENS I, GERHARDT H. Coordinating cell behaviour during blood vessel formation[J]. Development, 2011, 138: 4569-4583.
[8] PEI J S, LIU C C, HSU Y N, et al. Amentoflavone induces cell-cycle arrest and apoptosis in MCF-7 human breast cancer cells via mitochondriadependent pathway[J]. In Vivo,2012,26 (6):963-970.
[9] 杨雨,徐文娟,彭康,等.穗花杉双黄酮通过影响caspase-3和β-catenin表达诱导结肠癌细胞SW480凋亡[J]. J South Med Univ, 2014, 34(7): 1035-1038.
[10] CARMELIET P, JAIN R K. Angiogenesis in cancer and other diseases[J]. Nature, 2000, 407: 249-257.
[11] LIAO Y,HUNG M C. Physiological regulation of Akt activity and stability[J]. Am J Transl Res,2010,2(1): 19-42.
[12] MARKMAN B,DIENSTMANN R,TABERNERO J. Targeting the pi3k /akt /mtor pathway—Beyond rapalogs[J].Oncotarget,2010,1(7) : 530-543.
[13] FELDMAN M E,APSEL B,UOTILA A, et al. Active-site inhibitors of mTOR target rapamycin-resistant outputs of mTORC1 and mTORC2 [J].PLoS Biol, 2009, 7(2): e38.
[14] ROMANIC A M,WHITE R F,ARLETH A J,et al.Matrix metalloproteinase expression in creases after cerebral focal ischemia in rats[J].Stroke,1998,29( 5) : 1020.
[15] GEHLING U M,ERGN S.Mechanisms of tumour vascularisation[J].Memo-Magazine of European Medical Oncology,2008, 1(1) :3-7.
Amentoflame inhibits human umbilical vein endothelial cells angiogenesis
ZHANGJinli,CAOWenjuan,XIONGXifei,DAILibing,LIUZhihe
(Guangzhou Institute of Traumatic Surgery,Guangzhou Red Cross Hospital,Medical Collage of Jinan University, Guangzhou 510220, China)
The present study was designed to investigate the effect of Amentoflame (AF) on the angiogenesis of human umbilical vein endothelial cells ECV304 and the mechanisms involved. MTS assay was performed to assess the effect of AF on ECV304 cell proliferation. Wound Healing was performed to assess the effect of AF on ECV304 cell migration. Matrigel assay was performed to assess the effect of AF on ECV304 tube formation. Western blotting was used to analyze the expression of cell angiogenesis related proteins such as angiopoietin 2 (Ang-2)、Matrix metalloproteinase-9 (MMP-9) and p-AKT in ECV304 treated with or without AF. The results demonstrated that AF inhibited the proliferation, migration and tube formation of ECV304 concentration-dependently. Western blot showed that the expression of p-AKT, Ang-2 and MMP-9 were significantly down-regulated by 100 μmol/l of AF.
angiogenesis;endothelial cells;Amentoflame
10.13471/j.cnki.acta.snus.2016.06.023
2016-04-08
广州市卫生局基金资助项目(20131A011038);国家自然科学基金资助项目(81272222)
张金丽(1979年生),女;研究方向:肿瘤分子生物学;通讯作者:刘志河;E-mail:zliu0731@163.com
R961;R966
A
0529-6579(2016)06-0148-05

