抗血管生成药物联合化疗在复发性卵巢癌治疗中的研究进展
张洁,王晓慧
抗血管生成药物联合化疗在复发性卵巢癌治疗中的研究进展
张洁,王晓慧△
【摘要】卵巢癌是妇科常见的恶性肿瘤之一,其发生、发展及肿瘤细胞的浸润转移离不开新生血管,因此通过抑制肿瘤新生血管形成,是治疗卵巢癌的有效途径之一。目前主要研究的抗血管生成药物包括血管内皮生长因子抑制剂(如贝伐单抗)、酪氨酸激酶抑制剂(如索拉菲尼、帕唑帕尼、西地尼布等)和血管生成素抑制剂(如Trebananib)。大量的Ⅱ、Ⅲ期临床试验表明抗血管靶向药物联合化疗为复发性铂敏感性或铂耐药性卵巢癌的治疗带来了曙光,明显延长了疾病无进展生存期。综述不同抗血管靶向药物联合化疗治疗复发性卵巢癌的临床研究现状及最新进展。
【关键词】卵巢肿瘤;抗肿瘤联合化疗方案;抗血管生成药物;贝伐单抗;西地尼布;复发性卵巢癌
作者单位:730000兰州,兰州大学第一临床医学院(张洁);兰州大学第一医院妇产科(王晓慧)
△审校者
(J Int Obstet Gynecol,2016,43:70-74)
卵巢癌早期临床症状不典型,大部分患者发现时已属晚期,在妇科恶性肿瘤中致死率最高,预后最差。世界卫生组织(WHO)全球健康数据报告指出2014年全球有超过150 000人死于卵巢癌[1]。由于其起病隐匿、缺乏早期诊断方法,绝大多数患者就诊时已是晚期,尽管经过新辅助化疗加肿瘤细胞减灭术以及术后化疗,使卵巢癌患者取得了明显的生存益处,但仍有70%的患者会复发,且铂耐药性复发约占25%[2]。对于部分铂耐药复发患者,二线化疗方案治疗效果仍不理想,这就为复发性卵巢癌(recurrence ovarian cancer)尤其是铂耐药性复发性卵巢癌的治疗提出了挑战。随着对肿瘤分子生物学的进一步研究,靶向治疗已成为一种新的治疗策略,特别是在抗肿瘤血管生成方面取得了显著的成效。贝伐单抗(Bevacizumab)是第一个被美国食品和药物管理局(FDA)批准上市,目前也是唯一经FDA批准用于治疗铂耐药性复发性卵巢癌以及晚期、持续性宫颈癌的抗血管生成药物。
各种抗血管生成药物根据治疗机制的不同可分为:①以血管内皮生长因子(vascular endothelial growth factor,VEGF)为靶点的重组人源化单克隆抗体:贝伐单抗;②小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI),以VEGF受体(VEGFR)、血小板源衍生因子受体(platelet-derived growth factor receptors,PDGFR)等为靶点,如索拉菲尼(Sorafenib)、西地尼布(Cediranib)、帕唑帕尼(Pazopanib)。③血管生成素抑制剂:Trebananib原名AMG386。④可溶性受体诱饵(VEGF Trap),如阿柏西普(Aflibercept)。可溶性受体诱饵是可诱捕VEGF的诱饵型VEGFR,增强VEGF抑制作用的抗血管新途径。⑤整合素抑制剂:伏洛昔单抗(Volociximab)。以上这些促血管生成因子在肿瘤血管生成的微环境中起着核心地位,同时也为肿瘤的治疗提供了理想的靶点。
1 贝伐单抗与复发性卵巢癌
体外血管模型显示VEGF与其受体作用可导致内皮细胞增殖和新生血管形成。卵巢癌组织中VEGF的表达水平比正常卵巢组织明显升高,且卵巢癌患者腹水中VEGF高表达,使得VEGF成为卵巢癌独立的预后因素[3]。贝伐单抗可特异性结合VEGF,阻碍其与受体在内皮细胞表面相互作用,抑制肿瘤组织血管生成。其次,抗VEGF药物可以使肿瘤组织血管结构正常化,促进化疗药物有效地到达肿瘤组织,与化疗发挥协同作用,这也是抗血管生成药物联合化疗的机制之一。
1.1贝伐单抗联合化疗在复发性卵巢癌中的应用两项成功开展的Ⅲ期临床试验GOG0218和ICON7,将贝伐单抗联合卡铂和紫杉醇应用于初治性晚期卵巢癌或存在高复发风险卵巢癌的治疗,并于化疗结束后贝伐单抗维持治疗,试验结果显示均显著延长了患者疾病无进展生存期(progression-free survival,PFS),不良反应发生率基本一致。对于总生存期(overallsurvival,OS),ICON7进一步证明了研究组较对照组显著延长7.8个月[4]。基于这两项研究结果,欧洲药品管理局(EMA)批准贝伐单抗用于晚期卵巢癌的一线化疗[5]。
临床上对复发性卵巢癌目前多采用二线化疗,并将二线化疗药与贝伐单抗联合应用,取得了较好的治疗效果,OCEANS、AURELIA是具有权威性及代表性的两项Ⅲ期临床试验。OCEANS是针对铂类敏感(以铂类为基础的一线化疗后复发时间≥6个月)的复发性卵巢癌、原发性腹膜癌或输卵管癌设计的Ⅲ期临床试验[6],该研究将484例患者随机分为两组:研究组(贝伐单抗15 mg/kg+吉西他滨+卡铂)及对照组(安慰剂+吉西他滨+卡铂),治疗6个疗程后两组分别以贝伐单抗和安慰剂维持治疗,直到出现疾病进展为治疗终点。试验结果:随访24个月,研究组中位PFS较对照组延长4个月(12.4个月vs.8.4个月,P<0.000 1),客观反应率(objective response rate,ORR)高于对照组(78.5%vs.57.4%,P<0.0001)。试验组降低复发风险52%,延长缓解持续时间3个月(10.4个月vs.7.4个月)。试验组和对照组OS分别为35.2个月及33.3个月,差异无统计学意义(P>0.05)。研究组3级或3级以上的高血压发生率(17.4% vs.<1%)和蛋白尿发生率(8.5%vs.<1%)更高。在治疗期间,30 d安全报告窗口期无一例患者出现胃肠道穿孔(gastrointestinal perforation),但治疗结束后研究组有2例患者出现胃肠道穿孔均在30天安全报告窗口期之外。根据试验结果可知贝伐单抗联合吉西他滨和卡铂并贝伐单抗维持治疗可明显延长铂类敏感复发性卵巢癌患者的PFS及ORR。
AURELIA是第1个将贝伐单抗与化疗联合治疗铂耐药型(以铂类为基础化疗后6个月内复发)复发性卵巢癌的Ⅲ期临床试验,将361例患者随机分为单药组:采用紫杉醇、拓朴替康、脂质体多柔比星任意一种周疗;联合组:加用贝伐单抗10 mg/kg每2 周1次或15 mg/kg每3周1次[7]。根据实体瘤的疗效评价标准(RECIST),首要终点为PFS,次要终点主要有ORR、OS及安全性。中位随访13.9个月,单药组91%出现疾病进展,联合组为75%。联合组较单药组PFS明显延长(6.7个月vs.3.4个月),两组ORR分别为27.3%及11.8%(P=0.001),联合组中位OS虽然较单药组延长[16.6个月vs.13.3个月,风险比(hazard ratio,HR):0.85],但差异无统计学意义(95%CI为0.66~1.08,P<0.174)。≥2级以上的高血压及蛋白尿在实验组更常见,胃肠道穿孔发生率在联合组为2.2%,单药组无一例发生。试验显示贝伐单抗联合化疗可显著提高铂耐药型复发性卵巢癌的PFS和ORR。基于此研究结果,2014年11月美国FDA批准贝伐单抗联合化疗用于铂耐药型复发性卵巢癌的治疗。
以上研究结果表明,对于卵巢癌,无论是初治性,还是复发性,对于复发性卵巢癌,无论是铂敏感型还是铂耐药型,贝伐单抗联合化疗均可显著延长PFS,不良反应均可耐受,为患者带来了生存益处。
1.2贝伐单抗用于化疗过程中的不良反应大量实验结果证明,应用贝伐单抗常见的不良反应包括高血压、蛋白尿,切口愈合延迟等;严重不良反应包括胃肠道穿孔、出血和动静脉血栓栓塞;少见的不良事件包括胃肠道外瘘管形成、可逆性后部白质脑病综合征等。
目前对于高血压的发生机制尚不清楚,高血压发生率与贝伐单抗剂量呈正相关,且用药时间越长,发病率越高,但是通过常规降压药物可使血压控制平稳。一项关于贝伐单抗应用于卵巢癌的4项Ⅲ期临床试验的Meta分析得出,贝伐单抗组静脉血栓栓塞发生率远高于动脉血栓栓塞,分别为2.8%~6.7%
和0.7%~3.6%[8]。另有研究提出贝伐单抗使用过程中静脉血栓栓塞的风险并未增加,血栓栓塞形成风险与不同肿瘤类型有关[9]。Burger等[10]研究分析得出,胃肠道穿孔事件发生率与患者既往化疗方案数有关,两者呈正相关。基于贝伐单抗在使用过程中发生的多种不良事件,临床应用中首先应对患者身体状况进行评估,对于同时患有高血压、消化道溃疡、肠梗阻、肾病、术后伤口愈合延迟者应禁用或慎用此药,权衡治疗效果与严重的毒副作用,做到用药合理性与治疗个体化。
1.3贝伐单抗联合化疗对于卵巢癌患者生活质量(quality of life,QoL)的影响Stark等[11]对ICON7试验中卵巢癌患者生活质量进行评估,将1 528例卵巢癌患者随机分为两组,研究组:卡铂+紫杉醇联合贝伐单抗(7.5 mg/kg),并贝伐单抗维持治疗;对照组:单纯卡铂+紫杉醇。采用欧洲癌症研究与治疗组织QoL问卷评估两组患者,治疗至18周时,对照组比研究组平均QoL值高7.2分。治疗至54周,对照组平均QoL值较研究组高6.4分。该研究结果虽然临床意义小,但差异仍有统计学意义(P<0.000 1)。Monk等[12]报道了另一项关于卵巢癌QoL评估的Ⅲ期临床试验,该试验分3组,结果显示贝伐单抗联合化疗组及联合化疗后并贝伐单抗维持治疗组均较单纯卡铂+紫杉醇标准化疗组QoL评分低。
2 TKI联合化疗在复发性卵巢癌中的应用
VEGFR,PDGFR等多种受体酪氨酸激酶在血管生成过程中起关键作用,多靶点TKI如索拉菲尼、西地尼布、帕唑帕尼通过与三磷酸腺苷竞争结合酪氨酸激酶活化位点,抑制VEGFR、PDGFR的激活,从而阻断肿瘤组织血管生成。其次,TKI通过多靶点的抑制作用或许能避免贝伐单抗单通路阻断时出现的耐药现象[13]。 2.1索拉菲尼索拉菲尼是一种多靶点、具有双重抗肿瘤作用的口服TKI,不仅可阻断VEGFR2、VEGFR3、PDGFR、Fit3、c-kit发挥抗肿瘤血管生成,而且可以抑制RAF/MEK/ERK信号转导通路直接抑制肿瘤生长[14]。Schwandt等[15]报道了关于索拉菲尼联合卡铂和紫杉醇或索拉菲尼单药治疗铂敏感复发性上皮性卵巢癌的有效性及安全性,结果见表1。
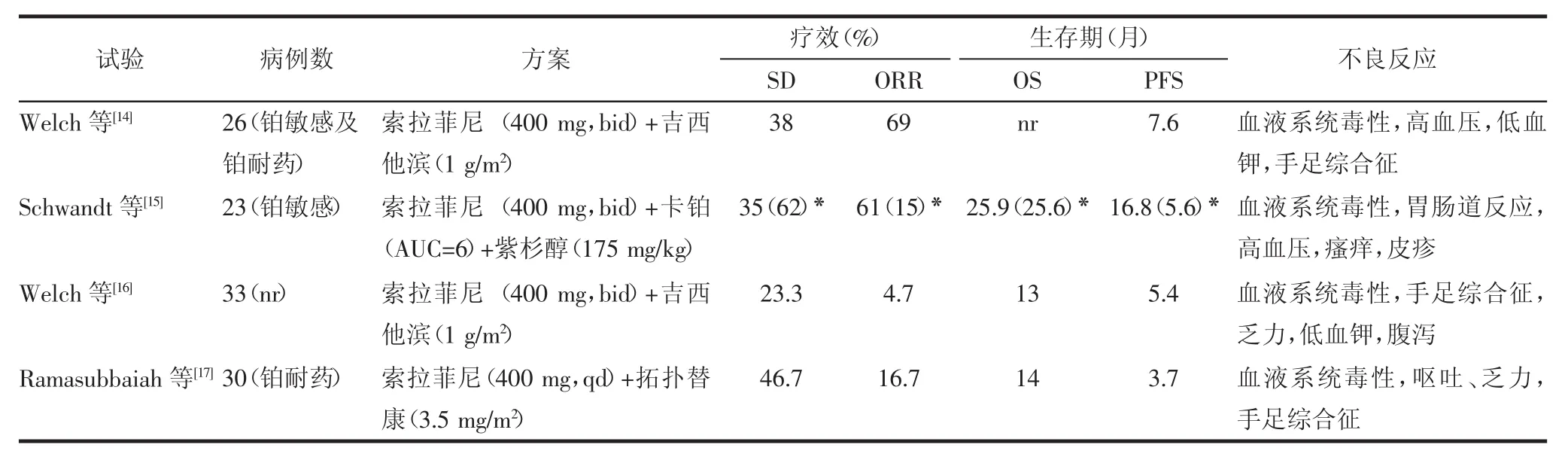
表1 索拉菲尼联合化疗治疗复发性卵巢癌的Ⅱ期临床研究结果汇总
2.2西地尼布西地尼布是一种口服高效选择性VEGFR通路抑制剂,能抑制VEGFR1,VEGFR2,VEGFR3,PDGFRβ及c-kit信号通路,从而阻断肿瘤血管生成,抑制肿瘤细胞增殖[18]。Hirte等[18]及Matulonis等[19]分别开展了关于西地尼布单药治疗复发性卵巢癌的Ⅱ期临床试验,结果提示西地尼布对于复发性卵巢癌有一定的临床治疗效果,其常见不良事件为高血压、乏力、腹泻。随后,一项随机双盲Ⅲ期临床试验ICNO6评估西地尼布联合化疗治疗铂敏感型复发性卵巢癌的临床疗效[20]。465例患者均为化疗和手术后首次复发,接受6个周期以铂为基础的化疗,随机分成3组,安慰剂治疗(对照组),西地尼布20 mg/d与化疗同期治疗并安慰剂维持治疗18个月(同步组),西地尼布联合化疗后并西地尼布维持治疗(同步+维持治疗组)。结果显示:通过2年的随访,同步+维持治疗组比对照组PFS延长3.2个月(12.6个月vs.9.4个月),OS提高2.7个月(17.6~20.3个月,HR=0.70,P=0.041 9)。对照组PFS比同步组提高了2个月(9.4~11.4个月,HR=0.68,P=0.0022)。高血压、腹泻、甲状腺功能减退、声音嘶哑、蛋白尿、出血、疲乏等不良反应在同步+维持治疗组更常见。此项试验证明西地尼布联合化疗可提高复发性卵巢癌患者的PFS及OS,尤其是当西地尼布维持治疗时对于PFS提高更显著。
美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)2014年报道了一项Ⅱ期临床试验[21],对比聚ADP核糖聚合酶(polyADP-ribosepolymerase,PARP)抑制剂奥拉帕尼联合西地尼布或奥拉帕尼单药治疗复发性铂敏感型高级别浆液性卵巢癌或乳腺癌易感基因(BRCA)突变卵巢癌的临床疗效。90例患者随机分成两组:单药组采用奥拉帕尼(400 mg,2 次/d),联合组采用奥拉帕尼(200mg,2次/d)联合西地尼布(30mg,1次/d),所有患者在肿瘤复发前均未接受过抗血管生成药或PARP抑制剂的治疗。试验结果:联合组中位PFS达17.7个月,单药组仅为9个月。联合组及单药组ORR分别为79.6%和47.8%。对于OS目前试验结果尚不成熟,24个月的OS,单药组为65%,联合组为81%。高血压(18%vs.0)、疲劳(27%vs.11%)、腹泻(23%vs.0)等3级以上不良事件发生率均在联合组更高。虽然实验结果明显改善了患者的生存时间,但目前这两种药均未被美国FDA批准用于卵巢癌的治疗。所以需要更多的临床试验证实此种联合用药的安全性及有效性。
2.3帕唑帕尼帕唑帕尼是VEGFR酪氨酸激酶3个亚型(VEGFR1,VEGFR2和VEGFR3)以及PDGFR 和c-kit的多靶点TKI[22]。2009年10月及2012年4月分别被美国FDA批准用于治疗晚期肾癌和已接受化疗的晚期软组织肉瘤。
一项随机多中心的Ⅱ期临床试验共纳入74例铂耐药、难治性晚期卵巢癌患者,均在最后1次以铂为基础的化疗后6个月内出现疾病进展[22]。随机分成两组,给予紫杉醇周疗加或不加帕唑帕尼,治疗的主要终点为PFS。中位随访12.5个月,其中无疾病进展66例,34例死亡,周疗紫杉醇组PFS为3.5个月,加帕唑帕尼组为6.3个月(HR=0.45,P=0.000 8)。中位OS同样加帕唑帕尼组比周疗紫杉醇组延长(18.7个月vs.14.8个月)。中性粒细胞减少、高血压、黏膜炎、感觉神经病变、腹泻均在加帕唑帕尼组更常见。3~4级毒性反应加帕唑帕尼组及周疗紫杉醇组发生率分别为54%和22%。结论认为,紫杉醇联合帕唑帕尼可明显延长铂耐药或难治性晚期卵巢癌患者的PFS和OS。
2013年ASCO报道了一项Ⅲ期临床试验AGOOVAR16,组织结构上证实为晚期卵巢癌患者均经过肿瘤细胞减灭术及>5次标准化疗后无疾病进展[23]。研究组给予帕唑帕尼(800 mg,1次/d)维持治疗,对照组给予安慰剂,共治疗2年,结果研究组可明显延长PFS 5.6个月(HR=0.766,P<0.002 1)。铂类药物化疗后,帕唑帕尼维持治疗可显著延长疾病无复发时间,此项实验对初治卵巢癌避免其复发具有一定的临床指导意义。
3 血管生成素抑制剂联合化疗在复发性卵巢癌中的应用
Trebananib为重组肽Fc融合蛋白通过结合Tie2受体,阻止其与血管生成素1和2结合发挥作用,从而阻断血管生成,是一种有别于传统抗VEGF药物的新型血管生成抑制剂,在一定程度上可避免抗VEGF药物导致的严重不良反应。一项关于Trebananib的随机、多中心、双盲Ⅲ期临床研究TRINOVA-1共纳入919例来自32个国家的复发性卵巢癌患者,所以患者之前均接受过≤3次治疗方案,无铂间期均<12个月,研究组461例患者给予紫杉醇80 mg/kg+ Trebananib 15 mg/kg,对照组458例患者给予紫杉醇+安慰剂,直至出现疾病进展或不耐受[1]。结果显示:研究组和对照组中位PFS分别为7.2个月和5.4个月(HR=0.66,P<0.000 1),ORR分别为38%及30%。研究组OS较对照组延长1.7个月,差异无统计学意义(HR=0.86,P=0.19)。3级及3级以上不良事件发生率研究组与对照组基本相似(56%vs. 54%)。研究组治疗中止相关性事件及严重不良事件发生率分别较对照组高(10%vs.6%),且水肿发生率明显高于对照组(64%vs.28%)。值得注意的是,与贝伐单抗联合化疗相比,两组中高血压、蛋白尿、切口愈合不良、血栓事件、胃肠道穿孔等不良事件发生率差异仅为2%,而出血性事件对照组却更常见(10%vs.17%)。Trebananib联合化疗可显著延长复发性卵巢癌患者PFS,此外由于作用机制与抗VEGF药物不同,避免了贝伐单抗在治疗过程中出现的严重不良事件。因此在临床上可以将其与抗VEGF药物作用互补,两种药物的序贯治疗及联合应用或许是下一步临床研究的方向。
基于TRINOVA-1研究结果,目前TRINOVA-2 将Trebananib与聚乙二醇脂质体阿霉素联合,TRINOVA-3将Trebananib与卡铂、紫杉醇联合治疗复发性卵巢癌,这两项Ⅲ期临床研究正处于进行中。TRINOVA-2由于聚乙二醇脂质体阿霉素提供短缺等原因,最终导致实验永久性停止。TRINOVA-3将研究例数从2 000减到1 000,以便于更准确的评估PFS,TRINOVA-3将会为Trebananib治疗复发性卵巢癌的有效性提供进一步的数据。
4 结语
美国FDA批准贝伐单抗应用于复发性铂耐药卵巢癌,给卵巢癌的治疗带来了新的选择,但是贝伐单抗在应用过程中的严重不良反应应引起高度重视;其次,该药价格昂贵,在中国的推广使用可能会受到一定的限制,所以,个体化治疗方案,靶向治疗时机以及避免不良毒副作用是成功应用贝伐单抗的关键。其他抗血管生成药物在卵巢癌治疗方面虽然还处于Ⅱ、Ⅲ期临床试验阶段,但试验结果已显示出可喜的治疗价值,相信随着对肿瘤血管生成机制不断地研究,以及更多、更成熟的试验成功开展,在卵巢癌抗血管生成治疗方面一定会有新的突破,在不久的将来使复发耐药性卵巢癌的治疗不再局限于缓解病情和改善患者症状,而是提高总的生存率。
参考文献
[1]Monk BJ,Poveda A,Vergote I,et al.Anti-angiopoietin therapy with trebananibforrecurrentovariancancer(TRINOVA-1):a randomised,multicentre,double-blind,placebo-controlled phase 3 trial[J].Lancet Oncol,2014,15(8):799-808.
[2]Hennessy BT,Coleman RL,Markman M.Ovarian cancer[J].Lancet,2009,374(9698):1371-1382.
[3]Duncan TJ,Al-Attar A,Rolland P,et al.Vascular endothelial growth factor expression in ovarian cancer:a model for targeted use of novel therapies?[J].Clin Cancer Res,2008,14(10):3030-3035.
[4]PerrenTJ,SwartAM,PfistererJ,etal.Aphase3trialof bevacizumab in ovarian cancer[J].N Engl J Med,2011,365(26):2484-2496.
[5]Banerjee S,Kaye SB.Gynecological cancer:First-line bevacizumab for ovarian cancer--new standard of care?[J].Nat Rev Clin Oncol,2012,9(4):194-196.
[6]Aghajanian C,Blank SV,Goff BA,et al.OCEANS:a randomized, double-blind,placebo-controlled phaseⅢtrial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent epithelial ovarian,primary peritoneal,or fallopian tube cancer[J].J Clin Oncol,2012,30(17):2039-2045.
[7]Pujade-LauraineE,HilpertF,WeberB,etal.Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer:The AURELIA open-label randomized phaseⅢtrial [J].J Clin Oncol,2014,32(13):1302-1308.
[8]Ye Q,Chen HL.Bevacizumab in the treatment of ovarian cancer:a meta-analysis from four phaseⅢrandomized controlled trials[J]. Arch Gynecol Obstet,2013,288(3):655-666.
[9]Hurwitz HI,Saltz LB,Van Cutsem E,et al.Venous thromboembolic events with chemotherapy plus bevacizumab:a pooled analysis of patients in randomized phaseⅡandⅢstudies[J].J Clin Oncol,2011,29(13):1757-1764.
[10]Burger RA,Sill MW,Monk BJ,et al.PhaseⅡtrial of bevacizumab in persistent or recurrent epithelial ovarian cancer or primary peritoneal cancer:a Gynecologic Oncology Group Study[J].J Clin Oncol,2007,25(33):5165-5171.
[11]StarkD,NankivellM,Pujade-LauraineE,etal.Standard chemotherapy with or without bevacizumab in advanced ovarian cancer:quality-of-life outcomes from the International Collaboration on Ovarian Neoplasms(ICON7)phase 3 randomised trial[J].Lancet Oncol,2013,14(3):236-243.
[12]Monk BJ,Huang HQ,Burger RA,et al.Patient reported outcomes of a randomized,placebo-controlled trial of bevacizumab in the frontline treatment of ovarian cancer:a Gynecologic Oncology Group Study[J].Gynecol Oncol,2013,128(3):573-578.
[13]Ivy SP,Wick JY,Kaufman BM.An overview of small-molecule inhibitors of VEGFR signaling[J].Nat Rev Clin Oncol,2009,6(10):569-579.
[14]Welch S,Hirte H,Schilder RJ,et al.PhaseⅡstudy of sorafenib (BAY 43-9006)in combination with gemcitabine in recurrent epithelial ovarian cancer:A PMH phaseⅡconsortium trial[J].J Clin Oncol,2006,24(18 Suppl):5084.
[15]Schwandt A,von Gruenigen VE,Wenham RM,et al.Randomized phaseⅡtrial of sorafenib alone or in combination with carboplatin/ paclitaxel in women with recurrent platinum sensitive epithelial ovarian,peritoneal,or fallopian tube cancer[J].Invest New Drugs,2014,32(4):729-738.
[16]Welch SA,Hirte HW,Elit L,et al.Sorafenib in combination with gemcitabine in recurrent epithelial ovarian cancer:a study of the Princess Margaret Hospital PhaseⅡConsortium[J].Int J Gynecol Cancer,2010,20(5):787-793.
[17]RamasubbaiahR,PerkinsSM,SchilderJ,etal.Sorafenibin combination with weekly topotecan in recurrent ovarian cancer,a phaseⅠ/Ⅱstudy of the Hoosier Oncology Group[J].Gynecol Oncol,2011,123(3):499-504.
[18]Hirte HW,Vidal L,Fleming GF,et al.A phase II study of cediranib (AZD2171)in recurrent or persistent ovarian,peritoneal or fallopian tube cancer:final results of a PMH,Chicago and California consortia trial[J].J Clin Oncol,2008,26(15):431-436.
[19]Matulonis UA,Berlin S,Ivy P,et al.Cediranib,an oral inhibitor of vascular endothelial growth factor receptor kinases,is an active drug in recurrent epithelial ovarian,fallopian tube,and peritoneal cancer [J].J Clin Oncol,2009,27(33):5601-5606.
[20]Ledermann JA,Perren TJ,Raja FA.Randomised double-blind phase Ⅲtrial of cediranib(AZD 2171)in relapsed platinum sensitive ovarian cancer:Results of the ICON6 trial[C].Amsterdam:European Cancer Congress,2013.
[21]Liu JF,Barry WT,Birrer M,et al.Combination cediranib and olaparib versus olaparib alone for women with recurrent platinumsensitive ovarian cancer:a randomised phase 2 study[J].Lancet Oncol,2014,15(11):1207-1214.
[22]Pignata S,Lorusso D,Scambia G,et al.MITO-11:a randomized multicenter phaseⅡtrial testing the addition of pazopanib to weekly paclitaxel in platinum resistant or refractory advanced ovarian cancer (AOC)[J].J Clin Oncol,2014,32(Suppl 15):5503.
[23]Du Bois A,Floquet A,Kim JW,et al.Randomized,double-blind, phaseⅢtrial of pazopanib versus placebo in women who have not progressed after first-line chemotherapy for advanced epithelial ovarian,fallopian tube,or primary peritoneal cancer(AEOC):Results of an international intergroup trial(AGO-OVAR16)[J].Am Soc Clin Oncol,2013,31(Suppl):5503.
[本文编辑王琳]
Research Progress of the Combination of Antiangiogenic Agents and Chemotherapy for Recurrent Ovarian Cancer
ZHANG Jie,WANG Xiao-hui.The First Clinical Medical College of Lanzhou University,Lanzhou 730000,China(ZHANG Jie);Department of Obstetrics and Gynecology,The First Hospital of Lanzhou University,Lanzhou 730000,China(WANG Xiao-hui)Corresponding author:WANG Xiao-hui,E-mail:xiaohuiwang2015@163.com
【Abstract】Ovarian cancer is one of the common gynecologic malignant tumors.The development of it and the metastases of tumor cells need new blood vessels.Therefore,by inhibiting tumor angiogenesis is one of effective ways to treat ovarian cancer. The main antiangiogenic agents included vascular endothelial growth factor inhibitor(such as Bevacizumab),tyrosine kinase inhibitors(such as Sorafenib,Pazopanib and Cediranib),and angiogenin inhibitor(such as Trebananib).The combination of antiangiogenic targeted agents with chemotherapy has been shown to benefit patients with platinum-sensitive or platinumresistant recurrent ovarian cancer by lots of phaseⅡandⅢclinical trials.Meanwhile,combination with chemotherapy provided a clinically meaningful prolongation in progression-free survival.This paper reviewed clinical research status and the latest development with the combination of different antiangiogenic targeted agents and chemotherapy in patients with recurrent ovarian cancer.
【Keywords】Ovarian neoplasms;Antineoplastic combined chemotherapy protocols;Antiangiogenic agents;Bevacizumab;Cediranib;Recurrence ovarian cancer
通信作者:王晓慧,E-mail:xiaohuiwang2015@163.com
收稿日期:(2015-08-09)

