低氮低热量肠外营养在肝叶切除患者术后的应用
陈剑 钟耀星 余莲花 邹道发 孙秋冬
低氮低热量肠外营养在肝叶切除患者术后的应用
陈剑 钟耀星 余莲花 邹道发 孙秋冬
目的 探讨低氮低热量肠外营养对肝叶切除术后患者的影响。方法 将预实施肝叶切除患者60例,随机分为试验组和对照组,各30例,术后分别应用低氮低热量肠外营养和传统肠外营养支持。比较2组患者血浆白蛋白(ALB)、前白蛋白(Pre-ALB)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、术后住院天数及住院费用的变化。结果 (1)手术前后ALB对照组:术前(37.6±3.7),术后3 d(34.2±3.4);试验组:术前(35.7±4.2),术后3 d(35.1±2.8);手术前后Pre-ALB对照组:术前(0.25±0.04),术后3 d(0.23±0.01);试验组:术前(0.26±0.08),术后3 d(0.27±0.03);术后试验组
ALB、Pre-ALB均高于对照组,2组蛋白总体水平较术前均有下降(P<0.05);(2)手术前后AST对照组:术前(125.0±13.5),术后3 d(150±24);试验组:术前(121±15),术后3 d(120±18);手术前后ALT对照组:术前(99.0±15.5),术后3 d(70.0±8.8);试验组:术前(105±12),术后3 d(60.0±10.5)。术后
2组患者AST、ALT均较术前升高(P<0.05),试验组转氨酶水平低于对照组,但差异无统计学意义;(3)2组住院天数:对照组(15±4)d,试验组(13±2)d;2组住院费用:对照组(19 306.0±526.6)元,试验组(18 047.0±415.3)元。试验组术后住院天数和住院费用明显低于对照组(P<0.05)。结论 实施肝叶切除患者术后低氮低热量肠外营养支持有利于改善营养状态,减少术后住院天数和住院费用。
低氮;低热量;肠外营养;肝叶切除
手术创伤可引起机体免疫功能失调、激活潜在的促炎介质,引起局部炎性细胞因子的生成释放,可能继发全身炎症反应[1],其结局是延长住院时间,增加患者住院费用。临床研究表明手术后给予合理的营养支持,有助于减少术后应激反应,缩短住院时间,促进康复。国内多个随机对照研究[2-3]结果提示低氮低热量肠外营养较传统肠外营养更有利于患者术后恢复,所以临床营养支持已成为多种外科疾病的治疗手段。但这些研究大多以胃肠肿瘤手术患者为研究对象,而针对肝叶切除术后患者资料甚少。本研究拟探讨不同氮量、热量肠外营养对肝叶切除术后患者营养状况、肝功能及术后住院天数及住院费用的影响。
1 资料与方法
1.1 一般资料 收集本院2014年10月~2015年10月实施肝叶切除患者60例,将符合纳入标准患者随机分成试验组和对照组,各30例,其中应用低氮低热量肠外营养支持者作为试验组,接受传统肠外营养支持者作为对照组。纳入标准:(1)年龄30~60岁;(2)营养风险筛查(NRS2002)≥3,病情比较平稳;(3)凡实施肝叶切除手术患者,包括肝癌、肝血管瘤、肝囊肿、肝内胆管结石、肝破裂患者;(4)手术方式包括:肝左外叶、肝右后叶、肝左叶、肝右叶切除等。排除标准:(1)严重肝肾功能异常;(2)心功能Ⅳ级;(3)重症感染;(4)有严重干扰能量代谢的疾病或治疗。2组患者手术均由同一手术组完成,并应用统一手术方法及器械,除营养补充方式外其它治疗措施同本院实施该手术传统治疗模式。2组患者一般资料比较差异无统计学意义,具有可比性。见表1。
1.2 方法 将参与试验行肝叶切除患者,于术后第1天开始应用低氮低热量肠外营养补充能量,对照组采用传统肠外营养方式,连续3 d;分别于术后第1~3天抽取晨空腹血检测血浆ALB、Pre-ALB、AST、ALT,并于出院时计算术后住院天数、总住院费用。
1.3 营养支持方法 本研究所有参与试验者,术后第1天起连续3 d补充肠外营养。根据人体应激状态下营养消耗标准补充氮量、热量,试验组采用卡文(1 440 mL,华瑞公司),补充标准:非蛋白质热量为85~105 kJ/(kg・d),氮为0.10~0.15 g/ (kg・d),氮热比为1 g∶410~500 kJ,糖脂比为1∶1~1.2。对照组患者采用单瓶输注葡萄糖、氨基酸和脂肪乳剂,非蛋白质热量为125 kJ/(kg・d),氮为0.20 g/(kg・d),氮热比为1 g:620 kJ,糖脂比为1∶1.2~1.5。试验组和对照组均通过中心静脉均匀输入,同时补充电解质、微量元素及维生素。
1.4 观察指标 在研究开始前及研究结束时,采集所有病例的晨空腹血标本。检测血浆ALB、Pre-ALB、ALT、AST,同时统计患者术后住院天数,住院费用。
1.5 统计学方法 采用SPSS 12.5统计分析软件分析本研究全部数据,计量资料采用“x±s”表示,组间比较采用t检验,计数资料组间比较采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 术前、术后白蛋白变化 术前2组血浆ALB、Pre-ALB的差异无统计学意义,研究结束时2组血浆ALB、Pre-ALB浓度均低于术前,试验组ALB、Pre-ALB水平均高于对照组,2组间比较差异有统计学意义(P<0.05)。见表2。
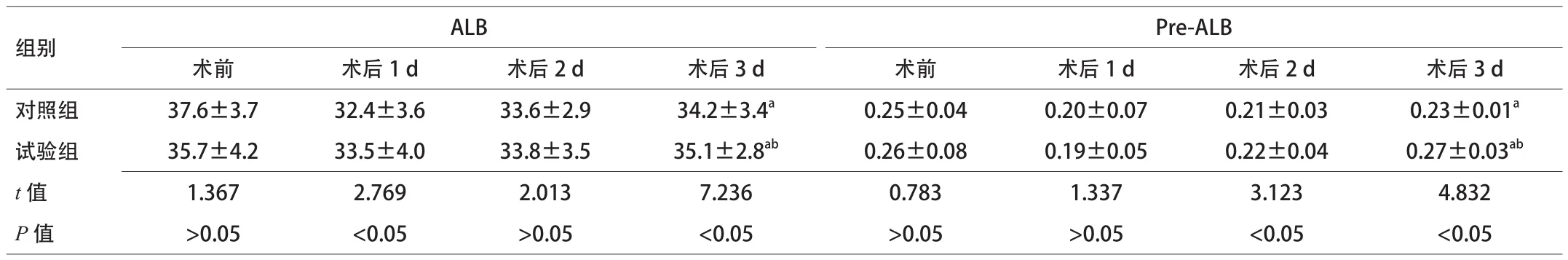
表2 2组术前后血浆蛋白变化比较(x±s,n=30)
2.2 术前后肝功能变化 术前2组AST、ALT的差异无统计学意义,研究结束时2组AST、ALT水平均高于于术前,试验组低于对照组,2组之间比较差异无统计学意义。见表3。
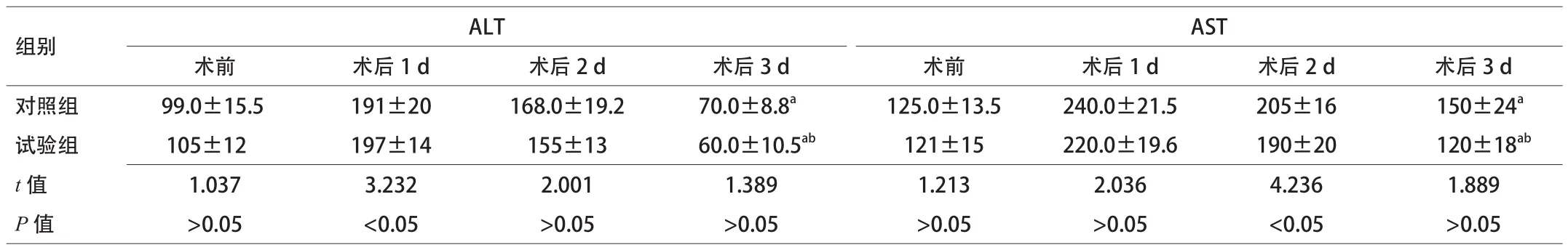
表3 2组术前后肝功能变化情况比较(x±s,n=30)
2.3 术后组间住院费用、术后住院天数变化 研究结束时2组住院费用、术后住院天数对比显示,试验组住院费用、术后住院天数明显低于对照组,2组之间比较差异有统计学意义(P<0.05)。见表4。

表4 2组住院费用及住院天数比较(x±s,n=30)
3 讨论
目前传统肠外营养倾向于进行高热量高氮量的营养补充,张莉研究认为[4]:对于重症患者早期给予高氮、高热量肠外营养法具有显著的临床效果,安全可靠。但近几年来有研究表明[5],严重创伤应激、大手术后等高代谢患者,较高能量与营养底物的供给对患者造成不利的临床结局,同时给予高热量高氮营养,不利于纠正术后蛋白质的分解代谢[6],而且提供过多的氮量对累积氮平衡也无益处,仍会出现负氮平衡,这只会加重患者的应激程度[7]。低氮低热量肠外营养支持,亦可使血糖保持在较低的水平,有利于减少二氧化碳的产生,从而减少心肺不良事件的发生[8],亦可有效对患者组织器官的结构、功能产生维持性作用,降低术后感染的发生率,进而缩短住院时间,减少患者的医疗费用[9]。总之,低氮低热量肠外营养支持是一种安全有效的营养治疗方法,有利于腹部手术后患者的康复[10]。
肝脏本身是主要物质代谢场所,实施肝叶切除手术操作相对复杂、耗时,又是麻醉、手术创伤、大量失血、低氧等各种因素首当其冲损害的脏器。由于手术减少肝组织,增加残存正常肝组织代谢负担,如不合理的能量补充,有可能进一步加重肝脏负担,诱发或加速肝衰;再者,经历大手术后机体处于中重度应激状态,代谢率升高,分解代谢增强,总体呈现负氮平衡,适当的营养支持不但能满足机体的代谢需求,而且有利于术后患者营养状况的改善,因此及时合理的营养支持是肝叶切除等重大手术患者术后治疗重要组成部分。术后及时给予营养支持以维持机体功能与代谢,提高机体免疫力,以利于患者的康复,当然肠外营养支持并非百益无害之事,长时间肠外营养治疗有肠粘膜萎缩,通透性增强和淤胆等缺点,可造成细菌和内毒素的易位,引发败血症,最终可导致多器官衰竭[11]。早期进行低氮低热量肠外营养支持,选择合适时机综合使用营养支持疗法效果比单一使用传统胃肠外营养方法效果好[12]。
本研究结果示,实施肝叶切除患者合并不同程度肝功能损害。术后血浆蛋白水平降低和转氨酶水平升高,考虑与手术创伤、麻醉、术后禁食等因素有关。经合理营养支持,术后肠外营养支持后2组患者血浆ALB、Pre-ALB有所上升,虽未达术前水平,但有升高趋势,提示肝叶切除术后早期营养支持有助于改善患者营养状况;而2组患者转氨酶则均有明显下降趋势,提示经手术切除病损肝组织并合理营养支持,有利于肝功能快速恢复;值得注意的是,试验组术后住院天数、住院费用较对照组明显下降(P<0.05)。由于营养费用低,术后住院天数减少,故住院费用亦同样减少(P<0.05)。
综上所述,肝叶切除术后给予低氮低热量肠外营养支持有利于改善患者营养状态,减少术后住院天数及住院费用。在本研究现有的样本量下,不足以全面完整反映肝叶切除术后应用低氮低热量肠外营养支持的优缺点,但仅从本研究情况来看,近期实验结果令人鼓舞,远期效果及对术后并发症、血糖、免疫功能等的影响,不得而知,均需长周期、大样本、甚至多中心等研究证实。
[1] Badia JM,Whanell SA,Scott-coombes DM,et al.Peritoneal and systemic cytokine response to laparotomy[J].Br J Surg,1996,83(3):347-348.
[2] 詹文华,蒋朱明,唐云,等.低氮低热量肠外营养对胃手术后患者结局的影响:120例随机对照多中心临床研究[J].中华医学杂志,2007, 87(25):1729-1733.
[3] 蒋朱明,王秀荣,韦军民,等.低氮低热量肠外营养与传统氮热量肠外营养对术后患者血糖、感染相关并发症、住院时间、费用等影响的比较(100例随机、对照、多中心临床研究)[J].中国临床营养杂志, 2003,11(3):179-183.
[4] 张莉.重症病人急性期不同肠外营养策略的护理要点分析[J].中外医疗,2015(27):144-146.
[5] Mccowen KC,Friel C,Sternberg J,et al.Hypocaloric total parenteral nutrition:effectiveness in prevention of hyperglycemia and in fectious complications, a randomized clinical trial[J].Crit Care Med,2000,28(11):3606-3611.
[6] Nordenstrom J.Free fatty acid mobilization and oxidation during parenteral nutrition[J].Ann Surg,1983,198:725-730.
[7] 蔡斌,江华,王秀荣,等.低热卡及低氮肠外营养对术后患者影响的随机对照研究的系统评价[J].中国临床营养杂志,2003,11(1):19-23.
[8] 翟春波,李伟,胡德宏.低氮低热量肠外营养对食管癌术后营养状态、血糖和并发症的影响[J].中国医学创新,2014,17(299):11-14.
[9] 李中国,吴瑶强.低氮低热量肠外营养对腹腔镜大肠癌术后患者短期疗效的影响探讨[J].中国医药指南,2016,2(16):107-108.
[10] 康凯,舒晓亮,姬舒荣,等.低氮低热量肠外营养对腹部手术病人疗效及预后影响的Meta分析[J].肠外与肠内营养,2013,20(6):332-337.
[11] 谢毅坚,黄利鹏,洪云峰.肠内、外营养对胃肠道肿瘤术后患者恢复的疗效观察[J].当代医学,2012,18(12):119-120.
[12] 李季冬.低氮低热量肠外营养联合肠内营养在老年胃癌术后的应用分析[J].现代诊断与治疗,2014,25(11):2517-2518.
Objective To observe the effects of hypocaloric andhyponitrogenic parenteral nutrition on patients after hepatolobectomy. Methods Six typatients after hepatolobectomy were randomly divided into control group (n=30) and study group (n=30), treated with hypocaloric and hyponitrogenic parenteral nutrition, and traditional parenteral nutrition respectively.serumalbumin (ALB), prealbumin (Pre-ALB), glutamic oxaloacetic transaminase (AST), glutamic pyruvic transaminase (ALT), postoperative hospital stay, total hospitalization expenditure were analyzed. Results (1)Perioperative period ALB the control group: preoperative (37.6±3.7), postoperative 3d (34.2±3.4); the experimental group: preoperative (35.7±4.2), postoperative 3d (35.1±2.8); perioperative period Pre-ALB the control group: preoperative (0.25±0.04), postoperative3d (0.23±0.01); the experimental group: preoperative (0.26±0.08), postoperative 3d (0.27±0.03); The experimental group ALB, Pre-ALB were higher than the control group after treatment, the overall level of serum proteins were decreased compared with preoperative (P<0.05); (2)Perioperative period AST the control group: preoperative (125.0±13.5), postoperative 3d (150±24); the experimental group: preoperative (121±15), postoperative 3d (120±18); perioperative period ALT the control group: preoperative (99.0±15.5), postoperative 3d (70.0±8.8); the experimental group: preoperative (105±12), postoperative 3d (60.0±10.5). Postoperative AST, ALT were increased compared with preoperative (P<0.05), the experimental group transaminase levels lower than the control group, but the difference was not statistically significant; (3)Postoperative hospital stay: the control group (15±4)d, the experimental group (13±2)d; total hospitalization expenditure: the control group (19 306.0±526.6), the experimental group (18 047.0±415.3). postoperative hospital stay, total hospitalization expenditure were signif i cantly lower than the control group (P<0.05). Conclusion The application of hypocaloric and hyponitrogenic parenteral nutritionon patients after hepatolobectomy will help to improve the nutritional status, reduce postoperative hospital stay and total hospitalization expenditure.
Hypocaloric; Hyponitrogenic; Parenteral nutrition; Hepatolobectomy
10.3969/j.issn.1009-4393.2016.32.002
九江市科技支撑计划项目(20150102)
江西 332400 修水县第一人民医院肝胆外科(陈剑 钟耀星 余莲花 邹道发 孙秋冬)

