基于微卫星标记的22个道氏虹鳟选育家系的遗传多样性研究
杨濯羽,张艳萍,娄忠玉,焦文龙,王 太
(甘肃省水产研究所,甘肃省冷水性鱼类种质资源与遗传育种重点实验室,兰州 730030)
基于微卫星标记的22个道氏虹鳟选育家系的遗传多样性研究
杨濯羽,张艳萍,娄忠玉,焦文龙,王太
(甘肃省水产研究所,甘肃省冷水性鱼类种质资源与遗传育种重点实验室,兰州730030)
摘要:采用10对微卫星标记分析了道氏虹鳟(Oncorhynchus mykiss)22个选育家系的遗传多样性及遗传结构。结果显示:22个道氏虹鳟家系均具有较高的遗传多样性,在9个微卫星位点共获得71个等位基因,平均等位基因数为7.89;平均多态信息含量(PIC)为0.74;平均观测杂合度(Ho)和期望杂合度(He)分别为0.780和0.771。进行Hardy-Weinberg平衡检验,发现22个群体在不同位点均发生了不同程度偏离。计算遗传距离,发现部分家系之间遗传距离较大。综合分析,得出22个道氏虹鳟家系中家系8、家系11、家系12、家系21、家系28、家系29遗传多样性相对丰富,具有较大的遗传潜力,可作为下一代繁育亲本。研究结果对22个道氏虹鳟家系的人工选育及其合理的推广应用具有一定的指导意义。
关键词:道氏虹鳟(Oncorhynchus mykiss);微卫星;遗传多样性;家系选育
虹鳟(Oncorhynchusmykiss)隶属鲑形目(Salmoniformes)鲑科(Salmonidae)大马哈鱼属(Oncorhynchs),是一种适应性很强的冷水性经济鱼类。为了培育优质高产抗逆的优良品种,早在20世纪30年代,美国学者道纳尔逊就已率先成功选育出优质道氏虹鳟品系,然而随着人工选育过程的推进,多年累代养殖所造成的近交繁殖,导致其种质在不同程度上发生退化,使选育群体的遗传多样性降低,生产性能衰退,从而选择效应降低[1]。因此,研究道氏虹鳟遗传变异显得尤为重要,根据其变异情况能够了解遗传结构,从而制订相应的科学措施以保证育种工作顺利进行。
微卫星标记作为一种新型的分子标记技术,在水生生物领域越来越得到重视,目前已广泛应用于人工选育的过程。目前国内外学者已利用微卫星标记对罗非鱼(Oreochromisniloticus)[2]、团头鲂(Megalobramaamblycephala)[3]、鲤(Cyprinuscarpio)[4]、大口黑鲈(Micropterussalmoides)[5]、虹鳟(Oncorhynchusmykiss)等[6-7]进行了良种选育、遗传多样性、指纹图谱构建等方面的研究;国内也有部分学者采用不同的微卫星标记对虹鳟的不同养殖群体[8]以及不同品系[9]进行了遗传结构的探讨,但对于道氏虹鳟家系内部的遗传结构研究甚少。
本研究以22个家系的道氏虹鳟为研究对象,采用微卫星分子标记,通过10对微卫星引物在不同道氏虹鳟家系的扩增情况,得到遗传参数,分析判断不同道氏虹鳟家系的遗传信息及多样性,旨在为筛选优势的道氏虹鳟亲本提供理论基础,为制定和优化育种方案及探讨选育效果提供理论依据。
1材料与方法
1.1实验材料
22个道氏虹鳟家系均来自甘肃省冷水鱼良种繁育场,每个家系随机选取10尾,剪取尾鳍约0.5 g浸泡于95%乙醇中保存,采用高盐法提取基因组DNA。
1.2引物设计
参考张艳萍等[10]及Deiner等[11]的微卫星分子标记引物,共选取10对引物,由上海生工生物工程技术服务有限公司合成,引物信息见表1。
1.3PCR反应体系及程序
PCR反应体系:总体系为13 μL,其中包括6.5 μL含染料的2×TaqPCR Mastermix(TaqDNA Polymerae:0.1 U/Μl;MgCl2:4 mmol/L;dNTPs:0.4 mmol/L),引物(10 mmol/L)各0.5 μL,0.5 μL DNA模板,其余双蒸水补足。PCR反应程序为:94 ℃变性3 min;94 ℃变性35 s,对应引物的退火温度45 s,72 ℃延伸45 s,共30个循环;反应结束后在72 ℃再延伸8 min。
1.4PCR产物凝胶电泳检测
PCR产物在10%变性聚丙烯酰胺凝胶上进行电泳,产物上样量为5 μL,DNA Marker(pBR322 DNA/MspI)上样量为3 μL。电泳条件:电泳缓冲液为1×TBE,电压200 V,电泳时间3~4 h。电泳完成后,进行硝酸银染色,最后将胶片平铺于观片箱上,拍照记录。
1.5数据处理
数据分析根据聚丙烯酰胺凝胶图谱上的扩增条带的位置判断个体的基因型。采用遗传学分析软件Popgen32统计微卫星位点上的等位基因数(Allele number,A)、有效等位基因数(Effective allele number,Ne)、观测杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)、遗传距离(Genetic distance,D),并用该软件计算P值进行χ2检验估计群体Hardy-Weinberg平衡偏离;用little Programe软件计算多态信息含量(Polymorphism Information content,PIC)。

表1 微卫星引物信息
2结果
2.1PCR扩增结果
运用10%聚丙烯酰胺凝胶电泳进行22个家系的10对微卫星分子标记的鉴定,10对微卫星分子标记均能较好地扩增出稳定、清晰的特异性条带,片段大小为84~326 bp,其中位点Omy27为单态性,其余9对均表现出不同程度的多态性。
2.2群体遗传结构
使用Popgen32软件计算9个多态性较高的微卫星标记的等位基因数(A)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、多态信息含量(PIC),结果如表2所示。22个家系在这9个多态性较高的基因位点上,共检测出71个等位基因,各个位点的A为6~12个,平均等位基因数为7.89个,位点AF352767获得等位基因数最多,为12个,AF352746、AF352752及AF352753三个位点的A最少,为6个,Ne在2.417~9.625之间,Ho与He分别在0.587~0.927和0.586~0.896之间,PIC在0.530~0.881,均大于0.5,平均多态信息含量为0.74。

表2 9个微卫星位点的遗传平衡分析
根据表3可以得到22个道氏虹鳟家系在不同微卫星位点上的遗传结构,家系29在这9个微卫星位点上获得的等位基因数目最多为42个,其次为家系28,共获得38个等位基因,家系1与家系3获得的等位基因数最少,为25个。22个家系的平均期望杂合度为0.567~0.978,观测杂合度最高的为家系11,平均观测杂合度为0.480~0.712,平均多态信息含量为0.417~0.666,家系29平均多态信息含量最高,家系1、家系3、家系4、家系5、家系6、家系10、家系30平均多态信息含量小于0.5,其余家系多态信息含量均大于0.5,认为这几个家系多态性低于其他几个家系。
同时由表3可以看出,不同家系在不同位点上获得的等位基因数目有所差异。家系28在位点AF352767获得的等位基因数目最多,为8个;22个家系中杂合子数目较多,家系3、家系4、家系9、家系20、家系23在AF352746位点上Ho为1,家系5、家系6、家系8、家系11、家系12、家系20、家系21、家系23、家系25在位点AF352752上Ho为1,家系3、家系11、家系23、家系27、家系28、家系29在AF352753位点上Ho为1,在其余各个位点,也有部分家系观测杂合度明显高于期望杂合度,说明杂合子过剩;不同家系在不同位点的平均多态信息含量也各不相同,家系9、家系28、家系29、家系28、家系29、家系29、家系20、家系6分别在AF352758位点、AF352752位点、AF352753位点、AF352767位点、AF352758位点、OtsG85位点、OtsG3位点、OtsG401位点上多态信息含量较高。

表3 22个道氏虹鳟家系的遗传多样性

续表3
2.3Hardy-Weinberg平衡检验
本实验各群体在各位点中的P值检验结果见表4。这22个家系在这9个位点上都不同程度的偏离H-W平衡位点,在OtsG3位点上,偏离的家系数量最多,共有11个家系,在AF352746位点上有10个家系偏离H-W平衡,在AF352752位点、AF352753位点、OtsG85位点、OtsG401位点各有5~8个家系偏离H-W平衡,在AF352758位点,除2个家系偏离H-W平衡,其余家系均符合H-W平衡。家系21在这9个位点P值均大于0.05,符合H-W平衡,家系1与家系2仅在1个位点未处于平衡状态。

表4 9个微卫星位点在道氏虹鳟家系中的Hardy-Weinberg平衡检验
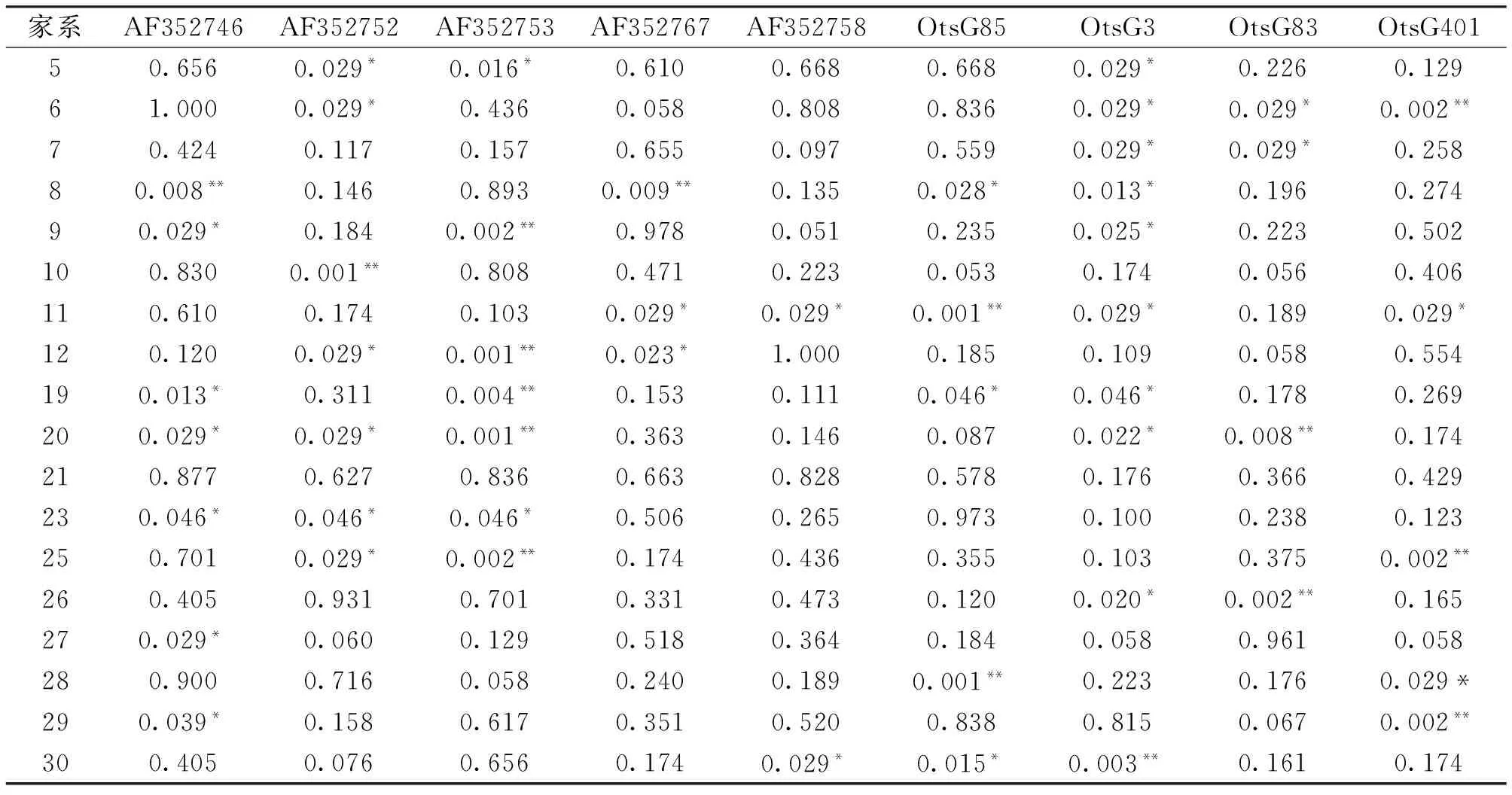
续表4
注:**表示P<0.01;*表示P<0.05
2.4家系之间遗传分化
使用软件Popgen32计算了22个家系之间的遗传距离和遗传相似指数,结果见表5,这22个道氏虹鳟家系遗传相似指数为0.320~0.790,家系4与家系8的遗传距离最大为0.898,家系28与家系25遗传距离最小为0.236。家系20与家系21,家系1与家系30,家系29与家系30,家系29与家系26,家系5与家系28,家系27与家系28,家系27与家系20,家系20与家系21,家系7与家系19,家系10与家系12,家系8与家系9,家系3与家系6,家系4与家系6遗传相似指数均大于0.7,这些家系之间遗传距离较近,分化程度低。家系9与家系3、家系6、家系1遗传相似指数分别为0.329,0.337,0.334,遗传距离较远,分化程度较高。

表5 22个道氏虹鳟家系遗传距离与遗传相似系数分析结果
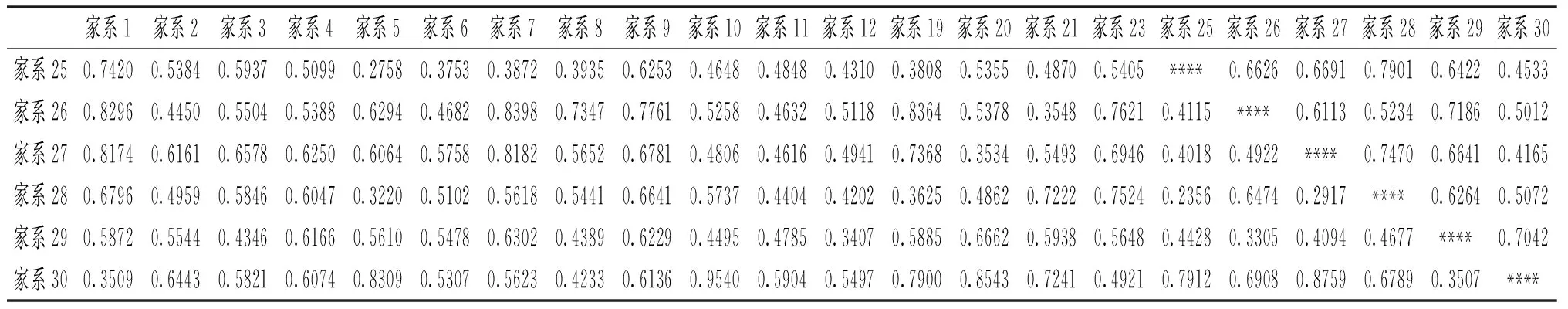
续表5
注:对角线以上为相似性指数,对角线以下为遗传距离。
3讨论
3.1PCR引物扩增的稳定性
微卫星选择的过程中,可以根据利用GenBank数据库信息或者已发表的文章,对相同或相近物种的微卫星引物进行优化设计,从而获得微卫星引物。这是一种较为简捷有效的途径,同时利用这种方法获得的引物得到的扩增产物稳定性较高。本研究中所选择的10对微卫星位点,均来自前人的研究,AF352746、AF352752、AF352753、AF352767、AF352758这些微卫星位点参考张艳萍等[10]的研究。OtsG85、OtsG3、OtsG83、OtsG401、Omy27这些位点参考Deiner等[11]的研究。经过试验发现,这些位点均可以获得清晰明确的条带,可信性较高,除Omy27位点呈现单态性,其余各位点均呈现较高的多态性,在Deiner的研究中发现,Omy27这一位点呈现出一定的多态性,探究原因可能是由于其研究对象为俄罗斯河流域的野生虹鳟,而本研究中实验样品属于人工养殖,由于样品的差别,并未呈现出预期的多态性。
3.2群体遗传结构分析
在已进行的微卫星DNA作为分子标记的遗传研究中,认为扩增产物多态性高低与研究对象本身的遗传多样性水平有高度相关[12]。多态信息含量的高低在一定程度上反映群体的多态性。根据Botstein等[13]对多态信息含量的解释,认为当某一群体的PIC>0.5具有高度多态性,当0.25 杂合度反应各群体在几个位点上的遗传结构变异程度的高低,群体的平均基因的杂合度即为群体杂合子的频率,是群体杂合程度的度量单位。群体平均基因杂合度的高低反映了群体遗传的一致性的程度。平均杂合度越高,则遗传多样性越高,该群体遗传一致性越低;平均杂合度越低,则遗传多样性越低,该群体遗传一致性越高[16]。一般认为,用来评价遗传变异的微卫星标记的平均杂合度范围应该在0.3~0.8之间,本研究获得22个家系平均观测杂合度为0.567~0.978,平均观测杂合度为0.781,略高于前人研究,一方面说明这些道氏虹鳟家系群体有较丰富的遗传变异,遗传多样性丰富,在该位点上杂合子的个体在生存中相比纯合子的个体具有一定的优势,另一方面,杂合子过剩现象也表明所分析群体可能处于不稳定的遗传状态[17]。 3.3Hardy-Weinberg平衡检验分析 微卫星DNA本身并未受到选择压力的影响,在一个理想群体中,各等位基因在群体中的分布频率应该是稳定的[18]。Hardy-Weinberg平衡检验对于遗传结构的分析具有重要意义,进行X2检验,根据P值可以判断基因型是否符合Hardy-Weinberg遗传平衡。本研究中只有家系21在这9个位点P值均大于0.05,在各个位点均符合H-W平衡,家系1仅在OtsG83位点未处于平衡状态,家系2仅在AF352746位点未处于平衡状态。其余大部分道氏虹鳟家系都不同程度地偏离H-W平衡位点,这与赵莹莹等[9]对6个虹鳟养殖群体的H-W平衡检验的结果相似,平衡状态的群体较少,处于不稳定状态的家系较多。这与前面对杂合度的研究相吻合,杂合子过剩,养殖群体处于不稳定的遗传状态,表明养殖群体的遗传多态性受世代人工选择的影响较大。 3.4家系之间遗传分化度量分析 遗传距离是研究物种遗传多样性的基础,它可以探究不同的种群或种之间的基因差异的程度,并且以某种数值将其量化,在一定程度上还能够反映所研究群体的系统进化,被用以描述群体的遗传结构和品种间的差异[19]。本研究中22个道氏虹鳟家系的遗传距离研究中,家系20与家系21,家系1与家系30,家系29与家系30,家系29与家系26等家系间遗传距离较近,分化程度低,从育种的角度进行探讨,遗传距离较小则不适宜作为两亲本,相反群体间的遗传距离大,群体变异性也越大,选择的潜力也越大,则群体的遗传多样性越丰富。故而在亲本的选育过程中,应当选择遗传距离较大的家系作为亲本,来注入新的基因流。本研究中的22个道氏虹鳟家系在进行下一代选育的过程中,可以选择这些遗传距离较远的亲本,从而避免因繁殖亲本数量太少所导致遗传漂变加剧,进一步防止平均杂合度的降低,物种生长速度和抗病力下降等问题的发生[20]。 4小结 综上所述,22个道氏虹鳟家系在9个微卫星位点上呈现出不同的遗传多样性,综合多态信息含量、杂合度、遗传平衡状态以及遗传距离等方面的因素,认为家系8、家系11、家系12、家系21、家系28、家系29具有较多的等位基因数,较高的多态信息含量,在日后的养殖过程中,可以作为家系繁育的亲本,同时在育种过程中应当尽量选择遗传距离较远的家系,尽力避免近亲繁殖,注重对种质资源的保护。 参考文献: [1]孙中武,李超,尹洪滨,等.不同品系虹鳟的肌肉营养成分分析[J].营养学报,2008,30(3):298-302. [2]刘福平,白俊杰,宋红梅,等.尼罗罗非鱼微卫星标记与主要生长性状的相关性分析[J].水产学报,2010,34(2):169-177. [3]罗伟.团头鲂EST-SSR的开发及在育种中的应用[D].武汉:华中农业大学,2014. [4]全迎春,孙效文,梁利群.应用微卫星多态分析四个鲤鱼群体的遗传多样性[J].动物学研究,2005,26(6):595-602. [5]樊佳佳,白俊杰,李胜杰,等.大口黑鲈微卫星DNA指纹图谱的构建和遗传结构分析[J].水生生物学报,2012,36(4):600-609. [6]Robert D W,Knut E J,Greg B M.Microsatellite diversity in rainbow trout (Oncorhynchusmykiss) introduced to Western Australia[J].Aquaculture,2003,219(1):169-179. [7]Sakamoto T,Danzmann R G,Gharbi K.A microsatellite link age map of rainbow trout(Oncorhynchusmykiss) characterized by large sex-specific differences in recombination rates[J].Genetics,2000,155(3):1331-1345. [8]于冬梅,马海涛,孙效文.三个虹鳟养殖群体遗传结构的微卫星分析[J].动物学研究,2007,42(4):8-14. [9]赵莹莹,朱晓琛,孙效文.虹鳟6个养殖群体遗传多样性的微卫星分析[J].遗传,2006,28(8):956-962. [10]张艳萍,苏军虎,龚雪芬,等.甘肃金鳟遗传资源评价及其与日本金鳟和道氏虹鳟遗传分化研究[J].水生生物学报,2010,34(2):262-269. [11]Deiner K,Garza J C,Coey R,et al.Population structure and genetic diversity of trout (Oncorhynchusmykiss) above and below natural and man-made barriers in the Russian River,California[J].Conserv Genet,2007,8(2):437-454. [12]耿波,孙效文,梁利群,等.利用17个微卫星标记分析鳙鱼的遗传多样性[J].遗传,2006,28(6):683-688. [13]Botstein D,White R L,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].Am J Hum Genet,1980,32(3):314-331. [14]徐浩,鲁翠云,郭薇,等.4个虹鳟养殖品系的分子鉴定和遗传多样性分析[J].中国水产科学,2013,20(4):713-721. [15]李鸥,赵莹莹,郭娜,等.草鱼种群SSR分析中样本量及标记数量对遗传多度的影响[J].动物学研究,2009,30(2):121-130. [16]谷伟,王炳谦,赵吉伟,等.虹鳟养殖品系个体繁殖力遗传进展的初步研究[J].淡水渔业,2010,40(6):71-74. [17]田华.鲢鳙长江野生群体和养殖群体微卫星的遗传多样性分析[D].武汉:华中农业大学,2008. [18]张天时,王清印,刘萍.中国对虾(Fenneropenaeuschinensis)人工选育群体不同世代的微卫星分析[J].海洋与湖沼,2005,36(1):72-81. [19]黄磊,王义权.扬子鳄种群的微卫星DNA多态及其遗传多样性保护对策分析[J].遗传学报,2004,31(2):143-150. [20]庞艳红,孙中武,尹洪滨,等.5个虹鳟群体的生化遗传分析[J].水产学报,2007,31(4):539-544. (责任编辑:张潇峮) Genetic diversity of 22 Oncorhynchus mykiss families based on microsatellite analysis YANG Zhuo-yu,ZHANG Yan-ping,LOU Zhong-yu,JIAO Wen-long,WANG Tai (GansuKeyLaboratoryofColdWaterFishesGermplasmResourcesandGeneticBreeding,GansuFisheryResearchInstitute,Lanzhou730030,China) Abstract:Ten microsatellite markers were selected to analyze the genetic diversity and struction of 22 Oncorhynchus mykiss families.The results showed that 22 Oncorhynchus mykiss families had high diversity.There were totally 71 alleles at 9 microsatellite loci,with an average 7.89 per locus.Average PIC was 0.74.Average Ho and He were 0.780 and 0.771.We found that 22 Oncorhynchus mykiss families had different degrees for deviation in different loci by Hardy-Weinberg test.Genetic distance showed several families had large distance.Furthermore,family8,family11,family12,family28 and family 29 had abundant genetic diversity and genetic potencial.They could be used as parent grouper.The result provided guidance for 22 Oncorhynchus mykiss families breeding and utilization. Key words:Oncorhynchus mykiss;microsatellite;genetic diversity;family selection 收稿日期:2015-09-28; 修订日期:2016-01-21 第一作者简介:杨濯羽(1988-),女,硕士,专业方向为鱼类遗传育种。E-mail:yzy03523@qq.com通讯作者:张艳萍。E-mail:aqhongqi@qq.com 中图分类号:S917.4 文献标识码:A 文章编号:1000-6907-(2016)03-0003-07 资助项目:国家自然科学基金(31160529)

