断奶时间对不同日龄湖羊羔羊瘤胃形态及表皮生长相关基因表达的影响
刘 婷 李发弟* 李 冲,2 王维民,2 汪晓娟 李 飞郑 琛 莫负涛 王芳彬 喇永富 李宝胜
(1.甘肃农业大学动物科学技术学院,兰州730070;2.甘肃省肉羊繁育生物技术工程实验室,民勤733300;3.兰州大学草地农业科技学院,兰州730020;4.甘肃金昌中天羊业有限公司,金昌737100)
断奶时间对不同日龄湖羊羔羊瘤胃形态及表皮生长相关基因表达的影响
刘婷1李发弟1*李冲1,2王维民1,2汪晓娟1李飞3郑琛1莫负涛1王芳彬1喇永富1李宝胜4
(1.甘肃农业大学动物科学技术学院,兰州730070;2.甘肃省肉羊繁育生物技术工程实验室,民勤733300;3.兰州大学草地农业科技学院,兰州730020;4.甘肃金昌中天羊业有限公司,金昌737100)
摘要:本试验旨在探讨断奶时间对不同日龄湖羊羔羊瘤胃形态及表皮生长相关基因表达的影响。采用两因子试验设计,设断奶时间和羔羊日龄2个因子。选择初生重[(3.51±0.57) kg]接近的54只湖羊羔羊,28日龄时随机屠宰6只后按照同质性原则将剩余48只湖羊分为28日龄断奶组[(8.21±0.97) kg]和56日龄断奶组[(8.06±0.53) kg],分别在42、56、70和84日龄从2组中各随机挑选6只羔羊进行屠宰。采集瘤胃腹囊组织样品测定瘤胃乳头长度、宽度和肌层厚度,提取瘤胃组织总RNA测定表皮生长相关基因表达量。结果表明:28日龄断奶组羔羊瘤胃乳头长度和宽度显著高于56日龄断奶组羔羊(P<0.05),瘤胃肌层厚度显著低于56日龄断奶组羔羊(P<0.05)。断奶时间和羔羊日龄之间的交互作用对瘤胃乳头长度和肌层厚度有显著影响(P<0.05)。28日龄断奶组羔羊瘤胃上皮胰岛素样生长因子结合蛋白(IGFBP)3、IGFBP5和IGFBP6表达量显著高于56日龄断奶组(P<0.05)。羔羊瘤胃乳头长度与转化生长因子β(TGFβ)1和IGFBP6表达量呈显著负相关(r=-0.318,P=0.001;r=-0.520,P<0.001);瘤胃乳头宽度与TGFβ1表达量呈显著负相关(r=-0.275,P=0.004),与IGFBP3和IGFBP5表达量呈显著正相关(r=0.344,P<0.001;r=0.256,P=0.001)。综上所述,28日龄断奶促进湖羊羔羊瘤胃乳头发育和瘤胃表皮生长相关基因表达,可能参与羔羊瘤胃早期发育的调控。
关键词:湖羊羔羊;早期断奶;瘤胃形态学;发育;基因表达
羔羊生长发育过程中瘤胃发育是一个重要的环节,断奶后瘤胃内发酵类型的改变,将难以消化的纤维类物质降解为最终产物挥发性脂肪酸,瘤胃上皮对于挥发性脂肪酸的吸收转运很大程度取决于角质层厚度。研究表明,高营养水平饲粮可通过增加上皮基底层细胞数量和提高细胞分化迁移率,引起棘状细胞层和颗粒层细胞数量增加,促进瘤胃上皮的发育[1]。瘤胃上皮细胞在胎儿期开始分化,直到出生时,分化仍未完成。出生时,可利用显微镜在瘤胃上皮观察到瘤胃乳头,随着年龄增长和饲料的影响,瘤胃乳头的面积、长度和宽度逐渐增加[2]。幼龄反刍动物瘤胃的发育与采食饲料类型直接相关。犊牛只采食牛奶时,其瘤胃乳头并不发育;牛奶和饲草共同饲喂对瘤胃乳头发育起不到有效的刺激作用[3]。此外,Žitan等[4]试验表明,早期断奶犊牛乳头的表面积大于常规饲养犊牛,但Klein等[5]使用2种不同的断奶体系,却并未发现与žitan等[4]相似的结果。本试验对早期饲喂开食料断奶时间不同的湖羊羔羊瘤胃形态发育展开研究,并揭示瘤胃乳头发育相关基因与湖羊羔羊瘤胃发育之间关系,为羔羊早期断奶及补饲提供理论依据。
1材料与方法
1.1试验动物及试验设计
试验采用两因子试验设计,设断奶时间和羔羊日龄2个因子。试验动物购于甘肃金昌中天羊业有限公司,选取初生重[(3.51±0.57) kg]接近的54只湖羊双羔饲养至28 d,随机屠宰6只[(8.22±0.87) kg]后按同质性原则将剩余48只湖羊分为28日龄断奶组[(8.21±0.97) kg]和56日龄断奶组[(8.06±0.53) kg]。28日龄断奶组在分组当天断奶,56日龄断奶组在56日龄断奶。
1.2试验饲粮及饲养管理
所有羔羊都从7日龄开始补饲开食料1,60日龄逐渐更换开食料2,过渡期10 d。开食料压缩比均为1∶6,制粒直径均为2.5 mm。饲粮中干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)、钙(Ca)和磷(P)含量测定参照《AOAC分析方法手册》[6]及《饲料分析及饲料质量检测技术》[7]。消化能和淀粉含量计算参照文献[8-9],开食料各个组成原料的绵羊消化能和淀粉含量,乘以开食料中各个原料的组成比例后,求出它们之和。开食料组成及营养水平见表1,开食料1和开食料2的精粗比分别为78∶22、57∶43。
羔羊与母羊共同饲养在同一圈栏内,圈栏内安有补饲栏。每天08:00—10:00、12:00—14:00、18:00—20:00将羔羊关进补饲栏,使其与母羊隔开,母羊采食饲料。母羊料为常规全混合日粮(TMR)(原料为青贮玉米40%、燕麦草12%、苜蓿10%、大麦秸秆8%、油菜秸秆5%、豆渣13%、玉米9%、豆粕3%,营养水平为消化能7.38 MJ/kg、粗蛋白质7.60%、钙0.32%、磷0.25%)。母羊采食TMR后,将饲槽和圈舍清扫干净,避免羔羊跟随母羊时采食母羊料,其余时间羔羊可跟随母羊自由吮乳。圈舍每隔15 d彻底消毒1次。表2为28日龄断奶组和56日龄断奶组羔羊不同日龄阶段日均干物质采食量。由于羔羊随母羊群饲,数据未进行统计分析。
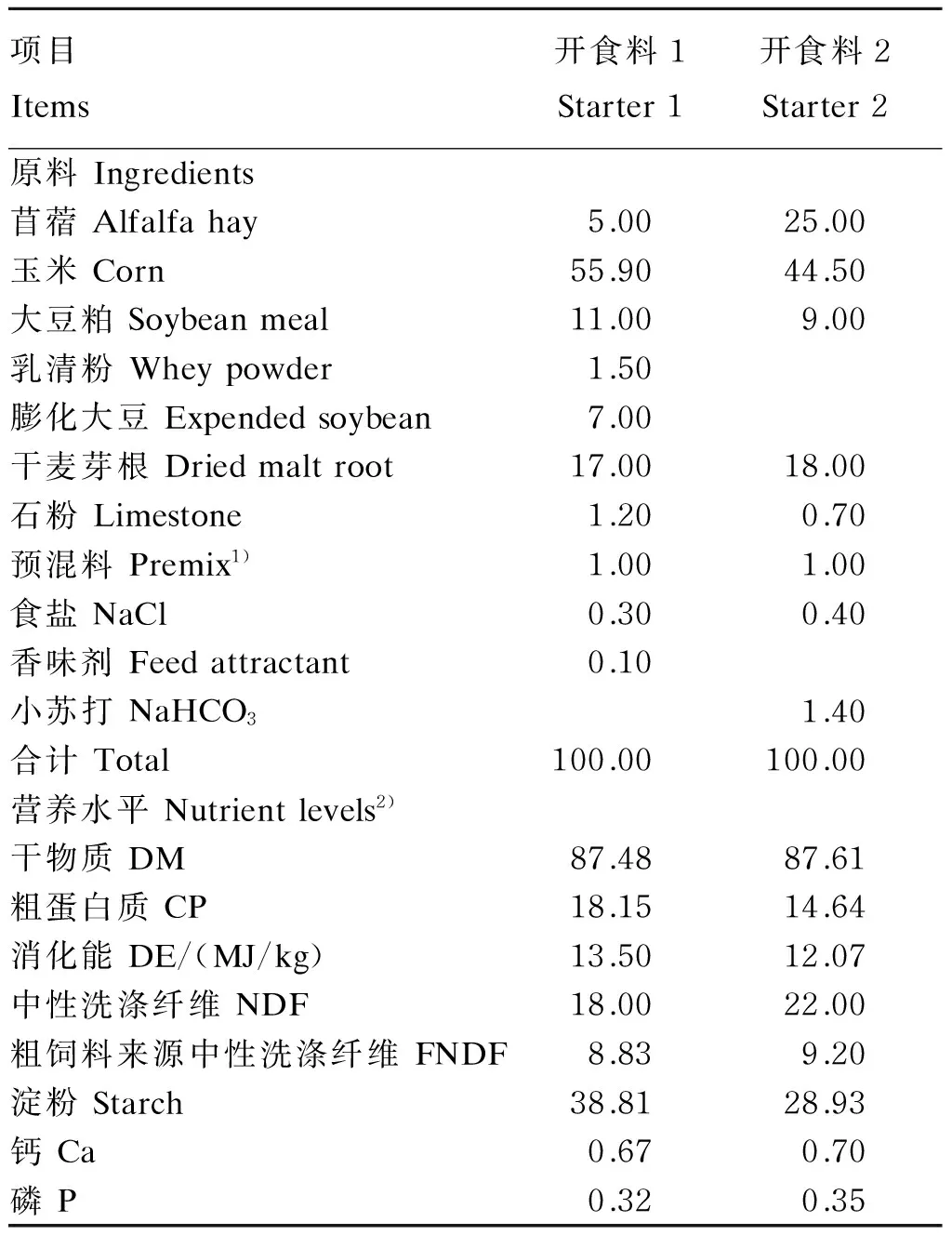
表1 开食料组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of diets:Fe 25 mg,Zn 40 mg,Cu 8 mg,Mn 40 mg,I 0.3 mg,Se 0.2 mg,Co 0.1 mg,VA 940 IU,VD 111 IU,VE 20 IU。
2)干物质、粗蛋白质、中性洗涤纤维、钙和磷为实测值,其他为计算值。DM, CP, NDF, Ca and P were measured values, while the others were calculated values.
1.3样品采集
试验羔羊分别于28、42、56、70和84日龄屠宰采样,每组在每个时间点随机屠宰6只羔羊。屠宰后迅速采集瘤胃腹囊右侧上皮组织5块,每块大小约为2 cm×2 cm×2 cm,用预冷的生理盐水冲洗干净后立即放入2.0 mL Eppendorf管,投入液氮速冻,后放入-80 ℃备用。采集瘤胃腹囊上皮组织,用预冷的磷酸盐缓冲液(PBS,pH=7.4,1×)反复冲洗后,立即放入4%甲醛溶液固定。将瘤胃内容物用4层纱布过滤,滤液装入5 mL Eppendorf管,投入液氮速冻,后放入-80 ℃备用。
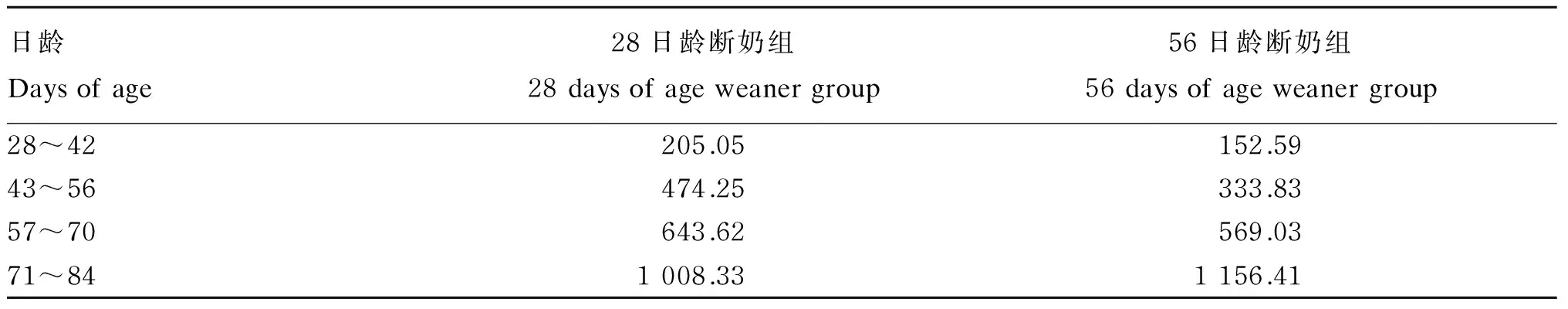
表2 湖羊羔羊不同日龄阶段日均干物质采食量
1.4主要仪器与试剂
显微镜(IX71,日本Olympus公司),实时定量PCR仪(CFX96,美国Bio-Rad公司),微量紫外可见分光光度计(NANODrop2000,德国Thermo公司),电泳仪(PowerPacTM,美国Bio-Rad公司)、凝胶成像仪(GelDoc-It310,美国UVP公司),气相色谱仪(Focus GC AI 3000,德国Thermo公司)。
Trizol、反转录试剂盒、SYBR Green PCR Master Mix均购自北京全式金生物技术有限公司。
1.5试验方法
1.5.1总RNA提取
按照Trizol的使用说明提取瘤胃腹囊上皮组织总RNA。用微量紫外可见分光光度计测定总RNA浓度和纯度,并用1.0%琼脂糖凝胶电泳检测总RNA的质量。
1.5.2实时定量PCR
参照TransScript One-Step gDNA Removal and cDNA Sythesis Super Mix试剂盒说明书中选择一种方法进行反转录(RT)。应用引物设计软件Primer5设计引物,以甘油酸-3-磷酸脱氢酶(GAPDH)为内参基因,使用20 μL的扩增体系:10 μL SYBR Premix Ex Taq Ⅱ,0.4 μL上游引物(10 μmol/L)和0.4 μL下游引物(10 μmol/L)(表3),1 μL cDNA,8.2 μL ddH2O,混合样品。扩增条件为:95 ℃预变性2 min;95 ℃变性10 s,退火20 s,72 ℃延伸10 s,读板2次,40个循环,72 ℃延伸5 min;熔解曲线条件为:60~95 ℃,每隔0.05 s读板1次;阴性对照用1 μL ddH2O代替模板。试验对每个样品检测进行4个技术重复。

表3 基因引物序列及参数
1.5.3光镜观察
石蜡切片制作过程参照施恩青[10]推荐方法。瘤胃组织用冰冷的PBS冲洗干净后,取瘤胃腹囊底部约1 cm2。将所采集的组织迅速投入4%甲醛溶液中固定,以备制作组织切片和相关测定。石蜡包埋、切片、苏木精-伊红染色后,选择5张切片,每张切片选5个典型视野(组织完整),分别测量瘤胃背囊乳头长度和宽度,瘤胃肌层的厚度。采用Image-Pro Express 6.0图像分析系统软件测量瘤胃乳头宽度和长度。
1.5.4瘤胃内挥发性脂肪酸的测定
使用气相色谱仪(AI 3000,德国Thermo公司)测定瘤胃液中挥发性脂肪酸含量。色谱柱为HP 19091N-213毛细管柱(Aglient)。色谱条件为:进样口温度220 ℃,氮气流量2.0 mL/min,分流比40∶1,程序升温模式(120 ℃ 3min,然后10 ℃/min至180 ℃,保持1 min),火焰氢离子检测器(FID)250 ℃,FID的空气、氢气和氮气流量分别为450、40和45 mL/min。
1.6数据统计分析
实时定量PCR样品设置相同的阈线值,采用2-△△CT方法处理数据[11]。数据分析利用SPSS 19.0统计分析软件进行两因子方差分析(two-way ANOVA,LSD),差异显著时,采用Tukey’s法进行多重比较,以P<0.05作为差异显著性判断标准。利用SPSS 19.0统计分析软件对数据(n=54)进行Pearson相关性分析,P<0.05为差异显著。
2结果
2.1瘤胃乳头形态
由表4可知,断奶时间和羔羊日龄之间的交互作用和断奶时间对羔羊瘤胃乳头长度和肌层厚度有显著影响(P<0.05)。
28日龄断奶组羔羊瘤胃乳头长度和宽度显著高于56日龄断奶组羔羊(P<0.05),但瘤胃肌层厚度显著低于56日龄断奶组羔羊(P<0.05)。
日龄对羔羊瘤胃乳头长度和肌层厚度产生显著性影响(P<0.05)。56、70和84日龄羔羊瘤胃乳头长度显著高于28和42日龄羔羊(P<0.05),42日龄羔羊瘤胃乳头长度显著高于28日龄羔羊(P<0.05)。56和70日龄时,羔羊瘤胃肌层厚度显著高于28、42和84日龄羔羊(P<0.05)。日龄对羔羊瘤胃乳头宽度无显著影响(P>0.05)。
表4 断奶时间对不同日龄湖羊羔羊瘤胃乳头形态的影响
Table 4 Effects of weaner time on morphological structure of rumen papillae ofHu lambs at different days of age m

表4 断奶时间对不同日龄湖羊羔羊瘤胃乳头形态的影响
项目Items日龄Daysofage瘤胃乳头长度Papillaheight瘤胃乳头宽度Papillawidth肌层厚度Muscularthickness28日龄断奶组28daysofageweanergroup28741.92d513.80835.07d421280.04bc664.28844.41d561667.51ab571.921131.56ab701908.78a595.82910.76cd841737.20ab640.00867.91d56日龄断奶组56daysofageweanergroup28741.92d513.80835.07d421035.51cd508.89849.62d561444.62b448.481080.36abc701487.37b500.791170.70a841605.07a465.30949.16bcd28日龄断奶组28daysofageweanergroup1610.38a618.01a937.81b56日龄断奶组56daysofageweanergroup1435.34b480.86b1012.46a28日龄28daysofage741.92c513.80835.07b42日龄42daysofage1157.77b586.58847.02b56日龄56daysofage1530.80a510.201105.96a70日龄70daysofage1698.07a548.311040.73a84日龄84daysofage1746.04a552.65906.84bSEM33.6413.2918.50
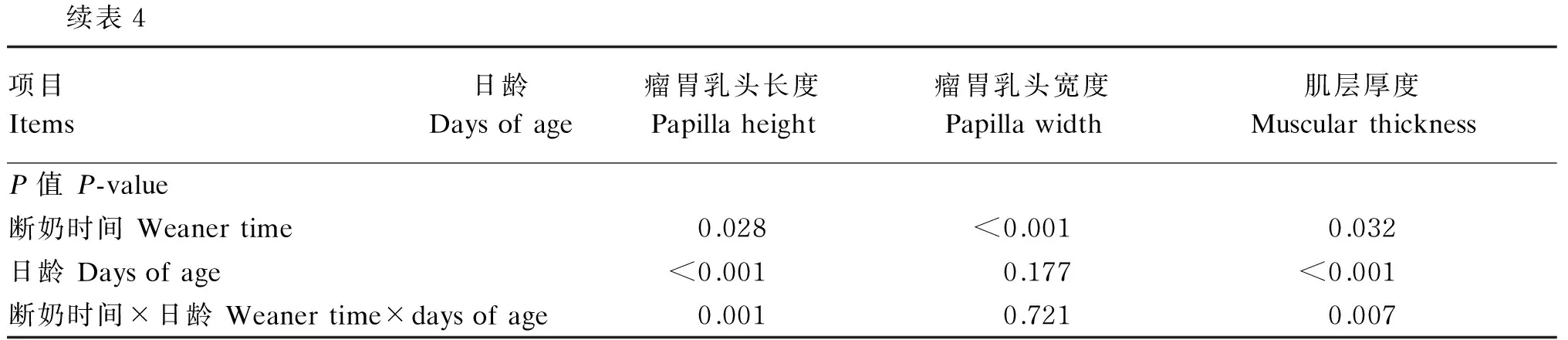
续表4项目Items日龄Daysofage瘤胃乳头长度Papillaheight瘤胃乳头宽度Papillawidth肌层厚度MuscularthicknessP值P-value断奶时间Weanertime0.028<0.0010.032日龄Daysofage<0.0010.177<0.001断奶时间×日龄Weanertime×daysofage0.0010.7210.007
同一项目、同列数据肩标相同或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
Values in the same column of the same item with the same or no letter superscripts mean no significant difference (P>0.05), and those with different lowercase letter superscripts differ significantly (P<0.05). The same as below.
2.2断奶时间对湖羊羔羊表皮生长相关基因表达量的影响
由表5可知,断奶时间和羔羊日龄之间的交互作用对羔羊瘤胃上皮转化生长因子β(TGFβ)1、胰岛素样生长因子结合蛋白(IGFBP)3、IGFBP5和IGFBP6表达量产生了显著影响(P<0.05)。
断奶时间对IGFBP3、IGFBP5和IGFBP6表达量有显著影响。28日龄断奶组羔羊瘤胃上皮IGFBP3、IGFBP5和IGFBP6表达量显著高于56日龄断奶组羔羊(P<0.05)。其他差异不显著(P>0.05)。
羔羊日龄对湖羊羔羊瘤胃上皮TGFβ1、IGFBP3和IGFBP5表达量有显著影响(P<0.05)。42、70和84日龄羔羊瘤胃上皮TGFβ1表达量显著高于28和56日龄表达量(P<0.05)。羔羊瘤胃上皮IGFBP3表达量,84日龄显著高于28、42和56日龄(P<0.05);56日龄显著高于28日龄(P<0.05)。羔羊瘤胃上皮IGFBP5表达量,56日龄显著高于28、70和84日龄(P<0.05);70和84日龄日龄显著高于28日龄(P<0.05)。羔羊日龄对瘤胃上皮IGFBP6表达量无显著性影响(P>0.05)。

表5 断奶时间对不同日龄湖羊羔羊瘤胃表皮生长相关基因表达量的影响
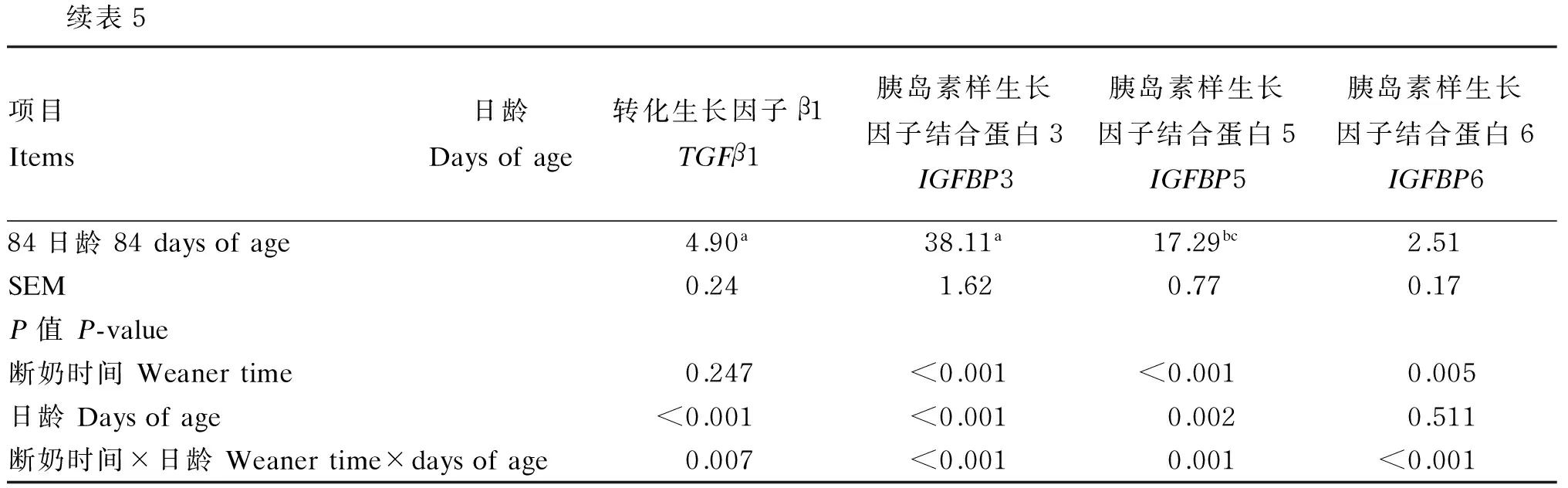
续表5项目Items日龄Daysofage转化生长因子β1TGFβ1胰岛素样生长因子结合蛋白3IGFBP3胰岛素样生长因子结合蛋白5IGFBP5胰岛素样生长因子结合蛋白6IGFBP684日龄84daysofage4.90a38.11a17.29bc2.51SEM0.241.620.770.17P值P-value断奶时间Weanertime0.247<0.001<0.0010.005日龄Daysofage<0.001<0.0010.0020.511断奶时间×日龄Weanertime×daysofage0.007<0.0010.001<0.001
2.3相关性分析
对试验54只羔羊瘤胃形态参数,短链脂肪酸(SCFA)和瘤胃上皮生长相关基因进行相关性分析。由表6可知,羔羊瘤胃液SCFA含量与瘤胃乳头长度、肌层厚度及瘤胃上皮TGFβ1、IGFBP3和IGFBP5表达量显著正相关(r=0.562,P<0.001;r=0.349,P<0.001;r=0.205,P=0.002;r=0.219,P=0.032;r=0.265,P=0.026),但与IGFBP6表达量显著负相关(r=-0.616,P<0.001)。丙酸含量与羔羊瘤胃乳头长度显著正相关(r=0.226,P=0.007)。丁酸含量与羔羊瘤胃乳头宽度和瘤胃上皮IGFBP5表达量显著正相关(r=0.216,P=0.009;r=0.316,P<0.001),与瘤胃上皮IGFBP6表达量显著负相关(r=-0.274,P=0.005)。
羔羊瘤胃乳头长度与瘤胃上皮TGFβ1和IGFBP6表达量呈显著负相关(r=-0.318,P=0.001;r=-0.520,P<0.001)。羔羊瘤胃乳头宽度与TGFβ1呈显著负相关(r=-0.275,P=0.004),与IGFBP3和IGFBP5呈显著正相关(r=0.344,P<0.001;r=0.256,P=0.001)。
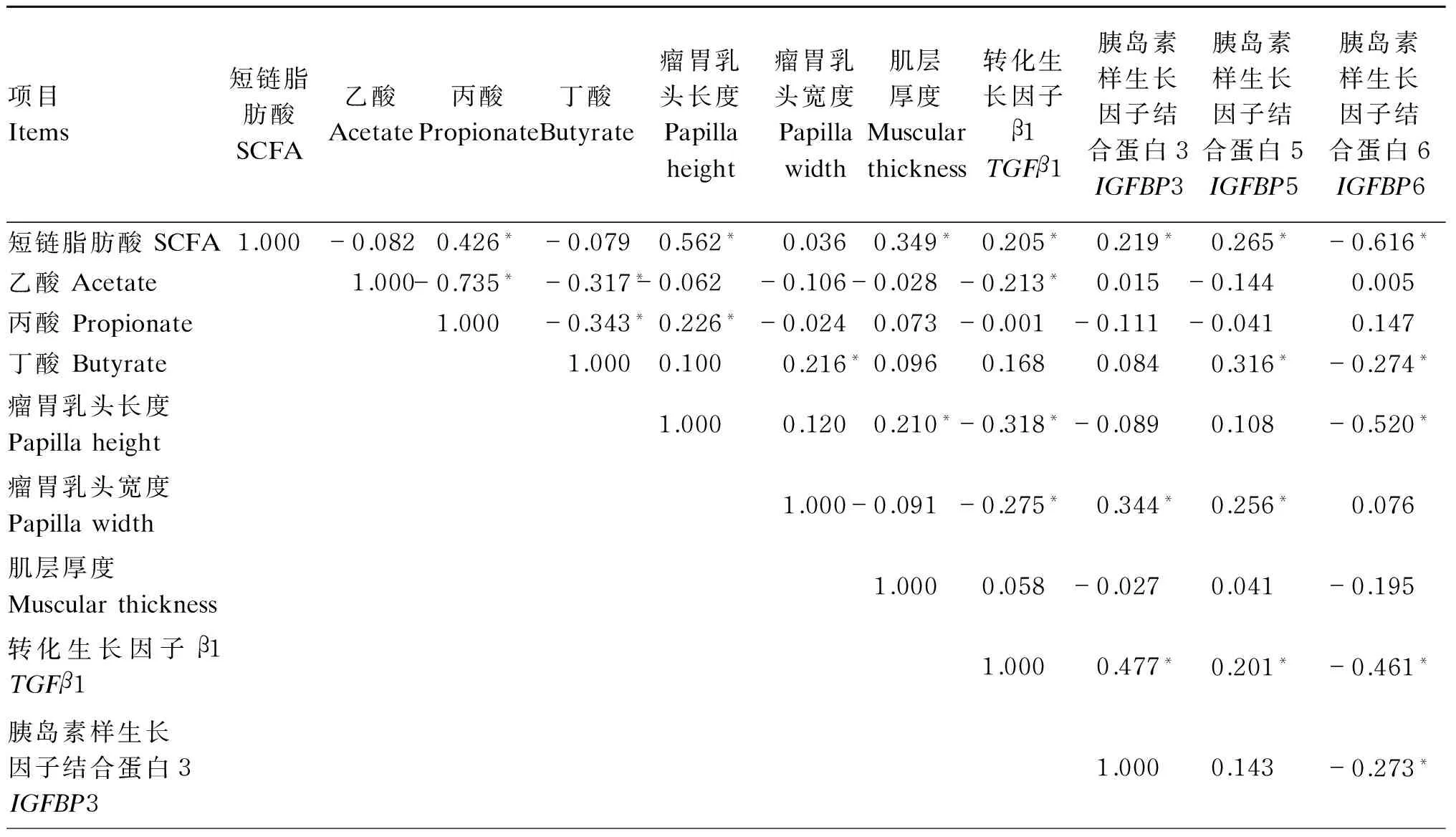
表6 瘤胃表皮生长相关基因与瘤胃形态和短链脂肪酸关联性分析

续表6项目Items短链脂肪酸SCFA乙酸Acetate丙酸Propionate丁酸Butyrate瘤胃乳头长度Papillaheight瘤胃乳头宽度Papillawidth肌层厚度Muscularthickness转化生长因子β1TGFβ1胰岛素样生长因子结合蛋白3IGFBP3胰岛素样生长因子结合蛋白5IGFBP5胰岛素样生长因子结合蛋白6IGFBP6胰岛素样生长因子结合蛋白5IGFBP51.000-0.103胰岛素样生长因子结合蛋白6IGFBP61.000
*表示显著相关 (P<0.05)。
* meant significant correlation (P<0.05).
3讨论
生长因子超家族中的TGFβ控制包括细胞增殖、识别、分化和细胞凋亡等各种过程[12-13],本试验中,羔羊瘤胃上皮TGFβ1表达量与瘤胃乳头长度和宽度呈显著负相关。有试验证明,TGFβ1的下调能促进瘤胃发育[14]。TGFβ1可能抑制羔羊瘤胃上皮细胞增殖和乳头状生长,Naeem等[15]的试验也得到了相同的结果。
研究发现,胰岛素样生长因子(IGF)对瘤胃上皮细胞的促增殖作用主要受IGFBP家族的调控[16]。瘤胃内丁酸含量影响IGFBP调节IGF1在组织细胞中活动[17]。本试验羔羊瘤胃液丁酸含量与IGFBP5表达量呈显著正相关,丁酸可能会影响到IGF轴,促使其分泌促细胞分化的激素,减少促细胞凋亡激素的分泌[18]。本试验中28日龄断奶组羔羊瘤胃上皮IGFBP5表达量显著高于56日龄断奶组,Steele等[19]试验证实,IGFBP5表达量上调时促进瘤胃上皮细胞的增殖,从而促进了28日龄断奶组瘤胃乳头长度和宽度显著高于56日龄断奶组羔羊。这也与本试验中,IGFBP5表达量与瘤胃乳头宽度呈显著正相关的结果一致。IGFBP6结合IGF2优先于IGF1,IGFBP6具有抑制IGF2的功能。在本试验中,羔羊瘤胃上皮IGFBP6表达量与乳头长度和宽度呈显著负相关。这与之前Bach等[20]的试验中IGFBP6在瘤胃上皮具有抑制作用的结果一致。IGFBP3抑制瘤胃组织细胞IGF1的活性,瘤胃内丁酸含量增加时,引起IGFBP3表达量下调[19,21]。但是,本试验中羔羊瘤胃乳头长度与瘤胃上皮IGFBP3表达量呈显著正相关,其原因还有待于进一步研究。
反刍动物瘤胃形态学研究中,瘤胃乳头长度是最重要的指标,其次是瘤胃乳头宽度和瘤胃壁厚度[22]。断奶前,小肠吸收是羔羊获得能量的主要来源。羔羊采食固体饲料时,瘤胃乳头开始增长,瘤胃黏膜开始加厚[23]。本试验28~84日龄28日龄断奶组羔羊日均干物质采食量(582.81 g/d)高于56日龄断奶组(552.97 g/d)。28日龄断奶组羔羊瘤胃乳头长度和宽度显著高于56日龄断奶组羔羊,28日龄断奶组瘤胃SCFA含量与瘤胃乳头长度呈正相关。这是因为羔羊断奶后,采食量增加,导致瘤胃内总挥发性脂肪酸含量增加,促进瘤胃发育[24]。Anderson等[25]报道28日龄断奶犊牛瘤胃内丙酸和丁酸含量显著高于未断奶犊牛。本试验28日龄断奶组瘤胃丙酸含量与瘤胃乳头宽度和肌层厚度呈正相关。有研究表明,丙酸和丁酸是影响瘤胃乳头发育的重要因素[26-27]。此外,由于羔羊对固体饲料采食量增加,瘤胃物理性刺激增强,进一步促进瘤胃乳头的发育[28]。žitan等[4]和Stobo等[29]试验也证明,犊牛早期断奶可显著增加瘤胃乳头长度。新生反刍动物的瘤胃壁很薄,瘤网胃的容积很小。本试验结果表明,56日龄断奶组羔羊瘤胃肌层厚度显著高于28日龄断奶组,Stobo等[29]试验也证实,随着精料饲喂量的增加,羔羊瘤胃肌层厚度没有显著变化。但是,本试验羔羊日龄和断奶时间的交互作用对于羔羊瘤胃肌层厚有显著性的影响。Žitan等[4]研究发现,断奶后犊牛瘤胃乳头数量随着年龄的增长而降低。本试验中没有测量瘤胃乳头数量,早期断奶如何影响湖羊瘤胃乳头数量变化还有待于进一步的研究。
4结论
在本试验饲养管理模式下,28日龄断奶能提高湖羊羔羊的开食料采食量,且促进瘤胃乳头发育。羔羊瘤胃内SCFA能促进瘤胃上皮IGFBP3、IGFBP5和IGFBP6表达,抑制TGFβ1表达;羔羊瘤胃上皮IGFBP5表达上调与瘤胃乳头发育呈显著正相关。
参考文献:
[1]LESMEISTER K E,HEINRICHS A J, GABLER M T.Effects of supplemental yeast (Saccharomycescerevisiae) culture on rumen development,growth characteristics,and blood parameters in neonatal dairy calves[J].Journal of Dairy Science,2004,87(6):1832-1839.
[2]RUSSELL J B,O’CONNOR J D,FOX D G,et al.A net carbohydrate and protein system for evaluating cattle diets:Ⅰ.Ruminal fermentation[J].Journal of Animal Science,1992,70(11):3551-3561.
[3]LESMEISTER K E,HEINRICHS A J.Effects of adding extra molasses to a texturized calf starter on rumen development,growth characteristics,and blood parameters in neonatal dairy calves[J].Journal of Dairy Science,2005,88(1):411-418.
[5]KLEIN R D,KINCAID R L,HODGSON A S,et al.Dietary fiber and early weaning on growth and rumen development of calves[J].Journal of Dairy Science,1987,70(10):2095-2104.
[6]李述信,孟广政,于建国,等.AOAC分析方法手册[M].14版.北京:中国光学学会光谱专业委员会,1986.
[7]张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007.
[8]中国饲料数据库.中国饲料成分及营养价值表(2013年第24版)(续)[J].中国饲料,2013(22):38-42.
[9]马志远,李飞,李发弟,等.早期断奶对湖羊羔羊生长性能及胃肠道发育的影响[J].动物营养学报,2015,27(5):1385-1393.
[10]施恩青.改良与常规石蜡切片方法在切片质量方面的比较[J].齐齐哈尔医学院学报,2014,35(16):2442-2443.
[11]SCHMITTGEN T D,LIVAK K J.Analyzing real-time PCR data by the comparative CTmethod[J].Nature Protocols,2008,3(6):1101-1108.
[12]SHI Y G,MASSAGUÉ J.Mechanisms of TGF-β signaling from cell membrane to the nucleus[J].Cell,2003,113(6):685-700.
[13]KRISHNAN K,ARNONE B,BUCHMAN A.Intestinal growth factors:potential use in the treatment of inflammatory bowel disease and their role in mucosal healing[J].Inflammatory Bowel Diseases,2011,17(1):410-422.
[14]CONNOR E E,BALDWIN Ⅵ R L,WALKER M P,et al.Transcriptional regulators transforming growth factor-β1and estrogen-related receptor-α identified as putative mediators of calf rumen epithelial tissue development and function during weaning[J].Journal of Dairy Science,2014,97(7):4193-4207.
[15]NAEEM A,DRACKLEY J K,LANIER J S,et al.Ruminal epithelium transcriptome dynamics in response to plane of nutrition and age in young Holstein calves[J].Functional & Integrative Genomics,2014,14(1):261-273.
[16]FIRTH S M,BAXTER R C.Cellular actions of the insulin-like growth factor binding proteins[J].Endocrine Reviews,2002,23(6):824-854.
[17]SANDERSON I R.Short chain fatty acid regulation of signaling genes expressed by the intestinal epithelium[J].The Journal of Nutrition,2004,134(9):2450S-2454S.
[18]MALHI M,GUI H B,YAO L,et al.Increased papillae growth and enhanced short-chain fatty acid absorption in the rumen of goats are associated with transient increases in cyclin D1expression after ruminal butyrate infusion[J].Journal of Dairy Science,2013,96(12):7603-7616.
[19]STEELE M A,CROOM J,KAHLER M,et al.Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J].American Journal of Physiology Regulatory,Integrative and Comparative Physiology,2011,300(6):R1515-R1523.
[20]BACH L A.IGFBP-6 five years on; not so ‘forgotten’?[J].Growth Hormone & IGF Research,2005,15(3):185-192.
[21]STEELE M A,SCHIESTEL C,ALZAHAL O,et al.The periparturient period is associated with structural and transcriptomic adaptations of rumen papillae in dairy cattle[J].Journal of Dairy Science,2015,98(4):2583-2595
[22]LESMEISTER K E,TOZER P R,HEINRICHS A J.Development and analysis of a rumen tissue sampling procedure[J].Journal of Dairy Science,2004,87(5):1336-1344.
[23]GORKA P,KOWALSKI Z M,PIETRZAK P,et al.Effect of sodium butyrate supplementation in milk replacer and starter diet on rumen development in calves[J].Journal of Physiology and Pharmacology,2009,60(Suppl.3):47-53.
[24]REY M,ENJALBERT F, MONTEILS V.Establishment of ruminal enzyme activities and fermentation capacity in dairy calves from birth through weaning[J].Journal of Dairy Science,2012,95(3):1500-1512.
[25]ANDERSON K L,NAGARAJA T G,MORRILL J L.Ruminal metabolic development in calves weaned conventionally or early[J].Journal of Dairy Science,1987,70(5):1000-1005.
[27]BEIRANVAND H,GHORBANI G R,KHORVASH M,et al.Forage and sugar in dairy calves’ starter diet and their interaction on performance,weaning age and rumen fermentation[J].Journal of Animal Physiology and Animal Nutrition,2014,98(3):439-445.
[28]NEMATI M,AMANLOU H,KHORVASH M,et al.Rumen fermentation,blood metabolites,and growth performance of calves during transition from liquid to solid feed:effects of dietary level and particle size of alfalfa hay[J].Journal of Dairy Science,2015,98(10):7131-7141.
[29]STOBO I J,ROY J H,GASTON H J.Rumen development in the calf.1.The effect of diets containing different proportions of concentrates to hay on rumen development[J].The British Journal of Nutrition,1966,20(2):171-188.
(责任编辑王智航)
Effects of Weaner Time on Rumen Morphology and Gene Expressions Involved in Rumen Epidermis Growth ofHuLambs at Different Days of Age
LIU Ting1LI Fadi1*LI Chong1,2WANG Weimin1,2WANG Xiaojuan1LI Fei3ZHENG Chen1MO Futao1WANG Fangbin1LA Yongfu1LI Baosheng4
(1. College of Animal Science and Technology, Gansu Agriculture University, Lanzhou 730070, China;2. Engineering Laboratory of Sheep Breeding and Reproduction Biotechnology in Gansu Province, Minqin 733300, China;3. College of Pastoral Agriculture Science and Technology, Lanzhou University,Lanzhou 730020, China; 4. Jinchang Zhongtian Sheep Industry Co. Ltd.,Jinchang 737100, China)
Abstract:The objective of this study was to investigate the effects of weaner time on rumen morphology and gene expressions involved in rumen epidermis growth of Hu lambs at different days of age. Two-factor design was used, and the factors were weaner time and days of age of lambs. A total of 54 Hu lambs with similar birth weight [(3.51±0.57) kg] were selected, and 6 of them were randomly selected and slaughtered on 28 days of age, while the remaining animals were randomly assigned to a 28 days of age weaner group [(8.21±0.97) kg] or a 56 days of age weaner group [(8.06±0.53) kg]. Six lambs from each group were randomly selected and slaughtered at 42, 56, 70 and 84 days of age, respectively. The ventral sac sample of rumen was collected to measure rumen papilla height, width and muscular thickness, and the tissue sample was extracted total RNA to measure gene expressions involved in rumen epidermis growth. The results showed as follows: rumen papilla height and thickness in 28 days of age weaner group was significantly higher than that in 56 days of age weaner group (P<0.05), however, rumen muscular thickness in 28 days of age weaner group was significantly lower than that in 56 days of age weaner group (P<0.05). There were significant interactions of weaner time and days of age for rumen papilla height and muscular thickness (P<0.05). The expressions of insulin-like growth factor binding protein (IGFBP)3, IGFBP5 and IGFBP6 in 28 days of age weaner group were significantly higher compared with 56 days of age weaner group (P<0.05). Rumen papilla length was negatively correlated with expressions of IGFBP6 and transforming growth factor β (TGFβ)1 (r=-0.318, P=0.001; r=-0.520, P<0.001); rumen papilla width was negatively correlated with the expression of TGFβ1 (r=-0.275, P=0.004), while were positively correlated with expressions of IGFBP3 and IGFBP5 (r=0.344, P<0.001; r=0.256, P=0.001). In conclusion, the results indicate that weaning at 28 days of age can promote rumen papillae development, affect expressions of genes involved in rumen epidermis growth, and may modulate early development of rumen of Hu lambs.[Chinese Journal of Animal Nutrition, 2016, 28(5):1384-1393]
Key words:Hu lamb; early weaning; rumen morphology; development; gene expression
doi:10.3969/j.issn.1006-267x.2016.05.014
收稿日期:2016-01-12
基金项目:国家自然科学基金(31260564);国家现代肉羊产业技术体系(CARS-39)
作者简介:刘婷(1985—),女,陕西临潼人,博士研究生,从事反刍动物营养研究。E-mail: lting822@sina.cn *通信作者:李发弟,教授,博士生导师,E-mail: lifd@lzu.edu.cn
中图分类号:S826
文献标识码:A
文章编号:1006-267X(2016)05-1384-10
*Corresponding author, professor, E-mail: lifd@lzu.edu.cn

