泛酸干预脂肪甘油三酯脂肪酶和长链脂酰辅酶A合成酶1基因表达对鹅生长和脂类代谢的反向调控
孔 敏 王宝维* 葛文华 张名爱 马传兴 张 肖
(1.青岛农业大学优质水禽研究所,国家水禽产业技术体系营养与饲料功能研究室,青岛266109;2.青岛农业大学动物科技学院,青岛266109)
泛酸干预脂肪甘油三酯脂肪酶和长链脂酰辅酶A合成酶1基因表达对鹅生长和脂类代谢的反向调控
孔敏1,2王宝维1,2*葛文华1张名爱1马传兴1,2张肖1,2
(1.青岛农业大学优质水禽研究所,国家水禽产业技术体系营养与饲料功能研究室,青岛266109;2.青岛农业大学动物科技学院,青岛266109)
摘要:本试验通过研究泛酸对5~16周龄五龙鹅肝脏中脂肪甘油三酯脂肪酶(ATGL)和长链脂酰辅酶A合成酶1(ACSL1)基因表达的影响,并分析其与生长性能、屠宰性能、肉品质的相关性,旨在从分子角度确定鹅饲粮中泛酸的适宜添加水平。选择5周龄五龙鹅360只,随机分为6个组,每个组6个重复,每个重复10只鹅。各组饲粮中泛酸添加水平分别为0(对照)、5、10、20、40、80 mg/kg。试验期12周。结果表明: 1)随着饲粮泛酸添加水平的提高,ATGL mRNA的表达量呈现先降低后升高的趋势,ACSL1 mRNA表达量呈现先升高后降低的趋势。由回归方程得出,当饲粮泛酸添加水平为13.86 mg/kg时,ATGL mRNA表达量最低;当添加水平为22.07 mg/kg时,ACSL1 mRNA表达量最高。2)与对照组相比,饲粮泛酸添加水平为10~20 mg/kg时极显著提高了五龙鹅的体重和平均日增重(P<0.01),同时极显著降低料重比(P<0.01)。3)ATGL mRNA表达量与胸肌率、腿肌率、屠宰率、半净膛率和全净膛率呈负相关;ACSL1 mRNA表达量与胸肌率、腿肌率、屠宰率、半净膛率和全净膛率呈正相关;二者mRNA表达量与腹脂率均呈负相关。4)ACSL1 mRNA表达量与红度和滴水损失显著相关(P<0.05)。5)ATGL mRNA表达量与血清脂类代谢各项指标呈正相关;ACSL1 mRNA表达量与血清脂类代谢各项指标呈负相关。由此表明,ATGL和ACSL1 mRNA表达量对鹅机体生长速度、屠宰性能和脂类代谢呈同步反向调控机制;从ATGL和ACSL1 mRNA表达量优势分析,建议5~16周龄鹅饲粮中泛酸适宜添加水平为13.86~22.07 mg/kg。
关键词:泛酸;ATGL;ACSL1;基因调控;生长发育;脂类代谢
泛酸即维生素B5,是畜禽所必需的维生素之一,具有水溶性,也是机体内多种生理和生化过程所必需的辅助因子,泛酸广泛参与多种基因的表达调控。脂肪甘油三酯脂肪酶(ATGL)是近年来发现的一种新的脂肪酶,它主要参与体内甘油三酯水解第一步的反应[1],参与脂肪动员过程,能防止脂肪在体内的过度积累,调节机体的生长发育。研究发现,ATGL的活性并不依赖于蛋白激酶A(PKA)的调控[2],激素、过氧化物酶体增殖物激活受体激动剂、饲料等都会影响ATGL基因和蛋白质的表达水平[3]。脂肪酸进行β氧化之前需要活化生成脂酰辅酶A,活化后生成的脂酰辅酶A进入脂肪酸β-氧化过程,此步反应由长链脂酰辅酶A合成酶1(acyl-CoA synthetase,ACSL1)催化[4],需要ATP、镁离子(Mg2+)、辅酶A等参与[5],ACSL1在甘油三酯、磷脂和胆固醇脂的合成中也起着关键作用。泛酸在体内不能储存,在组织中泛酸被转化成辅酶A及其他化合物,在肝脏和肾脏中的浓度较高[6]。由此可见,在动物体内脂肪代谢过程中,ATGL和ACSL1都扮演了重要的角色。然而,目前关于泛酸对ATGL和ACSL1基因表达的影响在家禽研究上尚未报道,国内鹅养殖业中对泛酸的添加水平主要以NRC(1994)[7]为参考,4周龄以后鹅的泛酸的添加水平为10 mg/kg。为此,本试验以5~16周龄五龙鹅为试验对象,通过研究饲粮中不同泛酸添加水平对鹅肝脏中ATGL和ACSL1基因表达的影响,并分析基因表达量与生长性能、屠宰性能和胴体品质的相关性,以确定泛酸对生长发育、肉品质和脂类代谢调控规律和适宜添加水平,为指导养鹅生产提供理论依据。
1材料与方法
1.1试验动物与设计
选择初始体重差异不显著(P>0.05)的5周龄五龙鹅360只,随机分为6个组,每个组6个重复,每个重复10只鹅(公母各占1/2)。各组(Ⅰ~Ⅵ组)饲粮中泛酸添加水平以NRC(1994)标准为主要参考依据;Ⅰ组为对照组,饲喂基础饲粮;Ⅱ~Ⅵ组分别饲喂在基础饲粮中添加5、10、20、40、80 mg/kg泛酸的试验饲粮。试验鹅由国家水禽产业技术体系育种基地高密银河润雁鹅业有限公司提供。试验用泛酸钙(纯度为98%)购自青岛普兴生物科技有限公司。
1.2试验饲粮
基础饲粮营养水平参照NRC(1994)家禽营养需要量设计配方。基础饲粮组成及营养水平见表1。采用高效液相色谱法测得基础饲粮中泛酸含量为9.45 mg/kg。
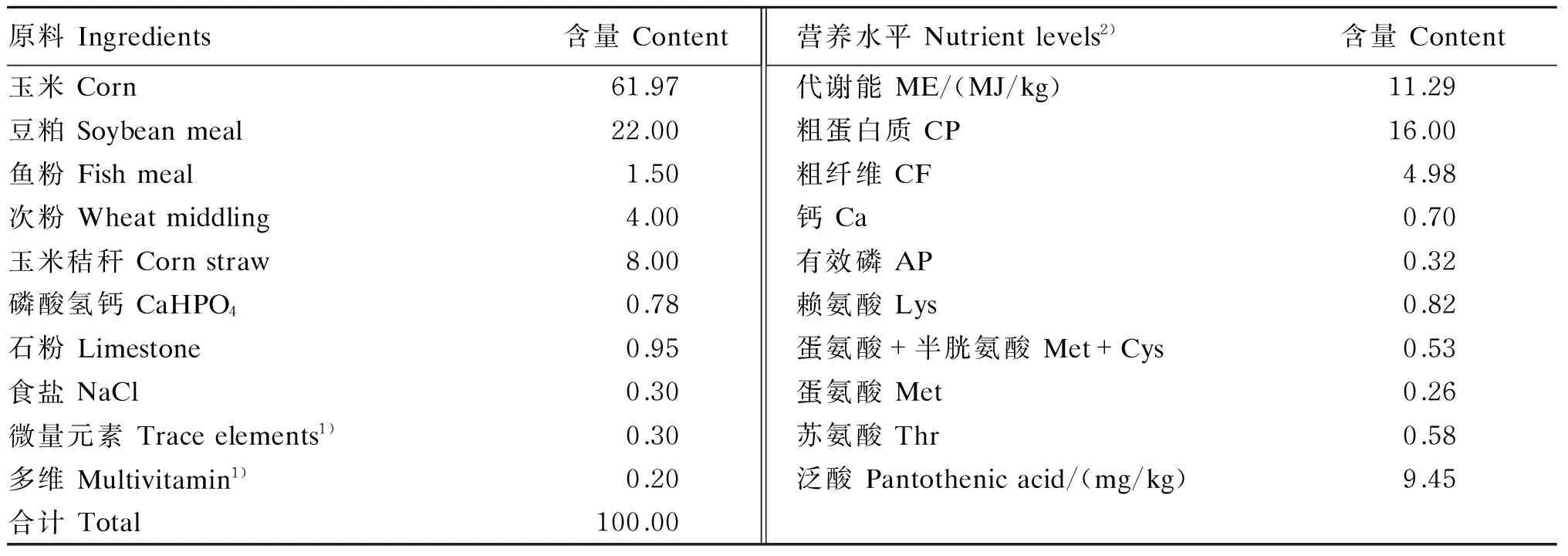
表1 基础饲粮组成及营养水平(风干基础)
1)多维和微量元素(不含泛酸)为每千克饲粮提供 The multivitamin and trace elements (without pantothenic acid) provided the following per kg of the diet:VA 1 500 mg,VD3200 IU,VE 12.5 mg,VK31.5 mg,VB12.2 mg,VB25.0 mg,烟酸 nicotinic acid 65 mg,VB62 mg,生物素 biotin 0.2 mg,叶酸 folic acid 0.5 mg,胆碱 choline 1 000 mg,Fe 85 mg,Cu 5 mg,Mn 80 mg,Zn 80 mg,I 0.42 mg,Se 0.3 mg,Co 2.5 mg。
2)泛酸为实测值,其他营养水平为计算值。Pantothenic acid was a measured value, while other nutrient levels were calculated values.
1.3饲养管理
试验前对鹅舍进行全面消毒;全期采取舍饲,地面厚垫料分栏饲养;试验鹅自由饮水和采食;少喂勤添;注意观察鹅群的健康状况。
1.4测定指标及方法
1.4.1生长性能指标
16周龄末,分别以重复为单位对试验鹅进行空腹称重,计算5~16周龄鹅的平均日增重(ADG),每日统计饲料消耗量,计算平均日采食量(ADFI)和料重比(F/G)。
1.4.2屠宰性能指标
16周龄末,翅静脉采血后对各组试验鹅进行屠宰(共72只,公母各占1/2);宰前禁食12 h,按照《家禽生产性能名词术语和度量统计方法》(NY/T 823—2004)[8]测定屠体重、半净膛重、全净膛重、腹脂重、胸肌重和腿肌重,并计算屠宰率、全净膛率、半净膛率、腹脂率、腿肌率和胸肌率6项屠宰性能指标。
1.4.3肌肉品质
16周龄末,每个重复随机选择2只鹅,6个组共72只(公母各占1/2),翅静脉采血,屠宰后采用《肉制品检测标准》(GB/T 9695)[9]测定肌肉品质。把整个胸肌从胸骨上剥离,取前端胸大肌作为肉样,用日本全自动色彩色差计测定胸肌肉色,用物性测试仪(TA-XT PLUS)测定剪切力,用HANHA-HI9025便携式酸度计测定pH,用自然蒸发法(吊袋法)测滴水损失,用压力计测失水率。
1.4.4血清生化指标
16周龄末,每个重复随机选择2只鹅,6个组共72只(公母各占1/2),翅下静脉采血5 mL,3 000 r/min离心10 min,取上清液。血清中甘油三酯、总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇含量均用试剂盒测定,所用试剂盒均购自南京建成生物工程研究所。
1.4.5基因表达量测定
16周龄末,对试验鹅进行屠宰时,取肝脏样品用液氮保存备用。将肝脏样品从液氮中取出,迅速剪取50~100 mg,加入1 mL RNAisoTMPlus试剂,按照说明书方法提取总RNA。用分光光度计(UV-1100)检查总RNA浓度及纯度;用琼脂糖凝胶电泳鉴定RNA质量,将RNA溶液稀释为1.0 μg/μL。
按照试剂盒说明书,用PrimeScriptTMRT Reagent Kit(TaKaRa,DRR037D)对提取的RNA立即进行反转录试验。反转录反应体系为20 μL:10 μL 2×RT Buffer,1 μL随机引物(100 pmol/μL),1 μL RT-mix,5 μL模板(RNA),3 μL焦碳酸二乙酯(DEPC)水。反应条件:轻轻搅拌;25 ℃ 10 min,42 ℃ 60 min,85 ℃ 5 min,反应结束后,将反转产物cDNA置于-20 ℃保存。
根据GenBank发表的鹅的ATGLmRNA序列(GenBank登录号HQ 914789)和ACSL1 mRNA序列(GenBank登录号GQ 891991)与鹅的全部基因组序列相对比,应用Primer5.0软件进行引物设计,ATGL基因上游引物5′-TCGCAACCTCTACCGCCTCT-3′,下游引物5′-TCCGCACAAGCCTCCATAAGA-3′;ACSL1基因上游引物5′-GGAGGAAGAGTAAGGCTGATGGT-3′,下游引物5′-CCAGGAACCGACAGTGAGCAT-3′;β-肌动蛋白(β-actin)为内参基因,上游引物5′-GTTCTTGACTCTGGCGATGG-3′,下游引物5′-TAAGGTTTCAGGACAGCGGA-3′。预测扩增长度为130 bp左右,基因扩增设计的引物由上海生工生物公司合成。
用实时定量PCR仪(Bio-Rad CFX)对反转录产物cDNA进行定量PCR,PCR反应体系为50 μL:25 μL 2×PCR Buffer,1.2 μL Primer (25 pmol/μL),0.3 μL SYBR Green Ⅰ,1 μL模板(cDNA),22.5 μL DEPC水。反应条件:94 ℃ 4 min;94 ℃ 20 s;60 ℃ 30 s;72 ℃ 30 s;循环35次,观察扩增曲线。
1.5数据处理与统计分析
采用2-△△Ct法处理试验原始数据,然后再将所得数据采用SPSS 17.0进行单因素方差分析(one-way ANOVA),显著性检验用LSD法,并在对比中选择多项式进行一次线性和二次曲线分析,同时对该基因表达量与其他指标的相关性进行分析。
2结果与分析
2.1饲粮泛酸添加水平对鹅肝脏中ATGL和ACSL1 mRNA表达量的影响
由表2可知,饲粮泛酸添加水平对ATGL和ACSL1 mRNA表达量有极显著影响(P<0.01)。ATGLmRNA表达量随饲粮泛酸添加水平增加,呈现先降低后升高的趋势,Ⅲ组ATGLmRNA表达量显著或极显著低于其他组(P<0.05或P<0.01)。ACSL1 mRNA表达量随饲粮泛酸添加水平的增加,呈现先升高后降低的趋势,Ⅲ、Ⅳ组ACSL1 mRNA表达量显著或极显著高于其他组(P<0.05或P<0.01)。
以上结果表明,饲粮泛酸添加水平较低时,试验鹅体内过氧化物酶体脂肪酸β-氧化受到抑制,同时ATGLmRNA表达量逐渐减少,ACSL1 mRNA表达量升高,有助于机体内长链脂肪酸的合成,机体脂肪沉积量逐渐增加,促进机体生长发育;随着饲粮泛酸添加水平的增多,泛酸在动物机体内逐渐积累,对体内脂肪酸β-氧化的抑制作用逐渐消除,ATGLmRNA表达量开始上升。
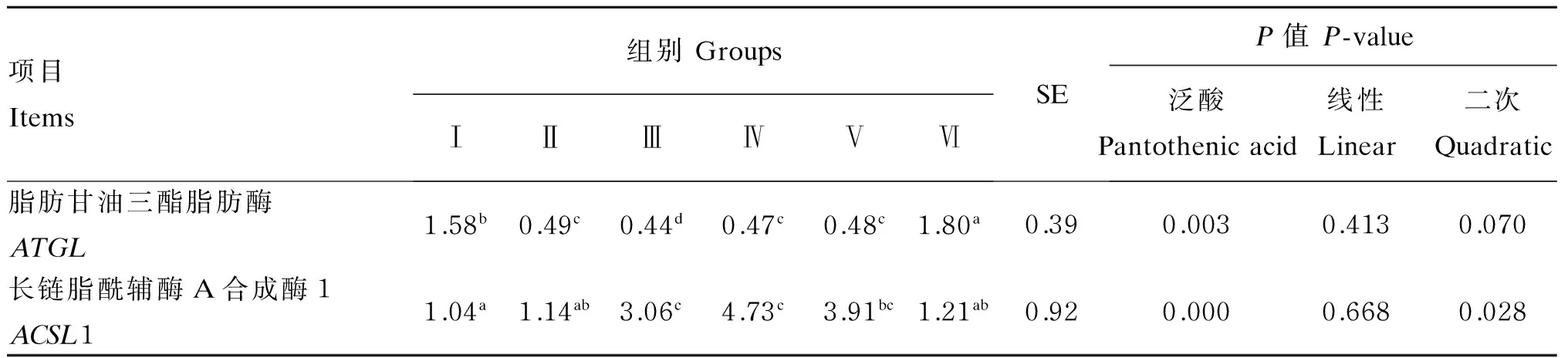
表2 饲粮泛酸添加水平对鹅肝脏中ATGL和ACSL1 mRNA表达量的影响
同行数据肩标相同小写字母或无字母表示差异不显著(P>0.05),相邻小写字母表示差异显著(P<0.05),相间小写字母差异极显著(P<0.01)。下表同。
In the same row, values with the same small or no letter superscripts mean no significant difference (P>0.05), while with adjacent small letter superscripts mean significant difference (P<0.05), and with alternate small letter superscripts mean extremely significant difference (P<0.01). The same as below.
以ATGL和ACSL1 mRNA表达量(Y1、Y2)分别与饲粮中泛酸添加水平(X)进行二次曲线拟合,建立回归方程如下:
Y1=0.007X2-0.194X+0.898
(R2=0.913,PQ=0.000);
Y2=-2.03E-4X2+0.09X+1.327
(R2=0.726,PQ=0.000)。
由上述曲线回归方程得出:饲粮泛酸添加水平为13.86 mg/kg时,ATGLmRNA表达量最低;添加水平为22.07 mg/kg时,ACSL1 mRNA表达量最高。
2.2鹅肝脏中ATGL和ACSL1 mRNA表达量与生长性能的相关性
由表3可知,饲粮泛酸添加水平对试验鹅的体重、平均日增重和料重比影响显著(P<0.05),且均呈显著的二次曲线关系(P=0.070、P=0.017和P=0.006),随着饲粮泛酸添加水平的提高,试验鹅的体重和平均日增重有先升高再降低的趋势,料重比有先降低后升高的趋势。饲粮泛酸添加水平对试验鹅平均日采食量影响不显著(P>0.05)。
以上结果表明,饲粮泛酸添加水平为10~20 mg/kg时,能极显著提高鹅的体重和平均日增重,降低料重比。
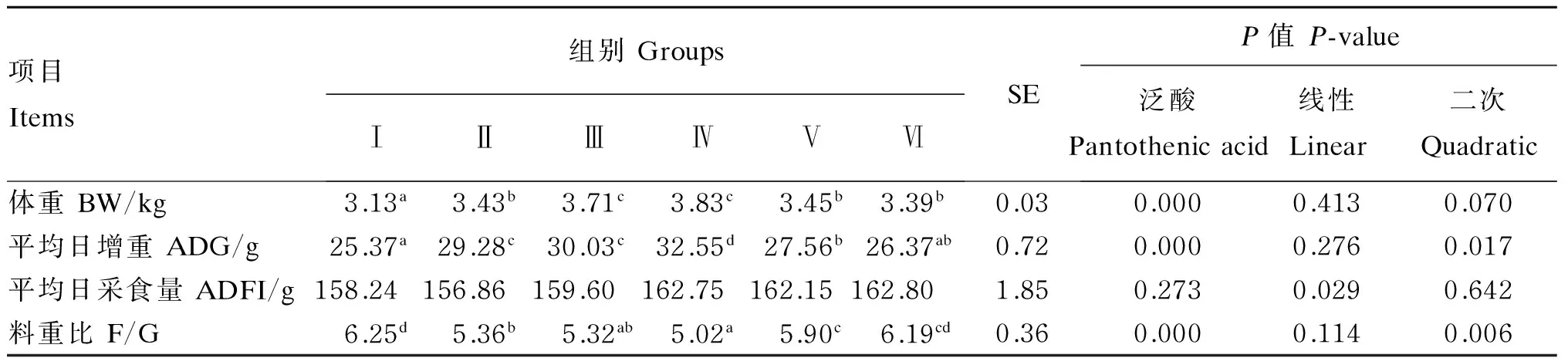
表3 饲粮泛酸添加水平对鹅生长性能的影响
由表4可知,ATGLmRNA表达量与体重(P>0.05)、平均日增重(P<0.05)呈负相关,与料重比(P<0.05)、泛酸添加水平(P>0.05)呈正相关;ACSL1 mRNA表达量与体重(P<0.05)、平均日增重(P>0.05)和平均日采食量(P>0.05)呈正相关,与料重比(P>0.05)、泛酸添加水平(P>0.05)呈负相关。
由此可见,随着饲粮泛酸添加水平的提高,ACSL1 mRNA的表达能够促进体重的增长,提高平均日增重;而ATGLmRNA的表达则抑制体重增长;以上结果表明,2基因对生长速度呈同步反向调控规律,机体生长发育存在平衡调控机制。
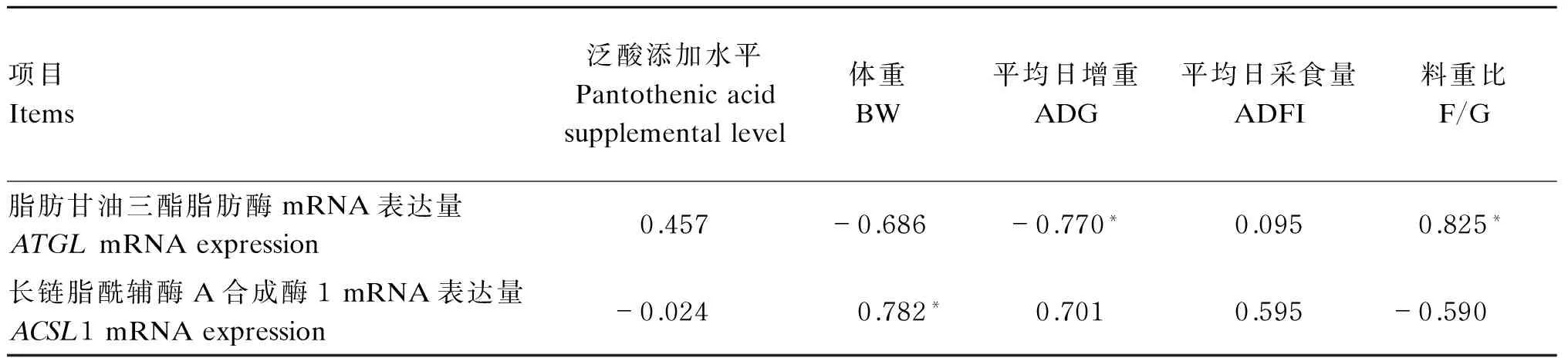
表4 肝脏中ATGL和ACSL1 mRNA表达量与生长性能的相关性
*、**分别表示在0.05、0.01水平上的差异显著。下表同。
* and ** mean significant difference at 0.05 and 0.01 levels, respectively. The same as below.
2.3鹅肝脏中ATGL和ACSL1 mRNA表达量与屠宰指标的相关性
由表5可知,ATGLmRNA表达量与胸肌率、腿肌率、屠宰率、半净膛率和全净膛率呈负相关,而ACSL1 mRNA表达量与胸肌率、腿肌率、屠宰率、半净膛率和全净膛率呈正相关;二者mRNA表达量对腹脂率均呈负相关。
以上结果表明,ATGL和ACSL1 mRNA表达量对鹅机体组织的构成有密切相关,并呈同步反向调控规律。
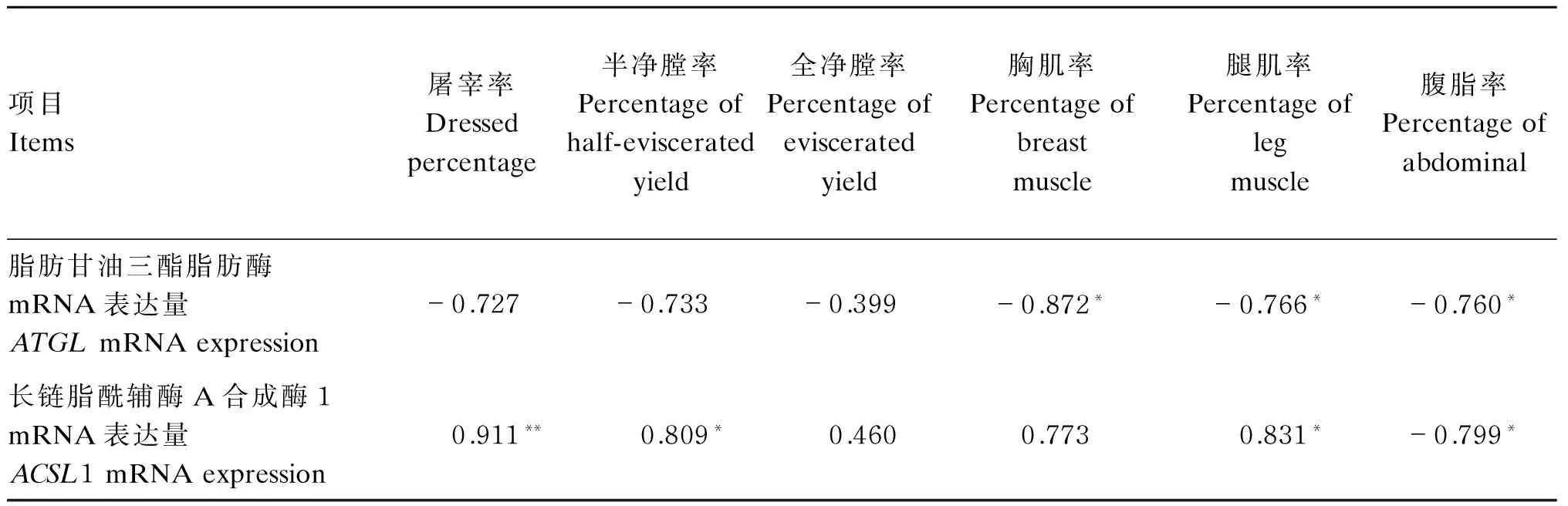
表5 肝脏中ATGL和ACSL1 mRNA表达量与屠宰性能的相关性
2.4鹅肝脏中ATGL和ACSL1 mRNA表达量与胴体品质的相关性
由表6可知,肝脏中ATGLmRNA表达量与鹅胴体品质的各项指标均无显著相关性(P>0.05);而肝脏中ACSL1 mRNA表达量与红度呈显著正相关(P<0.05),与滴水损失呈显著负相关(P<0.05)。
以上结果表明,ACSL1 mRNA与鹅胴体品质有关,随着ACSL1 mRNA表达量的提高,红度随之显著增加,滴水损失显著下降,有助于提高胴体品质。
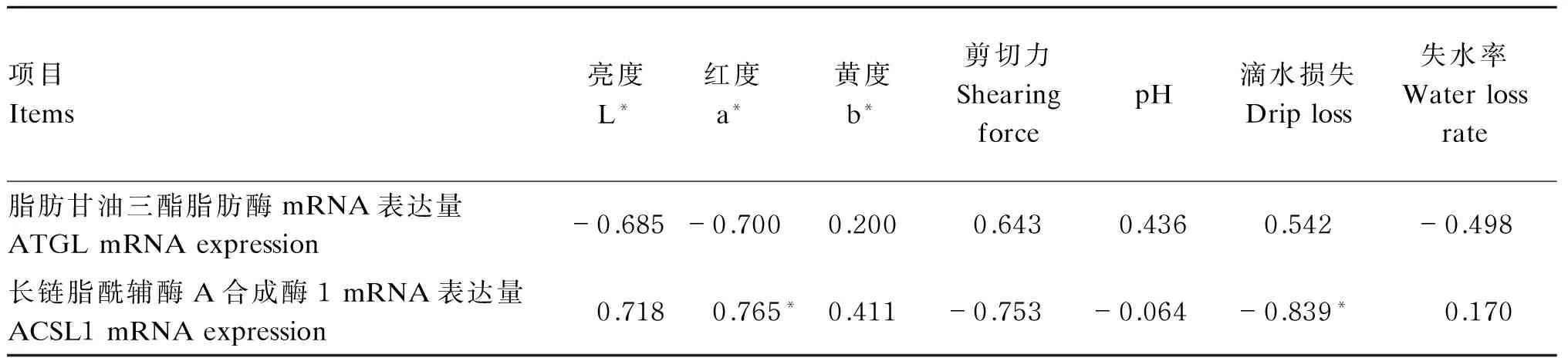
表6 肝脏中ATGL和ACSL1 mRNA表达量与胴体品质的相关性
2.5鹅肝脏中ATGL和ACSL1 mRNA表达量与血清脂类代谢指标的相关性
由表7可知,肝脏中ATGLmRNA表达量与甘油三酯呈极显著正相关(P<0.01),与高密度脂蛋白胆固醇和低密度脂蛋白胆固醇呈显著正相关(P<0.05),与总胆固醇无显著相关性(P>0.05);肝脏中ACSL1 mRNA表达量与甘油三酯呈显著负相关(P<0.05)。
以上结果表明,ATGLmRNA能显著促进脂类代谢,随着ATGLmRNA表达量的提高,血清中各项脂类代谢指标也随着增加;而ACSL1 mRNA对脂类代谢具有抑制作用,随着ACSL1 mRNA表达量的提高,血清中各项脂类代谢指标出现不同程度的降低;二者之间存在着同步反向调控机制。
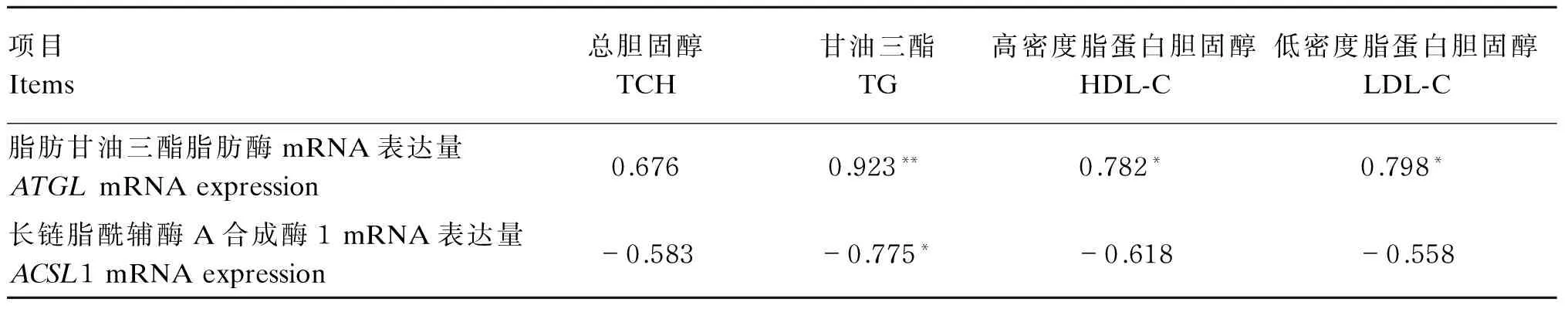
表7 肝脏中ATGL和ACSL1 mRNA表达量与血清脂类代谢指标的相关性
3讨论
3.1饲粮泛酸添加水平对鹅肝脏中ATGL和ACSL1 mRNA表达量的影响
泛酸是一种水溶性维生素,是辅酶A(CoA)和酰基载体蛋白(ACP)生物合成的重要前体物质,参与生物体内碳水化合物、脂肪酸、蛋白质和能量代谢反应;还可以通过修饰蛋白来影响蛋白质的定位、稳定性和活性。迄今为止,国内外关于泛酸对鹅肝脏中ATGL和ACSL1 mRNA表达量影响的研究尚处于空白。本试验结果表明,各组试验鹅肝脏中的ATGLmRNA表达量随饲粮泛酸添加水平的增加呈现先降低后升高的趋势,ACSL1 mRNA表达量随饲粮泛酸添加水平的增加呈现先升高后降低的趋势,两者呈同步反向调控规律。ATGLmRNA表达量的最低值出现在饲粮泛酸添加水平为10 mg/kg时;ACSL1 mRNA表达量的最高值出现在饲粮泛酸添加水平为20 mg/kg时。分析其原因,泛酸在生物体内的吸收机制是主动积累的过程,依靠一种广泛存在于机体中的Na+依赖转运体转运泛酸进入细胞,每转运1个泛酸需要2个Na+协同[10],具有种间相似性。泛酸缺乏时,会导致体内脂肪酸β-氧化受到抑制,体内主要产能过程受到抑制,不利于机体的生长发育,随着饲粮泛酸添加水平的增多,泛酸在动物机体内逐渐积累,体内脂肪酸β-氧化的抑制作用逐渐消除,伴随机体大量能量的产生,ACSL1 mRNA表达量开始上升,促进长链脂肪酸的合成,利于机体生长发育。随着脂肪酸在体内的积累,ATGLmRNA表达量逐渐下降,与Schoenborn等[11]关于ATGL基因与机体内游离脂肪酸的水平成反向调控的研究相一致。
从本试验的结果还可以看出,当饲粮泛酸添加水平达到13.86 mg/kg时,ATGLmRNA表达量最低,当添加水平达到22.07 mg/kg时,ACSL1 mRNA表达量最高,不仅表明ATGL和ACSL1 mRNA表达量与饲粮泛酸添加水平有着直接关系,而且显示其表达量达到极值时泛酸添加水平明显高于最佳生长性能状态下的添加水平,其内部调控机制还有待于继续研究。
3.2鹅肝脏中ATGL和ACSL1 mRNA表达量与生长性能的相关性
泛酸为辅酶A的组分,对于各种组织内的内源性代谢能量交换都很重要,其主要作用包括营养物的利用、脂肪的合成和分解代谢、柠檬酸循环等过程。Coelho[12]研究表明,饲粮中添加B族维生素能明显提高畜禽的日增重。Deyhim等[13]研究证实,泛酸可以促进肉鸡生长。祁风华等[14]试验结果表明,肉仔鸡饲粮中泛酸的添加水平为10 mg/kg时,可以提高粗蛋白质、粗脂肪等的代谢率,促进脂肪酸的合成,提高机体增重,当添加水平为15 mg/kg时,增重不显著且会增加饲养成本。本试验研究表明,饲粮添加10~20 mg/kg的泛酸能极显著提高五龙鹅的体重和平均日增重,同时极显著降低料重比,与上述的研究结果具有一致性。在鹅的饲粮中添加泛酸会促进ACSL1 mRNA的表达,增加脂肪的形成与沉积,并通过减少ATGLmRNA的表达,抑制相关酶的活性,促进体重的增长,2个基因对于机体的生长阶段均有显著相关性。
在家禽肉品质量的营养中,嫩度、多汁性、肉色是决定禽肉品质的重要因素。这些因素主要取决于动物或胴体内的一些代谢和生物学指标[15]。胴体品质中的红度值主要取决于肉色中的色素物质、肌红蛋白和血红蛋白含量及化学状态[16]。脂质氧化过程中产生的自由基可直接促进肌肉色素发生氧化,或者通过破坏色素还原系统间接作用导致肉色变差,肉质下降[17]。本试验研究表明,肝脏中ACSL1 mRNA表达量与红度值呈显著正相关,说明泛酸通过调节ACSL1 mRNA的表达,在一定程度上调控了机体中肌红蛋白、血红蛋白等色素物质的产生,对机体的抗氧化功能具有一定的影响。
3.3鹅肝脏中ATGL和ACSL1 mRNA表达量与血清脂类代谢指标的相关性
国外研究表明,ATGL参与了脂肪组织中95%的甘油三酯水解代谢,为甘油三酯分解过程中的关键脂肪酶。Ong等[18]研究显示,由腺病毒介导的肝脏ATGL基因敲除小鼠体内出现肝脂肪变性,同时原代肝细胞内甘油三酯降解速率受到抑制;与此同时,还发现脂肪酸氧化在ATGL基因超表达小鼠体内得到增加,而在ATGL基因敲除小鼠体内却得到相反的结果。Smirnoval等[19]研究表明,野生型ATGL基因在非脂肪细胞中的过量表达导致脂滴大小显著下降,相反,失去催化活性的突变体尽管具有保留定位于脂滴周围的能力,但已失去降解脂滴的作用;与此同时,他们对ATGL基因进行干扰试验后,发现脂滴大小显著增加,这说明ATGL基因在细胞脂滴周转更新过程中起着重要的作用。Zechner等[20]进一步研究证实,ATGL催化机体整个脂解过程中的第1步,也是脂解限速的关键一步。大量研究表明,在哺乳动物中ACSL1基因主要表达于脂肪组织和肝脏,与甘油三酯的合成和脂肪酸的摄取有关[21]。Bionaz等[22]研究发现,与初期相比,奶牛泌乳高峰期乳腺中ACSL1的表达量呈极显著上升,乳汁中甘油三酯含量也急剧上升。在HepG2细胞中,过表达ACSL1导致细胞内甘油三酯的含量增加了40%,并且长链脂酰辅酶A的含量也增加了60%[23]。本试验结果表明,ATGLmRNA表达量与血清中甘油三酯含量呈极显著正相关,与Coleman等[24]研究结果相一致。在五龙鹅的饲养过程中随着饲粮中泛酸添加水平的增加,肝脏中ACSL1 mRNA的表达量受到不同程度的影响,并且其表达量与血清中甘油三酯、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇含量的变化呈显著正相关。这暗示在五龙鹅的组织生长脂肪沉积过程中ATGL和ACSL1基因对促进脂质合成和脂肪酸的转运都发挥了积极的作用。
4结论
① 饲粮泛酸添加水平对鹅肝脏中ATGL和ACSL1 mRNA表达量影响显著,饲粮泛酸添加水平为13.86 mg/kg时,ATGLmRNA表达量最低;添加水平为22.07 mg/kg时,ACSL1 mRNA表达量最高。
② 饲粮中添加10~20 mg/kg泛酸能极显著提高五龙鹅的体重和平均日增重,同时极显著降低料重比。
③ATGL和ACSL1 mRNA表达量对鹅机体生长速度、屠宰性能和脂类代谢呈同步反向调控机制。
④ 建议5~16周龄五龙鹅饲粮中泛酸的适宜添加水平为13.86~22.07 mg/kg。
参考文献:
[1]ZIMMERMANN R,STRAUSS J G,HAEMMERLE G,et al.Fat mobilization in adipose tissue is Promoted by adipose triglyceride lipase[J].Science,2004,306(5700):1383-1386.
[2]LASS A,ZIMMERMANN R,HAEMMERLE G,et al.Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in chanarin-dorfman syndrome[J].Cell Metabolism,2006,3(5):309-319.
[3]KIM J Y,TILLISON K,LEE J H,et al.The adipose tissue triglyceride lipase ATGL/PNPLA2 is downregulated by insulin and TNF-α in 3T3-L1 adipocytes and is a target for transactivation by PPARγ[J].American Journal of Physiology:Endocrinology and Metabolism,2006,291(1):E115-E1127.
[4]LI S F,LU L,HAO S F,et al.Dietary manganese modulates expression of the manganese-containing superoxide dismutase gene in chickens[J].The Journal of Nutrition,2011,141(2):189-194.
[5]SWITALA J,LOEWEN P C.Diversity of properties among catalases[J].Archives of Biochemistry and Biophysics,2002,401(2):145-154.
[6]FENG J,MA W Q,XU Z R,et al.The effect of iron glycine chelate on tissue mineral levels,fecal mineral concentration,and liver antioxidant enzyme activity in weanling pigs[J].Animal Feed Science and Technology,2009,150(1/2):106-113.
[7]NRC.Nutrient requirements of poultry[S].9th ed.Washington,D.C.:National Academy Press,1994.
[8]陈宽维,高玉时,王志跃,等.中华人民共和国农业行业标准 家禽生产性能名词术语和度量统计方法[J].中国禽业导刊,2006(15):45-46.
[9]中华人民共和国国家质量监督检验检疫总局.GB/T 9695—2008 肉制品检测标准[S].北京:中国标准出版社,2008.
[10]丁玉琴,郭俊生,赵法伋.多维生素转运体[J].卫生研究,2002,31(6):481-483.
[11]SCHOENBORN V,HEID I M,VOLLMERT C,et al.The ATGL gene is associated with free fatty acids,triglycerides,and type 2 diabetes[J].Diabetes,2006,55(5):1270-1275.
[12]COELHO M.增加B族维生素喂量有利于瘦肉生长[J].孙晓燕,译.国外畜牧学:猪与禽,2002(2):31-33.
[13]DEYHIM F,BELAY T,TEETER R G.An evaluation of dietary pantothenic acid needs of broilers through eight weeks posthatching[J].Nutrition Research,1992,12(12):1549-1554.
[14]祈凤华,陈瑶,徐春生.泛酸对肉仔鸡营养物质代谢率影响的研究[J].黑龙江畜牧兽医,2009(8):36-37.
[15]CLOSE W H,杨虹.猪肉和禽肉质量的营养调控[J].国外畜牧学:猪与禽,1998(3):47-50.
[16]张惠,闫俊书,宦海林,等.放牧饲养对雪山草鸡屠宰性能及肉色的影响[J].南方农业学报,2011,42(6):672-675.
[17]MCKEE J S,HARRISON P C,RISKOWSKI G L.Effects of supplemental ascorbic acid on the energy conversion of broiler chicks during heat stress and feed withdrawal[J].Poultry Science,1997,76(9):1278-1286.
[18]ONG K T,MASHEK M T,BU S Y,et al.Adipose triglyceride lipase is a major hepatic lipase that regulates triacylglycerol turnover and fatty acid signaling and partitioning[J].Hepatology,2011,53(1):116-126.
[19]SMIRNOVA E,GOLDBERG E B,MAKAROVA K S,et al.ATGL has a key role in lipid droplet/adiposome degradation in mammalian cells[J].EMBO Reports,2006,7(1):106-113.
[20]ZECHNER R,KIENESBERGER P C,HAEMMERLE G,et al.Adipose triglyceride lipase and the lipolytic catabolism of cellular fat stores[J].Journal of Lipid Research,2009,50(1):3-21.
[21]LEWIN T M,KIM J H,GRANGER D A,et al.Acyl-CoA synthetase isoforms 1,4 and 5 are present in different subcellular membranes in rat liver and can be inhibited independently[J].Journal of Biological Chemistry,2001,276(27):24674-24679.
[22]BIONAZ M,LOOR J J.ACSL1,AGPAT6,FABP3,LPIN1 andSLC27A6 are the most abundant isoforms in bovine mammary tissue and their expression is affected by stage of lactation[J].The Journal of Nutrition,2008,138(6):1019-1024.
[23]PAKERS H A,PRESTON E,WILKS D,et al.Overexpression of acyl-CoA synthetase-1 increases lipid deposition in hepatic (HepG2) cells and rodent liverinvivo[J].American Journal of Physiology:Endocrinology and Metabolism,2006,291(4):E737-E744.
[24]COLEMAN R A,LEWIN T M,MUOIO D M.Physiological and nutritional regulation of enzymes of triacylglycerol synthesis[J].Annual Review of Nutrition,2000,20(1):77-103.
(责任编辑武海龙)
Pantothenic Acid Intervention of Adipose Triglyceride Lipase and Long-Chain-Fatty-Acid CoA Ligase 1 Gene Expression and Reverse Regulation of Growth and Lipid Metabolism of Geese
KONG Min1,2WANG Baowei1,2*GE Wenhua1ZHANG Ming’ai1MA Chuanxing1,2ZHANG Xiao1,2
(1. Nutrition and Feed Laboratory of China Agriculture Research System, Institute of High Quality Waterfowl,Qingdao Agricultural University, Qingdao 266109, China; 2. College of Animal Science and Technology,Qingdao Agricultural University, Qingdao 266109, China)
Abstract:This experiment was conducted to study the impact of pantothenic acid on liver adipose triglyceride lipase (ATGL) and long-chain-fatty-acid CoA ligase 1 (ACSL1) gene expression of Wulong geese aged from 5 to 16 weeks, to analyzed the correlation of growth performance, slaughter performance and meat quality with ATGL and ACSL1 genes, and to find the appropriate supplemental level of pantothenic acid of geese from the molecular point of view. A total of 360 five-week-old Wulong geese were randomly divided into 6 groups with 6 replicates per group and 10 geese per replicate. Geese in the 6 groups were fed the basal diet supplemented with 0 (control), 5, 10, 20, 40 and 80 mg/kg pantothenic acid, respectively. The experiment lasted for 12 weeks. The results showed as follows: 1) with the dietary pantothenic acid supplemented level increasing, the ATGL mRNA expression showed a firstly decreased and then increased trend and the ACSL1 mRNA expression showed a firstly increased and then decreased trend. Derived from the regression equation, the ATGL mRNA expression was the lowest when dietary supplemented with 13.86 mg/kg pantothenic acid, and the ACSL1 mRNA expression was the highest when dietary supplemented with 22.07 mg/kg pantothenic acid. 2) Compared with the control group, dietary supplemented with 10 to 20 mg/kg pantothenic acid significantly improved the body weight and average daily gain (P<0.01), and significantly reduced the feed to gain (P<0.01). 3) The ATGL mRNA expression with percentage of breast muscle, percentage of leg muscle, dressed percentage, percentage of half-eviscerated yield and percentage of eviscerated yield was negatively correlated; the ACSL1 mRNA expression with percentage of breast muscle, percentage of leg muscle, dressed percentage, percentage of half-eviscerated yield and percentage of eviscerated yield was positively correlated; and two genes mRNA expression with percentage of abdominal were negatively correlated. 4) The ACSL1 mRNA expression was significantly correlated with red value and water loss (P<0.05). 5) The ATGL mRNA expression was positively correlated with the serum lipid metabolism indicators, and the ACSL1 mRNA expression was negatively correlated with serum lipid metabolism indicators. In conclusion, the ATGL and ACSL1 mRNA expression of geese with body growth speed, slaughter performance and lipid metabolism shows a synchronous reverse regulation mechanism; from ACSL1 mRNA and ATGL mRNA advantage analysis of expression, the dietary appropriate pantothenic acid supplemental level of geese aged from 5 to 16 weeks is 13.86 to 22.07 mg/kg.[Chinese Journal of Animal Nutrition, 2016, 28(5):1433-1441]
Key words:pantothenic acid; ATGL; ACSL1; gene regulation; growth and development; lipid metabolism
doi:10.3969/j.issn.1006-267x.2016.05.019
收稿日期:2015-12-10
基金项目:国家水禽产业技术体系专项基金(CARS-43-11);山东省良种工程(2014LZ19)
作者简介:孔敏(1988—),男,山东烟台人,硕士研究生,从事动物遗传育种与繁育。E-mail: 364253720@qq.com *通信作者:王宝维,教授,硕士生导师,E-mail: wangbw@qau.edu.cn
中图分类号:S835
文献标识码:A
文章编号:1006-267X(2016)05-1433-09
*Corresponding author, professor, E-mail: wangbw@qau.edu.cn
——水溶性维生素泛酸篇

