抗性淀粉对饮食诱导肥胖大鼠排便状况及肠道菌群的影响
王志凡 杨秀琳 陈旺盛 马 慧
(西北民族大学医学院,兰州730030)
抗性淀粉对饮食诱导肥胖大鼠排便状况及肠道菌群的影响
王志凡杨秀琳*陈旺盛马慧
(西北民族大学医学院,兰州730030)
摘要:本试验旨在探讨抗性淀粉(RS)对饮食诱导肥胖(DIO)大鼠排便状况及肠道菌群的影响,为合理利用RS提供依据。选用100只健康雄性SD大鼠,随机分为2组,对照组10只饲喂基础饲粮,高脂组(HF组)90只饲喂高脂饲粮,7周后根据体重从HF组筛选出DIO大鼠27只,随机分为3组,每组9只,分别为HF组(饲喂高脂饲粮)、高脂饲粮抗性淀粉组(HFRS组,饲喂含10% RS的高脂饲粮)、高脂饲粮抗性淀粉+硫酸葡聚糖(DS)组(HFRS+DS组,饲喂含10% RS的高脂饲粮),试验期间HFRS+DS组每天用5% DS 1 mL灌胃,其他组分别用蒸馏水1 mL灌胃,试验期5周。于第7、12周收集新鲜成形大便1 g,稀释后用选择性培养基进行肠球菌、肠杆菌、双歧杆菌、乳酸杆菌、类杆菌检测并计数菌落总数。结果表明:1)试验第7周时,与对照组相比,HF组大鼠粪便湿重、粪便含水率以及粪样中肠球菌、双歧杆菌、乳酸菌、类杆菌数量显著降低(P<0.05),粪便颗粒数、粪样中肠杆菌数量显著升高(P<0.05)。2)试验第12周时,与对照组相比,HF组DIO大鼠粪便湿重、粪便含水率以及粪样中肠球菌、双歧杆菌、乳酸菌、类杆菌数量显著降低(P<0.05),粪便颗粒数、粪样中肠杆菌数量显著升高(P<0.05);与HF组相比,HFRS组DIO大鼠粪便湿重、粪便干重、粪便含水率以及粪样中肠球菌、双歧杆菌、乳酸菌、类杆菌数量均显著升高(P<0.05),粪便颗粒数、粪样中肠杆菌数量显著降低(P<0.05);与HFRS组相比,HFRS+DS组DIO大鼠粪便湿重、粪便含水率以及粪样中双歧杆菌、乳酸菌、类杆菌数量显著降低(P<0.05),粪样中肠杆菌、肠球菌数量显著增加(P<0.05)。由此可见,本试验条件下,RS可改善DIO大鼠排便状况和高脂饲粮造成的肠道菌群紊乱。
关键词:抗性淀粉;高脂饲粮;饮食诱导肥胖;肠道菌群
动物肠道中栖息着种类繁多、数量庞大且相互制约、平衡生长的微生物,它们参与了宿主的生理、代谢、免疫等多方面功能。因此,维持肠道微生态稳定对促进宿主健康具有重要意义[1-2]。遗传、生长、环境等诸多因素都可以影响肠道菌群结构,其中饲粮是最重要的环境因素之一[3]。由于不同种类肠道微生物对底物的发酵具有选择性,因此饲粮中产能营养素如蛋白质、脂肪、碳水化合物比例和数量的改变均可使肠道微生态发生相应改变[4]。已有研究显示,饲粮中蛋白质和脂类成分增多,可使肠道菌群向益生菌数量减少而有害菌数量增多的方向偏移,同时加重机体的代谢紊乱[5-6]。而高脂饲粮已成为目前研究的重点[7],探讨通过饲粮调整肠道微生态已成为营养领域面临的主要课题。一些研究认为,适当降低可消化碳水化合物比例、增加不消化碳水化合物比例,能降低食物的消化吸收速率,增加到达结肠的碳水化合物数量,为结肠益生菌生长提供充足的碳源,诱导肠道菌群向有利于健康的方向转变[8-9]。抗性淀粉(resistance starch,RS)是不能被小肠消化吸收的淀粉,研究已经证明RS具有纤维素样作用,摄入适量的RS可以改善糖脂代谢、促进肠道中双歧杆菌繁殖而抑制大肠杆菌生长[10-12]。但RS对高脂饲粮引起的肠道菌群失调是否有调控作用还有待于进一步研究。本研究在饮食诱导肥胖(diet induced obesity,DIO)大鼠出现肠道菌群紊乱的基础上,饲喂含10% RS的高脂饲粮,探讨RS对DIO大鼠肠道菌群紊乱的调控作用,为通过饲粮调整肠道菌群结构提供依据。
1材料与方法
1.1试验材料
1.1.1试验动物与饲粮
SPF级雄性SD大鼠100只,体重70~90 g,由甘肃中医学院动物中心提供[SCXK(甘)2011-0001]。动物饲粮分基础饲粮(对照组)、高脂饲粮(HF组)和高脂抗性淀粉饲粮(HFRS组),均由北京科奥协力饲料有限公司配制,饲粮组成及营养水平见表1。其中RS4为HI-MAIZE260[产地美国,购自国民淀粉工业(上海)有限公司,纯度67.7%,批号HAIO380],实际添加量为14.8%,有效浓度为10%。

表1 试验饲粮组成及营养水平(干物质基础)
1)矿物质预混料为每千克饲粮提供Mineral premix provided the following per kg of diets:NaCl 4 g,CaHPO313 g,K2HPO410 g,MgSO45 g,FeSO41 g,ZnSO40.2 mg。
2)维生素预混料为每千克饲料提供Vitamin premix provided the following per kg of diets:硫胺素 thiamine 100 mg,核黄素 riboflavin 100 mg,泛酸钙 calcium pantothenate 500 mg,烟酸 nicotinic acid 500 mg,吡哆醇 pyridoxine 100 mg,钴胺素 cobalamine 100 mg,生物素 biotin 50 mg,胆碱 choline 4 000 mg; 肌醇 inositol 2 000 mg,VC 1 000 mg,VA 10 000 IU,VD34 000 IU,VE 100 mg,VK 20 mg。
3)代谢能为实测值,其余为计算值。ME was a measured value, while the others were calculated values.
1.1.2试剂
硫酸葡聚糖(dextran sulfate,DS,沃森生物),用蒸馏水配制成5%的溶液待用。
1.2试验方法
1.2.1造模期
100只SD大鼠随机分为2组,对照组10只,体重(73.40±2.59) g,饲喂基础饲粮。HF组90只,体重(74.20±2.89) g,饲喂高脂饲粮,2组体重无统计学差异(P>0.05)。分组后常规饲养观察1周,无明显异常后开始试验。试验期间大鼠均以组分笼饲养,自由采食、饮水,环境温度21~24 ℃,相对湿度≥60%。每天记录给食量和剩食量(采食量=给食量-剩食量),每周称重1次。每天观察大鼠的皮毛色泽、饮食变化、活动状态及粪便形态,以评价大鼠的表象特征。7周后体重大于对照组体重均值加1.4倍标准差者为DIO大鼠,共55只,平均体重为(264.59±15.10) g,表明造模成功。
1.2.2动物分组
对照组10只大鼠继续饲喂基础饲粮,DIO大鼠55只随机选取27只,随机分为3组,每组9只,分别为HF组(饲喂高脂饲粮)、HFRS组(饲喂含10% RS的高脂饲粮)、高脂饲料抗性淀粉+DS组(HFRS+DS组,饲喂含10% RS的高脂饲粮),试验期间HFRS+DS组每天用5% DS 1 mL灌胃,其他组分别用蒸馏水1 mL灌胃,试验期5周。
1.2.3粪便重的测定
每周六08:00将试验动物单独放进代谢笼,收集24 h粪便后移回原处,称量粪便湿重后用定性滤纸吸干水分并包裹,于烘箱80 ℃干燥72 h,干燥后称粪便干重,计算含水率,计算公式:
含水率(%)=[(粪便湿重-粪便干重)/
粪便湿重]×100。
同时对1 g干粪便中粪便颗粒数进行计数,以粒/g表示。
1.2.4肠道菌群的检测
分别于第7、12周周日用无菌镊取各组大鼠新鲜成形大便1 g置10 mL无菌EP管中,加生理盐水至10 mL,于震荡器上充分震荡,直至粪便分散均匀,再用稀释液将粪便悬液依次稀释至10-2、10-3、10-4、10-5、10-6、10-7。选择合适的稀释度,分别用微量吸管吸取一定稀释度菌液50 μL(每个稀释度做3个平行)涂布于以下各选择培养基,肠球菌:肠球菌显色培养基;肠杆菌:伊红美蓝琼脂(EMB)培养基;乳酸杆菌:LBS培养基;双歧杆菌:BS培养基;拟杆菌:BDS培养基。肠球菌、肠杆菌直接在37 ℃恒温培养箱培养36 h。拟杆菌、乳酸杆菌和双歧杆菌经过厌氧系统处理,厌氧罐37 ℃恒温培养36 h。待菌落长出后以菌落形成单位(CFU/g)进行计数,结果以每克粪便中的细菌菌落数的对数[lg(CFU/g)]表示[13]。
1.3数据统计

2结果与分析
2.1试验大鼠排便状况
如表2所示,与对照组相比,经7周高脂饲粮饲喂,HF组大鼠粪便湿重、粪便含水率显著降低(P<0.05),粪便颗粒数显著升高(P<0.05),粪便干重呈降低趋势,但与对照组无显著差异(P>0.05)。经12周高脂饲粮饲喂,HF组DIO大鼠粪便湿重、粪便含水率显著降低(P<0.05),粪便颗粒数显著升高(P<0.05),粪便干重虽呈降低趋势,但与对照组无显著差异(P>0.05);与HF组相比,HFRS组DIO大鼠粪便湿重、粪便干重、粪便含水率均显著升高(P<0.05),粪便颗粒数显著降低(P<0.05);与HFRS组相比,HFRS+DS组DIO大鼠粪便湿重、粪便含水率显著降低(P<0.05)。
2.2试验大鼠粪便菌群数量
如表3所示,与对照组比较,第7周时HF组大鼠粪样中肠杆菌数量显著升高(P<0.05),肠球菌、双歧杆菌、乳酸菌、类杆菌数量则显著降低(P<0.05)。第12周时,与对照组相比,HF组DIO大鼠粪样中肠杆菌数量显著升高(P<0.05),肠球菌、双歧杆菌、乳酸菌、类杆菌数量均显著降低(P<0.05);与HF组比较,HFRS组DIO大鼠粪样中肠杆菌数量显著降低(P<0.05),肠球菌、双歧杆菌、乳酸菌、类杆菌数量均显著升高(P<0.05);与HFRS组比较,HFRS+DS组DIO大鼠肠杆菌、肠球菌数量显著升高(P<0.05),而双歧杆菌、乳酸菌、类杆菌数量则显著降低(P<0.05)。
3讨论
RS是近年来发现的一种在人体小肠中不被消化吸收的淀粉,研究表明RS可以逃逸小肠的消化进入结肠发挥纤维素样作用[14-15]。纤维素不能被人体消化酶分解,进入结肠后可被微生物发酵,对肠道菌群起一定的调节作用。据此推测RS也具有纤维素相似作用,但目前有关RS对肠道菌群影响的研究报道较少,对其作用机制的深入研究更为鲜见。试验前期研究分别选用5%、10%、15%的RS对DIO大鼠进行饮食干预,结果显示10% RS对体重增长的控制效果较好[16],与杨月欣等[17]和张珍珍等[18]报道结果相一致,故本试验选用10% RS作为试验动物的RS添加剂量,来探讨RS对大鼠肠道菌群的影响。由于肠道菌群受饲粮成分影响较大,为了避免除RS外其他饲粮成分的影响,本试验各组试验动物饲粮中粗蛋白质(含20%酪蛋白)、维生素、矿物质含量均相同。对照组含5%猪油,HF组、HFRS组含15%猪油;HF组和HFRS组饲粮的差异是淀粉含量不同,HFRS组用10% RS替代了10%可消化淀粉。由于可消化淀粉在小肠的消化吸收率达99%以上,大鼠摄入玉米淀粉120 min时的血糖生成指数可达(99±9)%,表明可消化淀粉可完全被小肠消化吸收[18-19],进入结肠的可消化淀粉极少,因此可认为HF组和HFRS组的差异主要是由RS引起的。
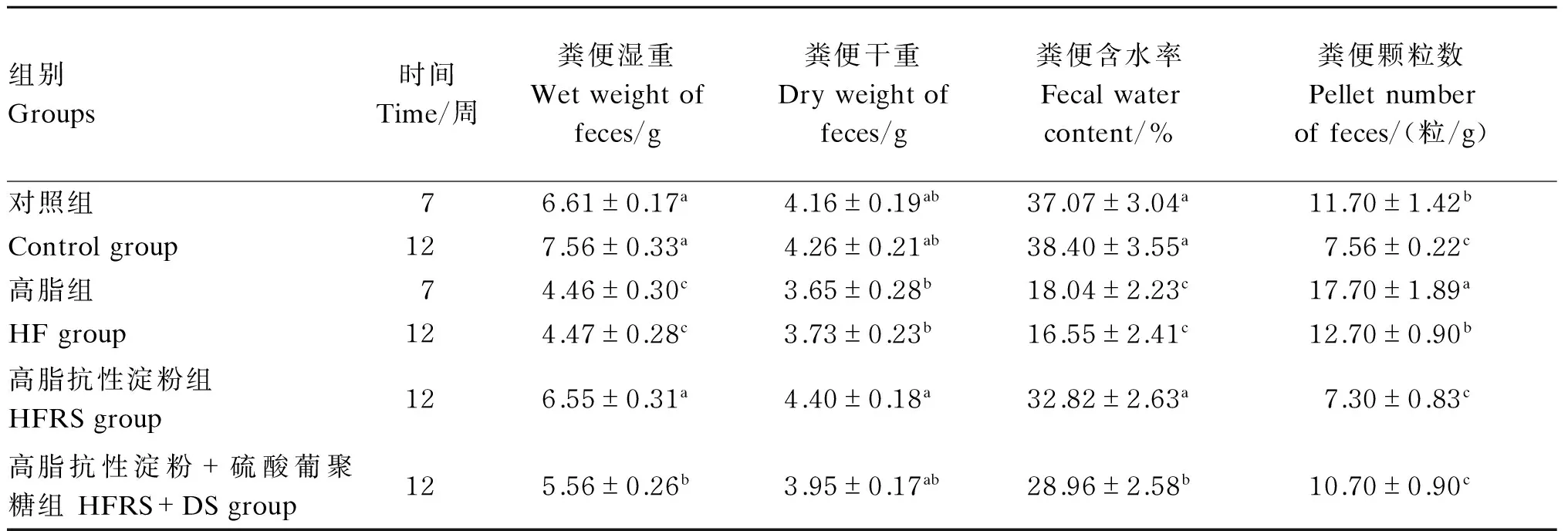
表2 试验大鼠排便状况
同列同一项目,数据肩标不同小写字母表示差异显著(P<0.05),肩标不同大写字母表示差异极显著(P<0.01),无肩标或肩标相同字母表示差异不显著(P>0.05)。下表同。
In the same column and the same item, values with different small letter superscripts mean significant difference (P<0.05), and with capital letter superscripts mean significant difference (P<0.01), while with no letter or the same letter superscripts mean no significant difference (P>0.05). The same as below.
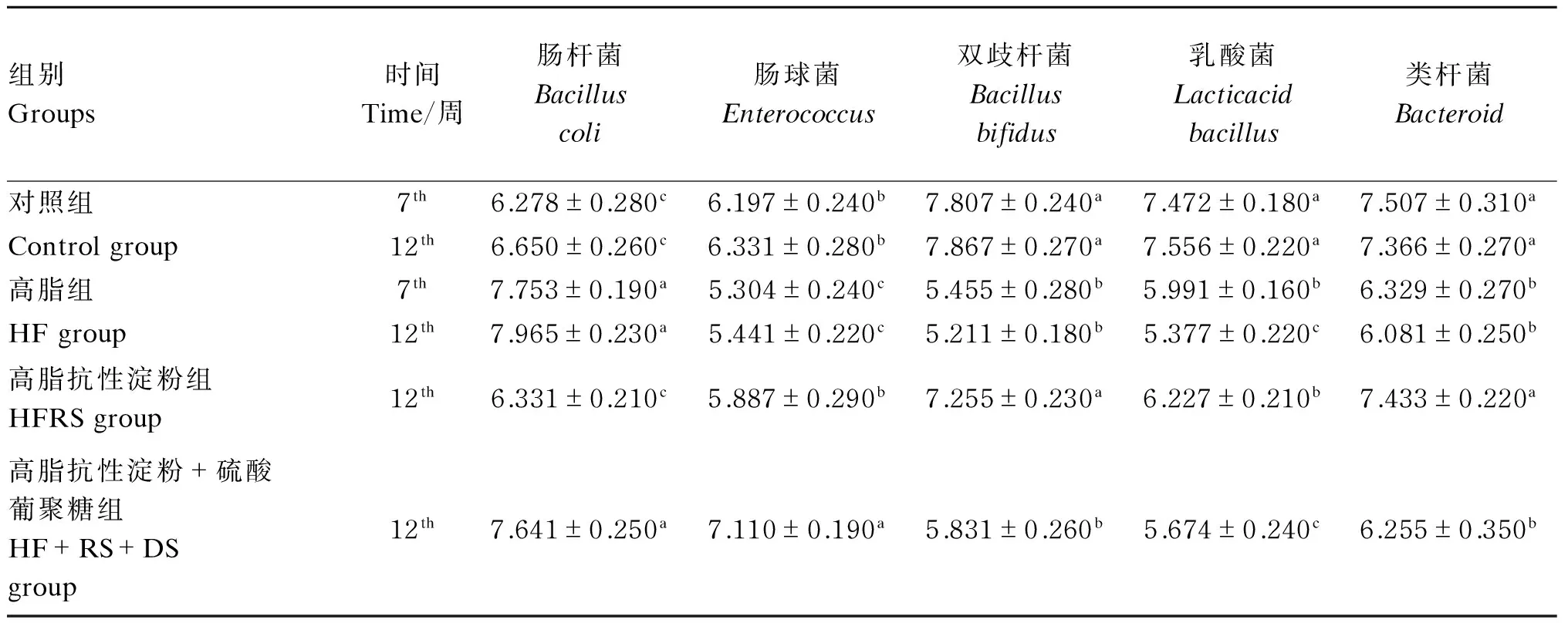
表3 试验大鼠粪便菌群数量
本试验研究结果显示,高脂饲粮使SD大鼠粪便湿重、粪便含水率显著降低,粪便颗粒数显著升高,但对粪便干重无显著影响,表明高脂饲粮会显著影响试验动物的排便状况,而这种影响主要体现在粪便含水量的降低,进而影响了粪便形态。原因可能是饲粮脂肪摄入过多,大量未被消化吸收的脂肪进入结肠后增加了粪便的疏水性,导致粪便干燥而颗粒变小、粒数增加。当摄入高脂RS饲粮后,粪便湿重、粪便干重及粪便含水率均显著升高,粪便颗粒数显著降低,表明RS有较好的吸水性能,对高脂饲粮引起的肠道功能紊乱有改善作用。而粪便干重的升高表明RS可以增加粪便总重,原因可能是RS具有促进排便的作用。
肠道菌群对动物健康有重要意义,在维护肠道生物屏障及营养代谢等方面发挥着重要作用[2]。在影响肠道菌群的诸多因素中,饲粮结构起主导作用[3,20-21]。已有研究显示,当饲粮中纤维素比例下降时会引起粪便含水量降低、排便量减少、肠道转运时间延长,饲粮结构的这种变化可使动物的排便状况发生显著变化[22]。另外,肠道中不同种类微生物生长繁殖所需的底物类型和数量存在差异。饲粮结构不同,经消化吸收后到达结肠的食物残渣成分就会存在差异,这种差异会选择性刺激肠内不同种类细菌的生长与繁殖,进而对肠道菌群产生影响。当饲粮蛋白质摄入过多或消化不良时,未被消化的蛋白质进入结肠长时间发酵,会诱导腐败菌大量增殖,导致肠内容物pH上升,抑制了双歧杆菌、乳酸菌等益生菌的增殖[6,23]。高脂饲粮也可通过减少结肠中可利用碳水化合物数量、增加肠道氧胁迫状态及自身的次级代谢产物来破坏肠道微生物环境而导致菌群失调[24-26]。本试验先利用高脂饲粮诱导大鼠肠道菌群紊乱,然后再饲喂10% RS饲粮后,肠道双歧杆菌和乳酸菌等益生菌数量增加,肠杆菌等条件致病菌数量减少,说明RS能够改善高脂饲粮引起的DIO大鼠肠道菌群紊乱状况,符合益生元的特征。DS是肠炎诱导剂,也是丁酸抑制剂,而丁酸是RS在结肠的主要发酵产物,是肠道黏膜细胞的主要能源物质。用5% DS灌胃后,诱导DIO大鼠发生了肠炎,因此HFRS+DS组DIO大鼠排便状况出现了异常,粪便湿重、粪便干重、粪便含水率均下降;同时,肠道微生态失衡,肠杆菌和肠球菌数量增加,双歧杆菌和乳酸菌等益生菌数量减少,表明DS阻断了RS对肠道功能紊乱的改善作用,原因可能是DS抑制了丁酸。提示通过饲粮成分的调整,适量摄入RS等不消化碳水化合物,维持肠道菌群稳定是可行的。
RS改善高脂饲粮引起的肠道微生态紊乱机制,推测可能与以下因素有关:1)未被机体消化吸收的蛋白质和脂肪进入结肠,会抑制厌氧菌生长而促进腐败菌增殖,RS通过其纤维素样作用改善了动物排便状况,使粪便在肠道停留时间缩短,减少了未消化食物残渣尤其是蛋白质及脂肪等被微生物发酵的时间,因此腐败性细菌数量减少[16,18];2)RS被结肠微生物发酵产生短链脂肪酸,降低了肠道pH,改善了肠道微生态环境[16];3)长期高脂饲粮可引起肠道氧化应激[26],进而引起肠壁炎性损伤,导致肠道菌群失调,常表现为大肠杆菌的过度增殖,而RS可通过改善脂质代谢来调整和改善肠道氧化应激状态;4)RS改变了饲粮的消化吸收特性,RS不能被小肠消化吸收,进入结肠后为双歧杆菌、乳酸菌等益生菌提供了充足的碳源,因而诱导其生长繁殖。
4结论
① 饲粮中添加适量RS可升高大鼠粪便湿重、粪便干重和粪便含水率,降低粪便颗粒数,进而改善排便状况。
② RS可使DIO大鼠肠道双歧杆菌和乳酸菌数量增加,使大肠杆菌数量减少。
致谢:
感谢西北民族大学医学院胜利博士在微生物检测及文稿方面所提出的宝贵意见。
参考文献:
[1]朱伟云,余凯凡,慕春龙,等.猪的肠道微生物与宿主营养代谢[J].动物营养学报,2014,26(10):3046-3051.
[2]CAESAR R,FÅK F,BCKHED F.Effects of gut microbiota on obesity and atherosclerosis via modulation of inflammation and lipid metabolism[J].Journal of Internal Medicine,2010,268(4):320-328.
[3]FUKUDA S,OHNO H.Gut microbiome and metabolic diseases[J].Seminars in Immunopathology,2014,36(1):103-114.
[4]LEY R E,TURNBAUGH P J,KLEIN S,et al.Microbial ecology:human gut microbes associated with obesity[J].Nature,2006;444(7122):1022-1023.
[5]陈杏云,曾本华,魏泓,等.高脂饮食对菌群人源化小鼠肠道菌群结构的影响[J].食品科学,2013,34(17):278-283.
[6]周中凯,杨艳,郑排云,等.肠道微生物蛋白质的发酵与肠道健康的关系[J].食品科学,2014,35(1):303-309.
[7]苏畅,王惠君,张兵,等.1989—2009年中国九省区膳食营养素摄入状况及变化趋势(五)1849岁成年居民膳食脂肪与胆固醇摄入状况及变化趋势[J].营养学报,2011,33(6):546-550.
[8]相振田.饲粮不同来源淀粉对断奶仔猪肠道功能和健康的影响及机理研究[D].博士学位论文.雅安:四川农业大学,2011.
[9]WALKER A W,INCE J,DUNCAN S H,et al.Dominant and diet-responsive groups of bacteria within the human colonic microbiota[J].The ISME Journal,2011,5(2):220-230.
[10]方建东.抗性淀粉对小鼠肠道菌群的影响以及作用机制的研究[D].硕士学位论文.杭州:浙江工商大学,2014.
[12]HIGGINS J A,BROWN M A.STORLIEN L H.Consumption of resistant starch decreasespostprandial lipogenesis in white adipose tissue of the rat[J].Nutrition Journal,2006,5(1):25-26.
[13]吴银伟.双歧三联活菌胶囊对腹泻型肠易激综合征患者肠道菌群的影响及疗效观察[J].中国微生态学杂志,2014,26(4):438-440.
[14]王竹,杨月欣,周瑞华,等.抗性淀粉的代谢及对血糖的调节作用[J].营养学报,2003,25(2):190-195.
[15]白永亮,彭真福,陈庆发,等.香蕉粉干预对糖尿病大鼠肠道菌群调节作用研究[J].现代食品科技,2013,29(9):2110-2114.
[16]王志凡,陈旺盛,张银霞.抗性淀粉对饮食诱导肥胖大鼠肠道发酵状况的改善作用[J].吉林大学学报:医学版,2013,39(1):42-45.
[17]杨月欣,王竹,洪洁,等.抗性淀粉结肠内酵解对大鼠肠道健康的影响[J].世界华人消化杂志,2004,12(11):2618-2622.
[18]张珍珍,尹富贵,黄菊,等.杂粮淀粉在仔猪体内的消化率研究[J].食品科学,2010,31(3):217-219.
[19]张慧,洪雁,顾正彪,等.3种谷物全粉中淀粉的消化性及影响因素[J].食品与发酵工业,2012,38(11):26-31.
[20]NATIVIDAD J M,HUANG X X,SLACK E,et al.Host responses to intestinal microbial antigens in gluten-sensitive mice[J].PLoS One,2009,4(7):e6472-e6473.
[21]DIBAISE J K,ZHANG H S,CROWELL M D,et al.Gut microbiota and its possible relationship with obesity[J].Mayo Clinic Proceedings,2008,83(4):460-469.
[22]王志凡,马慧,陈旺盛,等.高脂饮食对SD大鼠排便状况和粪便菌群的影响及其意义[J].吉林大学学报:医学版,2014,40(4):734-738.
[23]Welloek I J.Effect of weaning age,protein nutrition and enterotoxigenicEscherichacolichallenge on the health of newly weaned Piglets[J].Livestock Science,2007,108(1):102-105.
[24]RESTA S C.Effects of probiotics and commensals on intestinal epithelial physiology:implications for nutrient handling[J].Journal of Physiology,2009,587(Pt 17):4169-4174.
[25]ATTENE-RAMOS M S,NAVA G M,MUELLNER M G,et al.DNA damage and toxicogenomic analyses of hydrogen sulfide in human intestinal epithelial FHs 74 Int Cells[J].Environmental and Molecular Mutagenesis,2010,51(4):304-314.
[26]张蓉,孙进,李亚欣,等.硫辛酸对高脂日粮小鼠肠道氧化还原状态与微生物菌群的影响[J].食品工业科技,2010,31(9):321-326,369.
(责任编辑李慧英)
Effects of Resistant Starch on Defecation and Intestinal Microflora of Diet Induced Obesity Rats
WANG ZhifanYANG Xiuling*CHEN WangshengMA Hui
(Medical College, Northwest University for Nationalities, Lanzhou 730030, China)
Abstract:This experiment was conducted to discuss the influence of resistant starch (RS) on defecation and intestinal microflora of diet induced obesity (DIO) rat, to provide basis for the usage of RS. A total of 100 health male SD rats were randomly divided into two groups, basal diet was given to the control group which with ten rats and the high-fat diet was given to the high-fat group (HF group) which with ninety rats for seven weeks. Then twenty-seven DIO rats were picked out on the ground of their weight from the HF group, and randomly divided into three groups with nine replicates per group. Each group was offered one of the following diets: the high-fat diet in HF group, the high-fat diet with 10% RS in high-fat and resistant starch group (HFRS group) and high-fat and resistant starch+dextran sulfate group (HFRS+DS group). The experimental period was five weeks. During period, 1 mL 5% DS was given by gavage to HFRS+DS group, while 1 mL distilled water was administrated to other two groups. One gram fresh feces was collected in the 7thand the 12thweek. The number of Bacillus coli, Enterococcus, Bacillus bifidus, Lacticacid bacillus, and Bacteroid were tested using selective culture medium after dilution. The results showed as follows: 1) in the 7thweek, compared with the control group, wet weight and water content of feces, and the number of Enterococcus, Bacillus bifidus, Lacticacid bacillus and Bacteroid of feces in HF group were significantly decreased (P<0.05), while the pellet number and the Bacillus coli number of feces in HF group were significantly increased (P<0.05). 2) In the 12thweek, compared with the control group, wet weight and water content of feces, and the number of Enterococcus, Bacillus bifidus, Lacticacid bacillus and Bacteroid of feces in HF group were significantly decreased (P<0.05), while the pellet number and the Bacillus coli number of feces in HF group were significantly increased (P<0.05). Compared with the HF group, wet weight, dry weight and water content of feces, and the number of Enterococcus, Bacillus bifidus, Lacticacid bacillus and Bacteroid of feces in HFRS group were significantly increased (P<0.05), while the pellet number and the Bacillus coli number of feces in HFRS group were significantly decreased (P<0.05).Compared with the HFRS group, wet weight and water content of feces, and the number of Bacillus bifidus, Lacticacid bacillus and Bacteroid of feces in HFRS+DS group were significantly decreased (P<0.05), while the number of the Bacillus coli and Enterococcus of feces in HFRS+DS group were significantly increased (P<0.05). In conclusion, under the condition of this experiment, RS has benefit on defecation and intestinal microflora disturbance of DIO rats caused by high-fat diet.[Chinese Journal of Animal Nutrition, 2016, 28(5):1626-1632]
Key words:resistance starch; high-fat diet; diet induced obesity; intestinal microflora
doi:10.3969/j.issn.1006-267x.2016.05.041
收稿日期:2015-11-23
基金项目:国家自然科学基金项目(81160345)
作者简介:王志凡(1966—),男,甘肃兰州人,硕士研究生,从事营养与疾病研究。E-mail: 243150752@qq.com *通信作者:杨秀琳,讲师,E-mail: yxyxl@xbmu.edu.cn
中图分类号:S816.41
文献标识码:A
文章编号:1006-267X(2016)05-1626-07
*Corresponding author, lecturer, E-mail: yxyxl@xbmu.edu.cn

