黄芪甲苷对糖尿病肾病大鼠肾脏的保护作用及其机制
冉来虎,马红珍(.浙江中医药大学第一临床医学院,浙江杭州30053;.浙江中医药大学附属第一医院肾内科,浙江杭州30006)
黄芪甲苷对糖尿病肾病大鼠肾脏的保护作用及其机制
冉来虎1,马红珍2
(1.浙江中医药大学第一临床医学院,浙江杭州310053;2.浙江中医药大学附属第一医院肾内科,浙江杭州310006)
摘要目的:观察黄芪甲苷(AS-IV)对糖尿病肾病(DN)大鼠血糖、尿微量白蛋白、血清总蛋白、白蛋白、血清脂联素水平的影响及对肾脏的保护作用。方法:40只清洁级雄性SD大鼠分为正常组、模型组、黄芪甲苷低剂量组及黄芪甲苷高剂量组各10只。予链脲佐菌素造模,治疗8 w后处死大鼠取材及采血,取肾皮质行电镜观察,并检测血糖、尿微量白蛋白、血清总蛋白、白蛋白及脂联素水平。结果:与模型组比较,治疗后黄芪甲苷组血糖、尿微量白蛋白水平明显下降(P<0.05),血清总蛋白、白蛋白及血清脂联素水平明显增加。结论:AS-IV对DN肾脏有明显保护作用,能降低血糖和尿白蛋白排泄量,改善低蛋白血症,升高血清脂联素水平,从而延缓糖尿病肾病的进展,其作用机制可能与上调血清脂联素水平有关。
关键词糖尿病肾病;黄芪甲苷;脂联素;足细胞
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的并发症之一,其发病机制复杂,涉及到遗传背景、糖代谢紊乱、血流动力学、血液流变学、炎症、氧化应激及其他因素如足细胞损伤等[1-3]。有研究表明糖尿病肾病患者尿中丢失的足细胞数和尿蛋白量呈正相关[4],这提示足细胞对肾小球基底膜的黏附失常与脱落,是DN蛋白尿发生的主要原因之一。近几年来,国内外研究发现,脂联素水平的降低与足细胞损伤及丢失在糖尿病肾病进展过程中起着重要作用。因此,本实验通过黄芪甲苷(astragaloside IV,AS-IV)对糖尿病肾病大鼠进行干预,探讨其对DN病变时血糖、蛋白尿及血清脂联素水平的影响及血清脂联素与糖尿病肾病之间的关系。
1材料与方法
1.1实验材料
1.1.1实验动物健康清洁级雄性Sprague-DawLey (SD)大鼠,共40只,体重(250±10)g,购于浙江中医药大学实验动物中心,医学动物许可证号码:SCXK(沪)2013-0016,全封闭SPF状态下隔离标准饲料饲养。
1.1.2药品与仪器黄芪甲苷购自大连美仑生物技术有限公司(98%干粉,MB1955),链脲佐菌素(98%干粉,批号Sigma S0130)购自Sigma公司。血糖仪为罗氏(Roche)产品,7020全自动生化分析仪为日立股份有限公司产品。
1.2实验方法
1.2.1造模与给药40只SD大鼠购回后饲养于浙江中医药大学动物实验中心清洁级动物房,先予标准饲料适应性喂养1 w,称重,经尿糖及尿蛋白试纸测试阴性后随机分为4组:正常组、模型组、黄芪甲苷低剂量组及黄芪甲苷高剂量组各10只。参照文献[5-7]的方法,造模前予禁食不禁水12 h,正常组10只腹腔注射等体积柠檬酸-柠檬酸钠缓冲液,其余30只予链脲佐菌素(STZ)按65 mg/kg一次性腹腔注射,注射前在4℃环境下将1 000 mg STZ粉末溶解于50 mL 0.1 M无菌柠檬酸-柠檬酸钠缓冲液(pH= 4.5),现用现配,避光,15 min内用完。72 h后大鼠尾尖采血测空腹血糖,连续3 d,空腹血糖>16.7 mmoL/L,或随机血糖>22.2 mmoL/L,尿糖定性强阳性,尿量大于正常组的150%,并持续上述指标保持不变,确定糖尿病模型形成。模型形成后开始干预治疗:黄芪甲苷低、高剂量组分别予黄芪甲苷悬浮液灌胃,用量为2.5 mg/(kg·d)和5 mg/(kg·d),每日1次。正常组和模型组每日1次予等体积的蒸馏水灌胃。实验期间,所有实验动物均给予标准饲料饮食及饮水,自由摄取。在治疗过程中模型组有1只因不能耐受而死亡,其余各组大鼠未出现死亡情况。
1.2.2检测指标血、尿指标:实验过程中剪尾采血测血糖及留取24 h尿液测定24 h尿微量白蛋白,实验8 w结束时大鼠麻醉后腹主动脉取血留取血标本,分离血清,-20℃保存检测血清脂联素及其他指标。肾脏组织电镜观察:对肾皮质行透射电镜观察肾小球超微结构情况。
1.3统计学处理
全部数据采用SPSS17.0统计分析软件包进行处理,计量资料采用单因素方差分析(one way ANOVA),进一步采用SNK-q检验进行两两比较,以P<0.05为差异有统计学意义。
2结果
2.1治疗前后各组大鼠血糖变化
结果见表1。
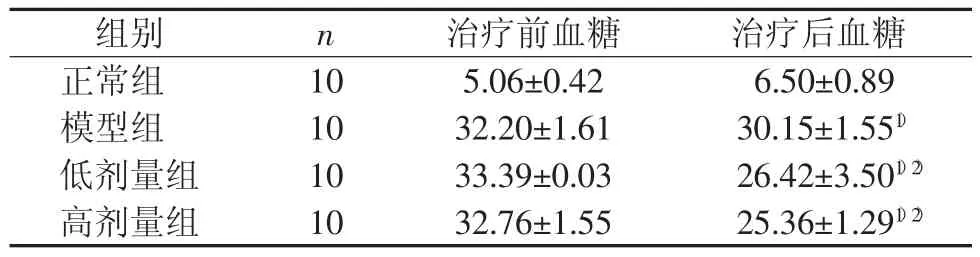
表1 治疗前后各组大鼠血糖变化情况(mmol/L?±s)
由表1可见,与正常组比较,模型组大鼠血糖升高(P<0.01),表明造模成功。与模型组比较,黄芪甲苷低、高剂量组血糖水平明显降低(P<0.05),说明黄芪甲苷对血糖有一定的控制作用。
2.2治疗后各组大鼠24 h尿微量白蛋白、总蛋白、白蛋白、血清脂联素变化比较
结果见表2。

表2 治疗后各组大鼠24 h尿微量白蛋白水平变化情况 (?±s)
与正常组比较,各组大鼠24 h尿微量白蛋白含量上升,总蛋白、白蛋白含量下降,差异具有统计学意义(P<0.01);黄芪甲苷低、高剂量组血清脂联素含量显著上升,差异具有统计学意义(P<0.01),模型组血清脂联素含量亦上升,但差异无统计学意义。
与模型组比较,黄芪甲苷低、高剂量组24 h尿微量白蛋白明显下降,差异具有统计学意义(P<0.05);黄芪甲苷高剂量组总蛋白、白蛋白、血清脂联素含量明显上升,差异具有统计学意义(P<0.05),黄芪甲苷低剂量组上述指标亦上升,但差异无统计学意义。表明黄芪甲苷能降低24 h尿微量白蛋白水平,升高血清脂联素水平,改善低蛋白血症。
2.3透射电镜肾脏组织结构观察
透射电镜下可见正常组大鼠足细胞结构完整,足突清晰附着于毛细血管基膜上,分布均匀,排列整齐,结构完整,无融合及脱落。模型组见肾小球系膜细胞及系膜基质增生,基膜皱缩,初级突起变短,足突消失,有些见足突融合。黄芪甲苷低剂量组、黄芪甲苷高剂量组上述病变不同程度得到改善。结果见图1。
3讨 论

图1 透射电镜肾脏组织结构观察
糖尿病肾病是糖尿病常见的慢性并发症之一,也是糖尿病患者致死、致残的主要原因,其发病机制涉及广泛,至今尚未完全阐明,其中足细胞在糖尿病肾病进展过程中的作用越来越受到人们的重视,足细胞的损伤及丢失能够导致蛋白尿的发生及糖尿病肾病的进一步恶化。足细胞是附着于肾小球基底膜外高度分化的细胞,其作为肾小球滤过屏障中重要的组成部分,具有滤过屏障及修复肾小球基底膜作用[8]。相邻足细胞的足突彼此交叉嵌合,构成约40 nm的裂孔,裂孔隔膜相互连接裂孔,构成阻止蛋白质等大分子物质滤过的最后屏障。其中,裂孔隔膜是连接相邻足细胞足突间的特殊蛋白复合体,Nephrin是裂孔隔膜上的一个跨膜蛋白分子,具有维持足细胞结构及维持滤过屏障的作用[9]。另一种裂孔隔膜跨膜蛋白CD2AP与Nephrin共同维持足细胞的结构功能。大量临床及实验研究表明,在糖尿病肾病患者中这两种蛋白分子及Nephrin mRNA的表达显著下降[10]。而近年来研究发现,脂联素的缺乏会引起足细胞的损害及丢失,导致蛋白尿的增加及糖尿病肾病的恶化[11]。
在人体脂联素(adiponectin,APN)以三聚体、六聚体及多聚体的形式存在于血浆之中,其活性形式为高分子量聚合物。脂联素通过脂联素受体1和脂联素受体2作用于机体[12]。脂联素受体1在所有组织中整体表达,其中,骨骼肌的表达是最丰富的。脂联素受体2存在于肝脏、肾脏、骨骼肌,而以肝脏中表达最丰富[13]。Guo X等[14]研究发现,血清脂联素可减少糖尿病肾病小鼠因血管紧张素Ⅱ(AngⅡ)刺激引起的肾组织TGF-β1、纤溶酶原激活物抑制物(PAI-1)、纤连蛋白(FN)表达水平,减轻肾小球病变。常快乐等[15]研究发现,氯沙坦联合贝那普利可显著提高早期糖尿病肾病患者血清脂联素水平,保护肾功能,降低24 h尿蛋白定量水平。另有实验发现,ADPN基因敲除的小鼠可出现足细胞数目的减少,足突的融合、消失,并且出现蛋白尿;而ADPN的增加可通过激活AMPK途径,减轻足细胞的氧化应激反应,从而减少足细胞的损失,并进一步修复足细胞的功能,减少蛋白尿[16]。此外,有研究证实,脂联素能够通过多种通路如抑制糖基化终末产物[17]、改善胰岛素抵抗和糖代谢紊乱缓解足细胞损伤,保护肾脏[18]。
黄芪甲苷为黄芪的单体,是其主要作用成分。黄芪味甘,性微温,归肺、脾、肝、肾经,据《本草纲目》记载黄芪具有补气固表、利水退肿、托毒排脓之功。黄芪能扩张肾血管,增加肾血流量,保护肾脏血管内皮细胞功能,减少蛋白尿[19],是治疗各种肾脏病的常用中药。以黄芪为主药的补中益气汤、参芪地黄汤等均是治疗慢性肾脏病的常用方剂。陈红波等[20]研究发现以黄芪为君药的参芪地黄汤能够通过上调肾组织Nephrin和Podocin表达,减轻足细胞损伤,起到保护肾脏的作用。而糖尿病肾病大鼠血清脂联素水平及肾组织AdiopR1表达的降低与足细胞损伤及尿蛋白排泄率增加有直接关系。黄芪是参芪地黄汤君药,黄芪甲苷是黄芪的主要作用成分。因此,通过深入研究黄芪甲苷治疗糖尿病肾病的机制及途径可为临床应用提供依据。本实验研究显示,经过黄芪甲苷治疗后,高剂量治疗组大鼠模型24 h尿微量白蛋白定量及血糖下降,血清脂联素水平明显升高,与模型组相比,差异具有统计学意义(P<0.05)。综上所述,黄芪甲苷有效改善尿蛋白、纠正低蛋白血症等方面作用可能与上调血清脂联素水平有关,其具体机制有待进一步研究。
参考文献
[1]Kato M,Zhang J,Wang M,et al.MicroRNA-192 in diabetic kidneyglomeruli and its function in TGF-beta-induced collagen expression via inhibition of E-box repressors[J].Proc Natl Acad Sci U S A,2007,104(9):3 432-3 437.
[2]Krupa A,Jenkins R,Luo D D,et al.Loss of MicroRNA-192 promotes fibrogenesis in diabetic nephropathy[J].J Am Soc Nephrol,2010,21(3):438-447.
[3]Putta S,Lanting L,Sung,et al.Inhibiting microRNA-192 ameliorates renal fibrosis in diabetic nephropathy[J].J Am Soc Nephrol,2012,23(3):458-469.
[4]郭维文,黎帅,陈玲玲,等.黄芪甲苷对糖尿病肾病大鼠肾脏的保护作用及其机制[J].中国病理生理杂志,2014(6):351-354.
[5]李伟,张红,殷松楼,等.不同剂量链脲佐菌素诱导SD大鼠糖尿病肾病模型的研究[J].徐州医学院学报,2006(5):52-55.
[6]赖洁梅,周玖瑶.糖尿病肾病动物模型的研究进展[J].中药新药与临床药理,2014(8):112-115.
[7]李志杰,张悦.糖尿病肾病动物模型的研究进展[J].生命科学,2011(9):90-95.
[8]Satchell S C,Braet F.Glomerular endothelial cell fenestrations:an integral component of theglomerular filtration barrier[J].Am J Physiol Renal Physiol,2009,296(7):F947-956.
[9]Roselli S,Heidet L,Sich M,et al.Earlyglomerular filtration defect and severe renal disease in podocin-deficient mice[J].Mol Cell Biol,2004,24(8):550-560.
[10]Jim B,Ghanta M,Qipo A,et al.Dysregulated nephrin in diabetic nephropathy of type 2 diabetes:a cross sectional study[J].Plos One,2012,7(9):e36 041.
[11]Stitt-Cavanagh E,MacLeod L,Kennedy C.The podocyte in diabetic kidney disease[J].Scientific World Journal,2009,9(4):1 127-1 139.
[12]Yamauchi T,Kamon J,Ito Y,et al.Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J].Nature,2003,423(7):762-769.
[13]BaLsang A,Vieira J L,OLiveira A M,et al.Relationship between adiponectin,obesity and insulin resistance[J].Rev Assoc Med Bras,2015,61 (10):72-80.
[14]Guo X,Zhoug,Guo M,et al.Adiponectin retards the progression of diabetic nephropathy in db/db mice by counteracting angiotensin II[J].Physiol Rep,2014,2(5):e00230.
[15]常快乐,王海昌,孙璐,等.氯沙坦联合苯那普利对早期糖尿病肾病患者血浆APN及hs-CRP的影响[J].西南国防医药,2013(12):830-832.
[16]Ohashi K,Iwatani H,Kihara S,et al.Exacerbation of albuminuria and renal fibrosis in subtotal renal ablation model of adiponectin-knockout mice[J].Arterioscler Thromb Vasc Biol,2007,27(9):1 910-1 917.
[17]邓翔,沈元琼,游咏,等.脂联素抑制晚期糖基化终末产物诱导的HUVEC-12细胞CD40高表达[J].中国现代医学杂志,2010(3):2 612-2 615.
[18]Wang Y,Tian J,Guo H,et al.Effects of adiponectin on endoplasmic reticulum stress-mediated apoptosis and cell cytoskeleton and its mechanism of podocytes cultured in highglucose[J].Chinese Medical Journal,2014,94(14):1 092-1 096.
[19]Li M,Wang W,Xue J,et al.Meta-analysis of the clinical value of Astragalus membranaceus in diabetic nephropathy[J].J Ethnopharmacol,2011,133 (11):412-419.
[20]陈红波,马红珍,庄英,等.参芪地黄汤对IgA肾病大鼠肾组织Nephrin表达的影响[J].中华中医药学刊,2013(10):1 753-1 755.
(编辑:梁葆朱)
Protective effect of astragaloside IV on kidney of diabetic nephropathy rats
Ran Laihu1,Ma Hongzhen2
(1.The First Clinical Medical College,Zhejiang Chinese Medical University,Hangzhou Zhejiang 310053;2.Department of Nephropathy,The First Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou Zhejiang 310006)
AbstractObjective:To investigate effects of astragaloside IV(AS-IV)on contents of bloodglucose,24 h urine microalbumin,serum total protein,serum albumin protein nd serum adiponectin of rats with diabetic nephropathy(DN)and its renal protective effect.Methods:Male SD rats(n=40)were divided into normalgroup,modelgroup,AS-IVgroup of low dose and AS-IVgroup of high dose,10 rats in eachgroup.The rats in modelgroup and interventiongroup were injected with streptozotocin to induce DN models.After treatment for 8 weeks,the rats were sacrifice,and the blood samples and the renal cortex were collected.Electron microscopy was applied for observing the pathological changes of the renal tissues.The contents of bloodglucose,urine microalbumin,serum total protein,serum albumin protein and serum adiponectin were detected.Results:At the end of the 8th weeks,compared with modelgroup,the amount of bloodglucose and urine microalbumin in AS-IV interventiongroup were significantly decreased(P<0.05),the levels of serum total protein,serum albumin and serum adiponectin were increased.Conclusion:AS-IV has a renal protective effect on DN rats and could delay the development of DN.The mechanism may be related to up-regulate the level of serum adiponectin.Key words diabetic nephropathy;astragaloside IV(AS-IV);adiponectin;podocyte
中图分类号:R285.5
文献标识码:A
文章编号:1671-0258(2016)02-0022-04
[基金项目]浙江省中医药科学研究基金项目(2016A060)
[作者简介]冉来虎,在读硕士,E-mail:755005875@qq.com
[通讯作者]马红珍,主任医师,教授,博士研究生导师,E-mail:mahongzhen0515@163.com

