原发性肝癌病人抑郁与血管生成的相关性研究
张 彧,谢 娟,徐 瑞,李丽娜,阮之平
原发性肝癌病人抑郁与血管生成的相关性研究
张彧,谢娟,徐瑞,李丽娜,阮之平
摘要:[目的]探索原发性肝癌抑郁对肿瘤进展的影响,为原发性肝癌伴抑郁病人的护理提供理论基础。[方法]采用Hamilton抑郁量表(HAMD)和Zung抑郁自评量表对原发性肝癌病人做心理筛查;酶联免疫吸附实验(ELISA)法检测病人血清中氧化应激指标和血管生成指标;利用体外培养系统,检测原发性肝癌伴抑郁病人的血清对血管内皮细胞增殖及迁移的影响;追踪原发性肝癌病人血清氧化应激及血管生成对原发性肝癌病人无进展生存期及总的生存期的影响。[结果]血管内皮生长因子(vascular endothelial growth fator,VEGF)在原发性肝癌伴抑郁病人中的表达显著高于其非抑郁病人中的表达水平(P<0.05);体外实验证明原发性肝癌伴抑郁病人的血清能够有效促进血管内皮细胞的增殖和迁移能力;原发性肝癌病人抑郁水平、血清氧化应激水平及VEGF水平与病人的生存期呈负相关。[结论]原发性肝癌病人抑郁水平与血清VEGF呈正相关,与病人的预后呈负相关。
关键词:原发性肝癌;抑郁;氧化应激;血管生成
原发性肝癌(primary liver cancer)是第5位常见的恶性肿瘤,全世界每年有约600 000人死于该疾病,占据肿瘤相关死亡率的第3位[1]。我国的肝癌发病人数约占全世界的55%;死亡率仅次于肺癌,位居第2位。由于原发性肝癌的起病隐匿、进展快、预后差、治疗效果不理想,在原发性肝癌病人中,抑郁的发生比例非常高[2]。近年来,由于对肿瘤病人心理因素的重视,一门新兴学科——肿瘤心理学得到长足发展[3]。肿瘤心理学认为恶性肿瘤属心身疾病,肿瘤的发生、发展与个性心理特征、情绪障碍、生活习惯、社会矛盾等有关。氧化应激对肿瘤血管生成的促进作用[4]越来越受到人们的重视。研究认为活性氧(ROS)对血管形成的促进作用源于在蛋白及信使核糖核酸(mRNA)水平上调了血管内皮生长因子(vascular endothelial growth fator,VEGF)的表达[5]。现有的研究可以证实抑郁与肿瘤的死亡相关,明确氧化应激参与了抑郁的病理、生理过程[6-8],而氧化应激会促进肿瘤血管的生成[9-11],那么在肝癌伴抑郁的病人中,会不会因较高的氧化应激水平而存在更强的肿瘤血管生成活性,由此影响病人的无进展生存期及总的生存期呢?本研究拟通过心理测评分组,动态观察原发性肝癌伴或不伴抑郁病人其氧化应激水平的差异,对比分析抑郁程度和血清VEGF的关系,旨在了解肝癌抑郁情绪与肿瘤血管生成之间的关系,并有望为心身疾病的发生、发展提供新的研究方向。
1资料和方法
1.1一般资料研究对象为2012年—2014年陕西省肿瘤医院住院病人40例。纳入标准:符合世界卫生组织(WHO)原发性肝癌诊断标准;尚未进行或1个月内未行化疗、放疗及手术者;Karnofsky功能状态评分≥60分;预计生存期≥3个月。排除标准:入组前1个月曾服用抗抑郁及抗氧化剂;既往有精神病史者;有智能障碍者;药物、烟酒依赖者;患有感染或其他严重躯体疾病者。设立两个研究组,每组20例,两组病人的年龄、性别、病理分型、临床分期、肿瘤大小及数目均差异无统计学意义(P>0.05)。依据Hamilton 17项抑郁量表(HAMD,评分≥18分)和Zung抑郁自评量表(SDS,标准分≥50分)做心理筛查。病人签知情同意书,临床研究内容符合《赫尔辛基宣言》及伦理委员会规定。
1.2试剂和仪器M199培养基购自Gibco BRL公司;胎牛血清(fetal bovine serum,FBS)购自Hyclone公司;96孔板和细胞培养皿购自Costar公司;Transwell小室购于Corning公司,基质胶购自日本BD公司。条件培养基制备:抽取病人全血5 mL,分离得到血清,并于1 000 rpm离心5 min 清除残留细胞,于-80 ℃保存备用。
1.3酶联免疫吸附实验(ELISA)分别将病人血清加入不同浓度标准品(3 200 pg/mL、1 600 pg/mL、800 pg/mL、400 pg/mL、200 pg/mL、100 pg/mL、50 pg/mL)各100 μL,37 ℃孵箱孵育2 h,洗涤5次,加入50 μL鼠抗人VEGF工作液,37 ℃孵箱孵育1 h,洗涤,加入100 μL酶标抗体工作液,37 ℃孵箱孵育1 h,每孔加入100 μL底物工作液,混匀37 ℃避光孵育10 min,加入50 μL中止液混匀后在492 nm处测吸光值。根据标准品浓度得到标准曲线和回归方程,计算得到待测样品VEGF含量。
1.4四甲基偶氨唑盐比色法(MTT)实验将人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)按1×104/mL的密度150 μL接种于96孔板中,待细胞贴壁后,去除培养基,换成含有抑郁肝癌病人或者非抑郁肝癌病人血清的条件培养基(血清量∶完全培养基为1∶1)继续培养直至7 d。以M199完全培养基为阳性对照。MTT法检测各组细胞的吸光值。
1.5细胞迁移实验胰酶消化HUVEC细胞成单细胞悬液,用含1%胎牛血清的M199培养基重悬,按1×104/mL的密度100 μL接种于Transwell上层小室。吸取各种条件培养基500 μL加入Transwell下层小室,置于37 ℃,5%CO2培养箱中培养24 h。以M199完全培养基为阳性对照。用棉签蘸磷酸缓冲盐溶液(PBS)轻轻地擦去小室上层聚碳酸酯膜上贴壁生长但未能穿过膜的细胞。将膜取出放入预先装有95%乙醇的24孔板内固定10min。吸弃乙醇,加0.1%的结晶紫染色30 min,用PBS小心洗去多余的染料,翻转聚碳酸酯膜,小心撕下,晾干,置载玻片上加中性树胶盖玻片封片。在200倍放大镜下随机观察并计10个视野内穿过聚碳酸酯膜的细胞数,照相记录。
1.6评价内容与方法原发性肝癌病人抑郁水平与氧化应激及VEGF表达的相关性研究,为了研究原发性肝癌病人抑郁水平对病人疾病进展及预后的影响,首先原发性肝癌病人抑郁水平与病人血管生成之间的关系,试图探讨与完善肝癌疾病进展的精神心理因素。通过提前设定好的临床病例筛选标准,结合抑郁量表的评估将研究对象分为原发性肝癌伴抑郁组和不伴抑郁组,通过临床生化试验检测病人血清中氧化应激指标,包括ROS、超氧化物歧化酶(SOD),血管生成指标通过ELISA方法检测血清VEGF水平。采用MTT实验检测来源于原发性肝癌伴抑郁和不伴抑郁病人的血管内皮细胞增殖能力;采用trans-well小室侵袭实验检测来源于原发性肝癌伴抑郁和不伴抑郁病人的血管内皮细胞侵袭能力。
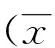
2结果
2.1原发性肝癌病人抑郁水平与氧化应激及VEGF表达的相关性研究原发性肝癌抑郁组病人血清氧化应激指标ROS显著高于原发性肝癌非抑郁组的病人,SOD水平低于非抑郁组(P<0.05),血管生成指标VEGF在抑郁组病人中显著高于非抑郁组的原发性肝癌组(P<0.05),见表1。相关分析显示:原发性肝癌病人血清中ROS与VEGF水平呈正相关(r=0.678,P<0.05),SOD则与VEGF呈负相关(r=-0.721,P<0.05)。

表1 两组原发性肝癌病人氧化应激及VEGF表达水平
2.2原发性肝癌病人血清中氧化应激物对血管内皮细胞增殖和迁移能力的影响分离两组原发性肝癌病人的血清(每组选择3例病人分别进入研究,最终以实验结果的平均值进行比较分析)与完全培养基共培养血管内皮细胞HUVEC,通过细胞增殖能力和迁移能力评价,结果来源于伴有抑郁病人的血清培养的血管内皮细胞的增殖能力显著高于非抑郁组(P<0.05),见图1;抑郁组细胞迁移能力也显著高于非抑郁组的迁移能力(P<0.05),见图2。

图1 抑郁对原发性肝癌病人血清血管内皮细胞增殖的影响

图2 抑郁对原发性肝癌病人细胞迁移能力的影响
2.3原发性肝癌病人抑郁水平、氧化应激及VEGF水平对病人预后的影响通过对入选的肝癌病人进行了为期3年的随访。结果显示:原发性肝癌抑郁组病人的生存期(5.24个月±0.15个月)较原发性肝癌非抑郁组病人(8.12个月±0.21个月)显著降低(P<0.05),并且呈负相关(r=-0.592,P<0.05)。进一步分析氧化应激指标及VEGF与病人生存时间的相关性:原发性肝癌病人ROS和VEGF均与病人的生存时间呈负相关,相关系数分别为-0.782,-0.845,SOD与病人的生存时间呈正相关,相关系数为0.692(P<0.05)。以上结果提示原发性肝癌病人抑郁程度及血清中氧化应激及VEGF指标可能作为病人的预后的影响因素。
3讨论
随着国民素质及病人认知度的提高,肿瘤科护士的护理对象中绝大多数对自己的病情有充分的认知,这使病人可以更好地了解疾病转归并积极配合治疗。另一方面对于那些恶性程度高、预后差的肿瘤病人,疾病确诊的同时,病人的心理也会产生急剧变化,常见抑郁等不良情绪。
氧化应激是由于机体或细胞内ROS的产生与内源性抗氧化防御之间的不平衡引起。该过程引发氧化损伤,促进ROS依赖的信号转导通路的调控而导致细胞表型的特异性改变等[11-12]。这一过程参与了细胞的凋亡、坏死及细胞增殖及肿瘤发生的多种病理生理过程[13]。在肝脏组织中氧化应激可以导致细胞的死亡及肝细胞的再生,从而直接导致肝脏中具有高度增殖活性、基因组不稳定性、高迁移性及高度成血管活性等致癌性的优势克隆出现[9]。而氧化应激对肿瘤血管生成的促进作用[4]越来越受到人们的重视[14-16]。研究认为ROS对血管形成的促进作用源于在蛋白及mRNA水平上调了VEGF的表达[9]。VEGF是血管内皮细胞特异的生长因子,不仅能刺激内皮细胞有丝分裂、增殖和存活,增加血管通透性,参与肿瘤血管生成,还直接与肿瘤浸润和转移有关,是迄今所发现的最强、最特异的促血管生成因子之一,在肿瘤新生血管形成过程中起关键作用[17-18]。它由肿瘤细胞或侵入肿瘤的巨噬细胞和肥大细胞产生,可以通过自分泌方式作用于肿瘤细胞本身,直接促进肿瘤生长,或通过旁分泌方式结合于血管内皮细胞,促进血管内皮细胞增殖、迁移并诱导新生血管生成[19]。肝癌是一种典型的富血供的实体肿瘤,肿瘤血管生成和血管侵犯是肝癌的重要病理学特点之一,具有生长快、恶性程度高、易发生肝内播散、易复发和转移,预后差等临床病理特征,与其有较强诱导肿瘤血管生成能力有关[20]。除了在肝癌组织中VEGF高表达,肝癌病人的血清和血浆中也存在高浓度的VEGF[21]。一项有60例肝癌病人入组的实验表明:血清VEGF含量和血小板计数的比值与肿瘤细胞中VEGF含量呈明显正相关,同时还发现,肿瘤细胞中VEGF含量、血清 VEGF含量及血清VEGF含量和血小板计数比值越高意味着肝癌病人的临床分期越晚[22]。另外一项有105例肝癌病人入组的实验表明,血清VEGF含量与肝癌门脉浸润和临床分期密切相关,具有高水平VEGF(>245.0 pg/mL)的病人无病生存期较低水平VEGF病人短,总体预后差[23]。因此,VEGF 在肝癌血管生成中发挥了重要作用,是肝癌血管生成的中心环节,同时也是肝癌侵袭转移过程中的关键分子[24]。
众所周知,癌症作为机体组织病变,肿瘤相关基因异常等环境因素和心理因素相互作用的疾病已得到广泛的认可,其中不良心理因素及应激反应对肿瘤的进展具有一定的促进作用。同时,癌症病人在接受治疗过程中,心理因素起着不可忽视的作用。然而目前对癌症病人确诊初期,治疗过程及临终整个过程的心理护理及疏导仍然不够全面与普及。本研究阐述了原发性肝癌伴抑郁和不伴抑郁病人氧化应激水平与癌症进展相关因素血管生成的关系,对个体化的临床诊疗及护理提供理论依据和量化指标。
本研究证实了抑郁与肝癌肿瘤病人的预后相关,提示肝癌伴抑郁的病人中,较高的氧化应激水平,使得病人具有更强的肿瘤血管生成活性,由此影响病人的无进展生存期及总的生存期。值得注意的是原发性肝癌伴抑郁病人血清氧化应激水平与病人血清VEGF相关,说明了肝癌抑郁情绪与肿瘤血管生成之间的关系,并有望为心身疾病的发生、发展提供新的研究方向。
参考文献:
[1]Parkin DM,Bray F,Ferlay J.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]Bosch FX,Ribes J,Díaz M,etal.Primary liver cancer:worldwide incidence and trends[J].Gastroenterology,2004,127(5 Suppl 1):S5-S16.
[3]Kash KM,Mago R,Duffany S,etal.Psycho-oncology:review and update[J].Curr Psychiatry Rep,2006,8(3):246-252.
[4]Rojas A,Silva R,Figueroa H,etal.Oxidative stress in tumor microenvironment:its role in angiogenesis[J].Zhongguo Fei Ai Za Zhi,2008,11(3):297-305.
[5]Kuroki M,Voest EE,Amano S,etal.Reactive oxygen intermediates increase vascular endothelial growth factor expression in vitro and in vivo[J].J Clin Invest,1996,98(7):1667-1675.
[6]Sarandol A,Sarandol E,Eker SS,etal.Major depressive disorder is accompanied with oxidative stress:short-term antidepressant treatment does not alter oxidative-antioxidative systems[J].Hum Psychopharmacol,2007,22(2):67-73.
[7]Michel TM,Frangou S,Thiemeyer D,etal.Evidence for oxidative stress in the frontal cortex in patients with recurrent depressive disorder:a postmortem study[J].Psychiatry Res,2007,151(1-2):145-150.
[8]Michel TM,Pulschen D,Thome J.The role of oxidative stress in depressive disorder[J].Curr Pharm Des,2012,18(36):5890.
[9]Storz P.Reactive oxygen species in tumor progression[J].Front Biosci,2005,10:1881-1966.
[10]Li Q,Fu GB,Zheng JT,etal.NADPH oxidase subunit p22(phox)-mediated reactive oxygen species contribute to angiogenesis and tumor growth through AKT and ERK1/2 signaling pathways in prostate cancer[J].Biochim Biophys Acta,2013,1833(12):3375-3385.
[11]Chang J,Jung HJ,Jeong SH,etal.A mutation in the mitochondrial protein UQCRB promotes angiogenesis through the generation of mitochondrial reactive oxygen species[J].Biochem Biophys Res Commun,2014,455(3-4):290-297.
[12]Kim HM,Haraguchi N,Ishii H,etal.Increased CD13 expression reduces reactive oxygen species,promoting survival of liver cancer stem cells via an epithelial-mesenchymal transition-like phenomenon[J].Ann Surg Oncol,2012(Suppl 3):S539-548.
[13]Matés JM,Segura JA,Alonso FJ,etal.Intracellular redox status and oxidative stress:implications for cell proliferation,apoptosis,and carcinogenesis[J].Arch Toxicol,2008,82(5):273-299.
[14]Schaafhausen MK,Yang WJ,Centanin L,etal.Tumor angiogenesis is caused by single melanoma cells in a manner dependent on reactive oxygen species and NF-κB[J].J Cell SCI,2013,126(17):3862-3872.
[15]Zhou AY,Ryeom S.Cyclosporin a promotes tumor angiogenesis in a calcineurin-independent manner by increasing mitochondrial reactive oxygen species[J].Mol Cancer Res,2014,12(11):1663-1676.
[16]Zhang M,Liu C,Zhang Z,etal.A new flavonoid regulates angiogenesis and reactive oxygen species production[J].Adv Exp Med Biol,2014,812:149-155.
[17]Roskoski R Jr.Vascular endothelial growth factor(VEGF)signaling in tumor progression[J].Crit Rev Oncol Hematol,2007,62(3):179-213.
[18]Ellis LM,Hicklin DJ.VEGF-targeted therapy:mechanisms of anti-tumour activity[J].Nat Rev Cancer,2008,8(8):579-791.
[19]Desroches-Castan A,Quélard D,Demeunynck M,etal.A new chemical inhibitor of angiogenesis and tumorigenesis that targets the VEGF signaling pathway upstream of Ras[J].Oncotarget,2015,16(7):5382-5411.
[20]Paloma Sanz-Cameno,María Trapero-Marugán,María Chaparro,etal.Angiogenesis:from chronic liver inflammation to hepatocellular carcinoma[J].J Oncol,2010,2010:272170.
[21]Liu M,Yang S,Zhang D,etal.Fructopyrano-(1→4)-glucopyranose inhibits the proliferation of liver cancer cells and angiogenesis in a VEGF/VEGFR dependent manner[J].Int J Clin Exp Med,2014,7(11):3859-3869.
[22]Poon RT,Lau CP,Cheung ST,etal.Quantitative correlation of serum levels and tumor expression of vascular endothelial growth factor in patients with hepatocellular carcinoma[J].Cancer Res,2003,63(12):3121-3126.
[23]Poon RT,Ho JW,Tong CS,etal.Prognostic significance of serum vascular endothelial growth factor and endostatin in patients with hepatocellular carcinoma[J].Br J Surg,2004,91(10):1354-1360.
[24]Matsui D,Nagai H,Mukozu T.etal.VEGF in patients with advanced hepatocellular carcinoma receiving intra-arterial chemotherapy[J].Anticancer Res,2015,35(4):2205-2210.
(本文编辑孙玉梅)
Correlation study between depression and angiogenesis in patients with primary liver cancer
Zhang Yu,Xie Juan,Xu Rui,et al
(Shaanxi Provincial Tumor Hospital,Shaanxi 710061 China)
基金项目陕西省科技厅社发公关项目,编号:2013K12-03-15。
作者简介张彧,主管护师,硕士研究生,单位:710061,陕西省肿瘤医院;谢娟、徐瑞、李丽娜单位:710061,陕西省肿瘤医院;阮之平(通讯作者)单位:710061,西安交通大学医学院第一附属医院。
中图分类号:R473.73
文献标识码:A
doi:10.3969/j.issn.1009-6493.2016.16.032
文章编号:1009-6493(2016)06A-2018-04
(收稿日期:2015-06-30;修回日期:2016-05-08)

