莱菔硫烷经由miR-124抑制SWO-38胶质瘤干细胞的增殖
谢有科,李雪梅,黄丁平
莱菔硫烷经由miR-124抑制SWO-38胶质瘤干细胞的增殖
谢有科,李雪梅,黄丁平
摘要:目的研究莱菔硫烷对SWO-38胶质瘤干细胞增殖的影响及其机制。方法细胞增殖实验检测莱菔硫烷对SWO-38细胞增殖的影响;克隆形成实验、肿瘤球形成实验、蛋白印迹法等检测并比较莱菔硫烷处理前后SWO-38细胞克隆形成能力、肿瘤球形成能力及干性相关基因(如β-catenin、Oct4、Sox-2、c-Myc)表达水平等改变,比较莱菔硫烷和(或)miR-124抑制物处理对干性相关基因表达水平的影响。实时荧光定量PCR检测莱菔硫烷对miRNA-9、21、221、124、128、181等转录水平的影响。结果莱菔硫烷有效抑制SWO-38细胞增殖,其平均半数抑制浓度为(26.41±2.13)μmol/L。莱菔硫烷呈现剂量依赖性地削弱SWO-38细胞克隆和肿瘤球形成的能力。莱菔硫烷下调β-catenin、Oct4、Sox-2和c-Myc等干性相关基因的表达。同时,莱菔硫烷还影响miR-9、21、221、124、128、181 等miRNA的转录水平,其中miR-124转录水平增高约5.9倍,miR-128增高约2.6倍。miR-124抑制物组βcatenin、Oct4、Sox-2等基因表达较空白对照组显著增高,而miR-124抑制物与莱菔硫烷联合组上述基因表达水平高于莱菔硫烷组,但低于miR-124抑制物组。结论莱菔硫烷有效抑制SWO-38胶质瘤干细胞的增殖,其机制可能与miR-124/(β-catenin/Sox-2/Oct4)通路有关。
关键词:神经胶质瘤;肿瘤干细胞;细胞增殖;微RNAs;莱菔硫烷;miR-124
作者单位:南宁,广西中医药大学附属瑞康医院肿瘤科(邮编530011)
莱菔硫烷(sulforaphane, SFN)是从十字花科蔬菜中提取的主要活性产物,其作为天然的预防肿瘤食物已有较长的应用历史,并显示了较强的防癌功效。莱菔硫烷可经多种途径减少肿瘤的发生,抑制肿瘤细胞增生并诱导肿瘤细胞凋亡。近来年研究发现莱菔硫烷能特异性抑制多种肿瘤干细胞的自我更新和增殖[1],其临床应用潜力巨大。脑胶质瘤因其存在位置的重要性、难以手术清除和血脑屏障等原因,一直是临床抗肿瘤治疗的难题。胶质瘤存在极少部分具有干性特征的细胞亚群,即胶质瘤干细胞(glio⁃ma stem cells,GSCs),而GSCs被认为是胶质瘤发生、复发及放化疗耐药的根源[2-3]。靶向GSCs的药物可能从根本上阻断胶质瘤的增殖与复发。目前已知莱菔硫烷对多种胶质瘤细胞株均有较强的抑制作用[4-5],展现了较强的抗肿瘤活性,而其对GSCs的影响至今尚鲜见报道。本研究采用克隆形成及肿瘤球形成、蛋白印迹、miRNA抑制物等方法分析莱菔硫烷对SWO-38细胞株中GSCs的抑制作用及其潜在分子机制,以期为莱菔硫烷的临床应用提供新的证据。
1 材料与方法
1.1材料莱菔硫烷购自Sigma公司,鼠抗人β-catenin、Oct4、Sox-2、c-Myc等单克隆抗体购自美国Santa Cruz公司,过氧化物酶标记的二抗、噻唑蓝、DMEM F12等购自北京鼎国生物公司,miRNA荧光定量PCR检测试剂盒购于北京博凌科为生物公司,Lipofectamine 2000及B27、EGF、Basic FGF等无血清培养基添加物购于Invitrogen公司,miRNA引物及miR-124抑制物由上海生工生物工程技术服务有限公司合成。ABI 7300型PCR仪(ABI公司),分子成像仪(XRS+)为Bio-Rad公司产品。
1.2细胞培养人脑胶质瘤细胞SWO-38由暨南大学医学院病理教研室钟雪云教授惠赠,在10%新生牛血清DMEM高糖培养液中常规培养及备用。实验用的细胞均处于对数生长期。
1.3细胞增殖实验细胞按1×105个/mL接种于96孔培养板中,细胞贴壁后,换成含有1、5、10、25、40、50、60 μmol/L莱菔硫烷的DMEM培养液。常规培养72 h后向各培养孔中加入噻唑蓝10 μL,继续培养4 h,在各培养孔中吸出培养液150 μL,回补等体积二甲基亚砜,避光振荡10 min后在酶标仪上选择570 nm波长测定各孔光密度(OD)值。每组设3个复孔,重复实验3次,然后计算各组细胞存活率。存活率(%)=(处理组OD值-对照组OD值)/对照组OD值×100%,以及平均半数抑制浓度(IC50)。
1.4平板克隆形成实验贴壁细胞经胰酶消化,充分吹打,加入常规培养液,制备成单细胞悬液,细胞终浓度为40个细胞/mL。细胞分5组,每组3个重复孔。每孔加入200个细胞约5 mL,并适当震动以使细胞均匀分散。置入恒温细胞培养箱中,8 h后加入莱菔硫烷,浓度分别为0、2.5、5.0、10、25 μmol/L,每3~4 d换培养液1次,培养2~3周。当培养皿中出现肉眼可见的克隆时,以多聚甲醛固定细胞,加Giemsa液染色,轻柔洗去染色液后常温干燥。在低倍镜下计数>50个细胞的克隆数。克隆形成率=(克隆数/接种细胞数)× 100%。
1.5肿瘤球形成实验细胞经胰酶消化后,常温离心,1 000 r/min,2 min,弃上清。加入3 mL无菌磷酸盐缓冲液,轻柔吹散并洗涤细胞沉淀,再次离心。洗涤3次后,加入无血清的肿瘤球培养基,制备成单细胞悬液。调整细胞密度为1 500 个/mL,加入超低黏附6孔板,5 mL/孔,加入相应浓度莱菔硫烷,置入细胞培养箱常规培养。实验按药物浓度分为0、2.5、5.0、10、25 μmol/L等5组。每3~4 d更换培养液1次,7 d后在低倍镜下观察并计数或测量肿瘤球。肿瘤球体积V = (4/ 3)πR3,其中R为肿瘤球半径。
1.6蛋白印迹实验莱菔硫烷对干性相关基因表达影响的实验分为对照组和处理组。处理组在细胞贴壁后加入含莱菔硫烷培养液(终浓度10 μmol/L)。莱菔硫烷与miR-124相互作用实验分为对照组、莱菔硫烷组、miR-124抑制物组和联合组。细胞按5×105/mL接种于200 mL培养瓶中,贴壁后处理组加入莱菔硫烷(终浓度10 μmol/L)和(或)miR-124抑制物(按说明书使用)。以上实验的对照组均常规培养,不作任何处理。72 h后用胰酶消化并收集细胞沉淀。按10×106个细胞加入1 mL预冷RIPA裂解液,4℃低温下裂解20 min,于4℃离心12 000 r/min,20 min,收获上清液,测定蛋白浓度后分装备用于-80℃冰箱。电泳前取蛋白液解冻,按1∶5加入十二烷基磺酸钠⁃聚丙烯酰胺凝胶电泳(SDS⁃PAGE)上样缓冲液,96℃恒温水浴加热5 min,各组取等量蛋白电泳(12% SDS-PAGE),并转移到硝酸纤维素膜,经5%脱脂奶粉封闭,加入稀释的β-catenin、Oct4、Sox-2、c-Myc、GAPDH等单克隆抗体(一抗),37℃下孵育2 h,TBST缓冲液[含10 mmol/L Tris⁃HCl(pH值7.50)、100 mmol/L NaCl、0.50 g/L Tween-20]洗膜5 min,3次,加入辣根过氧化物酶标记羊抗鼠IgGⅡ(1∶2 000)室温孵育1 h,TBST液洗涤5 min,3次,化学发光法显影于分子成像仪。
1.7实时荧光定量PCR(qRT-PCR)检测实验分为对照组和莱菔硫烷组。莱菔硫烷组在SWO-38细胞贴壁后更换培养液(莱菔硫烷终浓度10 μmol/L),对照组不作任何处理。常规培养72 h后使用Trizol试剂提取细胞总RNA。根据待测miRNA序列设计合成引物,见表1。利用SYBR Green试剂盒进行qRT-PCR验证,U6基因为内参。扩增程序为97℃3 min;95℃变性30 s,56℃退火20 s,72℃延伸30 s,40个循环。实验重复3次。结果以2-ΔΔCt表示[6]。

Tab. 1 Oligonucleotide primers in quantitative real-time PCR表1实时定量PCR的寡核苷酸引物
1.8统计学方法采用SPSS 13.0软件进行统计,计量资料以均数±标准差(x ±s)表示,miRNA表达结果采用配对资料t检验,多组样本均数比较采用完全随机设计的单因素方差分析,多样本均数间多重比较采用q检验。P<0.05为差异有统计学意义。
2 结果
2.1莱菔硫烷对SWO-38细胞增殖的抑制作用莱菔硫烷终浓度分别为1、5、10、25、40、50、60 μmol/L时,作用于SWO-38细胞72 h,细胞存活率分别为95.15%、85.38%、71.66%、53.71%、22.82%、12.39%和8.42%。随着莱菔硫烷剂量增加,SWO-38细胞的增殖活性逐渐降低,呈明显的剂量依赖关系。IC50为26.41 μmol/L。
2.2莱菔硫烷抑制SWO-38细胞的克隆形成和肿瘤球形成莱菔硫烷在较低浓度(2.5 μmol/L)时即能削弱SWO-38细胞克隆形成能力,克隆形成率随莱菔硫烷浓度增高而降低,在10 μmol/L以上较为明显,IC50为5.62 μmol/L。同时,在肿瘤球培养实验中,SWO-38肿瘤球形成的数量及体积随莱菔硫烷剂量增高而下降,呈剂量依赖性。肿瘤球形成IC50为5.37 μmol/L。见表2。

Tab. 2 Effects of sulforaphane on the growth of cell cloneand tumor sphere (SWO-38)表2莱菔硫烷对SWO-38细胞克隆及细胞肿瘤球生长的影响 (n=3,x ±s)
2.3莱菔硫烷抑制SWO-38细胞干性相关基因的表达蛋白印迹法检测发现,与对照组比较,处理组(莱菔硫烷终浓度10 μmol/L)β-catenin、c-Myc、Oct4、Sox-2等基因表达水平显著下降,见图1。
2.4莱菔硫烷上调miR-124的表达qRT-PCR检测miRNAs发现,莱菔硫烷处理后miRNAs表达谱发生不同程度改变,其中miR-124转录水平较对照组增高(5.9±1.2)倍(t=11.132,P=0.008);miR-128增高(2.6±0.7)倍(t=3.357,P=0.078);miR-181增高(0.84±0.71)倍(t=1.173,P=0.341)。而miR-9、21、221等与对照组比较均呈现不同程度地下降,见图2。
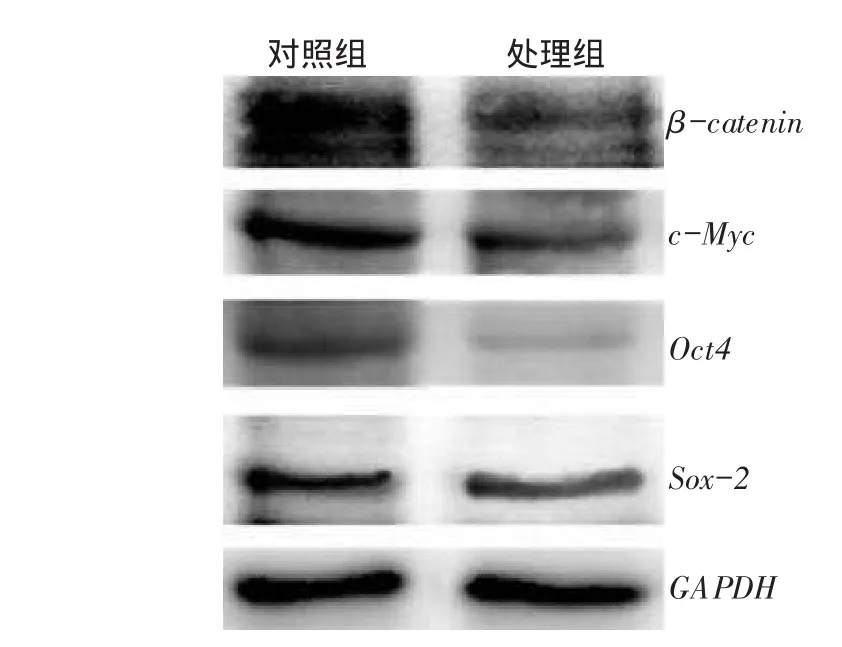
Fig.1 Effects of sulforaphane on the expressions of stem-relative genes in SWO-38 cells图1莱菔硫烷对干性相关基因表达的影响(SWO-38细胞)

Fig. 2 Changes of miRNAs after treatment with sulforaphane图2莱菔硫烷处理后miRNAs转录水平变化
2.5莱菔硫烷与miR-124抑制物对干性相关基因的影响蛋白印迹法检测发现,与对照组比较,βcatenin、Oct4、Sox-2等基因的表达在miR-124抑制物组中表现为增高;在莱菔硫烷组中表现为降低。在miR-124抑制物与莱菔硫烷联合组中这些蛋白表达水平较莱菔硫烷组有所增高,但低于miR-124抑制剂组,见图3。
3 讨论
肿瘤干细胞理论认为,肿瘤组织中存在着数量极少的肿瘤干细胞,它是导致肿瘤复发及放化疗耐受的主要原因。开发和研究针对肿瘤干细胞的靶向药物在肿瘤精准治疗中具有重要意义。但至今为止,仅有莱菔硫烷、盐霉素、小檗胺等少数天然提取物或合成药物被认为对肿瘤干细胞有特异性抑制作用。莱菔硫烷来源于天然食物,无明显不良反应,容易通过血脑屏障,可抑制乳腺癌、肺癌、胃癌等多种肿瘤干细胞的增殖,受到广泛关注[1,7]。本研究表明,莱菔硫烷有效抑制胶质瘤细胞增殖,并且胶质瘤细胞形成细胞克隆及肿瘤球的能力受到明显削弱。莱菔硫烷在抑制胶质瘤细胞克隆和肿瘤球形成的最低有效浓度(5.0 μmol/L)明显低于抑制胶质瘤细胞增殖浓度[(26.41±2.13)μmol/L]。因克隆形成率反映细胞群体依赖性和增殖能力,而肿瘤球形成实验反映了肿瘤干细胞自我更新及增殖的能力。笔者推测莱菔硫烷在较低的浓度下可能优先抑制GSCs的增殖。

Fig. 3 The effect of sulforaphane and miR-124 on stem relative genes图3莱菔硫烷与miR-124抑制物对SWO-38细胞干性相关基因表达的影响
莱菔硫烷抗肿瘤干细胞机制目前仍未完全清楚。近年研究证实,在乳腺癌中莱菔硫烷可下调Wnt/β-catenin通路,通过GSK3β诱导β-catenin磷酸化和泛素化降解[1]。Sox-2、Oct4和c-Myc等蛋白与肿瘤干细胞的增殖密切相关,其表达异常直接影响肿瘤干细胞的生物学行为[8-10]。Lin等[11]发现,白血病干细胞高表达Sox-2、Oct4和β-catenin基因,而莱菔硫烷能经由β-catenin通路加强伊马替尼对白血病干细胞的抑制作用。本研究同样发现莱菔硫烷有效地抑制β-catenin通路及Sox-2、Oct4、c-Myc等干性相关基因的表达。最新研究证实,miR-208a可能是β-catenin和Sox-2的上游调节子,且miR-208a可能与let-7形成反馈调节环,共同调节乳腺癌干细胞的自我更新[12]。因此,本课题组推测莱菔硫烷在β-catenin、Sox-2、Oct4等信号通路上游可能存在共同的调节因子。
miRNAs是一类功能强大的调节子,一种miRNA可调节成百上千个不同通路基因。miR-124在脑组织中含量最丰富,在神经系统相对特异表达,参与神经元的发育、分化、轴突生长以及对突触可塑性的调节[13-14]。miR-124表达失活极易导致正常细胞的调节失控,进而导致恶性肿瘤等疾病的产生[15-16]。研究表明,miR-124在胶质母细胞瘤组织中表达下调[17],其表达情况可能与胶质母细胞瘤的恶性增殖情况呈反比。而miR-124可通过靶向PPP1R13L基因而抑制胶质母细胞瘤的增殖[18]。本课题组曾报道,通过增强miR-124的转录,可以上调Twist和SLUG的表达,从而抑制胶质瘤细胞的分化[19]。这些研究均提示miR-124可能广泛参与胶质瘤生物学行为的调控。
本研究表明,莱菔硫烷可增强miR-124的转录,从而抑制β-catenin、Sox-2、Oct4等干性相关基因的表达。而下调miR-124则部分地削弱莱菔硫烷对这些干性相关基因的调控,降低其抗肿瘤效率。miR-124与β-catenin、Sox-2、Oct4等基因的调控关系目前鲜见报道。积累的证据显示,miRNA除了直接结合于靶基因的3′末端非编码区域外,还可结合于靶基因编码区域[20]。同时,miRNA与靶基因之间的标靶序列结合形式也存在多样性,可通过严密或非严密互补结合发挥调控作用[20]。例如,在胚胎干细胞分化过程中miR-296、miR-470和miR-134分别被证实调控着Nanog、Oct4和Sox2,其作用机制是通过编码区序列的非严密结合原则进行的[20]。笔者推测,miR-124可能直接与β-catenin、Sox-2、Oct4等基因的mRNA结合,从而在转录水平调节基因的表达。这些相互作用的细节仍有待进一步研究。
综上所述,莱菔硫烷有效抑制胶质瘤细胞克隆和肿瘤球的形成以及部分干性相关基因的表达,提示莱菔硫烷可抑制GSCs的增殖,其分子机制可能与miR-124/(β-catenin/Sox-2/Oct4)通路有关。
参考文献
[1] Li Y, Zhang T, Korkaya H, et al. Sulforaphane, a dietary component of broccoli/ broccoli sprouts, inhibits breast cancer stem cells[J]. Clin Cancer Res, 2010, 16(9): 2580- 2590. doi: 10.1158/1078-0432.CCR-09-2937.
[2] Singh SK, Hawkins C, Clarke ID, et al. Identification of human brain tumour initiating cells[J]. Nature, 2004, 432(7015): 396-401. doi:10.1038/nature03128.
[3] Galli R, Binda E, Orfanelli U, et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma [J]. Cancer Res, 2004, 64(19): 7011- 7021. doi: 10.1158/0008-5472.CAN-04-1364.
[4] Lee CS, Cho HJ, Jeong YJ, et al. Isothiocyanates inhibit the inva⁃sion and migration of C6 glioma cells by blocking FAK/JNK-medi⁃ated MMP- 9 expression[J]. Oncol Rep, 2015, 34(6):2901- 2908. doi: 10.3892/or.2015.4292.
[5] Huang TY, Chang WC, Wang MY, et al. Effect of sulforaphane ongrowth inhibition in human brain malignant glioma GBM 8401 cells by means of mitochondrial- and MEK/ERK-mediated apoptosis pathway [J]. Cell Biochem Biophys, 2012,63(3):247-259. doi: 10.1007/s12013-012-9360-3.
[6] Yin F, Zhang JN, Zhao MM, et al. Identification of the difference in gene expression between glioma stem cells and neural stem cells by oligonucleotide microarray[J]. Med J Chin PLA, 2014, 39(10):801-803.[尹丰,张剑宁,赵明明,等.胶质瘤干细胞与神经干细胞基因表达差异的微阵列基因芯片分析[J].解放军医学杂志, 2014, 39(10):801-803]. doi:10.11855/j.issn.0577-7402.2014.10.08.
[7] Qu HL. Effect of sulforaphane combine with tea polyphenols on ex⁃pression of protein kinase A anchored protein 95 and cyclin E2 in tissues of lungcancer[J]. Drugs & Clinic, 2014, 29(10):1092-1095. [曲洪澜.莱菔硫烷联合茶多酚对蛋白激酶A锚定蛋白95、细胞周期蛋白E2在肺癌组织中表达的影响研究[J].现代药物与临床, 2014, 29(10):1092-1095]. doi:10.7501/j.issn.1674-5515.2014.10.004.
[8] Yang J, Liao D, Chen C, et al. Tumor-associated macrophages regu⁃late murine breast cancer stem cells through a novel paracrine EG⁃FR/Stat3/Sox-2 signaling pathway[J]. Stem Cells, 2013, 31(2):248-258. doi: 10.1002/stem.1281.
[9] Arsic N, Gadea G, Lagerqvist EL, et al. The p53 isoform Δ133p53β promotes cancer stem cell potential[J]. Stem Cell Reports, 2015, 4 (4):531-540. doi: 10.1016/j. stemcr.2015.02.001.
[10] Zhang H, Cai K, Wang J, et al. MiR-7, inhibited indirectly by lin⁃cRNA HOTAIR, directly inhibits SETDB1 and reverses the EMT of breast cancer stem cells by downregulating the STAT3 pathway[J]. Stem Cells, 2014, 32(11):2858-2868. doi: 10. 1002/stem.1795.
[11] Lin LC, Yeh CT, Kuo CC, et al. Sulforaphane potentiates the effica⁃cy of imatinib against chronic leukemia cancer stem cells through enhanced abrogation of Wnt/β- catenin function[J]. J Agric Food Chem, 2012, 60(28):7031-7039. doi: 10.1021/ jf301981n.
[12] Sun X, Jiang S, Liu J, et al. MiR-208a stimulates the cocktail of SOX2 and β-catenin to inhibit the let-7 induction of self-renewal repression of breast cancer stem cells and formed miR208a/let-7 feedback loop via LIN28 and DICER1[J]. Oncotarget, 2015, 6(32): 32944-32954. doi: 10.18632/oncotarget.5079.
[13] Liu K, Liu Y, Mo W, et al. MiR-124 regulates early neurogenesis in the optic vesicle and forebrain, targeting NeuroDl[J]. Nucleic Acids Res, 2011, 39(7): 2869-2879. doi: 10.1093/nar/gkq904.
[14] Gu X, Meng S, Liu S, et al. miR-124 represses ROCK1 expression to promote neurite elongation through activation of the PI3K/Akt sig⁃nal pathway[J]. J Mol Neurosci, 2014, 52(1):156-165. doi: 10.1007/ s12031-013-0190-6.
[15] Lu SH, Jiang XJ, Xiao GL, et al. miR-124a restoration inhibits glio⁃ma cell proliferation and invasion by suppressing IQGAP1 and βcatenin[J]. Oncol Rep, 2014, 32(5): 2104- 2110. doi: 10.3892/ or.2014.3455.
[16] Shi Z, Chen Q, Li C, et al. MiR-124 governs glioma growth and an⁃giogenesis and enhances chemosensitivity by targeting R-Ras and N-Ras[J]. Neuro Oncol, 2014, 16 (10):1341-1353. doi: 10.1093/ neuonc/nou084.
[17] Fowler A, Thomson D, Giles K, et al. miR-124a is frequently downregulated in glioblastoma and is involved in migration and invasion[J]. Eur JCancer, 2011, 47(6): 953-963. doi: 10.1016/j.ejca.2010.11.026.
[18] Zhao WH. MicroRNA-124 suppresses glioblastoma cell prolifera⁃tion and invasive by directly targeting PPP1R13L[D].Changsha: Medical College of Central South University, 2014.[赵卫华.miR⁃NA-124靶向调控PPP1R13L抑制胶质母细胞瘤增殖和侵润[D].长沙:中南大学医学院,2014] .
[19] Xie YK, Huo SF, Zhang G, et al. CDA-2 induces cell differentiation through suppressing Twist/SLUG signaling via miR-124 in glioma [J]. J Neurooncol, 2012, 110(2):179- 186. doi: 10.1007/s11060-012-0961-x.
[20] Tay Y, Zhang J, Thomson AM, et al. MicroRNAs to Nanog, Oct4 and Sox2 coding regions modulate embryonic stem cell differentia⁃tion[J]. Nature, 2008, 455(7216): 1124- 1128. doi:10.1038/na⁃ture07299.
(2015-09-28收稿2015-11-12修回)
(本文编辑李国琪)
Sulforaphane suppressed the proliferation of glioma stem cells via miR-124
XIE Youke, LI Xuemei, HUANG Dingping
Department of Oncology, Ruikang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning 530011, China
Abstract:Objective To investigate the effect of sulfuraphane (SFN) on proliferation of glioma stem cell line SWO-38, and its mechanism threreof. Methods Cell proliferation of SWO-38 treated with SFN was measured by cell prolifera⁃tion assay. Clone formation experiment, tumor sphere formation experiment and Western blotting method were applied to de⁃tect the ability of cell clone formation and tumor sphere formation, and the expression of stemness relative genes, such as βcatenin, Oct4, Sox-2 and c-Myc. The effects of SFN and/or miR-124 inhibitor (miR-124i) on the expression of stemness rel⁃ative genes were compared. Changes of miRNAs (miRNA-9, 21, 221, 124, 128 and 181) induced by SFN were measured by real time quantity PCR. Results SFN suppressed the proliferation of SWO-38 cells in a dose-dependent manner, in which IC50was (26.41±2.13)μmol/L. SFN also decreased the ability of forming cell clone and tumor sphere, as well as the expres⁃sion of stemness relative genes (β-catenin, Oct4, Sox-2 and c-Myc) in a dose-dependent manner. At the same time, SFN led to the change in many miRNAs, during which SFN increased the transcription of miR-124 (-5.9-fold) and miR-128 (-2.6-fold), and decreased the transcription of miR-9, miR-21 and miR-221. Compared to the blank control, the expression levels of β-catenin, Oct4, and Sox-2 were significantly increased in miR-124i group. On the other hand, the expressions of above genes were also higher in combined group, which was treated with miR-124i and SFN than those in SFN group, but lower than those of miR-124i group. Conclusion SFN can efficiently inhibit the proliferation of giloma stem cells in SWO-38 cell line through miR-124/(β-catenin/Sox-2/Oct4)signalingpathway.
Key words:glioma; neoplastic stem cells; cell proliferation; microRNAs; sulforaphane; miR-124
中图分类号:R739.4
文献标志码:A
DOI:10.11958/20150197
基金项目:国家自然科学基金资助项目(81560476)
作者简介:谢有科(1979),男,主治医师,博士,主要从事胶质瘤及肺癌等肿瘤干细胞的临床防治研究

