HnRNPA2/B1shRNA慢病毒载体感染Hela细胞的稳定株筛选*
刘 瑶, 石 祥, 方 文*
(贵州医科大学 临床生化教研室, 贵州 贵阳 550004)
·专题研究·
HnRNPA2/B1shRNA慢病毒载体感染Hela细胞的稳定株筛选*
刘瑶**, 石祥, 方文***
(贵州医科大学 临床生化教研室, 贵州 贵阳550004)
[摘要]目的: 筛选不均一核糖核蛋白A2/B1(hnRNPA2/B1)的短发夹RNA (shRNA)慢病毒载体感染宫颈癌细胞株Hela细胞的稳定细胞株。方法: 利用hnRNPA2/B1 shRNA 慢病毒载体转染Hela细胞,采用嘌呤霉素抗性方法筛选稳定转染的Hela细胞系;将Hela细胞分为空白组(Hela)、阴性组(NC-shRNA)、干扰组1(shRNA1)、干扰组2(shRNA2)、干扰组3(shRNA3)和干扰组4(shRNA4),实时荧光定量 PCR(RT-PCR)检测各组细胞hnRNPA2/B1 mRNA表达水平,Western blot检测hnRNPA2/B1蛋白表达水平,筛选干扰沉默效率最高的细胞作为稳定沉默hnRNPA2/B1基因的稳转株。结果: 经筛选获得稳定转染的宫颈癌Hela细胞株,干扰组2,干扰组3和干扰组4与空白组比较,hnRNPA2/B1基因和蛋白表达量降低,差异有统计学意义(P<0.05),其中干扰组4沉默效率最高。结论: 成功构建hnRNPA2/B1 shRNA 慢病毒载体感染的Hela稳定细胞株。
[关键词]RNA干扰; 短发夹RNA; 宫颈癌; Hela细胞; 慢病毒;不均一核糖核蛋白基因
在全球女性恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌,严重威胁着女性的健康[1]。化疗在恶性肿瘤治疗中占据着不可替代的地位,但其对大多数恶性肿瘤的疗效不佳。本课题组前期用洛铂作用宫颈癌细胞,用双向电泳及质谱技术分析鉴定差异表达蛋白,发现不均一核糖核蛋白A2/B1(heterogeneous nuclear ribonucleoproteinA2/B1, hnRNPA2/B1)表达下调[2]。HnRNPA2/B1 是一组参与基因转录与翻译的前体mRNA结合蛋白,它的异常表达可使基因表达过程失去正常调控,导致正常细胞发生癌变[3]。有实验表明干扰hnRNPA2/B1会增加抗癌药物对胰腺癌细胞的敏感性[4]。本课题组前期成功构建了hnRNPA2/B1短发夹RNA (short hairpin RNA, shRNA)的重组慢病毒质粒,本研究把前期构建好的重组慢病毒稳定转染宫颈癌Hela细胞,通过RT-PCR和Western blot筛选出沉默效率最高的稳转Hela细胞株,为深入研究hnRNPA2/B1 在宫颈癌发生及治疗奠定基础。
1材料与方法
1.1材料和试剂
hnRNPA2/B1-shRNA(1-4)慢病毒液、慢病毒阴性对照(negative control-shRNA,NC-shRNA)为本实验组前期制备,Hela细胞(中国科学院细胞库),DMEM培养基(Hyclone公司,美国),胎牛血清(杭州四季青公司),SYBR Green PCR Master Mix(ABI公司,美国),BSA(Sigma公司,美国),一抗(hnRNPA2/B1)(biowoeld公司,美国),二抗(鼠抗人)(Jackson ImmunoResearch公司,美国),显影定影试剂盒、超敏ECL化学发光试剂盒(碧云天生物科技有限公司)。
1.2方法
1.2.1细胞培养Hela细胞置于完全培养基(含10%的胎牛血清、88% DMEM,另添加1%抗生素和1% L-谷氨酰胺)37 ℃、5% CO2混合气体培养箱中培养。每2~3 d更换1次培养液,换液时用PBS洗涤。
1.2.2慢病毒感染Hela细胞及实验分组用胰酶消化处于对数生长期的Hela细胞,制成细胞悬液,接种到3.5 cm培养皿中。待细胞贴壁达到50%的融合度时,将前期制备好的病毒原液融化后,用含5 mg/L Polybrene新鲜培养基按预实验MOI值=10×稀释病毒原液,将含有NC-shRNA稀释液加到阴性对照组细胞中,含有hnRNPA2/B1-shRNA慢病毒稀释液加到处理组细胞中。在感染24 h后将含有慢病毒的培养液换成正常培养液,细胞继续培养72 h后,加入终浓度为2 mg/L的Puromycin(嘌呤霉素)进行筛选,药物筛选约10 d后,拍荧光照片。由于慢病毒载体为pGMLV-SC5RNAi慢病毒载体,含有eGFP基因和抗Puromycin基因,因此转染慢病毒的细胞在具有抗Puromycin作用的同时会发出绿色荧光。实验分为6组:空白组(Hela细胞)、阴性组(转染NC-shRNA的Hela细胞)、干扰组1(转染shRNA1的Hela细胞)、干扰组2(转染shRNA2的Hela细胞)、干扰组3(转染shRNA3的Hela细胞)和干扰组4(转染shRNA4的Hela细胞)。
1.2.3hnRNPA2/B1 mRNA检测慢病毒感染细胞成功后,将培养皿中10 cm2细胞加入1 mL Trizol液,分别提取每组细胞的总RNA。按下列体系和步骤进行逆转录,RNA 2 μL, 5×VILO Reaction Mix 4 μL, 10×SuperScript Enzyme Mix 2 μL, DEPC-treated water 12 μL,轻轻混匀后,25 ℃孵育10 min,42 ℃孵育60 min,85 ℃孵育5 min终止反应,所得到的cDNA -20 ℃保存备用。取Hela细胞的cDNA为模板进行RT-PCR,向体系中加入超纯水5.7 μL,2×SYBR Mix7.5 μL,分别加入上游引物和下游引物各0.15 μ(表1),模板cDNA 1.5 μL。反应条件为预变性95 ℃ 10 min,PCR循环95 ℃ 15 s,60 ℃ 60 s,40个循环,溶解曲线60~95 ℃。通过RT-PCR检测细胞样品中目的基因和内参基因的表达量,根据qPCR反应曲线得到各样品目的基因和内参基因的域值循环数Ct值(threshold cycle number,,Ct值),采用ΔΔCt的方法进行相对定量。数据分析使用QIAGEN公司RT2 Profiler PCR Array Data Analysis 系统。使用转染阴性干扰载体的样品作为对照样品,比较各干扰载体组样品目的基因的表达,并计算干扰效果。ΔΔct=(待测样品的目的基因的ct平均值—待测样本的内参基因的
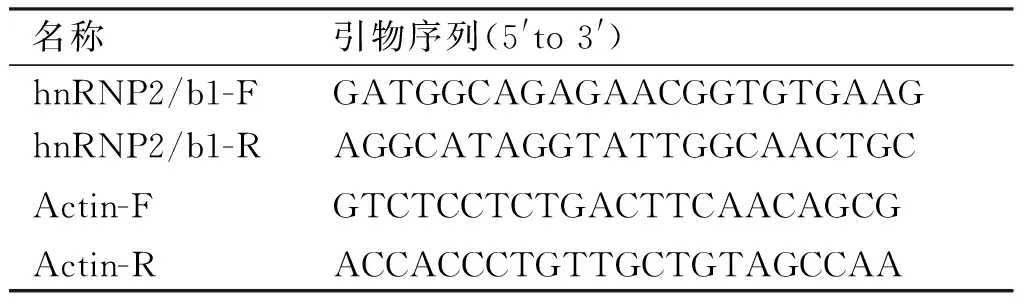
表1 目的基因和内参基因引物序列
ct的平均值)-(对照样品的目的基因的ct的平均值-对照样本的内参基因的ct的平均值)基因的表达量F=2-ΔΔct,目标基因的沉默效率为1-2-ΔΔct。
1.2.4hnRNPA2/B1蛋白检测 慢病毒感染细胞后,取出状态良好感染成功的靶细胞,PBS洗涤2次,加入适量预冷的1×Lysis Buffer,取上清,用Bradford方法测蛋白浓度。每个样品取相同总蛋白量,加入1/3体积的4× loading buffer上样缓冲液,混匀后,沸水浴煮10 min,4 ℃存放备用。制胶,上样,电泳可以用protein molecular weight maker作参照,转膜,封闭,封闭结束后,用TBST溶液洗膜2次,10 min/次。用一抗(用含5% BSA的TBST溶液稀释一抗原液)4 ℃孵育过夜,用TBST溶液洗膜3次,10 min/次,用二抗(用含5%脱脂牛奶的TBST溶液稀释相应的二抗)室温孵育2 h。采用ECL试剂盒进行显色,取出X光片,晾干,分析。
1.3统计学处理

2结果
2.1慢病毒感染Hela细胞
药物筛选10 d后,荧光显微镜下,无细胞死亡,细胞内有绿色荧光表达(图1),说明转染hnRNPA2/B1 shRNA 慢病毒载体的Hela细胞株筛选成功。
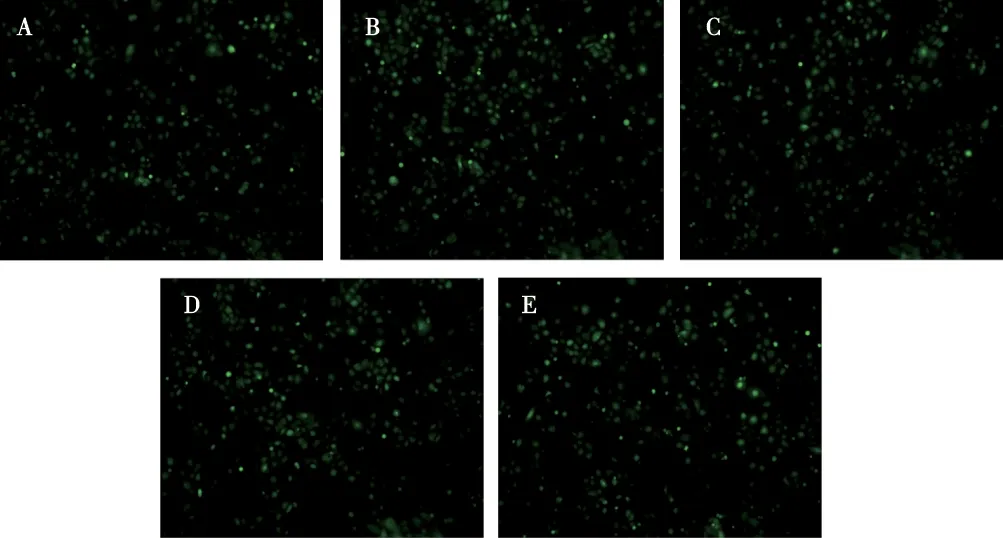
注:A为shRNA1、B为shRNA2、C为shRNA3、D为shRNA4,E为NC-shRNA图1 药物筛选后的Hela细胞(100×)Fig.1 Hela cells under fluorescence microscope after drug screening
2.2慢病毒感染Hela细胞后hnRNPA2/B1 mRNA表达及抑制率
Hela细胞中的目的基因和内参基因扩增曲线及熔解曲线(图2),说明hnRNPA2/B1和Actin为特异性扩增,无非特异性产物产生,实验结果可靠。阴性组与空白组hnRNPA2/B1基因表达量比较,差异无统计学意义(P>0.05);干扰组2,干扰组3和干扰组4与空白组比较,hnRNPA2/B1基因表达量降低(P<0.05),其中干扰组4沉默效率最高(76.58%)。见表2。
2.3慢病毒感染Hela细胞后hnRNPA2/B1 蛋白表达及抑制率
阴性组与空白组hnRNPA2/B1蛋白表达量比较,差异无统计学意义(P>0.05);干扰组1、干扰组2,干扰组3和干扰组4与空白组比较,hnRNPA2B1蛋白表达量降低,差异有统计学意义(P<0.05),其中干扰组4的沉默效率最高(76.24%)。见图3。
3讨论
宫颈癌严重威胁着女性的健康。2015中国癌症统计数据指出,近年女性发病率持续上升的六种癌症中就包括宫颈癌,女性死亡率持续上升的三种癌症中也包括宫颈癌。治疗宫颈癌最有效的化疗药物是铂类药物,但自从铂类药物开始应用于临床以来疗效不佳。这就需要寻找新的治疗靶点。

图2 HnRNPA2/B1和Actin扩增曲线及融解曲线Fig.2 Amplification curve and Melting curve of HnRNPA2/B1 and Actin

组别ACTINCtHNRNPA2B1Ct2-ΔΔCt抑制率(%)空白组17.21±0.0612.44±0.251.00±0.130阴性组17.14±0.0912.57±0.190.95±0.084.25干扰组117.41±0.0412.82±0.120.90±0.229.74干扰组217.17±0.0913.19±0.04(1)0.51±0.02(2)48.44干扰组317.19±0.0913.79±0.08(1)0.38±0.01(2)61.39干扰组417.37±0.0814.71±0.04(1)0.23±0.03(2)76.58
与空白组比较,(1)P<0.05,(2)P<0.01
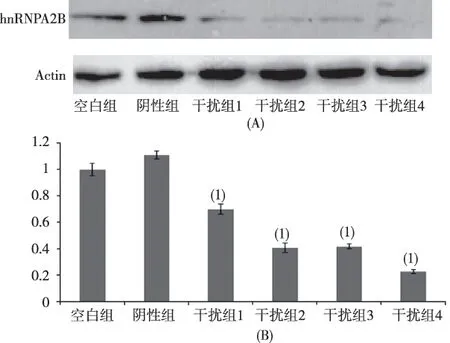
注:A为条带图,1组~4组为干扰组;B为柱状图,(1)与空白组比,P<0.01图3 各组hnRNPA2/B1-shRNA的沉默效果(Western Blot) Fig.3 Western Blot verifies the silence effect of hnRNPA2/B1-shRNA
核内不均一核糖核蛋白A2/B1是由hnRNPA2和hnRNPB1共同组成的RNA连接蛋白复合体[5]。hnRNPA2与hnRNPB1是起源于人的第7染色体的p15上的同一个单拷贝基因,经过不同的剪接作用形成的变异体,两者不同之处在于hnRNPB1的第2个外显子在选择性剪切的作用下N端额外插入了12个氨基酸序列[6]。HnRNPA2/B1在胞质与核内之间穿梭具有将mRNA输出到胞质的功能,参与mRNA的转运、RNA转录、转录后调节、RNA的代谢、DNA的复制、外显子剪切位点选择、Pre-mRNA的成熟和降解,对细胞凋亡的调节、细胞的有丝分裂等也起重要作用[7]。近年来研究表明,hnRNPA2/B1与多种肿瘤的发生、发展密切相关。hnRNPA2/B1已经被证实是一种原癌基因,不仅参与肿瘤形成和癌细胞的恶性增殖,同时也已成为肿瘤诊断和预后判定的指标[8]。HnRNPA2/B1在恶性肿瘤的发生、发展过程中调控肿瘤细胞的代谢、分化、迁移、侵袭、多药耐药和血管形成等,其中对细胞增殖与凋亡作用的调控更为显著[9-10]。细胞过度增殖和细胞凋亡失调是近年来肿瘤研究热点之一,陈倩竹[11]指出通过下调骨肉瘤MG-63细胞中hnRNPA2/B1基因的表达,发现细胞增殖和成瘤能力均明显减弱,同时早期凋亡增加。Chen等[12]研究发现在胰腺癌细胞中hnRNPA2B1可与Bcl-X mRNA结合, 抑制hnRNPA2B1基因可上调Bcl-X(S)与Bcl-X(L)的比值,从而促进胰腺癌细胞的凋亡。有研究指出,上调hnRNPA2/B1基因的表达水平,细胞增殖活性会随着增强及促进肿瘤形成[13]。同时,在裸鼠成瘤方面,抑制鼠恶性胶质瘤细胞 hnRNPA2/B1可抑制肿瘤的形成,试验证明hnRNPA2/B1基因序列可被抑制,减少hnRNPA2/B1过度表达,从而抑制肿瘤形成[14]。可能的机制是由于hnRNPA2/B1与端粒单链 DNA 重复序列特异性结合后,能保护后者免受核酶分解。同时,hnRNPA2/B1还能激活端粒酶,促进端粒延伸,导致肿瘤细胞无限增殖[7],但具体机制还不是很清楚。因此,对hnRNPA2/B1基因的深入研究有助于寻找治疗宫颈癌的新靶点。
本课题组前期成功构建了hnRNPA2/B1慢病毒干扰载体。本研究应用慢病毒转染宫颈癌Hela细胞,由于pGMLV-SC5RNAi慢病毒载体本身携带eGFP基因和抗puromycin基因,因此,观察到细胞发出绿色荧光,同时用终浓度为2 mg/L的puromycin进行筛选,最终获得稳定转染慢病毒的细胞株。与空白对照组和阴性对照组比较,用RT-PCR和Western blot对4组Hela细胞进行hnRNPA2/B1表达检测,发现阴性对照组与空白组表达差异不显著,而shRNA4干扰组沉默效率在mRNA水平和蛋白水平均达到70%以上,说明本研究构建的慢病毒干扰载体hnRNPA2B1-shRNA4可以沉默hnRNPA2B1基因的表达,筛选出shRNA4组Hela细胞为稳定沉默hnRNPA2/B1基因表达的细胞株。为进一步探讨hnRNPA2/B1基因在宫颈癌Hela细胞中的作用机制打下基础。
4参考文献
[1] Mencezer J. Patient-tailored conservative surgical treatment of invasive uterine cervical aquamous cell carcinoma [J]. Minerva Ginecol, 2013(4):407-415.
[2] Li XQ,Ran L,Fang W,et al. Lobaplatin arrests cell cycle progression,induces apoptosis and alters the proteome in human cervical cancer cell line CaSki[J]. Biomedicine & Pharmacotherapy, 2014(3):291-297.
[3] Golan-Gerstl R,Cohen M,Shilo A,et al. Splicing factor hnRNPA2/B1 regulates tumor suppressor gene splicing and is an oncogenic driver in glioblastoma[J]. Cancer Res, 2011(13):4464-4472.
[4] Gu WJ,Liu HL. Induction of pancreatic cancer cell apoptosis,invasion,migration,and enhancement of chemotherapy sensitivity of gemcitabine,5-FU,and oxaliplatin by hnRNPA2/B1 siRNA[J].Anticancer Drugs, 2013(6):566-576.
[5] Zuccotti P,Colombrita C,Moncini S,et al. hnRNPA2/B1 and nELAV proteins bind to a specific U-rich element in CDK5R1 3-UTR and oppositely regulate its expression[J]. Biochim Biophys Acta, 2014(39):506-516.
[6] He Y,Smith R. Nuclear functions of heterogeneous nuclear ribonucleoproteins A/B[J].Cell Mol Life Sci, 2009(7):1239-1256.
[7] Moran-Jones K,Wayman L,Kennedy DD,et al. hnRNPA2,a potential ssDNA/RNA olecular adapter at the telomere [J]. Nucleic Acids Res, 2005(33):486-496.
[8] Shilo A,Ben Hur V,Denichenko P,et al. Splicing factor hnRNPA2 activates the Ras-MAPK-ERK pathway by controlling A-Raf splicing in hepatocellular carcinoma development[J]. RNA, 2014(4):505-515.
[9] 李业山,雷祖宝,徐美清,等. 抗hnRNPA2/B1多克隆抗体制备及其在非小细胞肺癌中的应用[J]. 肿瘤, 2007(12):985-989.
[10]Clower CV,Chatterjee D,Wang Z,et al. The alternative splicing repressors hnRNPA1/A2 and PTB influence pyruvate kinase isoform expression and cell metabolism[J]. Proc Natl Acad Sci USA, 2010(5):1894-1899.
[11]陈倩竹,马磊,陈欢,等. 下调 hnRNPA2/B1基因表达对骨肉瘤MG-63细胞生长的影响及其机制[J]. 肿瘤, 2015(35):1287-1295.
[12]Chen ZY,Cai L,Zhu J,et al. Fyn requires HnRNPA2B1 and Sam68 to synergistically regulate apoptosis in pancreatic cancer[J]. Carcinogenesis, 2011(10): 1419-1426.
[13]Zhou J,Nong L,Wloch M,et al. Repression of early lung cancer Detection maker: hnRNPA2/B1 and its relation to microsatellite alteration in non-small cell lung cancer[J]. Lung Cancer, 2001(3): 341-350.
[14]Golan-Gerstl R,Shilo A,Cohen M. Splicing factor hnRNPA2/B1 regulates tumor suppressor gene splicing and is an oncogenic driver in glioblastoma[J]. Cancer Res, 2011(13): 4464-4472.
(2016-03-20收稿,2016-05-27修回)
中文编辑: 文箐颍; 英文编辑: 刘华
Screening of Stable Hela Cell Infected with hnRNPA2/B1 shRNA Lentivirus
LIU Yao, SHI Xiang, FANG Wen
(DepartmentofClinicalBiochemistry,GuizhouMedcialUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To screen the stable Hela cell line infected with hnRNPA2/B1shRNA lentivirus vector. Methods: hnRNPA2/B1 shRNA lentivirus vector was used to stably transfect into HeLa cells. The Hela cell lines were screened by using the method of resistance of puromycin. Hela cell lines were divided into blank group(Hela group), negative group (NC-shRNA group), interference group1 (shRNA1group), interference group2 (shRNA2 group), interference group3 (shRNA3 group) and interference group4 (shRNA4 group). RT-PCR was adopted to detect the mRNA expression level of hnRNPA2/B1 and Western blot adopted to detect the protein expression level of hnRNPA2/B1. A group of cells with the highest silencing efficiency was selected as the Hela lines of hnRNPA2/B1 gene stable silencing. Results: Stably transfected HeLa cell line of cervical cancer was obtained by screening. Compared with blank group, mRNA level and protein level of hnRNPA2/B1 gene expression significantly decreased in shRNA2 group, shRNA3 group and shRNA4 group (P<0.01). Among them, silence efficiency was highest in shRNA4 group. Conclusion: Stable Hela cell line infected with hnRNPA2/B1shRNA lentivirus vector is successfully constructed.
[Key words]RNA interference; Short hairpin RNA; cervical carcinoma; Hela cell line; lentivirus; heterogeneous nuclear ribosomal protein gene
*[基金项目]国家自然科学基金(81560481)
[中图分类号]Q782
[文献标识码]A
[文章编号]1000-2707(2016)06-0625-05
DOI:10.19367/j.cnki.1000-2707.2016.06.002
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:281123997@qq.com
网络出版时间:2016-06-16网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160616.1645.020.html

