猪繁殖与呼吸综合症病毒结构蛋白GP5-M腺病毒载体的构建及其在山羊乳腺中的表达
兰 辉 ,卓伟伟,刘 军,罗 艳,权富生,华 松
(西北农林科技大学 动物医学院,陕西杨凌 712100)
猪繁殖与呼吸综合症病毒结构蛋白GP5-M腺病毒载体的构建及其在山羊乳腺中的表达
兰辉 ,卓伟伟,刘军,罗艳,权富生,华松
(西北农林科技大学 动物医学院,陕西杨凌712100)
摘要猪繁殖与呼吸综合症(PRRS)是严重威胁养猪业的病毒性疾病,疫苗免疫是预防该病的最有效途径,PRRSV糖蛋白GP5和基质蛋白M融合后制成的基因工程疫苗能够有效激发机体产生免疫应答。通过在 GP5和M基因的5′ 端依次加上组氨酸标签序列、信号肽序列,利用Linker(GP)序列将 GP5和M基因连接构建融合表达GP5和M蛋白的重组质粒pMD18T-SignalP-His- GP5-M。以该质粒为模板,构建重组腺病毒载体并包装腺病毒。结果表明,用包装的腺病毒感染乳腺上皮细胞,测得最佳感染复数(MOI)为25,定量PCR和Western blot方法均检测到 GP5-M的表达。大量扩增腺病毒并使用不连续氯化铯浓度梯度离心纯化病毒,使用纯化的病毒灌注山羊乳腺,采用Western blot在收集的乳汁中也检测到GP5-M蛋白的表达。结果证实,利用腺病毒载体作为基因转导的媒介,在山羊乳腺中可以表达GP5-M融合蛋白。
关键词猪繁殖与呼吸综合症;腺病毒载体;GP5-M蛋白;山羊乳腺
猪繁殖与呼吸综合症(Porcine reproductive and respiratory syndrome,PRRS),又称猪蓝耳病,是由于猪感染繁殖与呼吸综合症病毒(PRRS virus,PRRSV)引发的,临床症状主要表现为各年龄段猪严重的呼吸系统障碍,母猪流产,仔猪高死亡率等[1],该病毒已严重威胁到全球养猪业的健康发展,并造成严重的经济损失[2]。因此,猪蓝耳病是当前养猪行业中亟需预防的病毒性疾病之一。研究表明[3],PRRSV对猪的免疫系统是一把双刃剑:一方面,由于PRRSV能够特异性的结合免疫细胞,特别是巨噬细胞,一旦PRRSV广泛复制就会导致免疫系统受到抑制,造成多种传染病疫苗的免疫失败;另一方面,由于病毒感染刺激机体的免疫系统,机体产生免疫力,会保护机体免受二次感染。近些年,中国PRRS疫情一直很严重,2006年的PRRS疫情迫使中国农民宰杀数百万头猪,进而导致中国的通胀率达到过去10 a中的最高水平[4]。由于目前没有针对PRRS的有效药物[5],疫苗研究和开发就成为预防和治疗猪蓝耳病的首要选择[6]。当前市场上用于预防PRRS的疫苗有灭活苗和弱毒苗,虽然这些疫苗在预防和控制PRRS上发挥一定的作用,但由于PRRSV特殊的感染机制,接种灭活苗和弱毒苗存在很大的安全隐患[7]。在研究PRRS疫苗方面,许多研究人员倾向于在破坏病毒增殖的基础上将特异性引起机体产生免疫保护的病毒结构成分挑选出来作为疫苗研究和开发的抗原材料。已有报道指出,GP5和M蛋白在病毒的整个生存周期中都是必要的[8-9],同时它们与中和抗体的产生、细胞免疫、个体保护也密切相关[10-11]。Meulenberg等[12]利用复制缺陷型腺病毒单独表达GP5或M蛋白或将两者融合表达,并在小鼠模型中检测这些蛋白的免疫原性,发现免疫表达GP5和M融合蛋白的重组腺病毒小鼠产生的中和抗体滴度显著高于免疫单独表达GP5或M蛋白的重组腺病毒小鼠产生的中和抗体滴度。因此,融合表达GP5和M蛋白成为研发预防PRRS高效疫苗的新方向。
近年来,与PRRSV GP5-M相关的疫苗研究报道越来越多,GP5-M融合蛋白能提供给机体相对于传统疫苗更高的保护性,但目前还难以实现规模化生产。在转基因动物组织中表达重组蛋白并将它们分泌到体液中的技术已经被开发利用[13-14],乳腺生物反应器已被确定为生产重组蛋白的重要选择[15]。在乳腺上皮细胞中合成的异源蛋白会分泌到乳汁中,这些蛋白可以使用相对简单的层析系统进行纯化[16]。腺病毒载体可以将基因转移到靶细胞,却不整合到宿主细胞基因组中,基因的表达不会受到整合位点的负面影响[17]。因而,这些载体已被广泛地用于许多基因治疗研究并取得成功[18]。在乳腺中使用腺病毒感染的方法表达外源蛋白,在小鼠和山羊已经实现高于0.3 g/L的量。所以,利用转基因动物的乳腺生产重组蛋白具有较大优势。基于此,本研究利用腺病毒载体作为基因转导的媒介,在山羊乳腺中进行PRRSV糖蛋白GP5-M的表达,为下一步GP5-M蛋白在真核细胞体内大量表达、收集纯化、免疫验证、疫苗生产等奠定理论基础。
1材料与方法
1.1试验材料
1.1.1试验动物及样品采集与处理试验所涉及到的组织样品均获自西北农林科技大学克隆羊动物基地,试验用3只健康关中奶山羊均处于泌乳期,样品采集和处理参照文献[19]进行。
1.1.2主要试剂质粒纯化试剂盒购自promega公司,脂质体2000购自invitrogen公司,反转录试剂盒、T4DNA连接酶、单克隆鼠源抗His标签一抗、山羊抗小鼠二抗购自北京全式金生物技术有限公司,DNA连接试剂盒购自TaKaRa公司,限制性内切酶购自北京NEB公司,琼脂糖凝胶DNA回收试剂盒购自Axygen公司,质粒小量抽提试剂盒购自上海生工生物工程有限公司,实时定量PCR试剂盒购自TaKaRa公司,氯化铯购自上海阿拉丁公司。
1.2方 法
1.2.1重组腺病毒载体pBHG-SignalP-His- GP5-M的构建用Linker(GP)序列将 GP5和M基因(基因片段由河南农业大学张改平院士课题组馈赠,为不含信号肽的部分序列)连接在一起组装成 GP5-M基因片段,在 GP5-M基因片段的5′ 端依次加上组氨酸标签、信号肽序列,组装成SignalP-His- GP5-M片段,随后根据设计的引物(表1),通过PCR在该片段的5′ 端添加EcoRⅠ酶切位点,3′ 端添加NotⅠ酶切位点,同pMD18T进行连接构建pMD18T-SignalP-His- GP5-M载体,将该载体同腺病毒穿梭质粒pHBAd-CMV-IRES-GFP双酶切构建重组质粒pBHG-SignalP-His- GP5-M(图1)。
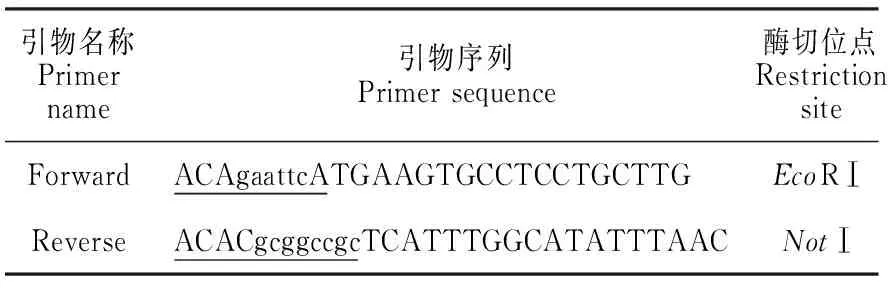
表1 用于扩增 GP5-M的引物
注:小写字母表示酶切位点。
Note:Lowercase letters indicate restriction site.

图1 pBHG-SignalP-His- GP5-M质粒结构
1.2.2重组腺病毒的包装和奶山羊乳腺上皮细胞最佳感染复数(MOI)测定将HEK293A细胞接种于60 mm培养皿中,使用含φ=10%胎牛血清的DMEM细胞培养液培养至70%~80%汇合度时,用Lipofectamine2000转染重组质粒pBHG-SignalP-His- GP5-M,参照文献[20]在HEK293A细胞中进行腺病毒的包装、扩增、浓缩、滴度测定。将获得的腺病毒命名为rHAd-SignalP-His- GP5-M。将生长良好的乳腺上皮细胞计数后每孔1×104个细胞接种于96孔细胞板,待细胞达到70%左右汇合度时,分别按MOI=5、25、35、50 将腺病毒rHAd-SignalP-His- GP5-M加入96孔细胞板,每个感染剂量做3个重复,并设置培养液阴性对照。72 h后于荧光显微镜下观察细胞绿色荧光量及细胞生长状况(每24 h更换1次培养液),确定最佳感染剂量。
1.2.3 GP5-M mRNA水平和蛋白水平的检测
将生长良好的奶山羊乳腺上皮细胞(Mammary epithelial cells,GMECs)接种于12孔板,待细胞生长至70%~80%汇合度时,按MOI=25用腺病毒rHAd-SignalP-His- GP5-M感染GMECs。试验设对照组(感染pHAd-GFP)、试验组(感染rHAd-SignalP-His- GP5-M)、空白组(等量培养液),每个处理组3个重复。细胞处理48 h后收集提取总RNA,反转录成cDNA;并以该cDNA为模板采用实时荧光定量PCR(qPCR)检测 GP5-M基因的表达,引物参照表2。将同样处理的细胞经加有蛋白酶抑制剂的细胞裂解液裂解后制成蛋白上样液,以单克隆鼠源抗His标签抗体作为一抗,辣根过氧化酶(HRP)标记的羊抗小鼠IgG(H+L)抗体作为二抗,通过Western blot检测GP5-M蛋白的表达水平。

表2 qPCR引物信息
1.2.4腺病毒的大量扩增、收集和纯化用腺病毒rHAd-SignalP-His- GP5-M感染状态良好(70%左右汇合度)的接种于60 mm皿中的HEK293A细胞,3 d后观察细胞的绿色荧光表达是否出现空斑形成、是否细胞变圆脱落、细胞核是否变大等细胞病变效应(Cytopathic effect,CPE),若无此现象,继续培养直至出现上述症状后收集病毒。
收集扩增病毒的细胞,600 r/min离心5 min,弃上清后加入最小体积病毒保存液(一般为原始体积的1/10)重悬细胞。-70 ℃/37 ℃连续冻融4次,冷冻和融化要持续在5 min以内,每次解冻后都要涡旋,使细胞团块完全重悬,以便细胞冷冻更彻底、破碎更完全。随后 12 000 r/min室温离心10 min,收集上清。
将病毒悬浮于10 mL 1.10 g/mL的CsCl溶液。在制备的CsCl梯度溶液(2.0 mL 1.40 g/mL的CsCl溶液中缓慢加入3.0 mL 1.30 g/mL的CsCl溶液)中加入5 mL的病毒悬浮液,20 000 r/min室温离心20 min。收集1.30 ~1.40 g/mL的病毒条带至透析袋中(透析袋使用前用10 mmol/L的EDTA-Na2煮沸10 min)4 ℃过夜,中间换1次透析液。收集病毒,测定病毒滴度。
1.2.5His-GP5-M蛋白在奶山羊乳腺中的表达参考文献[21]的方法,选择3只1岁龄健康萨能奶山羊,连续2周每天注射荷尔蒙诱导乳腺发育和泌乳。随后每个乳腺灌注滴度为1.0 ×1010TU/mL的腺病毒和含36 mmol/L EGTA的PBS(pH=7.6)至乳腺最大容量。另外1只灌注不相关的腺病毒(pHAd-GFP)作为对照组,1只灌注不加病毒的PBS作为空白对照组。灌注前挤空乳腺中的乳汁,灌注后1 d挤尽乳腺中的乳汁,在灌注后2 d开始收集所有山羊的乳汁。
1.2.6乳汁His-GP5-M蛋白检测将收集的乳汁4倍稀释于乳汁分离缓冲液中(10 mmol/L Tris-HCl,10 mmol/L CaCl2,pH =8.0),冰上放置30 min后10 000 r/min、4 ℃离心30 min,弃去脂肪层,乳清用酪蛋白沉淀法进行分离,纯化的乳清制成蛋白上样液后通过Western blot检测His-GP5-M蛋白的表达。
2结果与分析
2.1重组腺病毒载体pBHG-SignalP-His- GP5-M的构建
用EcoRⅠ和NotⅠ酶切pBHG-SignalP-His- GP5-M质粒,琼脂糖凝胶电泳检测得到约9 000 bp 的载体条带和1 221 bp的目的基因条带(图2),测序结果与 GP5和M基因克隆的测序结果一致,表明重组腺病毒穿梭载体构建成功。
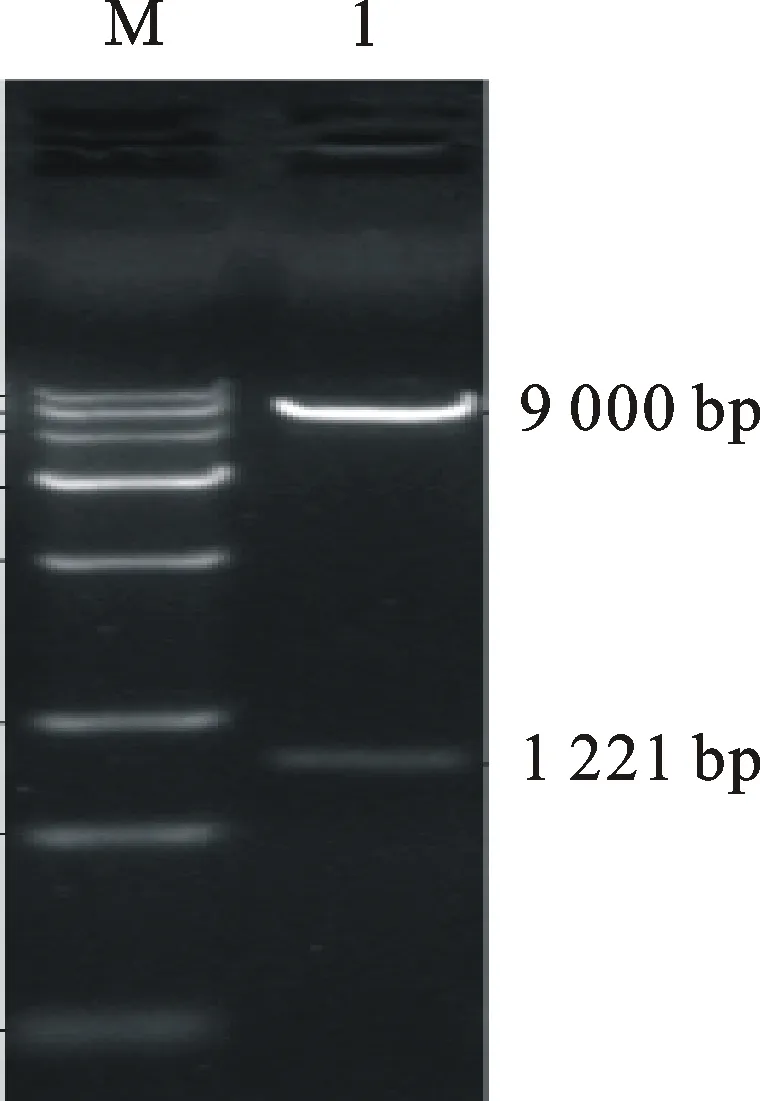
M.Trans15K@DNA marker;1. pBHG-SignalP-His- GP5-M质粒的EcoRⅠ和NotⅠ双酶切鉴定pBHG-SignalP-His- GP5-M digested byEcoRⅠ andNotⅠ
图2 pBHG-SignalP-His- GP5-M的双酶切鉴定
Fig.2Double digestion identification of pBHG-SignalP-His- GP5-M
2.2重组腺病毒包装和奶山羊乳腺上皮细胞最佳感染复数(MOI)确定
转染2 d后,在倒置荧光显微镜下观察到少量绿色荧光蛋白表达(图3-A),8 d时细胞中的绿色荧光量明显增多,并出现CPE现象,可看到细胞层出现空洞(图3-B),10 d时培养皿中的大部分细胞变圆脱落、崩解,此时收集细胞,反复冻融3次后得到第1代腺病毒(图3-C)。被病毒感染的HEK293A细胞3 d后出现明显的CPE现象,通过TCID50法测定得到腺病毒的滴度为1.0×1011TU/mL,达到要求滴度。不同剂量的腺病毒感染乳腺上皮细胞3 d,绿色荧光表达和细胞形态都正常(图4-B1),并通过观察荧光强度和细胞形态发现MOI=25的病毒剂量为最佳病毒接种量(图4-B3)。
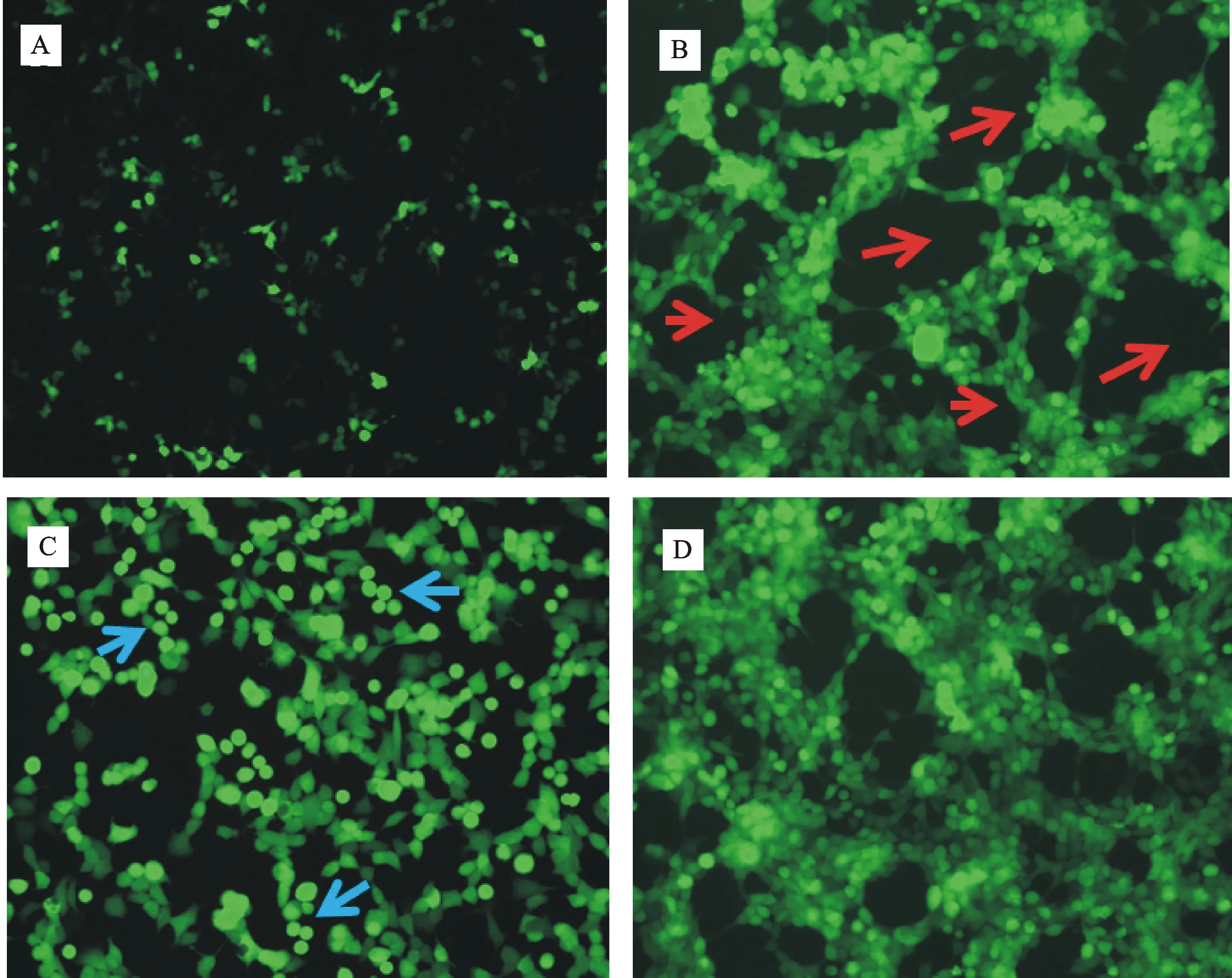
A~C.依次为rHAd-SignalP-His- GP5-M重组腺病毒感染HEK293A细胞2、8和10 d的绿色荧光图片Fluorescence of HEK293 cell after transfeced rHAd-SignalP-His- GP5-M recombinant adenovirus for 2 d,8 d and 10 d,respectively;A.2 d时有少量绿色荧光表达且荧光强度弱Slight green fluorescence observed at 2 d;B.8 d时绿色荧光量明显增多,并出现细胞病变效应,同时可看到细胞层出现空洞(图中红色箭头) Massive green fluorescence and CPE observed at 8 d,at the same time the empty cell layer appeared (Red arrows in Figure B);C.10 d时细胞变圆、脱落(图中蓝色箭头) Cells round up and detach from the plate at 10 d (Blue arrows in figure C);D.高滴度的腺病毒感染HEK293A细胞3 d时的绿色荧光,可看到细胞几乎完全变亮同时细胞层也出现空斑Fluorescence microscopic image of HEK293 cell 3 d after infection of high titer adenovirus,cells almost completely brighten and the cell layer was also observed plaque
图3转染重组质粒pBHG-SignalP-His- GP5-M的HEK293A细胞绿色荧光图(×100)
Fig.3Green fluorescence image of transfected recombinant plasmid pBHG-SignalP-His- GP5-M HEK293A(×100)
2.3His- GP5-M mRNA水平和蛋白水平表达检测
qPCR结果表明,试验组 GP5-M基因的mRNA大量表达,而对照组、空白组未检测到表达(图5)。Western blot结果显示,在预期表达His-GP5-M融合蛋白的45 ku处出现明显的蛋白印迹条带,与预期His- GP5-M融合蛋白大小一致,表明目的蛋白成功表达(图6)。
2.4腺病毒的大量扩增
收集出现CPE现象的细胞,-80 ℃和37 ℃反复冻融4次释放病毒,通过不连续CsCl密度梯度离心法得到1条粉白色条带,透析去除盐离子后,测出病毒滴度为1.0×1013TU/mL。

B1. 接种腺病毒3 d后的乳腺上皮细胞GMECS infected with adenovirus for 3 d;B2~B5. 依次为MOI=5、25、35、50 4个感染复数的腺病毒感染乳腺上皮细胞 Four GMECS infected with MOI respectively at which the MOI was 5,25,35,50;B2. 荧光最弱The weakest green fluorescence;B3. 细胞荧光最亮且死细胞少The brightest cell fluorescence and few dead cells;B4~B5. 细胞出现死亡Cell death occured;B6. 空白对照 Blank control
图4 接种腺病毒3 d的山羊乳腺上皮细胞(×40)
Fig.4Green fluorescence image of GMECS inoculated by adenovirus for 3 d(×40)

图5 His- GP5-M mRNA水平的相对表达量

a. 感染pHAd-SignalP-His- GP5-M的山羊乳腺上皮细胞pHAd-SignalP-His- GP5-M infected GMECs;b.山羊乳腺上皮细胞空白对照Control of GMECs;c. 感染pHAd-GFP的山羊乳腺上皮细胞pHAd-GFP infected GMECs; d.25 ku带His标签的蛋白标准品25 ku with His tag protein standard
图6His-GP5-M的蛋白水平表达
Fig.6 Expression of His-GP5-M protein
2.5乳汁中His-GP5-M蛋白的检测
腺病毒灌注山羊乳腺48 h后收集乳汁,Western blot鉴定结果表明,在预期的45 ku处出现明显的蛋白条带,与His-GP5-M蛋白大小一致,表明利用高滴度腺病毒进行乳腺灌注,可以感染乳腺上皮细胞,乳腺上皮细胞可以分泌目的蛋白(图7)。

1. 14 ku带His标签蛋白标准品14 ku protein standard with His tag;2. 灌注PBS后收集的乳汁The collected milk after Perfusion PBS;3. 正常乳汁Normal breast milk;4.感染pHAd-GFP的乳汁pHAd-GFP infected milk;5.PBS;6. 感染pHAd-SignalP-His- GP5-M的乳汁pHAd-SignalP-His- GP5-M infected milk
图7山羊乳腺His-GP5-M蛋白检测结果
Fig.7Western blot detection of His-GP5-M protein in goat mammary gland
3讨 论
通过乳腺生物反应器,选择病毒的衣壳蛋白作为抗原研发新一代基因工程疫苗,首先要解决的便是如何让胞内的蛋白分泌到胞外以及如何将目的蛋白纯化出来。基于此,本研究选择在抗原蛋白基因的前端添加上便于纯化富集的His标签序列和利于胞外分泌的信号肽序列,同时,添加标签蛋白也可为抗病毒衣壳蛋白单克隆抗体的检测提供方便。目前,虽然各国的研究工作者对猪蓝耳病疫苗(基因工程疫苗,亚单位疫苗,DNA疫苗)开展大量研究,部分已经进入临床试验和临床应用阶段,但在大规模推广应用上遭遇障碍,究其原因在于生产成本高、投入高、产出低。伴随乳腺生物反应器的出现,研发新一代低成本、高产出基因工程疫苗成为现实,并且在许多研究中已经取得良好的效果。Cammuso等[22]利用小鼠和山羊的乳腺分别表达2.8和0.3 g/L的人生长因子,Toledo等[23]利用山羊乳腺生物反应器表达2 g/L 的人促红细胞生成素。
腺病毒介导的超表达技术因其介导基因转导效率高、靶细胞种类多、同时感染分裂或不分裂的细胞、不会整合到宿主细胞基因组中、不会导致宿主基因组插入突变的危险、对机体无遗传毒性、无免疫原性、很容易制备高滴度病毒等诸多优点,使其成为研究基因疫苗和基因治疗使用最多的病毒载体之一[24]。本研究中为保证GP5-M蛋白的正确表达和方便验证获得重组病毒的正确性,选择双启动子控制的穿梭载体pHBAd-CMV-IRES-GFP,CMV启动子控制GP5-M蛋白的表达,IRES启动子控制GFP的表达,从而使GP5-M蛋白的表达不受GFP空间折叠和表达量的影响,保证GP5-M蛋白的大量表达和蛋白活性,另外,使用穿梭载体pHBAd-CMV-IRES-GFP构建的重组病毒能够表达GFP,有利于观察病毒包装和对病毒进行定量。用构建的腺病毒pHAd-SignalP-His- GP5-M感染乳腺上皮细胞后,通过定量PCR和Western blot均检测到His-GP5-M蛋白的表达。后期扩增病毒进行山羊活体灌注,Western blot检测乳汁中也出现1条明显的、与预期大小一致的条带,证明蛋白在山羊乳汁中成功表达,为研制新一代抗PRRSV疫苗提供思路。
参考文献Reference:
[1]ROSSOW K D. Porcine reproductive and respiratory syndrome[J].VeterinaryPathologyOnline,1998,35(1):1-20.
[2]ERIC J S ,JANNEKE J M. The molecular biology of arteriviruses [J].GeneralVirology,1998,79(5):961-979.
[3]NEUMANN E J,JAMES B,JOHNSON C D,etal.Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States[J].AmericanVeterinaryMedicalAssociation,2005,227(3):385-392.
[4]邹学刚,吴继先,侯国帅,等.高致病性猪繁殖与呼吸综合征病毒引发高热综合征病因分析与防治措施[J].中国兽药杂志,2007,41(10):54-55.
ZOU X G,WU J X,HOU G SH,etal.Highly pathogenic porcine reproductive and respiratory syndrome virus cause hyperpyrexia syndrome causes analysis and control measures of [J].ChineseJournalofVeterinaryMedicine,2007,41 (10):54-55(in Chinese).
[5]ALLENDE R,LAEGREID W W,KUTISH G F,etal.Porcine reproductive and respiratory syndrome:description of persistence in individual pigs upon experimental infection[J].Virology,2000,74(22):10834-10837.
[6]NIELSEN J,BOTNER A,BILLE H V,etal.Experimental inoculation of late term pregnant sows with a field isolate of porcine reproductive and respiratory syndrome vaccine derived virus[J].VeterinaryMicrobiology,2002,84(1):1-13.
[7]YOON K J,WU L L,ZIMMERMAN J J,etal.Antibody-dependent enhancement(ADE) of porcine reproductive and respiratory syndrome virus(PRRSV) infection in pigs[J].ViralImmunol,1996,9(1):51-63.
[8]STENM,HENRIK S,RIKKE S,etal.Risk factors for infection of sow herds with procine reproductive and respiratory syndrome(PRRS) virus[J].PreventiveVeterinaryMedicine,2002,53(1):83-101.
[9]NILUBOL D ,PLATT K B ,HALBUR P G ,etal.The effect of a killed Porcine reproductive and respiratory syndrome virus (PRRSV) vaccine treatment on virus shedding in previously PRRSV infected pigs [J].VeterinaryMicrobiology,2004,102(1):11-18.
[10]NIELSON T L,NIELSOM J,HAVE P,etal.Examination of virus shedding in semen from vaccinated and from previously infected boars after experimental challenge with poricine reproductive and respiratory syndrome virus[J].VeterinaryMicrobiology,1997,54(2):101-112.
[11]YOON K J,WU L L,ZIMMERMAN J J,etal.Field isolate of porcine reproductive and respiratory syndrome virus(PRRSV) vary in their susceptibility to antibody dependent enhancement(ADE) of infects[J].VeterinaryMicrobiology,1997,55(1):277-287.
[12]MEULENBERG J J,PETERSONDEN B A,DEKL-UYVER E P,etal.Characterization of proteins encoded by ORFs 2 to 7 of lelystad virus[J].Virology,1995,206(1):155-163.
[13]KAPUR V,ELAM M R,PAWLOWICH T M,etal.Genetic variation in porcine reproductive and respiratory syndrome virus isolates in the midwestern united states[J].JournalofGeneralVirology,1996,77(6):1271-1276.
[14]PIRZADEH B,DEA S.Immune response in pigs vaccinated with plasmid DNA encoding ORF5 of porcine reproductive and respiratory syndrome virus[J].JournalofGeneralVirology,1998,79(5):989-999.
[15]DURAN J P,CLIMENT I,SRRASICA J,etal.Baculo virus expression of proteins of porcine reproductive and respiratory syndrome virus strain Olot/91. Involvement of ORF3 and ORF5 protein in protection[J].VirusGenes,1997,14(1):19-29.
[16]GALLICHAN W S,JOHNSON D C,GRAHAM F L ,etal.Mucosal imm unity and protection after intranasal immunization with recombinant adenovirus expressing herpes simplex virus glycoprotein B[J].JournalofInfectiousDiseases,1993,168(3):622-629.
[17]TIMS T,BRIGGS D J,DAVIS R D,etal.Adult dogs receiving a rabies booster dose with a recombinant adenovirus expressing rabies virus glycoprotein develop high titers of neutralizing antibodies [J].Vaccine,2000,18(25):2804-2807.
[18]BRUNA R O,SCHMIEG J,DEL V M,etal.The dendritic cell-specific chemokine,dendritic cell-derived CC chemokine1,enhances protective cell-mediated immunity to murine malaria [J].Immunology,2003,170(6):3195-3203.
[19]RAQUEL M ,JORGE R T.The mammary gland bioreactor for the production of recombinant proteins[J].BiotecnologiaAplicada,2006,23(4):279-286.
[20]LUO J,DENG Z L,LUO X,etal.A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J].NatureProtocols,2007,2(5):1236-1247.
[21]OLIBERTO S,JORGE R T,MARIA P R,etal.Adenoviral vector mediates high expression levels of human growth hormone in the milk of mice and goats[J].Biotechnology,2004,114(1):89-97.
[22]CAMMUSO C,PORTER C,NIMS S,etal.Hormonal induced lactation in transgenic goats[J].AnimalBiotechnology,2000,11(1):1-17.
[23]TOLEDO J R,SANCHEZ O,MONTESINO R,etal.High expression level of recombinant human erythropoietin in the milk of non-transgenic goats[J].Biotechnology,2006,123(2):225-235.
[24]郑秋红,龚福生,陈蓉明,等.GM-CSF基因重组腺病毒载体的构建及鉴定[J].肿瘤防治杂志,2005,12(4):257-260.
ZHENG Q H,GONG F SH,CHEN R M,etal.Construction and identification of recombinant adenovirus vector ofGM-CSFgene [J].JournalofCancerPreventionandControl,2005,12(4):257-260(in Chinese with English abstract).
Received 2016-03-25Returned2016-04-12
First authorLAN Hui,male,master student. Research area: animal embryo engineering.E-mail:lanhsa@163. com
(责任编辑:顾玉兰Responsible editor:GU Yulan)
Construction of PRRS GP5-M Adenovirus Vector and Its Expression in Goat Mammary Gland
LAN Hui,ZHUO Weiwei,LIU Jun,LUO Yan,QUAN Fusheng and HUA Song
(College of Veterinary Medicine,Northwest A&F University,Yangling Shaanxi712100,China)
AbstractPorcine reproductive and respiratory syndrome (PRRS) is a serious threat to the pig industry and vaccination is the most effective way to prevent it. The vaccine manufactured by fusing PRRSV glycoprotein GP5 and matrix protein M can stimulate body's immune response effectively. Through adding the GP5 tag sequence and signal peptide sequence into the GP5 and M gene sequences 5′-end and using the Linker (GP) sequence to connect GP5 and M gene,the recombinant plasmid of pMD18T-SignalP-His- GP5-M that expresses GP5 and M protein was constructed. Using this plasmid as a template,we constructed and packaged recombinant adenovirus which was then used to infect goat mammary epithelial cells. The best MOI was 25,and the expression of GP5-M were detected by real-time quantitative PCR and Western blot. We amplified adenoviruses and use discrete cesium chloride density gradient centrifugation to purify it,and then used purified adenoviruses to perfuse into goat mammary gland. The expression of GP5-M protein was tested in collecting milk by Western blot. The results confirmed that by using adenovirus as a vehicle for gene transfer,the expression of GP5-M fusion protein can be found in goat mammary gland,which laid the foundation for the research of PRRSV-specific genetic engineering vaccine.
Key wordsPorcine reproductive and respiratory syndrome(PRRS); Adenovirus vector; GP5-M protein; Goat mammary
收稿日期:2016-03-25修回日期:2016-04-12
基金项目:国家高科技研究发展计划(2011AA100303)。
通信作者:华松,男,硕士生导师,研究方向为动物胚胎工程。E-mail:hs863@126.com
中图分类号S858.26
文献标志码A
文章编号1004-1389(2016)06-0804-07
Foundation itemThe National High Technology Research and Development Program of China(No.2011AA100303). HUA Song,male,master supervisor.Research area: animal embryo engineering.E-mail:hs863@126.com
网络出版日期:2016-06-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160601.0914.004.html
第一作者:兰辉,男,硕士研究生,研究方向为动物胚胎工程。E-mail:lanhsa@163. com

