产气荚膜梭菌毒素型菌落多重PCR方法的建立及应用
李伟杰,于建慧,魏财文,蒋桃珍
(1.中国兽医药品监察所,北京 100081;2.中国农业科学技术出版社,北京 100081)
产气荚膜梭菌毒素型菌落多重PCR方法的建立及应用
李伟杰1,于建慧2,魏财文1,蒋桃珍1
(1.中国兽医药品监察所,北京100081;2.中国农业科学技术出版社,北京100081)
摘要根据产气荚膜梭菌α、β、ε和ι毒素基因cpa、cpb、etx、iA设计并合成4对特异性引物,建立快速鉴定产气荚膜梭菌毒素型的多重PCR方法。结果显示:产气荚膜梭菌A、B、C、D和E型参考菌株均扩增出相应的片段,而肉毒梭菌、气肿疽梭菌、腐败梭菌、诺维梭菌的扩增均为阴性;将产气荚膜菌株单个菌落稀释100倍,仍能扩增出相应的目的片段。利用此多重PCR方法对16株不同动物来源的产气荚膜梭菌进行分型鉴定,并与毒素中和试验鉴定结果进行比较,结果显示2种方法具有较高的符合率。该方法可有效进行产气荚膜梭菌的快速检测和分型,对产气荚膜梭菌感染与食品安全问题的研究具有参考价值。
关键词产气荚膜梭菌;菌落多重PCR;毒素分型
产气荚膜梭菌(Clostridiumperfringens)广泛存在于土壤、人和动物的肠道中,在一定条件下可引起人和动物的多种严重疾病。截止目前,产气荚膜梭菌毒素至少已发现19种,其中α、β、ε和ι为主要致死毒素,传统上以这4种毒素的产生情况将产气荚膜梭菌分为A(α)、B(α、β、ε)、C(α、β)、D(α、ε)和E(α、ι)5个类型[1-3]。A型菌株主要引起人食物中毒,禽坏死性肠炎,人和动物气性坏疽,驹、犊牛、羊、新生羊驼、野山羊、驯鹿、仔猪、犬、家兔肠炎和肠毒血症;B型菌株主要引起羔羊痢疾,驹、犊牛、羔羊、绵羊和山羊的肠毒血症或坏死性肠炎;C型菌株主要引起人、禽坏死性肠炎,驹、仔猪、羔羊、犊牛、绵羊、山羊坏死性肠毒血症,绵羊猝狙,仔猪血痢;D型菌株引起羔羊、绵羊、山羊、牛、马以及灰鼠的肠毒血症,山羊小肠结肠炎;E型菌株可致犊牛、羔羊肠毒血症[4]。
产气荚膜梭菌分型是该菌鉴定的一个重要方面,在利用已建立的多重PCR方法[5]进行分型中发现,部分菌株α毒素不能有效扩增,从而影响鉴定结果。因此,本研究设计合成1对针对α毒素的特异性引物,与其他3种毒素特异性引物建立产气荚膜梭菌毒素分型的多重PCR检测方法,并对16株产气荚膜梭菌进行复核验证,以期达到对产气荚膜梭菌快速分型的目的。
1材料与方法
1.1菌 株
产气荚膜梭菌A、B、C、D和E型5株参考菌株,产气荚膜梭菌16株国内分离株,均由中国兽医微生物菌种保藏管理中心提供,具体信息见表1。肉毒梭菌(CVCC60352)、气肿疽梭菌(CVCC60001)、腐败梭菌(CVCC60021)和诺维梭菌(CVCC60281)分别分离自肉毒中毒山羊、气肿疽羊、快疫羊和黑疫湖羊,由中国兽医微生物菌种保藏管理中心提供。
1.2菌株的培养
将冻干保存的产气荚膜梭菌、肉毒梭菌、气肿疽梭菌、腐败梭菌、诺维梭菌用适量的厌气肉肝汤复原溶解,接种厌气肉肝汤培养基,37 ℃培养过夜。吸取适量培养物滴加到含2 g/L葡萄糖的TSA平皿上,37 ℃厌氧培养24 h。
1.3PCR引物设计与合成
根据GenBank上已公布的α毒素基因序列,利用Primer premier 5.0软件设计1对特异性引物,由中美泰和生物技术有限公司合成。参照文献[7],由中美泰和生物技术有限公司合成3对针对β、ε和ι毒素编码的特异性引物。将各引物浓度稀释至10 μmol/L,置-20 ℃保存,备用。引物见表2。
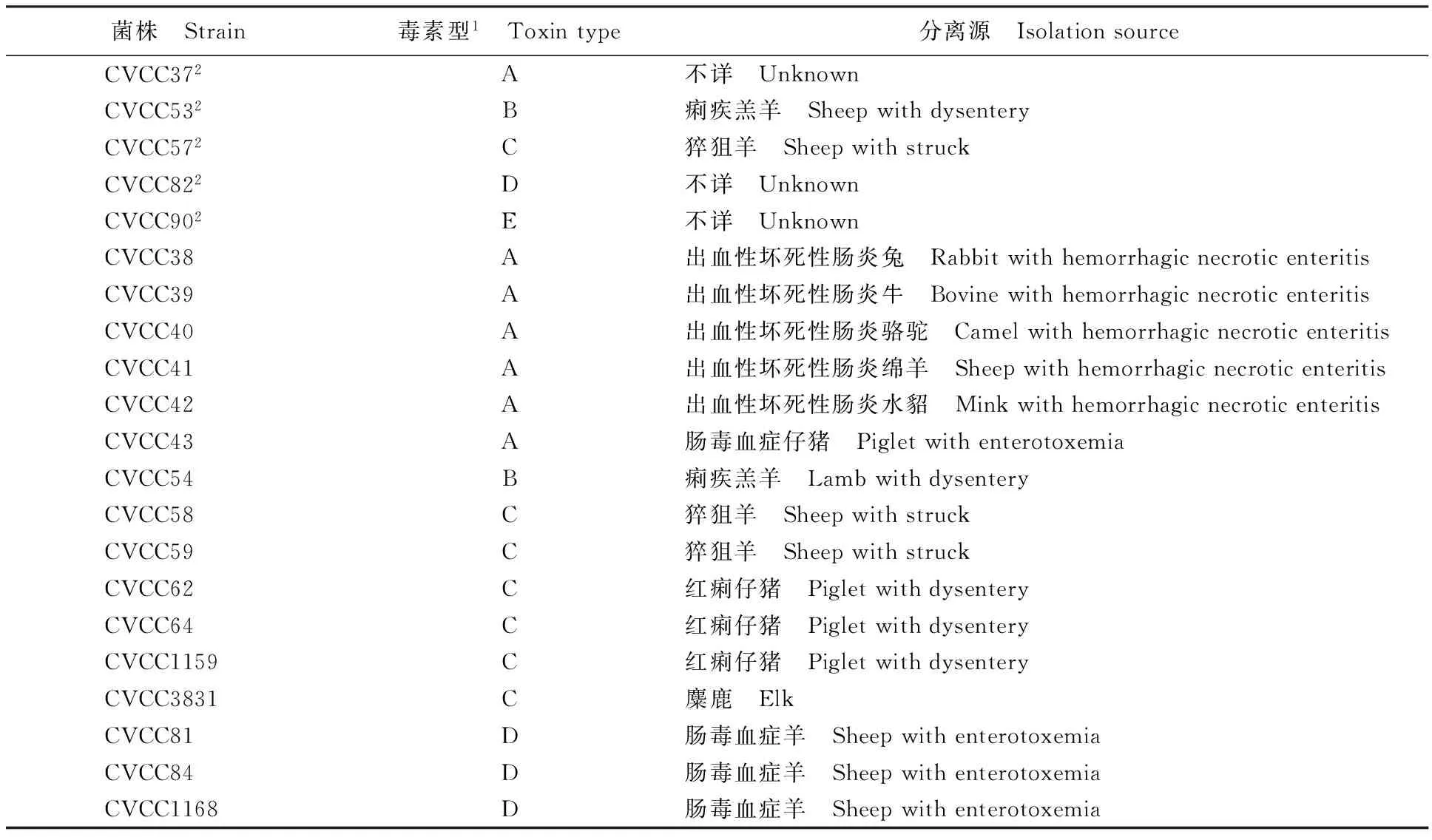
表1 产气荚膜梭菌信息[6]
注:1表示中和试验结果;2表示产气荚膜梭菌参考菌株。
Note:1 means the results of the neutralization test;2 means the reference strains ofC.perfringens.

表2 产气荚膜梭菌毒素基因检测引物
1.4多重PCR反应体系的建立与优化
挑取参考菌株的单菌落为模板,设置引物浓度梯度,分别对产气荚膜梭菌A、B、C、D和E型的参考菌株进行毒素扩增;将产气荚膜梭菌参考菌株B型和E型菌落混合后,设置温度梯度,分别对产气荚膜梭菌α、β、ε和ι毒素基因进行扩增。根据电泳检测结果,优化建立多重PCR反应体系与反应程序。
1.5敏感性检测
分别随机挑取产气荚膜梭菌B型和E型参考菌株的单菌落混合溶于10 μL灭菌双蒸水后,进行10倍倍比稀释,每个稀释度分别取1 μL稀释液作为模板,采用优化后的多重PCR进行扩增。
1.6特异性检测
利用建立的多重PCR方法对产气荚膜梭菌各型参考菌株、肉毒梭菌、气肿疽梭菌、腐败梭菌、诺维梭菌进行PCR扩增,以检测其特异性。
1.7多重PCR的应用
取16株产气荚膜梭菌国内分离株,利用建立的多重PCR方法进行毒素分型,并与毒素中和试验结果进行比较。
2结果与分析
2.1多重PCR反应体系和反应程序的确定
根据引物浓度梯度和退火温度梯度的结果,以条带较亮、试剂用量较少为原则,确定反应体系和反应程序,得多重PCR反应体系为10 ×ExTaqBuffer(含Mg2+25 mmol/L)5 μL,dNTP(2.5 mmol/L)4 μL,引物(10 μmol/L)各2 μL,ExTaq酶(5 U/μL)0.5 μL,加灭菌双蒸水至50 μL。多重PCR反应条件为95 ℃预变性10 min;95 ℃变性1 min,46 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃再延伸10 min。20 g/L琼脂糖凝胶电泳检测。
2.2多重PCR敏感性检测结果
将B型和E型2菌株随机挑取的单菌落混合后10倍系列稀释作为模板,按照“2.1”中的多重PCR反应体系和反应程序进行扩增,由图1可知,该方法对B型和E型菌株单菌落各稀释100倍后仍能观察到目的条带。

M.DL2000 DNA Maker; 1~4.10~103倍稀释10~103times dilution; CK.阴性对照Negative control
图1多重PCR敏感性检测结果
Fig.1Sensitivity results of multiplex PCR
2.3多重PCR特异性检测结果
利用建立的多重PCR方法对产气荚膜梭菌各型参考菌株、肉毒梭菌、气肿疽梭菌、腐败梭菌、诺维梭菌进行毒素PCR扩增。由图2可知,5株产气荚膜梭菌参考菌株均能扩增出相应的片段,其中CVCC37扩增片段约为400 bp,CVCC53扩增片段约为200、400和660 bp,CVCC57扩增片段约为200 bp和400 bp,CVCC82扩增片段约为400 bp和660 bp,CVCC90扩增片段约为400 bp和450 bp,而肉毒梭菌、气肿疽梭菌、腐败梭菌、诺维梭菌均未扩增出相应的片段。
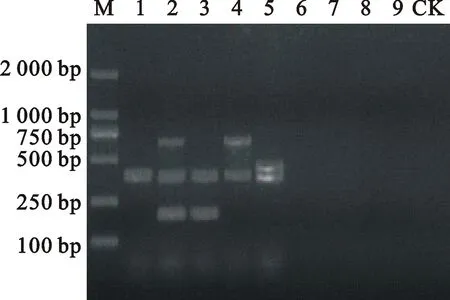
M.DL2000 DNA Maker; 1.CVCC37; 2.CVCC53; 3.CVCC57; 4.CVCC82; 5.CVCC90; 6.CVCC60352;7.CVCC60001; 8.CVCC60021; 9.CVCC60281; CK.阴性对照Negative control
图2多重PCR特异性检测结果
Fig.2Specificity results of multiplex PCR
2.3多重PCR检测方法的应用
利用所建立的多重PCR检测方法对中国兽医微生物菌种保藏管理中心保藏的16株不同来源、不同毒素型的产气荚膜梭菌进行鉴定(图3),结果表明:CVCC38、CVCC39、CVCC40、CVCC41、CVCC42和CVCC43为毒素A型;CVCC54为毒素B型;CVCC58、CVCC59、CVCC62、CVCC64和CVCC1159为毒素C型;CVCC81、CVCC84和CVCC1168为毒素D型。PCR检测方法与中和试验结果相比有很高的符合率,16株菌株2种方法的符合率为100%。
3讨 论
1892年,产气荚膜梭菌首先报道[7],1964年,中国首次从患红痢仔猪中分离出该菌[8]。近年来,由产气荚膜梭菌引起的羔羊痢疾、仔猪红痢、家禽的坏死性肠炎、犊牛和羊肠毒血症等疾病的流行面积不断扩大,给畜牧业造成很大的经济损失[8]。要做到有效的预防,注射针对不同毒素型合适疫苗是十分必要的,因此,对疫区流行的产气荚膜梭菌进行毒素分型的调查研究是非常必要。通常采用的定型主要是通过毒素中和试验来确定,中和试验前需要进行菌株所产毒素的滴定,而产气荚膜梭菌不同的毒素其产毒条件不尽相同,对培养基的要求也不同,只有在最佳产毒条件下所产生的毒素进行中和试验才可能准确[9]。因此,利用动物体内毒素中和试验对未知菌株进行定型是非常费力、费时的。随着PCR技术被广泛应用于疾病的诊断,快速、敏感、特异的检测方法不断产生[10-11]。本试验中建立的产气荚膜梭菌菌落多重PCR方法不需要提取细菌DNA或制备细菌的裂解液,直接以菌落为模板进行多重PCR扩增,省去增菌和提取DNA的步骤;另外本方法不涉及毒素产生条件的控制,极大地缩短了试验时间,且与中和试验结果相比具有很高的符合率,与传统的中和试验相比,具有高效、便捷及成本低廉等显著优点。

M.DL2 000 DNA Maker; CK.阴性对照Negative control ; 1.CVCC81; 2.CVCC84; 3.CVCC1168;4.CVCC58; 5.CVCC59; 6.CVCC62; 7.CVCC64; 8.CVCC1159; 9.CVCC3831; 10.CVCC54;11.CVCC38; 12.CVCC39; 13.CVCC40; 14.CVCC41; 15.CVCC42; 16.CVCC43
图316株产气荚膜梭菌多重PCR扩增
Fig.3Multiplex PCR amplification of 16C.perfringens
参考文献Reference:
[1]EROL L,GONCUOGLU M,AYAZ ND,etal.Molecular typing ofClostridiumperfringensisolated from turkey meat by multiplex PCR[J].LettersinAppliedMicrobiology,2008,47(1):31-34.
[2]STILES B G,PRADHAN K,FLEMING JM,etal.ClostridiumandBacillusbinary enterotoxins:bad for the bowels,and eukaryotic being[J].Toxins,2014,6(9):2626-2656.
[3]SILVA R O S,LOBATO F C F.Clostridiumperfringens:a review of enteric diseases in dogs,cats and wild animals[J].Anaerobe,2015,33:14-17.
[4]NAGAHAMA M,OCHI S,ODA M,etal.Recent insights intoClotridiumperfringensbeta-toxin[J].Toxins,2015,7(2):396-406.
[5]MEER R R,SONGER J G.Multiplex polymerase chain reaction assay for genotypingClostridiumperfringens[J].AmericanJournalofVeterinaryResearch,1997,58(7):702-705.
[6]冯忠武,陈敏,蒋玉文,等.中国兽医菌种目录[M].第2版.北京:中国农业科学技术出版社,2002:220-231.
FENG ZH W,CHEN M,JIANG Y W,etal.CVCC Catalogue of Cultures[M].2nd ed.Beijing:China Agricultural Science and Technology Press,2002:220-231( in Chinese).
[7]YOO H S,LEE S U,PARK K Y,etal.Molecular typing and epidemiological survey of prevalence ofClostridiumperfringenstypes by multiplex PCR [J].JournalofClinicalMicrobiology,1997,35(1):228-232.
[8]王海荣,唐德宏,鹿道新,等.畜舍环境中魏氏梭菌分离及基因型鉴定[J].中国人兽共患病杂志,2005,21(11):985-987.
WANG H R,TANG D H,LU D X,etal.Isolation and genotypic identification ofClostridiumperfringensfrom environments of animal houses [J].ChineseJournalofZoonoses,2005,21(11):985-987(in Chinese with English abstract).
[9]王开功,文明,周碧君,等.A型产气荚膜梭菌最佳产毒时间的确定[J].中国兽医科技,2003,33(8):42-44.
WANG K G,WEN M,ZHOU B J,etal.Determination of the optimal toxin production time ofClostridiumperfringens[J].ChineseJournalofVeterinaryScienceandTechnology,2003,33(8):42-44(in Chinese).
[10]VANASTEN A J,VANDER WIEL C W,NIKOLAOU G,etal.A multiplex PCR for toxin typing ofClostridiumperfringensisolates [J].VeterinaryMicrobiology,2009,136(3/4):411-412.
[11]董洁,杨晓静,苗承霞,等.产气荚膜梭菌菌落多重PCR方法的建立及初步应用[J].中国兽医学报,2013,33(12):1842-1847.
DONG J,YANG X J,MIAO CH X,etal.Development and preliminary application of colony multiplex PCR for serotyping ofClostridiumperfringensstrains[J].ChineseJournalofVeterinaryScience,2013,33(12):1842-1847(in Chinese with English abstract).
Received 2015-04-09Returned2015-05-10
First authorLI Weijie,male,associate research fellow.Research area:veterinary microbiology and biological product.E-mail: weijielee@163.com
(责任编辑:史亚歌Responsible editor:SHI Yage)
Establishment and Application of Colony Multiplex PCR Assay for ToxinotypingClostridiumperfringens
LI Weijie1,YU Jianhui2,WEI Caiwen1and JIANG Taozhen1
(1.China Institute of Veterinary Drug Control,Beijing100081,China;2.China Agricultural Science and Technology Press,Beijing100081,China)
AbstractAccording to the genes(cpa,cpb,etx,and iA) encoding four major toxins(α,β,ε,ι) of C.perfringens,four primers were designed and the colony multiplex PCR were established.The expected sequences were obtained successfully from C.perfringens reference strains including A,B,C,D and E by the multiplex PCR assay.However,the sequences were not amplified from C.botulinum,C.chauvoei,C.septicum and C.novyi.The expected sequences were obtained from C.perfringens single colony when diluted to 100 times.Sixteen C.perfringens strains isolated from different animals were toxinotyped by the multiplex PCR assay,and the results were compared with the results of toxins neutranization test in mice.The two assays showed good accordance.The established colony multiplex PCR can rapidly detect and toxinnotype C.perfringens effectively,which can be referred for the future study on C.perfringens infection in animal and food safety issue.
Key wordsClostridium perfringens;Colony multiplex PCR; Toxinotype
收稿日期:2015-04-09修回日期:2015-05-10
基金项目:国家微生物资源平台项目(NIMR-5)。
通信作者:蒋桃珍,女,研究员,主要从事禽病研究。E-mail:jiangtaozhen@ivdc.org.cn
中图分类号S855.1
文献标志码A
文章编号1004-1389(2016)06-0823-05
Foundation itemNational Science and Technology Infrastructure(No.NIMR-5). JIANG Taozhen,female,research fellow.Research area: poultry disease.E-mail: jiangtaozhen@ivdc.org.cn
网络出版日期:2016-06-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160601.0914.010.html
第一作者:李伟杰,男,副研究员,主要从事兽医微生物及生物制品研究。E-mail:weijielee@163.com

