籽用西瓜SCoT-PCR反应体系优化及引物筛选
杨 静,王 萍,石 磊
(内蒙古农业大学 农学院,内蒙古野生蔬菜种质资源与创新重点实验室,呼和浩特 010019)
籽用西瓜SCoT-PCR反应体系优化及引物筛选
杨静,王萍,石磊
(内蒙古农业大学 农学院,内蒙古野生蔬菜种质资源与创新重点实验室,呼和浩特010019)
摘要采用L25(56)正交试验设计,对影响目标起始密码子多态性-聚合酶链式反应(SCoT-PCR)的5个因素(Taq酶用量、Mg2+浓度、模板 DNA 用量、dNTPs 浓度和引物浓度) 进行优化试验,建立了籽用西瓜SCoT-PCR反应体系:Mg2+2.5 mmol·L-1、dNTPs 0.15 mmol·L-1、Taq酶 1.5 U、引物 0.5 μmol·L-1、模板DNA 20 ng,总体积20 μL。比较各因素对扩增反应的结果,其中以Mg2+浓度的影响最大,Taq酶用量的影响最小。应用22个籽用西瓜品种验证该体系稳定可靠,并从 41个 SCoT 引物中筛选出扩增条带清晰、多态性丰富的22个引物,并逐一筛选出最适退火温度。该反应体系的建立为今后利用SCoT标记技术对籽用西瓜种质遗传多样性评价、指纹图谱构建、种质鉴定、分子标记辅助选择育种等研究提供了新的技术手段。
关键词籽用西瓜;SCoT-PCR;体系优化;正交设计
籽用西瓜(Citrulluslanatusvar.megulasnemusLin et Chao)[1],属于葫芦科普通西瓜亚种中的籽瓜变种,俗称“打瓜”“瓜籽瓜”,主要以种子为食用器官。籽用西瓜在植物学上有不同分类,依其种子颜色可以分为红籽瓜和黑籽瓜2种,依其板型则分为大板、中板、小板[2]。籽瓜的分布较广, 主要分布在甘肃、新疆、内蒙古、宁夏、广西等10省(区),呈现南“红”(红瓜子)北“黑”(黑瓜子)的种植格局,每年播种面积在10万hm2以上,已成为南方和西北地区重要的经济作物之一。
目标起始密码子多态性(Start codon targeted polymorphism, SCoT) 分子标记是Collard等[3]在水稻上提出的基于单引物扩增反应(Single primer amplification reaction,SPAR) 的新型分子标记,是一种新的目的基因分子标记。其原理是根据植物基因中的 ATG 翻译起始位点侧翼序列的保守性,设计单引物并对基因组进行扩增,产生偏向候选功能基因区显性多态性标记。具有操作简单、引物通用性强、成本低、多态性高、遗传信息丰富、能有效产生与性状联系标记、有利于辅助育种等优点。该标记兼具RAPD和ISSR的优点,除可作为对ISSR和RAPD的有效补充之外,更能利用该分子标记有效跟踪性状[4]。该分子标记目前已成功应用于柑橘[5]、芒果[6]、草莓[7]、葡萄[8]、牡丹[9]、铁皮石斛[10]、枇杷[11]和番木瓜[12]等多种植物,但在籽用西瓜遗传多样性上以及种质鉴定等方面未见报道。由于籽用西瓜是西瓜的变种,本身资源缺乏,育种材料亲缘关系过分单一,造成籽用西瓜育种工作很难取得突破。籽用西瓜育种要取得突破关键在于优质种质资源的开发和利用,本研究旨在较全面地建立并优化籽用西瓜的 SCoT 反应体系,筛选出最适SCoT引物,为应用 SCoT 分子标记技术进一步研究籽用西瓜种质资源的起源、进化及遗传多样性奠定基础。为此,本试验以籽用西瓜为材料,利用正交设计优化籽用西瓜的 SCoT-PCR 反应体系,并筛选适用于籽用西瓜的 SCoT 引物,为其在籽用西瓜种质资源的遗传多样性分析、遗传资源评价分析、图谱构建与种质鉴定以及分子标记辅助育种等领域的应用提供技术支撑及理论依据。
1材料与方法
1.1材料及试剂
供试材料取自萌发6 d后的种子(表1),经冷冻干燥机干燥24 h后充分研磨。其中‘内蒙黑中片’‘道县红籽瓜’和‘兰州大板一号’分别用于SCoT-PCR反应体系的优化、退火温度的筛选及引物的筛选,所列22个试材均用于优化体系的验证。
SCoT 引物序列来自于 Collard 等[3],由上海生工生物工程技术服务有限公司合成。DL2000 Marker、dNTPs、TaqDNA 聚合酶、10×Buffer 等均购自全式金生物工程有限公司。
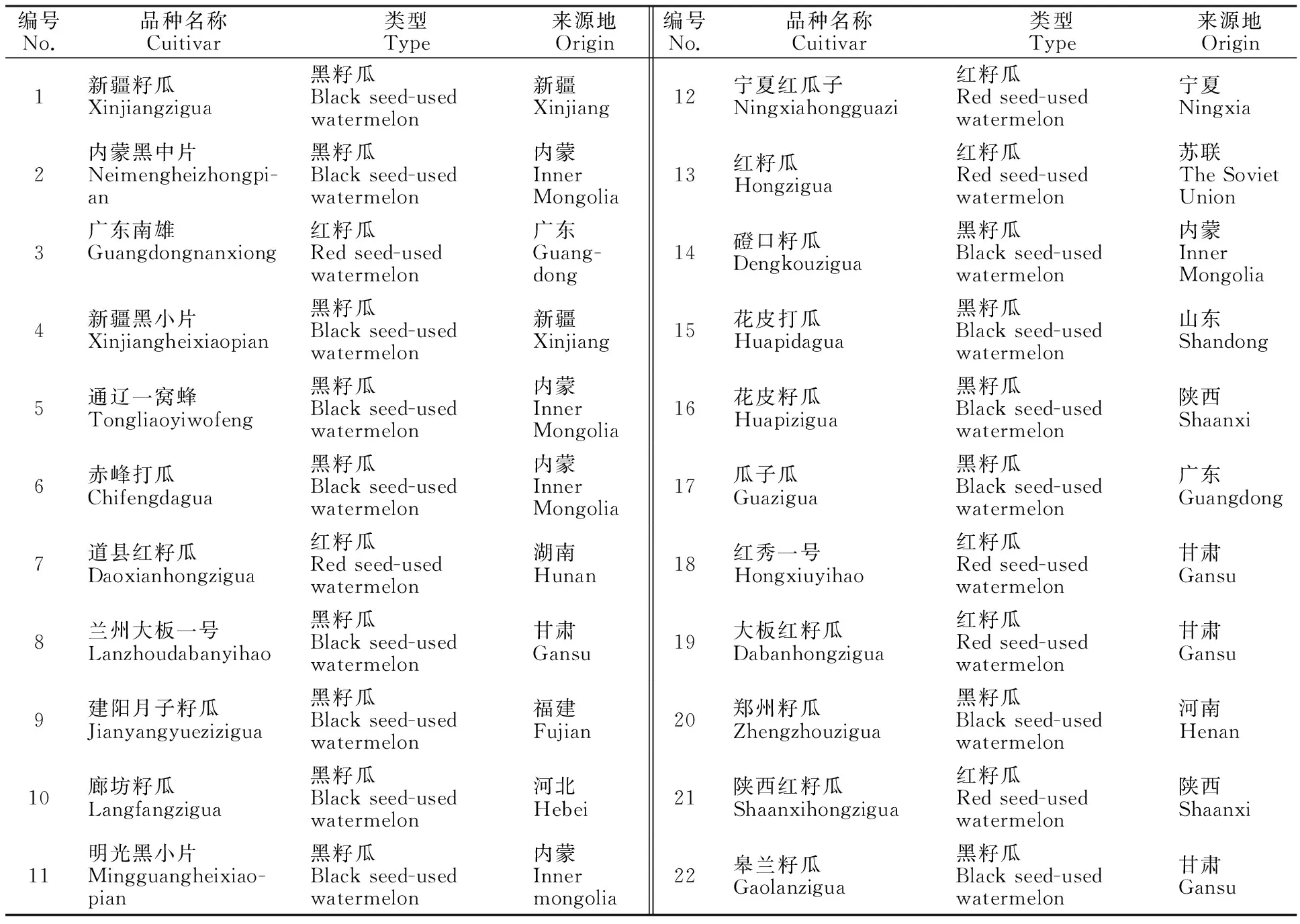
表1 供试材料信息
注:6~22号籽用西瓜品种均由国家西瓜与甜瓜中期库提供。
Note:All of 6-22 seed-used watermelon were provided by watermelon and melon middle library of countries.
1.2基因组DNA的提取与检测
籽用西瓜基因组DNA提取采用改良的十六烷基三甲基溴化铵法(CTAB)[13],所得DNA用紫外分光光度法和10 g·L-1琼脂糖凝胶电泳法检测其质量及完整性。根据检测结果将DNA稀释至所需浓度后,-20 ℃保存待用。
1.3SCoT-PCR扩增程序
PCR扩增反应在BYQ6031E-505型PCR扩增仪上进行。初始扩增程序参考 Collard 等[3]和韩国辉等[14]的方法,具体反应程序为:94 ℃预变性4 min,94 ℃变性30 s,47.7 ℃复性退火30 s,72 ℃延伸1 min,循环 35次,最后72 ℃延伸5 min,扩增产物于4 ℃下保存。扩增反应结束后,加入2 μL 6×loading buffer,取4~6 μL扩增产物在10 g·L-1琼脂糖凝胶中电泳,电极缓冲液为0.5×TBE,经Gelview核酸染料染色后,电压120 V电泳1 h,最后紫外灯下照相保存。
1.4SCoT-PCR体系的正交优化设计
采用 L25(56)正交表设计,对反应体系中的Mg2+、dNTPs、引物、Taq酶和DNA模板5种影响因素设置5个水平(表2)共25个组合。试验以‘内蒙黑中片’基因组DNA为模板,S19为扩增引物,每个处理重复2次。各处理的PCR扩增体系为20 μL,每个处理10× Buffer用量均为2.0 μL,不足部分用ddH2O补足。对扩增结果进行人工评分后,利用正交设计助手 3.1软件进行直观分析。
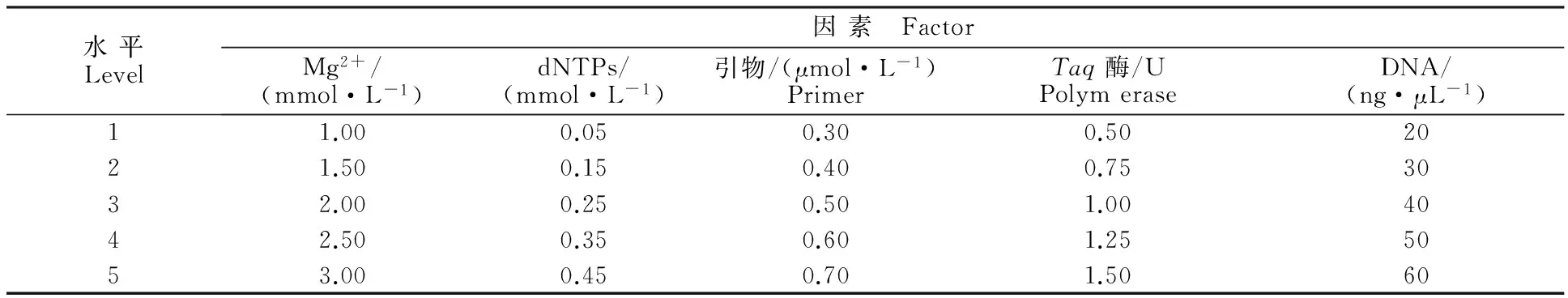
表2 L25(56)正交试验的因素及水平
1.5SCoT引物和退火温度的筛选
根据正交试验结果,选择‘兰州大板一号’和‘道县红籽瓜’,运用最佳反应体系进行引物筛选和退火温度的确定试验(表3)。

表3 籽用西瓜SCoT引物筛选及最适退火温度
1.6数据统计与处理
参照何正文等[15]和姜小凤等[16]的方法对电泳结果打分,主要依据PCR扩增结果电泳条带的多少、清晰度、杂带的多少以及背景颜色对正交试验各个处理依次打分:1~25(最差的扩增结果记“1”分; 条带多态性最高、清晰度最好、分散性强和背景颜色少的最佳扩增结果记“25”分)。根据打分结果进行直观分析,在假设不存在交互作用情况下,试验每一因素下各水平的平均值能够反映影响因素各水平对反应体系的影响情况,因此本试验首先根据电泳平均得分求出每一因素下各水平的均值Ki用以反映因素各水平的影响大小; 最后求出同一因素不同水平间平均值的极差R,用最大平均值减去最小平均值即为同因素不同水平间的极差R,R大小反应该因素对试验结果影响的程度,R越大说明该因素对试验结果影响越大。
1.7反应体系稳定性的验证
根据所确定的SCoT-PCR最佳反应体系,选用多个引物对22个籽用西瓜品种进行PCR扩增,以验证该SCoT-PCR最适反应体系的可靠性及稳定性。
2结果与分析
2.1籽用西瓜DNA浓度的检测
对提取的籽瓜DNA纯度进行琼脂糖凝胶电泳检测。检测结果显示所得的DNA条带清晰完整,无拖尾现象。用Biophotometre型核酸蛋白仪检测DNA浓度,OD260/OD280为1.9~2.0,说明所提取的籽瓜DNA较纯净,无杂质污染,可用于试验研究进行PCR扩增。
2.2籽用西瓜SCoT反应体系的正交优化分析结果
正交试验采用‘内蒙黑中片’基因组DNA为模板,S19为扩增引物进行扩增,并对扩增产物进行电泳检测(图1)。由正交试验结果可以看出,不同的处理组合,由于Mg2+、dNTPs、Taq聚合酶、引物和模板DNA用量搭配组合的不同,扩增结果存在着明显的差异。其中,处理1、2、3无扩增结果,处理4、6、9、10、20、21、25条带弱,处理5、7、8、11、12、13、14、15、16、22、23、24条带亮但不清晰,扩增效果以组合17、18、19为最好,条带亮且清晰。依据PCR扩增结果电泳条带的多少、清晰度、杂带的多少以及背景颜色对正交试验各个处理依次打分,最好的记为25分,最差的记为1分,对试验结果进行直观分析(表4)。
根据直观分析结果,各因素极差R大小依次为 Mg2+>模板DNA>引物>dNTPs>Taq酶,表明各因素对反应体系的影响程度大小亦以此排序。根据直观分析中各因素水平下的得分数据平均值Ki可以确定各个因素的最适浓度(得分最高),由表4中的Ki值可以初步确定各因素单一最佳水平分别为:Mg2+2.5 mmol·L-1、dNTPs 0.15 mmol·L-1、Taq酶 1.5 U、引物 0.7 μmol·L-1、模板DNA 60 ng。但相应组合在正交设计表中并未出现,该体系与组合17最为接近,只是引物与模板DNA含量有所不同,根据组合 17 的扩增效果并结合经济角度考虑,选择0.5 μmol·L-1、20 ng 作为引物与模板DNA最佳用量,所以确定最佳组合为 17。因此,籽用西瓜SCoT-PCR的最佳反应体系为总体积20 μL中含Mg2+2.5 mmol·L-1、dNTPs 0.15 mmol·L-1、Taq酶 1.5 U、引物 0.5 μ mol·L-1、模板DNA 20 ng。Mg2+对PCR扩增的特异性和产量有显著的影响,Mg2+浓度过高,反应特异性降低,出现非特异扩增,浓度过低会降低TaqDNA聚合酶的活性,使反应产物减少。在17、18、19组合中Mg2+的浓度相对较高,均为2.5 mmol·L-1,是最佳水平,而1~5组合Mg2+浓度最低,表明籽用西瓜在SCoT-PCR扩增上需要较高浓度的Mg2+,并且Mg2+的影响最大。而其他组合在Mg2+浓度适当的范围内均有条带,说明其他因素对PCR扩增反应体系的影响较小。
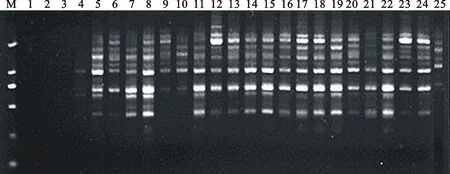
M.DL2000 marker;1~25.处理编号,同表4 Code is the same as table 4

处理组合TreatmentNo.Mg2+/(mmol·L-1)dNTPs/(mmol·L-1)Taq/U引物/(μmol·L-1)PrimerDNA/ng评分Score11.000.050.500.3020121.000.150.750.4030131.000.251.000.5040141.000.351.250.6050251.000.451.500.70601861.500.050.750.50501671.500.151.000.60602081.500.251.250.70202291.500.351.500.303014101.500.450.500.404012112.000.051.000.703020122.000.151.250.304021132.000.251.500.405019142.000.350.500.506021152.000.450.750.602023162.500.051.250.406022172.500.151.500.502025182.500.250.500.603024192.500.350.750.704023202.500.451.000.305020213.000.051.500.604010223.000.150.500.705022233.000.250.750.306019243.000.351.000.402021253.000.451.250.503012K14.613.816.015.018.4K216.817.816.415.014.2K320.817.016.415.013.4K422.816.215.815.815.8K516.817.017.221.020.0R18.24.01.46.06.6
2.3引物筛选
根据正交试验结果确定的籽用西瓜SCoT-PCR 最佳反应体系,以‘兰州大板一号’基因组 DNA为模板,对41个引物进行筛选,筛选出条带清晰、种间差异明显、多态性好的 22个引物用于后续籽用西瓜的SCoT分析。22个引物扩增效果如图2。
2.4最适退火温度的筛选
利用优化的 SCoT 体系对筛选出的每一个引物逐一进行退火温度的筛选,根据(50±5) ℃的温度设定范围,PCR仪自动生成10个温度梯度,分别为45.0 ℃、45.7 ℃、46.6 ℃、47.7 ℃、49.0 ℃、50.4 ℃、51.8 ℃、53.0 ℃、54.1 ℃、55.0 ℃。退火温度的高低直接影响引物与模板DNA的特异性结合,当退火温度过低时,非特异性扩增条带的数目增加,当退火温度过高时,引物与DNA模板的结合能力差,电泳条带弱从而导致扩增失败,而不同的引物退火温度可能不同。根据电泳检测结果,选择扩增条带数量多、条带清晰的作为最适退火温度,扩增效果相同的情况下选择温度高的作为最适退火温度,以确保 PCR产物的特异性。其中引物S8和S26的扩增结果见图3。由S8扩增结果可以看出,当退火温度低于 47.7 ℃时,非特异性条带较多,温度为 47.7 ℃时条带多且清晰,此后随着退火温度的升高特异性增强,条带减少,由于 SCoT 的引物较短,温度过高可能会影响其扩增效果,所以确定引物 S8 的最适退火温度为47.7 ℃。由S26扩增结果可以看出,当退火温度低于 49.0 ℃时,条带弱且少,温度为 49.0 ℃时条带多且清晰,大于49.0 ℃时条带减少,所以引物 S26 的最适退火温度为49.0 ℃。各引物最适退火温度见表3。
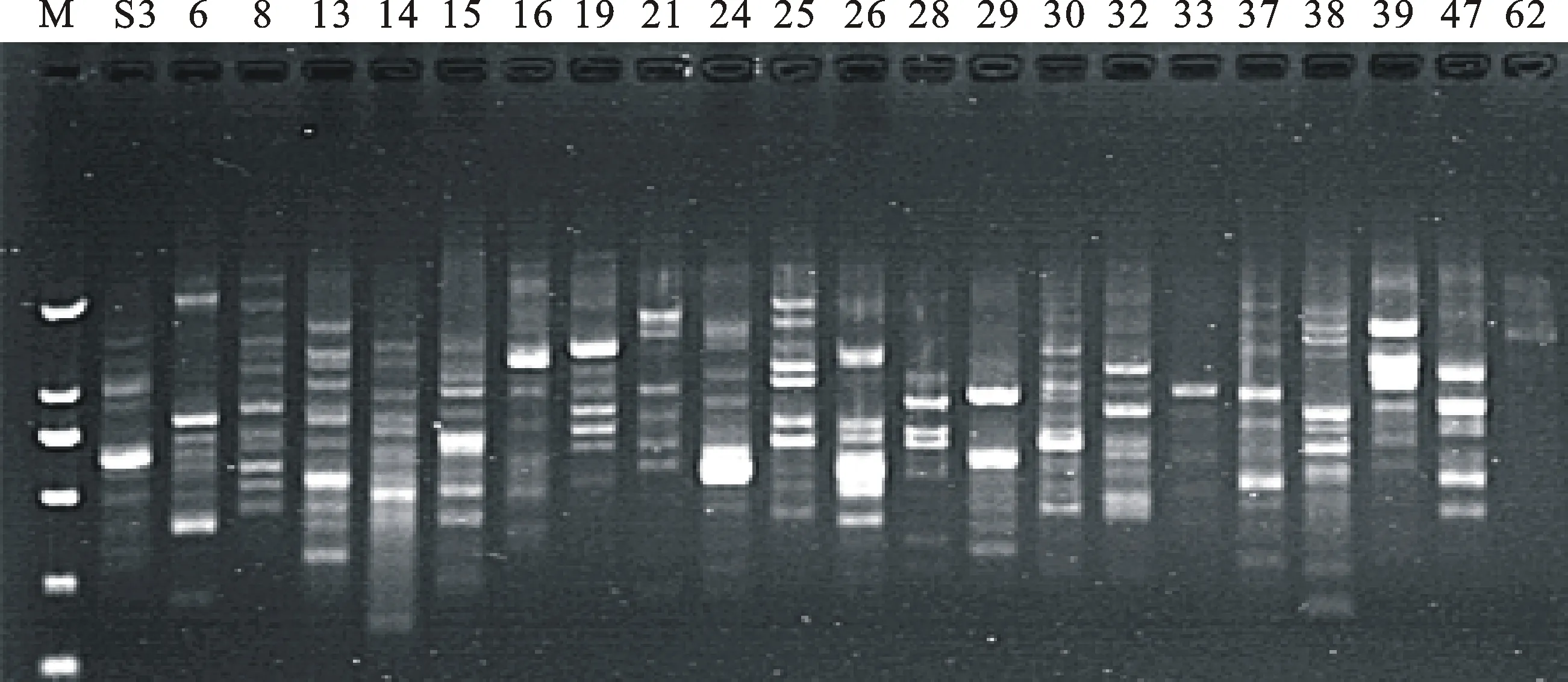
M.DL2000 marker;S3~S62.引物同表3 SCoT primers as table 3

M.DL2000 marker;1~10:退火温度 Annealing temperatures 45.0, 45.7, 46.6, 47.7, 49.0, 50.4, 51.8, 53.0, 54.1,55.0 ℃
2.5籽用西瓜SCoT-PCR反应体系的验证
选用S8、S19、S21等多个引物及其最适退火温度,对已优化的籽用西瓜SCoT-PCR反应体系进行多次重复验证,结果表明,所用引物均能在供试材料中扩增出清晰度高、分散性好、多态性高、亮度适中、重复性好的条带。如引物S8在22份供试材料中能扩增出清晰可见、分散性好、重复性高的条带(图4)。由此可见,优化的反应体系稳定性好、多态性好、重复性高、扩增效果良好,适用于籽用西瓜的多方面研究,能满足诸如遗传多样性分析、种质鉴定、指纹图谱构建等方面的需要,为SCoT标记在籽用西瓜中的应用奠定基础。
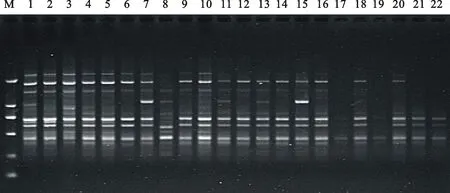
M.DL2000 marker;1~22.处理编号,同表1 Code is the same as table 1
3讨论与结论
随着功能基因组学和生物信息学的发展,目的基因分子标记越来越受到研究者重视,因其本身可能是目的基因的一部分或与目的基因紧密连锁,这样通过对某个分子标记筛选即能对性状进行筛选,从而加速育种进程。为此,建立一种简单、有效和实用的目的基因分子标记技术对籽用西瓜遗传育种研究等方面有着重要意义。SCoT 标记作为一种基于 PCR 技术的新型分子标记具有诸多优点,能更好地反应物种的遗传多样性和亲缘关系。
SCoT 标记作为一种新型的目的基因分子标记,虽然在多种植物上证明具有操作简单、重复性好、引物通用性强的优点,但对于不同材料所适用的反应体系仍有很大不同,因此,采用 SCoT 分子标记时应首先对其反应体系进行优化。本试验利用正交设计方法,对籽用西瓜SCoT-PCR 反应体系中的Mg2+、dNTPs、Taq酶、引物及模板 DNA 等主要因素的影响进行了研究,发现各因素对反应体系的影响程度大小为 Mg2+>模板DNA>引物>dNTPs>Taq酶,且各因素下不同水平间及各因素间差异均未达显著水平,而且经过比较此标记下不同的试验材料均有较为明显的差异。侯小改等[9]、龙治坚等[17]、王玉等[18]和姜小风等[16]对牡丹、芥菜、玫瑰和葡萄的研究中,均认为Mg2+是影响SCoT-PCR反应体系最主要的因素,这与本研究结果相一致。研究认为Mg2+浓度对TaqDNA聚合酶的活性起决定作用,当其浓度过低时,酶活力明显降低,浓度过高则催化非特异片段的扩增[19]。本试验结果与该结论相符,并表明籽用西瓜在SCoT-PCR扩增上需要较高浓度的Mg2+。
目前,SCoT分子标记在瓜类上的应用仅局限于丝瓜,在有关籽用西瓜SCoT-PCR反应优化体系建立上还未见报道。蒋雅琴等[20]建立的丝瓜SCoT-PCR的反应体系为总体积20 μL中含Mg2+2.0 mmol·L-1、dNTPs 0.5 mmol·L-1、引物 0.5 μmol·L-1、模板DNA 50 ng、Taq酶 1.0 U。本体系的成分含量与其相比,引物浓度相同,Mg2+、Taq酶浓度略高,dNTPs和模板DNA浓度是其含量的近1/3,说明在籽用西瓜SCoT-PCR体系中,用较低浓度的dNTPs和模板DNA就能起到相同的效果。由此可知,本试验得出的反应体系从经济角度和实验操作等方面均达到了最优效果,从而降低试验成本并且证实了本试验的成功。
SCoT分子标记的引物在不同植物中具有一定的通用性。侯小改等[9]、赵瑞强等[10]、杨祥燕等[12]及陈虎等[13]已验证Collard等[3]开发的SCoT-PCR引物在牡丹、石斛、番木瓜及龙眼中的通用性。本试验利用 ‘兰州大板一号’基因组DNA为模板,从Collard等[3]报道的一部分SCoT引物中筛选 22 个适于籽用西瓜 SCoT 分析的引物,验证了SCoT分子标记的引物具有一定的通用性。本试验对筛选出的引物逐一进行退火温度的优化,发现不同的引物最适退火温度不同,范围从 46.6 ℃ 到 55.0 ℃,而不同于其他植物的引物均采用单一退火温度。
综上所述,该试验建立并优化了籽用西瓜SCoT-PCR的最佳反应体系为总体积20 μL中含Mg2+2.5 mmol·L-1、dNTPs 0.15 mmol·L-1、Taq酶 1.5 U、引物 0.5 μ mol·L-1、模板DNA 20 ng。从41条引物中初步筛选出22条符合多态性要求的SCoT引物,并利用不同的籽用西瓜品种和引物对优化出的籽用西瓜SCoT-PCR的最佳反应体系进行了验证,得到多态性高、重复性好的条带,大小为250~2 500 bp,验证了其稳定性及可靠性。为后期籽用西瓜种质资源的遗传多样性分析、遗传资源评价分析、图谱构建与种质鉴定以及分子标记辅助育种等领域的应用提供技术支撑及理论依据,也为此标记应用于其他植物的研究提供了借鉴。
参考文献Reference:
[1]魏大钊,吴大康.西北的瓜[M].西安:陕西科学技术出版社,1985.
WEI D ZH,WU D K. The Melon in Northwest[M].Xi’an:Shaanxi Science and Technology Press,1985(in Chinese).
[2]张桂芬,张建农.西瓜种子大小的遗传规律[J].江苏农业科学,2011,39(4):216-217.
ZHANG G F,ZHANG J N. Genetic patterns of the size of a watermelon seed [J].JiangsuAgriculturalScience,2011,39(4):216-217(inChinese).
[3]COLLARD B C Y,MACKILL D J. Start codon targeted ( SCOT) polymorphism: a simple,novel DNA marker technique for generating gene-targeted markers in plants[J].PlantMolecularBiologyReporter,2009,27(1):86-93.
[4]熊发前,唐荣华,陈忠良,等.目标起始密码子多态性(SCoT):一种基于翻译起始位点目的基因标记技术[J].分子植物育种,2009,7(3):635-638.
XIONG F Q,TANG R H,CHEN ZH L,etal.SCoT: anovel gene targeted marker technique based on the translation start codon[J].MolecularPlantBreeding,2009,7(3):635-638(in Chinese with English abstract).
[5]韩国辉.基于EST-SSR、Genomic-SSR和SCoT标记的柑橘连锁图谱构建及杂种和多倍体遗传分析[D].重庆:西南大学,2012.
HAN G H.Construction of molecular linkage map and genetic analysis of hybrids and polyploidy of citrus based on EST-SSR,genomic-SSR and SCoT markers[D].Chongqing:Southwest University,2012(in Chinese with English abstract).
[6]LUO C,HE X H,CHEN H,etal. Genetic diversity of mango cultivars estimated using SCoT and ISSR markers[J].BiochemicalSystematicsandEcology,2011,39(4):676-684.
[7]秦国新,何桥,梁国鲁,等.草莓属植物SCoT分析体系的建立及优化[J].果树学报,2012,29(3):393-397.
QIN G X,HE Q,LIANG G L,etal. Establishment and optimization of SCoT-PCR system inFragaria[J].JournalofFruitScience,2012,29(3):393-397(in Chinese with English abstract).
[8]张君玉,郭大龙,龚莹,等.葡萄目标起始密码子多态性反应体系的优化[J].果树学报,2011,28(2):209-214.
ZHANG J Y,GUO D L,GONG Y,etal. Optimization of start codon targeted polymorphism PCR(SCoT-PCR) system inVitisvinifera[J].JournalofFruitScience,2011,28(2):209-214(in Chinese with English abstract).
[9]侯小改,王娟,贾甜,等.牡丹SCoT 分子标记正交优化及引物筛选[J].华北农学报,2011,26(5):92-96.
HOU X G,WANG J,JIA T,etal.Orthogonal optimization of SCoT- PCR system and primer screening of tree peony[J].ActaAgriculturaeBoreali-Sinica,2011,26(5):92-96(in Chinese with English abstract).
[10]赵瑞强,高燕会,章晓玲,等.铁皮石斛 SCoT-PCR 反应体系构建及优化[J].核农学报,2012,26(4):648-655.
ZHAO R Q,GAO Y H,ZHANG X L,etal. Establishment and optimization of SCoT-PCR reaction system for Dendrobium officinale[J].JournalofNuclearAgriculturalSciences,2012,26(4):648-655(in Chinese with English abstract).
[11]龙治坚.枇杷属植物的遗传多样性分析和指纹图谱初步构建[D].重庆:西南大学,2013.
LONG ZH J.Genetic diversity analysis and fingerprint construction ofEriobotryabased on SSR and SCoT markers[D].Chongqing: Southwest University,2013(in Chinese with English abstract).
[12]杨祥燕,蔡元保,郭凌飞,等.番木瓜SCoT反应体系建立及引物筛选[J].热带亚热带植物学报,2012,20(6):578-584.
YANG X Y,CAI Y B,GUO L F,etal.Establishment of SCoT amplification system and primer selection forCaricapapaya[J].JournalofTropicalandSubtropicalBotany,2012,20(6):578-584(in Chinese with English abstract).
[13]陈虎,何新华,罗聪,等.龙眼24个品种的SCoT遗传多样性分析[J].园艺学报,2010,37(10):1651-1654.
CHEN H,HE X H,LUO C,etal.Analysis on the genetic diversity of 24 longan(Dimocarpuslongan)accessions by SCoT markers[J].ActaHorticulturaeSinica,2010,37(10):1651-1654(in Chinese with English abstract).
[14]韩国辉,汪卫星,向素琼,等.多倍体枇杷 SCoT分析体系的建立与优化[J].果树学报,2011,28(3):433-437.
HAN G H,WANG W X,XIANG S Q,etal.Establishment and optimization of SCoT system in polyploidy loquats[J].JournalofFruitScience,2011,28(3):433-437(in Chinese with English abstract).
[15]何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
HE ZH W,LIU Y SH,CHEN L H,etal.Orthogonal design-direct analysis for PCR optimization[J].BulletinofHunanMedicalUniversity,1998,23(4):403-404(in Chinese with English abstract).
[16]姜小凤,高燕会,童再康,等.石蒜属植物SCoT-PCR反应体系构建及优化[J].浙江农林大学学报,2013,30(3):444-452.
JIANG X F,GAO Y H,TONG Z K,etal.Establishing and optimizing a SCoT-PCR system forLycoris[J].JournalofZhejiangA&FUniversity,2013,30(3):444-452(in Chinese with English abstract).
[17]龙治坚,王莹,韩国辉,等.芥菜SCoT分析体系的建立与优化[J].西南大学学报(自然科学版),2013,35(4):20-25.
LONG ZH J,WANG Y,HAN G H,etal.Establishment and optimization of SCoT system of mustard[J].JournalofSouthwestUniversity(NaturalScienceEdition),2013,35(4):20-25 (in Chinese with English abstract).
[18]王玉,赵兰勇,申宏伟,等.玫瑰SCoT-PCR反应体系优化及引物筛选[J].北方园艺,2014(23):91-96.
WANG Y,ZHAO L Y,SHEN H W,etal.Optimization for SCoT-PCR systemand primer selection ofRosarugosa[J].NorthernHorticulture,2014(23):91-96(in Chinese with English abstract).
[19]周静,陈书霞,程智慧,等.大蒜SSR体系的建立与优化[J].西北农业学报,2011,20(11):117-122.
ZHOU J,CHEN SH X,CHENG ZH H,etal.Establishment and optimization of SSR reaction system in garlic[J].ActaAgriculturaeBoreali-occidentalisSinica,2011,20(11):117-122(in Chinese with English abstract).
[20]蒋雅琴,黎炎,李文嘉,等.SCoT分子标记技术在丝瓜上的应用[J].南方农业学报,2014,45(12):2117-2122.
JIANG Y Q,LI Y,LI W J,etal.Application of SCoT markers on genetic diversity analysis ofLuffaMill[J].JournalofSouthernAgriculture,2014,45(12):2117-2122(in Chinese with English abstract).
Received 2015-09-29Returned2015-10-09
First authorYANG Jing,female,master student.Research area: germplasm resources and germplasm innovation.E-mail:964054378@qq.com
(责任编辑:潘学燕Responsible editor:PAN Xueyan)
Optimization for SCoT-PCR System and Primer Selection of Seed-used Watermelon
YANG Jing, WANG Ping and SHI Lei
(Key Laboratory of Wild Vegetable Germplasm Resources and Innovation,College of Agronomy,Inner Mongolia Agricultural University, Huhhot010019,China)
AbstractAn orthogonal design L25(56) was used to optimize SCoT-PCR (start codon targeted polymorphism) amplification system of seed-used watermelon in five factors such as Taq DNA polymerase, Mg2+, DNA template, dNTPs and primer concentrations).The results showed that the optimized system was 2.5 mmol·L-1Mg2+, 0.15 mmol·L-1dNTPs, 1.5 U Taq polymerase, 0.5 μmol·L-1primer, 20 ng DNA template in 20 μL mixture.Each factor had different effect on the results.The concentration of Mg2+was the key factor affecting the SCoT-PCR system.The optimized SCoT-PCR system was tested on 22 seed-used watermelons,and the result was stable and reliable.From the 41 primer combinations tested, 22 were selected with clear band patterns and abundant polymorphism.The most suitable annealing temperature of primers was selected.The optional reaction system provide a new technology for evaluation of genetic diversity, construction of fingerprinting, germplasm identification and molecular marker assisted breeding on seed-used watermelon.
Key wordsSeed-used watermelon; SCoT-PCR; Reaction optimization; Orthogonal design
收稿日期:2015-09-29修回日期:2016-10-09
基金项目:内蒙古自然科学基金(2016MS0356);内蒙古科技计划项目(20090707,2010704,20110711,20120212);内蒙古高寒地区高产安全蔬菜生产的研究与创新项目(NDPYTD2013-3)。
通信作者:王萍,女,副教授,硕士生导师,主要从事种质资源与种质创新研究。E-mail: wangping@imau.edu.cn
中图分类号S651
文献标志码A
文章编号1004-1389(2016)06-0889-08
Foundation itemInner Mongolia Natural Science(No.2016MS0356);Science and Technology Plan Projects in Inner Mongolia(No.20090707,2010704,20110711,20120212);Alpine Region of Inner Mongolia High Security Research and Innovation of Vegetable Production(No.NDPYTD2013-3). WANG Ping, female, associate professor,master’s supervisor.Research area:germplasm resources and germplasm innovation.E-mail: wangping@imau.edu.cn
网络出版日期:2016-06-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160601.0919.030.html
第一作者:杨静,女,硕士研究生,从事蔬菜种质资源与种质创新研究。E-mail:964054378@qq.com

