马铃薯与玉米间作体系根际土壤放线菌多样性及拮抗菌株的筛选
郑亚强,陈 斌,宋培勇,李正跃,肖关丽
(1.云南农业大学 植物保护学院,云南省微生物发酵工程研究中心,昆明 650201;2.云南农业大学 农学与生物技术学院,昆明 650201;3.遵义师范学院 生命科学学院,贵州遵义 563002)
马铃薯与玉米间作体系根际土壤放线菌多样性及拮抗菌株的筛选
郑亚强1,陈 斌1,宋培勇3,李正跃1,肖关丽2
(1.云南农业大学 植物保护学院,云南省微生物发酵工程研究中心,昆明650201;2.云南农业大学 农学与生物技术学院,昆明650201;3.遵义师范学院 生命科学学院,贵州遵义563002)
摘要为研究马铃薯间作玉米体系土壤放线菌的群落多样性,采用微生物分离培养技术,运用高氏Ⅰ号培养基对马铃薯单作田、马铃薯间作玉米田和玉米单作田土壤放线菌进行分离培养,对各菌株进行16S rDNA序列分析、纤维素酶活性评价和拮抗植物病原真菌菌株筛选。结果显示,挑取的代表菌株中,马铃薯间作玉米田的17株土壤放线菌均为链霉菌属(Streptomyces),马铃薯单作田的11株放线菌也均为链霉菌属,玉米单作田的16株菌株中仅有1株为小单孢菌属(Micromonospora),其他15株均为链霉菌属;马铃薯间作玉米田、马铃薯单作田、玉米单作田土壤放线菌中具纤维素酶活性的菌株分别占各处理菌株数的41.17%、27.27%和25.00%;具拮抗活性的菌株分别占各处理菌株数的29.42%、27.27%和37.50%,其中,菌株J2-3/4对小麦根腐病菌(Cochliobolus sativus)、小麦全蚀病菌(Gaeumannomyces graminisr)、烟草赤星病菌(Alternar iaalternata)和稻瘟病菌(Magnaporthe oryzae) 有良好的抑菌效果,抑菌率分别为75.70%、63.97%、64.85%和72.94%。说明:不同种植模式下,土壤放线菌群落结构均较单一,且链霉菌属为优势种群;菌株J2-3/4在作物真菌病害生物防治菌株资源开发中具有良好的潜在价值。
关键词马铃薯;玉米;间作;土壤放线菌;拮抗作用
土壤微生物是土壤生态系统的重要组成部分,参与土壤中重要的生理化学反应,对保持土壤生态平衡有重要作用,也是土壤肥力评价的指标之一[1]。放线菌是土壤微生物中的第二大类群,能分泌许多活性物质,土壤中放线菌的数量及有益拮抗放线菌的比例对土壤微生物生态平衡有重要的调节作用[2]。间作适宜的作物能提高土壤微生物多样性、增加有益微生物的数量、提高植物对病原微生物的抵御能力[3],马铃薯连作4 a后,健康植株根区土壤放线菌的数量及其拮抗潜势值均明显高于发病植株根区[4]。马铃薯间作玉米是国内外重要的间作种植模式[5]。据报道,马铃薯间作玉米能提高土壤放线菌的数量,具有缓解连作障碍的作用[6],然而对于马铃薯间作玉米田土壤放线菌的群落结构及组成却未见相关研究报道。
本研究采用传统微生物分离培养方法,分离培养马铃薯间作玉米系统根际土壤放线菌,对典型菌株进行分子鉴定和系统发育分析,以明确马铃薯间作玉米系统根际土壤放线菌群落结构及组成,为间作体系土壤放线菌的群落研究提供理论依据。同时,以小麦、烟草和水稻的主要病原真菌为研究对象,测定分离获得的放线菌株的拮抗活性,以筛选具有生物防治潜力的放线菌菌株,为控制小麦、烟草和水稻的主要病害提供新途径。
1材料与方法
1.1材 料
1.1.1试验设计及土样采集试验设在云南省宣威市板桥镇马铃薯种植区,N26°05′52.3″,E104°04′27.5″,海拔1 967 m。设置马铃薯单作种植、玉米单作种植、马铃薯玉米按照行比为2∶3模式间作种植3个处理,每处理3个小区,每小区270 m2,随机区组设计。马铃薯品种为‘宣薯2号’,玉米品种为‘会单4号’,马铃薯和玉米分别于2013-03-16和2013-03-31播种。玉米收获前1周,在各小区采用5点法取样,再用4分法采集作物根际土壤[7],将采集的土样装入无菌袋密封,带回实验室于4 ℃冰箱保存,备用。
1.1.2拮抗作用测定供试真菌小麦全蚀病菌[Gaeumannomycesgraminisrvar.graminis(Sacc.) Walker]、小麦根腐病菌[Cochliobolussativus(Ito et Kurib.) Drechsl.]、烟草赤星病菌[Alternariaalternata(Fr.) Keissl]、水稻稻瘟病菌[Magnaporthegrisea(Hebert)Barrnov.],均由云南农业大学植物保护学院云南省植物病理重点实验室提供。
1.1.3主要试剂 琼脂糖,基因科技(上海)有限公司;100 bpDNA Ladder和2×TaqPCR Mastermix,北京全式金生物技术有限公司;Goldview核酸染料,上海赛白百盛基因技术有限公司;引物Prime1:27f-AGAGTTTGATCCTGGCTCAG和引物Prime2:1492r-CGGTTACCTTGTTACGACTT,英潍捷基(上海)贸易有限公司;溶菌酶、蛋白酶K、酚-氯仿-异戊醇混合液[V(酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1]、1×TE,均按照文献[8]方法配制。
1.1.4培养基参照文献[9]方法配制纤维素酶筛选培养基,参照文献[10-11]方法配制高氏Ⅰ号培养基。
1.2方 法
1.2.1放线菌的分离及形态鉴定将采集回的土样于阴凉处放置6 d,自然风干后,取5 g土样溶于盛有45 mL无菌水的200 mL锥形瓶,摇床震荡30 min,配制成悬浮液,然后按10倍浓度梯度稀释成10-3、10-4的稀释液,运用平板涂布稀释法,取200 μL稀释液分别涂布于高氏1号培养基,每浓度梯度设置3个重复,倒置放于28 ℃培养箱培养7 d。根据菌落特征,挑取形态各异的菌株在高氏Ⅰ号平板培养基上纯化2~3次,运用斜面培养基于4 ℃冰箱保存。采用插片法进行形态观察,每个平板插4片,于盖玻片1/2处接种放线菌,培养7~10 d,经美蓝染色后在显微镜下观察拍照[10-11]。
1.2.2放线菌基因组DNA的提取将培养7 d的放线菌,用无菌打孔器(直径5 mm)打取2块菌饼,加入盛100 mL液体高氏Ⅰ培养基的250 mL锥形瓶, 28 ℃摇床振荡培养7 d,取1.5 mL菌液于EP管,12 000 r/min离心10 min,弃上清液。加入含20 g/L溶菌酶的1×TE 500 μL,37 ℃水浴1 h,每10 min震荡1次。然后加入50 μL SDS(200 g/mL)和5 μL蛋白酶K(20 g/L),37 ℃水浴1 h。 加入500 μL酚-氯仿-异戊醇混合液[V(酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1],4 ℃、12 000 r/min离心10 min,取上清液,重复2次。加1/10体积3 mol/L乙酸钠和500 μL异丙醇,4 ℃沉淀2 h以上。12 000 r/min离心15 min,去上清液,加φ=70%乙醇洗涤2次,风干,加50 μL 1×TE溶解DNA。取5 μL基因组DNA以琼脂糖电泳检测。
1.2.316S rRNA基因的扩增 16S rRNA基因PCR扩增反应体系:共50 μL,其中,引物27 f和1492 r各1 μL,PCR mix 25 μL,模板DNA 0.5 μL,ddH2O 22.5 μL。反应条件:94 ℃预变性5 min;94 ℃变性 1 min,59 ℃退火1 min,72 ℃ 延伸2 min,32个循环;72 ℃总延伸5 min。反应结束后取3 μL产物凝胶电泳检测。将已鉴定的PCR产物送中美泰和生物技术(北京)有限公司测序。
1.2.4分子鉴定及系统发育分析根据测序结果拼接序列,将拼接完整的16S rDNA 序列提交至网站EzTaxon server 2.1(http://147.47.212.35:8080/)[12]进行比对,查找相似性最高的典型菌株并下载其序列。运用MEGA6.06 软件,采用国际通用的邻接法和Kimura双参数矫正模型构建系统发育树。重复取样1 000次进行自展值分析,评估系统进化树拓扑结构的稳定性[13]。
1.2.5具纤维素酶活性菌株筛选放线菌用无菌接种环点接于纤维素酶筛选培养基中央,28 ℃生化培养箱培养7 d后取出观察其有无透明圈[9]。
1.2.6具拮抗真菌活性菌株的筛选运用对峙生长法测定放线菌的抑菌活性,将放线菌和供试真菌分别用高氏Ⅰ号培养基和PDA培养基培养7 d,然后用无菌打孔器(直径5 mm)取出直径为5 mm的菌饼, 对接于新鲜PDA培养基(供试真菌接于培养基中心,距供试真菌2 cm处的两边接放线菌),每处理重复3次,28 ℃培养箱培养5 d后,测定各处理组和对照组的菌落半径。各菌株抑菌率=1-处理半径/对照半径[14]。
2结果与分析
2.1土壤放线菌数量分析
分析不同种植模式农田每克土壤放线菌的数量可知,马铃薯单作、玉米单作和马铃薯间作玉米田土壤放线菌平均数量分别为3.702×106、4.681×106和5.197×106CFU/g,三者间无显著差异(F=1.145,P=0.326>0.05)。
2.2放线菌菌落的形态特征
根据放线菌菌落形态特征,从马铃薯间作玉米田、马铃薯单作田和玉米单作田供试土样的培养基中分别挑取42、35和39株菌,再根据菌株孢子丝形态和在高氏Ⅰ号培养基上的培养特征,去除重复菌株后,共得到44株菌,其中,挑取自马铃薯单作、玉米单作和马铃薯间作玉米田供试土样培养基的放线菌分别为11、16和17株,各菌株形态特征见表1。44株菌的孢子丝形态呈直线型、钩型、螺旋型、弯曲型、轮生柔曲和锯齿型等形状,其中菌株Y1-2/8为单孢子型。除J3-3/3可在高氏Ⅰ号培养基产生色素外,其他菌株在高氏Ⅰ号培养基均未产生水溶性色素。
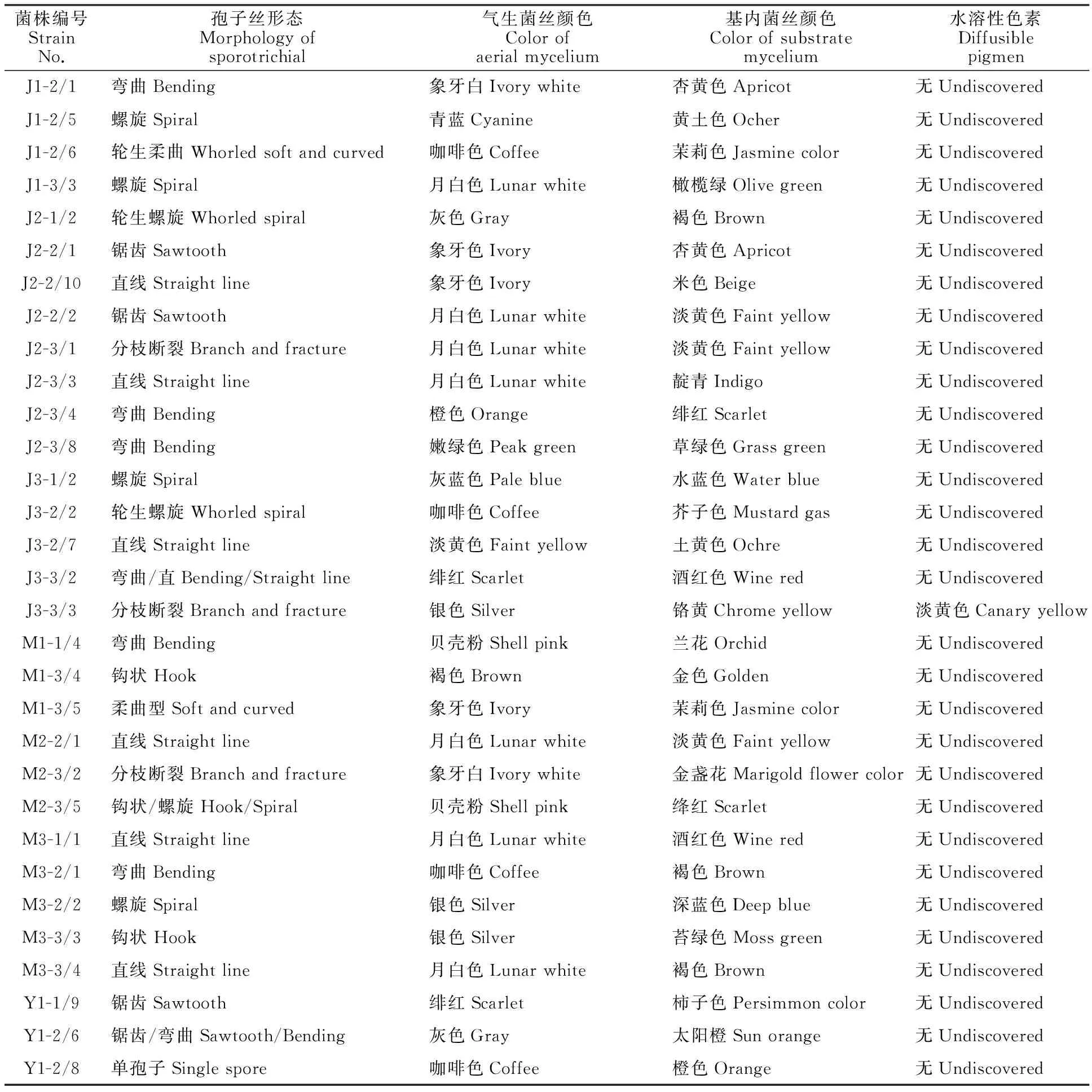
表1 不同处理田土壤放线菌菌株的形态特征
(续表1Continued table 1)

菌株编号StrainNo.孢子丝形态Morphologyofsporotrichial气生菌丝颜色Colorofaerialmycelium基内菌丝颜色Colorofsubstratemycelium水溶性色素DiffusiblepigmenY1-3/3直线Straightline月白色Lunarwhite杏黄色Apricot无UndiscoveredY1-3/4弯曲Bending月白色Lunarwhite象牙色Ivory无UndiscoveredY2-1/3螺旋Spiral灰色Gray茉莉色Jasminecolor无UndiscoveredY2-1/5螺旋Spiral褐色Brown杏黄色Apricot无UndiscoveredY2-2/1未见孢子丝Undiscovered褐色Brown卡基色Khaki无UndiscoveredY2-2/4锯齿Sawtooth橄榄绿Olivegreen深蓝色Deepblue无UndiscoveredY2-2/8螺旋Spiral月白色Lunarwhite蜂蜜色Honeycolor无UndiscoveredY2-3/3轮生螺旋Whorledspiral水泥灰Graycement咖啡色Coffee无UndiscoveredY2-3/6锯齿Sawtooth月白色Lunarwhite象牙白Ivorywhite无UndiscoveredY3-1/3直线/锯齿Straightline/Sawtooth月白色Lunarwhite茉莉色Jasminecolor无UndiscoveredY3-1/4直线Straightline象牙白Ivorywhite淡黄色Faintyellow无UndiscoveredY3-2/5直线/弯曲Straight/Bending象牙白Ivorywhite淡黄色Faintyellow无UndiscoveredY3-2/6轮生螺旋Whorledspiral银色Silver深褐Darkbrown无Undiscovered
2.3放线菌菌株的16S rDNA序列分析
经16S rDNA序列比对可知,马铃薯间作玉米田的17株放线菌均为链霉菌属,相似性为98.91%~100%,可能为链霉菌属的不同种。单作马铃薯田11株放线菌菌株也均为链霉菌,相似性为99.19%~100%,其中,菌株M2-2/1和M3-1/1与StreptomycesumbrinusNBRC 13091(T)的相似性分别为99.34%和99.42%,M1-3/5和M3-2/2与菌株StreptomycescoelescensDSM 40421(T)的相似分别为100%和99.92%。玉米单作田16株放线菌中有15株为链霉菌属,1株为小单孢菌属,其中,Y1-2/8与Micromonosporachokoriensis2-19/6(T)的相似性为99.71%,Y2-1/5和Y3-2/6与菌株Streptomycesdiastaticussubsp.ardesiacusNRRL B-1773(T)的相似性均为99.71%,Y3-1/4和Y3-2/5与StreptomycesrectiviolaceusNRRL B-16374(T)的相似性也均为99.78%(表2)。
2.4放线菌菌株的纤维素酶活性
纤维素酶活性测定结果表明,间作田具纤维素酶活性的菌株占间作田总菌株数的41.17%,马铃薯单作田具纤维素酶活性的菌株占马铃薯单作田总菌株数的27.27%,玉米单作田具纤维素酶活性的菌株占玉米单作田总菌株的25.00%。由透明圈直径大小可知(表3),菌株J1-2/1、J1-2/5、J1-2/6、Y2-3/3、M3-2/1、M1-1/4透明圈直径均大于3 cm,其中菌株Y2-3/3的抑菌圈直径最大,达3.5 cm。
2.5放线菌菌株的拮抗真菌活性
放线菌菌株的拮抗真菌活性测定结果表明,间作田17株菌株中有5株菌具有抑菌活性,占间作田总菌株数的29.42%;马铃薯单作田共有3株菌具抑菌活性,占马铃薯单作田总菌株数的27.27%;玉米单作田共有6株菌具抑菌活性,占玉米单作田总菌株数的37.50%。间作田具抑菌活性的5株菌中,J2-3/4和J2-2/2抑菌效果较好;J2-2/2仅对稻瘟病菌有抑菌活性,抑菌率为68.90%;J2-3/4对小麦全蚀病菌、小麦根腐病菌、烟草赤星病菌、水稻稻瘟病菌的抑菌效果均较好,其中,对小麦根腐病菌抑菌效果最强,抑菌率达75.70%,对稻瘟病抑菌效果次之,抑菌率为72.94%。马铃薯单作田仅菌株M3-3/4的抑菌效果较好,对稻瘟病菌的抑菌率为60.50%。玉米单作田抑菌活性较好的菌株有Y2-2/1、Y2-2/4、Y2-3/3、Y3-1/4和Y3-2/5,其中, Y2-2/1和Y3-2/5对小麦全蚀病菌、小麦根腐病菌、烟草赤星病菌、水稻稻瘟病菌均有抑菌活性;Y2-3/3仅对小麦根腐病菌有抑菌活性,抑菌率为59.91%;Y2-2/4对小麦根腐病菌和小麦全蚀病菌有抑菌活性,抑菌率分别为59.09%和60.71%;Y3-1/4除对烟草赤星病菌无活性外,对小麦全蚀病菌、小麦根腐病菌和水稻稻瘟病均具抑菌活性。抑菌活性较好菌株的抑菌率见表4。综上所述,菌株J2-3/4对植物病原真菌的抑菌效果最好,具有植物病害生物防治放线菌资源菌株开发的潜在价值。

表2 不同种植模式田土壤放线菌与数据库典型菌株的相似性

表3 放线菌菌株的纤维素酶活性
注:数据为“平均值±标准差”。下同。
Note:Data in table is “mean±standard deviation”.The same as below.
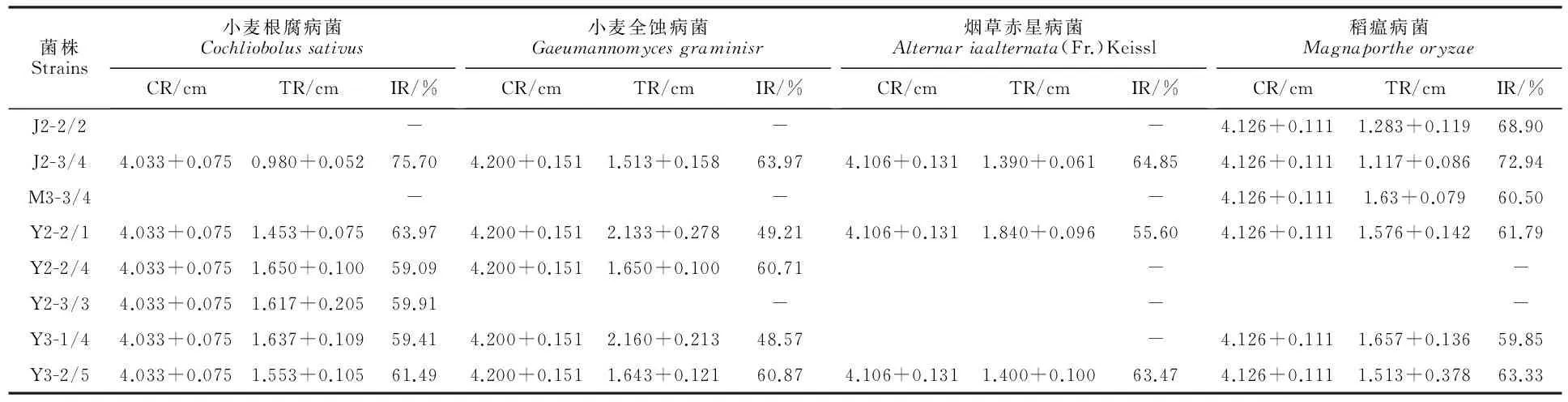
表4 拮抗真菌菌株筛选结果
注:CR代表对照组菌落半径;TR代表处理组菌落半径;IR代表抑菌率;“-”表示无活性。
Note:CR:Control experiments of colony radius; TR:Treatment experiments of colony radius; IR:Inhibition rates of mycelium growth; “-”:Mmean no inhibition effects.
2.6系统发育分析
对抑菌效果较好的菌株进行系统发育分析(图1),结果显示,系统树共分为4大支,菌株M3-3/4、Y3-1/4、Y3-2/5和Y2-2/2聚为一大支,其下又分2小支,M3-3/4与StreptomycesglomeroaurantiacusNBRC 15418(T)(球团橙色链霉菌)和StreptomycesaurantiacusNBRC 13017(T)(桔橙链霉菌)聚为一支,说明这3株菌间系统发育关系较近。Y3-1/4、Y3-2/5和Y2-2/1与典型菌株StreptomycesrectiviolaceusNRRL B-16374(T)(直丝紫链霉菌)聚在一大支,表明这4株放线菌的亲缘关系较近;J2-2/2和StreptomycessindenensisNBRC 3399(T)(仙台链霉菌)和StreptomycesglobisporusNBRC 12867(T)(球孢链霉菌)等菌株聚为一支;菌株J2-3/4和菌株Y2-3/3聚在一大支,其下又分为2小支,J2-3/4和StreptomycesspectabilisNBRC 13424(T)(壮观链霉菌)菌株聚为一小支。Y2-3/3和StreptomyceserythrogriseusLMG 19406(T)(暗红灰链霉菌)等菌株聚为一小支。
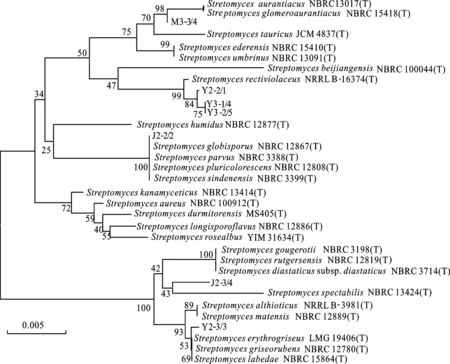
图1 基于16S rDNA序列信息构建的系统发育树
3讨 论
分离培养鉴定结果显示,马铃薯间作玉米田土壤微生物的平均数量达5.197×106CFU/g,略高于马铃薯单作田(3.702×106CFU/g)和玉米单作田(4.681×106CFU/g),但差异未到达显著水平(F=1.145,P=0.326),表明间作种植在一定程度上能提高土壤中放线菌的数量,这与汪春明等[6]的研究结果一致。另外,从挑取的典型菌株鉴定结果来看,无论是马铃薯单作田、玉米单作田,还是马铃薯间作玉米田,其链霉菌属均为绝对优势种群,这与烟田[15]和樱桃园[16]等农田生态系统土壤放线菌群落结构相似。但本研究仅采用高氏Ⅰ号培养基,不能分离出一些对营养有特殊要求的菌株。因此,若要全面剖析可培养放线菌的群落结构,应结合多种分离培养基进行分离鉴定。
纤维素分解菌在大气碳素循环中有重要作用,其分布与土壤性状、肥力有密切关系。因此,土壤中分解纤维素微生物的存在和数量与土壤的肥力、土壤健康程度均有重要关系。同时,分解纤维素强度的大小也是表征土壤微生物量和土壤肥力的一项重要指标[17]。本研究关于纤维素酶活性放线菌的筛选结果表明,间作田具有纤维素酶活性的放线菌菌株的比例(41.17% )明显高于马铃薯单作田(27.27%)和玉米单作田(25.00%),表明间作种植模式可有效增加土壤中分解纤维素的放线菌的数量,这可能也是间作种植提高土壤养分利用率的原因之一。
拮抗植物病原真菌菌株筛选的结果表明,菌株J2-3/4对小麦根腐病菌、小麦全蚀病菌、烟草赤星病菌和稻瘟病菌均具较好的抑菌活性,并且对小麦根腐病菌、稻瘟病菌的抑菌率达70%以上。因此,菌株J2-3/4可用于小麦根腐病菌、稻瘟病生物防治菌株的开发。同时,马铃薯间作玉米田具拮抗活性菌株的比例与马铃薯单作田和玉米单作田间均无明显差异,说明马铃薯间作玉米种植可能对土壤中有益拮抗放线菌的含量无明显影响,但本研究采用的供试病原菌株不是马铃薯和玉米的致病菌,因此,不同种植模式土壤放线菌对玉米和马铃薯病原菌的抑菌效果,还有待深入研究。
对不同种植模式田土壤中放线菌的16S rDNA序列比对和系统发育分析结果表明,J2-3/4菌株与壮观链霉菌StreptomycesspectabilisNBRC 13424(T)的亲缘关系较近,而且形态特征也很相近。因此,J2-3/4可能为壮观链霉菌。据报道,J2-3/4菌株能产生许多抗生素,如大观霉素、曲张链菌素、硝苯吡喃酮、巴佛洛霉素、间环丙菌素、壮观霉素和壮观链菌素等,具有抗菌、抗病毒、抗肿瘤、杀虫、除草等活性[18-19]。而本研究发现,J2-3/4菌株对供试小麦全蚀病菌、小麦根腐病菌、烟草赤星病菌、水稻稻瘟病菌均具有明显的抑制作用,然而对于其拮抗真菌活性物质、杀虫活性等还需进一步研究。
参考文献Reference:
[1]WANG M CH,LIU Y H,WANG Q,etal.Impacts of methamidophos on the biochemical,catabolic,and genetic characteristics of soil microbial communities[J].SoilBiologyandBiochemistry,2008,40(3):778-788.
[2]张鸿雁,薛泉宏,唐明,等.不同种植年限人参地土壤放线菌生态研究[J].西北农林科技大学学报(自然科学版),2011,32(8):151-159.
ZHANG H Y,XUE Q H,TANG M,etal.Study on actinomycetic ecology in soil with the different cultivating years of ginseng [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2011,32(8):151-159(in Chinese with English abstract).
[3]董艳,董坤,汤利,等.小麦蚕豆间作对蚕豆根际微生物群落功能多样性的影响及其与蚕豆枯萎病发生的关系[J].生态学报,2013,33(23):7445-7454.
DONG Y,DONG K,TANG L,etal.Relationship between rhizosphere microbial community functional diversity and faba bean fusarium wilt occurrence in wheat and faba bean intercropping system[J].ActaEcologicaSinica,2013,33(23):7445-7454(in Chinese with English abstract).
[4]陈杰,郭天文,谭雪莲,等.马铃薯连作地健康株与病株根区土壤微生态特性比较[J].作物学报,2013,39(11):2055-2064.
CHEN J,GUO T W,TAN X L,etal.Comparison of microecological characterization in rhizosphere soil between healthy and diseased plants in continuous cropping potato fields[J].ActaAgronomicaSinica,2013,39(11):2055-2064(in Chinese with English abstract).
[5]吴开贤,安瞳昕,范志伟,等.玉米与马铃薯的间作优势和种间关系对氮投入的响应[J].植物营养与肥料学报,2012,18(4):1006-1012.
WU K X,AN T X,FAN ZH W,etal.Effects of nitrogen input on yields advantage and interaction of the maize and potato intercropping[J].PlantNutritionandFertilizerScience,2012,18(4):1006-1012(in Chinese with English abstract).
[6]汪春明,马琨,代晓华,等.间作栽培对连作马铃薯根际土壤微生物区系的影响[J].生态与农村环境学报,2013,29(6):711-716.
WANG CH M,MA K,DAI X H,etal.Effect of intercropping on soil microflora in rhizosphere soil of potato under continuous cropping[J].JournalofEcologyandRuralEnvironment,2013,29(6):711-716(in Chinese with English abstract).
[7]程丽娟,薛泉宏.微生物学实验技术[M].北京:科学出版社,2012:54-57.
CHENG L J,XUE Q H.Laboratory Manual of Microbiology[M].Beijing:Science Press,2012:54-57(in Chinese).
[8]萨姆布鲁克,D W 拉塞尔.分子克隆实验指南[M].北京:科学出版社,2002
SAMBROOK J,RUSSELL D W.Molecular Cloning,a Laboratory Manual[M].Beijing:Science Press,2002(in Chinese).
[9]阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011:72-77.
RUAN J SH,HUANG Y .Fast Identification and Systematic Classfication on Actinomycetes[M].Beijing:Science Press,2011:72-77(in Chinese).
[10]周德庆.微生物学实验教程[M].北京:高等教育出版社,2006:275-276.
ZHOU D Q.Microbiology Experiment Course[M].Beijing:Higher Education Press,2006:275-276(in Chinese).
[11]黄秀梨,辛明秀.微生物学实验指导[M].北京:高等教育出版社,2008:31-32.
HUANG X L,XIN M X.Microbiology Experiment Guidance[M].Beijing:Higher Education Press,2008:31-32(in Chinese).
[12]CHUN J,LEE J H,JUNG Y,etal.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].InternationalJournalofSystematicandEvolutionaryMicrobiology,2007,57(10):2259-226.
[13]关统伟,吴晋元,唐蜀昆,等.新疆塔里木盆地可培养嗜盐放线菌系统发育多样性[J].微生物学通报,2008,35(11):1698-1702.
GUAN T W,WU J Y,TANG SH K,etal.Phylogenetic diversity of halophilic actinomycetes from hypersaline environments in tarim basin of Xinjiang,China[J].Microbiology,2008,35(11):1698-1702(in Chinese with English abstract).
[14]陈双臣,刘爱荣,郑继亮,等.放线菌对番茄灰霉病和早疫病的拮抗作用研究[J].北方园艺,2008(9):171-173.
CHEN SH CH,LIU A R,ZHENG J L,etal.Antagonism effect of actinomycetes against tomato grey mould and early blight[J].NorthernHorticulture,2008(9):171-173(in Chinese with English abstract).
[15]李小林,赵克伟,张波,等.四川盐边植烟土壤放线菌的遗传多样性及抗菌活性[J].应用与环境生物学报,2014,20(2):192-197.
LI X L,ZHAO K W,ZHANG B,etal.Genetic diversity and antibiotic activity of actinomycetes from tobacco soils in Yanbian,Sichuan[J].ChineseJournalofAppliedandEnvironmentalBiology,2014,20(2):192-197(in Chinese with English abstract).
[16]刘灵芝,秦嗣军,吕德国,等.樱桃园土壤优势放线菌的分离及其促长功能研究[J].中国农业科学,2013,46(6):1221-1229.
LIU L ZH,QIN S J,LÜ D G,etal.Isolation of dominant actinomycetes from cherry orchard soil and their functions in bio-control and plant promotion[J].ScientiaAgriculturaSinica,2013,46(6):1221-1229(in Chinese with English abstract).
[17]张丽华,黄高宝,张仁陟.免耕及覆盖对土壤纤维素分解强度和纤维素分解菌的影响[J].草原与草坪,2007(1):5-8.
ZHANG L H,HUANG G B,ZHANG R ZH.Effects of cover and no-tillage on soil cellulose-decomposing bacterium population and cellulose decomposition intensity[J].GrasslandandTurf,2007(1):5-8(in Chinese with English abstract).
[18]万中义,李万德,张丽,等.放线菌 Wa-13868 的分类鉴定及其代谢产物的研究[J].湖北农业科学,2009,48(5):1136-1138.
WAN ZH Y,LI W D,ZHANG L,etal.Classification and identification of an actinomyces Wa-13868 and study on its metabolite[J].HubeiAgriculturalSciences,2009,48(5):1136-1138(in Chinese with English abstract).
[19]金燕华,裘娟萍,何景昌.壮观链霉菌产生抗生素的多样性[J].中国医药工业杂志,2006,37(12):849-855.
JIN Y H,QIU J P,HE J CH.Diversity of antibiotics fromStreptomycesspectabilis[J].ChineseJournalofPharmaceuticals,2006,37(12):849-855(in Chinese with English abstract).
Received 2015-09-13Returned2015-12-20
First authorZHENG Yaqiang,male,master student.Research area:agrobiodiversity and pest management.E-mail:736364746@qq.com
XIAO Guanli,female,Ph.D,professor.Research area:crops cultivation and plant physiology.E-mail: glxiao9@163.com
(责任编辑:郭柏寿Responsible editor:GUO Baishou)
Diversity of Actinomycetes in Rhizosphere Soil of Potato Intercropping Maize System and Antagonistic Activity against Plant Pathogenic Fungi
ZHENG Yaqiang1,CHEN Bin1,SONG Peiyong3,LI Zhengyue1and XIAO Guanli2
(1.Yunnan Microbial Fermentation Engineering Research Center,College of Plant Protection,Yunnan Agricultural University,Kunming650201,China; 2.College of Agronomy and Biotechnology,Yunnan Agricultural University,Kunming650201,China;3.School of Life Science,Zunyi Normal College,Zunyi Guizhou563002,China)
AbstractTo study the community structure of soil actinomycetes strains in the potato intercroping maize system,the soil actinomycetes in the monocropped potato ,potato intercropped with maize,as well as monocrop maize plots were isolated and cultured using microbial isolation and culture technique.The 16S rDNA sequences of different strains from each treatment were analyzed,the cellulose activity against plant pathogenic fungi strains were screened.The results showed that the 17 strains of soil actinomycetes from the intercropping system of potato intercroping with maize belonged to Streptomyces,the 11 strains actinomycetes from monocropped soil of potato field belonged to Streptomyces,15 of the 16 strains of soil actinomycetes from soil of monocropped maize field belonged to Streptomyces and the one strain belonged to Micromonospora.The cellulase production strains from the intercropped potato and intercropped maize,monocropped potato and monocropped maize filed accounted for 41.17%,27.27% and 25.00% of each treatment strains,respectively.The strain J2-3/4 showed a good bacteriostasis effect,and its inhibitory rate for Cochliobolus sativus,Gaeumannomyces graminisr,Alternar iaalternata and Magnaporthe oryzae was 75.70%,63.97%,64.85% and 72.94%,respectively.The results showed that the community structure of soil actinomycetes was singular in field soils under different treatments,Streptomyces was the predominant species.The strain J2-3/4 as a biological control fungus resource has a potential value for the biological control of crops fungal diseases.
Key wordsPotato; Maize; Intercropping ; Soil actinomycetes; Antimicrobial activity
收稿日期:2015-09-13修回日期:2015-12-20
基金项目:国家重点基础研究发展计划(973计划)(2011CB100404);云南省政府特色农业产业专项(云财农[2013]364号);云南省教育厅科学研究基金重大专项(ZD 2015006)。
通信作者:陈斌,男,博士,教授,主要从事农业昆虫与害虫综合治理教学与科研工作。 E-mail:chbins@163.com
中图分类号S154.3
文献标志码A
文章编号1004-1389(2016)06-0912-09
Foundation itemKey Project of Chinese National Programs for Fundamental Research and Development (973 Program) of China (No.2011CB100404); Special Agricultural Industry Project of Yunnan Province Government (Yunnan Finance and Agriculture[2013] No.364); The Key Special Science and Technology Project of Education Department of Yunnan Province (No.ZD 2015006). CHEN Bin,male,Ph.D,professor.Research area:agricultural entomology and pest management.E-mail:chbins@163.com
网络出版日期:2016-06-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160601.0919.036.html
第一作者:郑亚强,男,硕士研究生,研究方向为昆虫农业生物多样性与害虫综合防治。E-mail:736364746@qq.com
肖关丽,女,博士,教授,主要从事作物栽培与植物生理教学与科研工作。E-mail:glxiao9@163.com

