术前甲胎蛋白水平在热消融治疗肝细胞癌中的预后价值
王昔明 刘建伟 雷正清 李俊 夏勇 沈锋
·论 著·(肝脏疾病微创治疗)
术前甲胎蛋白水平在热消融治疗肝细胞癌中的预后价值
王昔明 刘建伟 雷正清 李俊 夏勇 沈锋
目的 探索术前甲胎蛋白(AFP)水平在热消融治疗肝细胞癌(HCC)病人中的预后价值。方法 回顾性分析临床诊断为HCC病人305例,均为单发直径<3 cm肿瘤,109例接受射频治疗,196例接受微波治疗,比较两组病人的远期疗效并统计分析病人的预后影响因素。结果 AFP≥400 μg/L组和AFP<400 μg/L组病人1、3、5累积生存率分别为83.6%、66.9%、49.8%和96.2%、90.0%、74.7%(P=0.001),1、3、5累积复发率分别为36.3%、61.2%、75.2%和17.6%、38.9%、59.0%(P=0.003)。COX多因素分析中,AFP≥400 μg/L是影响术后生存和复发的独立危险因素。射频组和微波组1、3、5年累积生存率分别为91.7%、79.5%、65.8%和94.8%、82.4%、69.4%(P=0.211)。1、3、5年复发率分别为24.1%、50.6%、61.1%和21.4%、40.1%、59.7%(P=0.424)。结论 AFP≥400 μg与肝癌预后的生存和复发密切相关,可作为早期肝癌病人术后预后的指标。早期肝癌射频和微波消融远期疗效无明显差异。
肝细胞癌;甲胎蛋白; 射频消融;微波消融
肝细胞癌(hepatocellular carcinoma, HCC)是世界范围内第五大常见的恶性肿瘤。手术治疗被认为是首选治疗方式,但只有约10%~20%的病人有机会接受肝移植和根治性手术治疗[1-3]。目前以射频消融和微波消融为代表的局部消融治疗方法已发展成为继手术切除、肝动脉栓塞化疗之后又一常用的肝癌治疗方法[4-5]。欧洲肝病学会(BCLC)、美国肝病学会(AASLD)和亚太肝病学会(APASL)已经将手术切除、肝脏移植和射频消融治疗同列为直径≤3 cm肝癌的根治性治疗方法[6]。但高复发率仍是影响肝癌病人热消融疗效的主要原因。如果能较为准确地预测哪类病人更易复发,就能更好地行个体化治疗干预较差的预后。目前,比较广为接受的肿瘤标志物是甲胎蛋白(AFP),75%的HCC病人APF血清学水平大于10 μg/L[7-9]。AFP血清浓度不仅可作为诊断的肿瘤标志物,还被视为预测肝癌切除术后复发和转移的重要指标[10]。本研究拟通过回顾性研究早期单发≤3 cm肝细胞癌病人热消融术后生存和复发的相关危险因素,通过消融方式对病人分组,从而探讨术前AFP血清浓度作为预测术后生存和复发的价值。
资料与方法
一、病例收集
收集2003年6月至2012年6月于上海东方肝胆外科医院行射频和微波消融治疗肝细胞癌病人。入组标准:①临床诊断为肝细胞癌;②无肝外转移及大体门静脉癌栓;③未接受保肝药物之外的其他抗肿瘤治疗;④单发结节且肿瘤直径≤3 cm;⑤肝功能Child-Pugh分级A级或B级。排除标准:①术前肿瘤远处转移;②心、肺功能差不能耐受手术者;③随访资料不全;④肝功能Child-Pugh C级;所有治疗均经病人和家属同意,并签署知情同意书。诊断参照的EASL(European Association for the Study of the Liver)肝癌临床诊断标准直径1~3 cm的肝内结节符合以下情况:①两种影像学检查(多排CT和MRI)均符合肝细胞癌典型表现;②一种影像学检查(多排CT或MRI)符合肝细胞癌典型表现,同时血清AFP≥400 μg/L[11]。
二、治疗仪器
射频仪器为美国威力公司Cool-Tip RF射频仪,穿刺针长20 cm,裸露端2~3 cm,微波仪器为南京康友KY2000微波治疗仪,微波频率为(2450±50) MHz,输出功率为10~100 W,工作模式为连续工作模式。穿刺针为水冷式循环低杆温18 G微波针,长180 mm,外径1.9 mm,前极长11 mm,引导超声为开立S20超声治疗仪,频率为2~15 MHz。
三、手术过程
术前检查包括血常规、凝血功能、肝肾功能、胸部X线检查和心电图检查。治疗前1 d进行肿瘤B超定位。
1.射频组 麻醉采取(2%利多卡因)局部麻醉,消融范围包括肿瘤组织和周围0.5~1.0 cm肝组织,在B超引导下,尽量避开膈顶、大血管、胃肠管、胆管和胆囊,将射频针插入肿瘤中心,根据肿瘤大小设定时间,开启射频仪器,至肿瘤区域在B超上显示被强回声所覆盖,拔出射频针,手术结束,病人生命体征平稳后送回病房。术后48 h内行复查增强CT,并与术前CT/MRI对比检查治疗疗效。
2.微波组 麻醉采取(2%利多卡因)局部麻醉,消融范围包括肿瘤组织和周围0.5~1.0 cm的肝组织,在B超引导下,尽量避开膈顶、大血管、胃肠管、胆管和胆囊,将微波针插入肿瘤中心,微波治疗仪功率设定为80~100 W,根据肿瘤大小设定时间,开启微波治疗仪,至设定时间结束。B超下见肿瘤区域完全被高回声覆盖,拔出微波针。手术结束,病人生命体征平稳后送回病房。术后48 h内复查增强CT,并与术前CT/MRI对比检查治疗疗效。
四、随访
入组病人在治疗后6周行肝脏增强CT或MRI检查,了解完全消融及早期复发情况。治疗后病人定期随访,第一年每1.5个月复查,第二年每3个月复查,3年后每6个月复查。复查项目包括肝功能、AFP,以及增强CT或MRI。
五、疗效评价及观察项目
病人出院后定期随访,总体生存和肿瘤复发是主要的研究终点,总体生存的计算是从术后到死亡或者最后一次随访,肿瘤复发是从手术到术后第一次诊断复发或转移。
六、统计学方法
结 果
一、临床一般情况
收集2003年6月至2012年6月于上海东方肝胆外科医院行射频和微波消融治疗肝细胞癌病人305例。其中男性235例,女性70例,男女比例3.36∶1,中位年龄56岁。糖尿病病人50例 (16.39%)。肝脏基础疾病包括乙型肝炎病毒携带者288例(94.43%)、乙型肝炎病毒DNA载量>104U/ml88例(28.85%)、肝硬化206例 (67.64%)。根据Child-Pugh分级A级295例(96.72%)、B级10例 (3.28%)。肿瘤平均直径2.0 cm,均为单发肿瘤。AFP≥400 μg/L病人67例,AFP<400 μg/L病人238例。术前接受抗病毒治疗病人60例 (19.67%)。接受射频治疗109例,微波治疗196例。
二、生存和复发的影响因素分析
多因素分析结果显示:肝硬化(P=0.042)、AFP≥400 μg/L(P=0.005)是影响术后累积生存率的独立危险因素(表1)。白蛋白低(P=0.006)、凝血酶原时间长(P=0.048)、AFP≥400 μg/L(P=0.029)是影响术后累积复发率的独立危险因素(表2)。射频组平均生存时间(66.0±2.9)个月,微波组平均生存时间(69.6±3.0)个月。射频组和微波组1、3、5年累积生存率分别为91.7%、79.5%、65.8%和94.8%、82.4%、69.4%(P=0.211,图 1A)。射频组平均复发时间(43.9±3.1)个月,微波组平均复发时间(46.8±2.8)个月。射频组和微波组1、3、5年复发率分别为24.1%、50.6%、61.1%和21.4%、40.1%、59.7%(P=0.424,图1B)。
三、AFP≥400 μg/L和AFP<400 μg/L组的累积生存率和复发率比较
305例病人平均生存时间(68.5±1.9)个月,分为AFP≥400 μg/L组67例,AFP<400 μg/L组238例。AFP≥400 μg/L组平均生存时间(57.6±4.3)个月,1、3、5年累积生存率为83.6%、66.9%、49.8%。AFP<400 μg/L组平均生存时间(71.2±2.0)个月,1、3、5年累积生存率为96.2%、90.0%、74.7%(P=0.001,图 2A)。平均复发时间(46.5±1.9)个月,AFP≥400 μg/L组平均复发时间(36.4±4.0)个月,AFP<400 μg/L组平均复发时间(48.6±2.0)个月。AFP≥400 μg/L组1、3、5年累积复发率为36.3%、61.2%、75.2%。AFP<400 μg/L组1、3、5年累积复发率为17.6%、38.9%、59.0%(P=0.003,图2B)。
四、射频组中AFP≥400 μg/L和AFP<400 μg/L分层对生存和复发的影响
109例病人平均生存时间(66.0±2.9)个月,分为AFP≥400 μg/L组29例,AFP<400 μg/L组80例。AFP≥400 μg/L组平均生存时间(52.4±6.6)个月,1、3、5年累积生存率为79.3%、58.6%、45.5%。AFP<400 μg/L组平均生存时间(70.9±3.1)个月,1、3、5年累积生存率为95.0%、85.9%、70.6%(P=0.008,图 3A)。平均复发时间(43.9±3.1)个月,AFP≥400 μg/L组平均复发时间(36.4±4.0)个月,AFP<400 μg/L组平均复发时间(48.6±2.0)个月(P=0.049,图3B)。
五、微波组中AFP≥400 μg/L和AFP<400 μg/L分层对生存和复发的影响
196例病人平均生存时间(69.6±3.0)个月,分为AFP≥400 μg/L组38例,AFP<400 μg/L组158例。AFP≥400 μg/L组平均生存时间(61.0±5.7)个月,1、3、5年累积生存率为86.8%、70.5%、50.9%。AFP<400 μg/L组平均生存时间(72.1±3.2)个月,1、3、5年累积生存率为96.2%、84.6%、67.9%(P=0.031,图4A)。平均复发时间(46.8±2.8)个月,AFP≥400 μg/L组平均复发时间(37.5±5.1)个月,AFP<400 μg/L组平均复发时间(42.9±1.9)个月。AFP≥400 μg/L组1、3、5年累积复发率为36.8%、55.3%、79.7%。AFP<400 μg/L组1、3、5年累积复发率为17.1%、36.3%、57.5%(P=0.036,图4B)
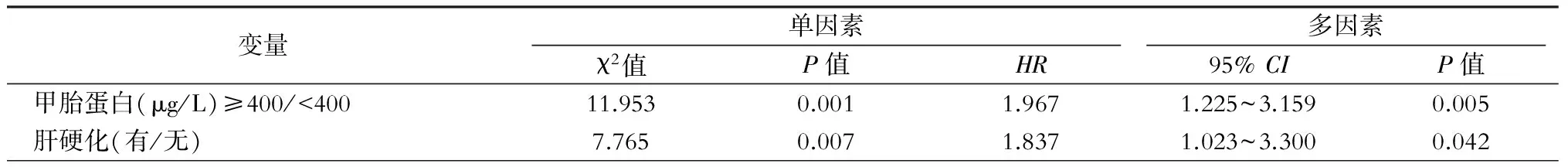
表1 累积生存率相关因素分析
注:Log-rank检验行单因素分析,Cox比例危险模式(Wald检验)行多因素分析
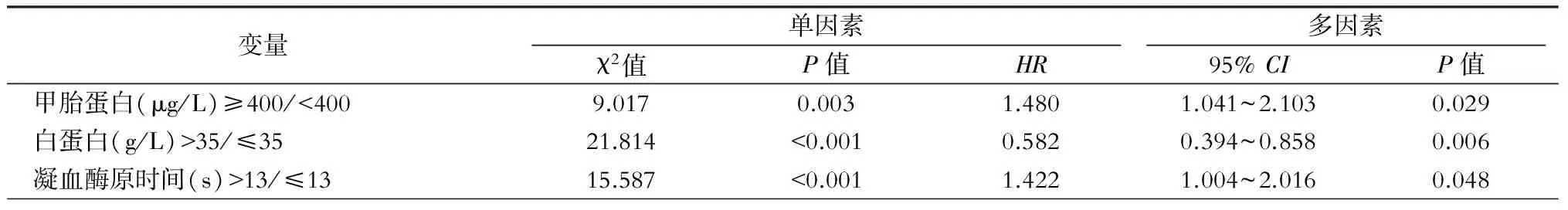
表2 累积复发率相关因素分析
注:Log-rank检验行单因素分析,Cox比例危险模式(Wald检验)行多因素分析
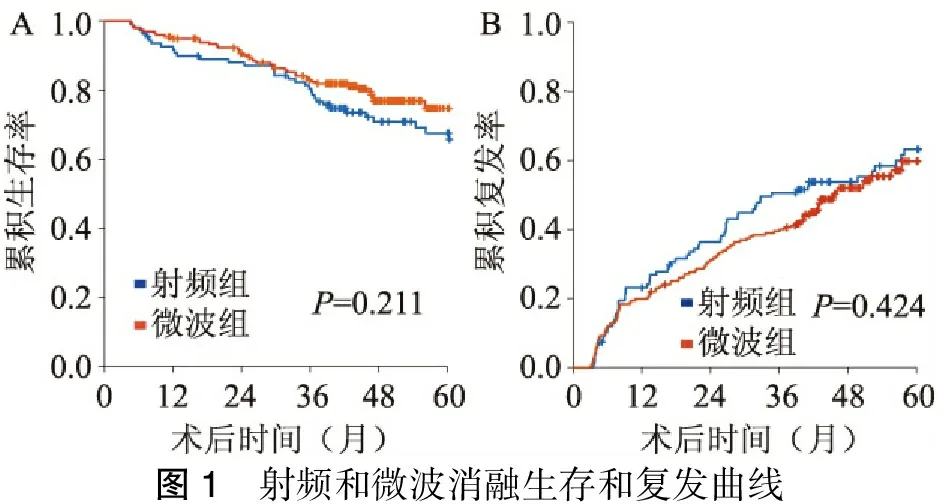
图1 射频和微波消融生存和复发曲线
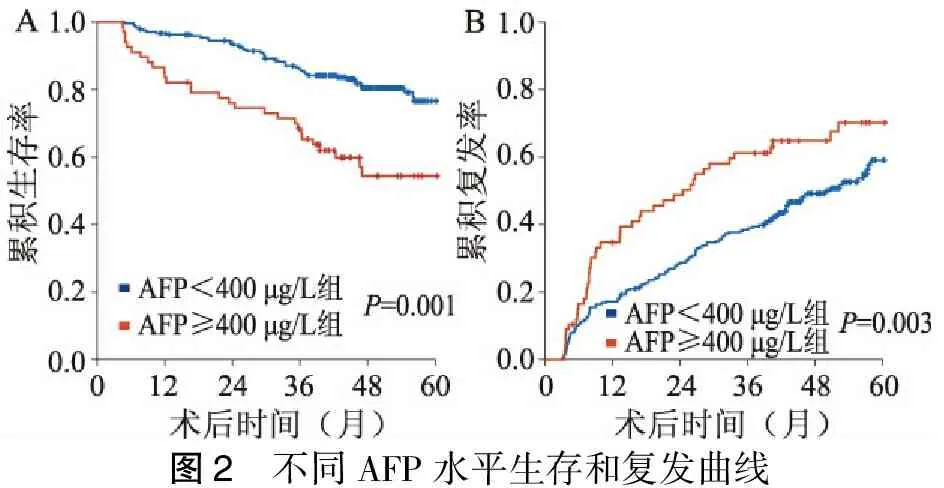
图2 不同AFP水平生存和复发曲线
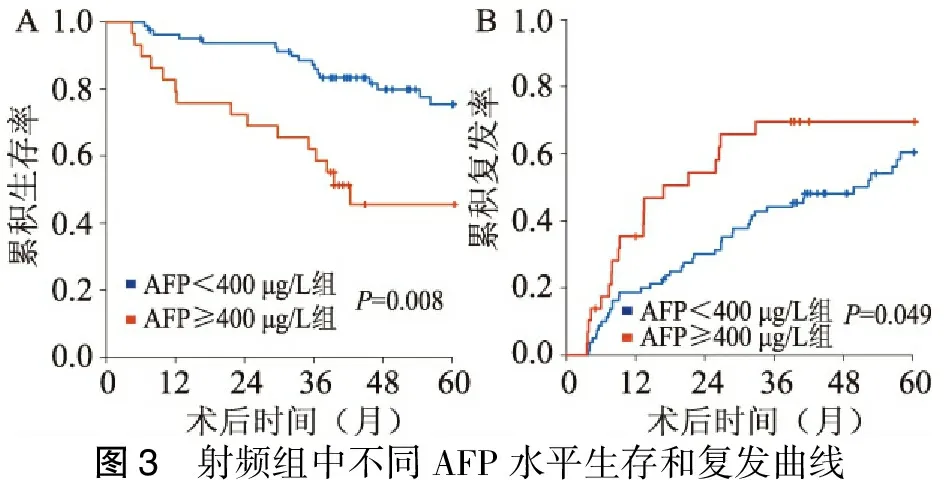
图3 射频组中不同AFP水平生存和复发曲线
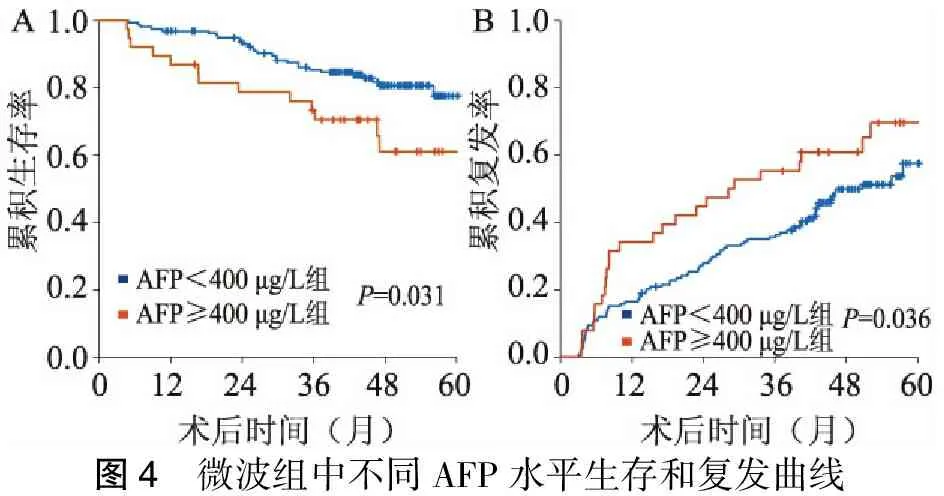
图4 微波组中不同AFP水平生存和复发曲线
讨 论
临床研究表明,肝癌病人确诊时病期越早,预后越理想,早期肝癌的预后明显优于中晚期肝癌。手术切除一直被认为是早期肝癌的首选治疗方式,随着技术的发展,研究发现消融治疗早期肝癌可以获得手术切除相似的效果,且具有手术创伤小、并发症少、住院时间短等优势[12-14]。2009年,刘允怡等[2]采用Meta 分析分析了44 个射频治疗肝癌的研究报告,认为在直径≤3.0 cm肝癌中,射频消融治疗的疗效与手术切除相似。肝癌射频和微波消融治疗的高完全消融率(>90%)与高复发率的矛盾仍然存在。肝癌病人的远期疗效固然与治疗手段有关,但与肿瘤分期和病理分级、病人的肝功能储备和自身细胞免疫状况关系可能更为密切。因为热消融病人缺少术后病理证实,所以究竟哪类消融病人更易复发,预后较差,目前还缺乏合理和具有说服力的评价标准。
临床实践表明,热消融术治疗肝癌的疗效三大因素的影响:一是肿瘤自身的解剖病理因素,如大小、位置、血供、病理分化程度等;二是手术操作的因素,如射频消融范围、术者操作水平等;三是病人自身的细胞免疫水平;在微波消融和手术切除的病例对照研究中,平均最大消融直径为5.5 cm,因为消融直径一般超过瘤体1 cm,故肿瘤>3 cm时,微波完全消融率明显下降[15]。多篇文章报道射频消融病人肿瘤直径>3 cm和多发肿瘤其复发率明显增高,累积生存率明显降低,这可能归因于直径较大和多发肿瘤恶性程度高和较差的完全消融率[16-17]。研究显示,随着肿瘤直径的增大,射频完全消融率急速下降,肿瘤直径<3.0 cm时完全消融率≥90%,介于3.1~5.0 cm时完全消融率71.0%,而对于直径超过5.0 cm的肿瘤完全消融率只有25.0%[4]。为保证在高完全消融率下讨论AFP血清学水平对预后的影响及两种消融方法的远期疗效,我们选择直径≤3 cm的单发肿瘤病人入组。
相较射频治疗,微波消融技术具有产热快、瘤内温度高、消融时间短且消融范围大、受碳化血流影响小、不受阻抗影响和更少的术中疼痛[18-20]。以往文章报道射频组1、2、3、4年无瘤生存率为80.3%、61.8%、39.5%、19.0%,微波组1、2、3、4年无瘤生存率为75.0%、59.4%、32.1%、16.1% (P=0.376)。 射频组1、2、3、4年累积生存率为98.7%、92.3%、82.7%、77.8%,微波组1、2、3、4年累积生存率为98.0%、90.7%、77.6%、77.6%(P=0.729)[21]。Lu等[22]在一项微波和射频消融治疗肝细胞癌病人的对照研究中报道病人1、2、3年无瘤生存率和1、2、3、4年累积生存率差异无统计学意义。在本研究中,射频和微波消融的1、3、5年累积生存率和复发率差异无统计学意义,与以往研究结果相符。我们认为虽然射频和微波在成热原理、热场分布等方面存在若干差异,但尚不能说明这些差异具有临床显著性意义。就目前研究而言,可以认为射频和微波的治疗效果基本类似。
AFP是胎儿肝细胞和卵黄囊产生的一种特殊糖蛋白,成年人由于肝癌细胞的幼稚化及无休止生长,其合成甲胎蛋白的能力得到恢复,是临床上广泛接受和应用的肝癌肿瘤标志物之一[23]。较高的血清AFP浓度往往意味着有较大的肿瘤、弥散性肿瘤、门静脉癌栓的可能,AFP水平是一个重要的预测肝癌切除术后复发和预后的因素[24-25]。既往文献报道肝癌病人AFP≥400 μg/L肝癌切除术后结合经导管肝动脉化疗栓塞术(TACE)治疗能获得更好的预后[26]。本研究依据血清AFP水平独立危险因素分组,AFP≥400 μg/L组较AFP<400 μg/L组病人累积生存率低、复发率高,利用血清AFP水平鉴别高危病人,从而对其行个体化治疗,对干预其可能较差的预后具有一定指导意义。
本研究也有相对不足之处:本研究是单中心的回顾性分析;AFP≥400 μg/L组病人病例67例,在消融方式中再分层研究可能个体差异对结果影响较大;选择射频还是微波消融是由病人及其家属决定的,未能随机化分组;不同的随访时间可能对生存率的比较有影响;AFP敏感性和特异性较低(均不足70%),存在一定漏诊和误诊率[27];另外以AFP≥400 μg/L为肝癌判断标准时,本研究结果AFP在肝癌中的阳性率为21.96%,与其他文献的报道有一定差距,可能是由于入组病人均为早期单发肿瘤以及阳性界定值的选择造成的。
血清AFP水平与肝细胞癌的生存和复发密切相关,可作为预测早期肝癌病人热消融术后的预后指标。射频和微波的治疗效果基本类似。
1 Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008.Int J Cancer,2010,127:2893-2917.DOI:10.1002/ijc.25516.2 Lau WY,Lai EC.The current role of radiofrequency ablation in the management of hepatocellular carcinoma:a systematic review.Ann Surg,2009,249:20-25.DOI:10.1097/SLA.0b013e31818eec29.
3 Lai EC,Lau WY.The continuing challenge of hepatic cancer in Asia.Surgeon,2005,3:210-215.4 Tateishi R,Shiina S,Teratani T,et al.Percutaneous radiofrequency ablation for hepatocellular carcinoma- An analysis of 1 000 cases.Cancer,2005,103:1201-1209.DOI:10.1002/cncr.20892.
5 Liang P,Yu J,Yu XL,et al.Percutaneous cooled-tip microwave ablation under ultrasound guidance for primary liver cancer:a multicentre analysis of 1363 treatment-naive lesions in 1007 patients in China. Gut,2012,61:1100-1101.DOI:10.1136/gutjnl-2011-3013 16.
6 Bruix J,Sherman M.AASLD Practice Guideline, Management of hepatocellular carcinoma: an update. Hepatology,2011,53:1020-1022.DOI:10.1002/hep. 24199.
7 Yao S,Zhang J,Chen H,et al.Diagnostic value of immunohistochemical staining of GP73,GPC3,DCP, CD34,CD31and reticulinstaining in hepatocellular carcinoma.J Histochem Cytochem,2013,61:639-648. DOI:10.1369/00221554134 92771.
8 Yamamoto K,Imamura H,Matsuyama Y,et al.AFP, AFP-L3,DCP,and GP73 as markers for monitoring treatment response and recurrence and as surrogate markers of clinicopathologicaI variables of HCC. Gastroenter,2010,45:1272-1282.DOI:10.1007/s005 35-010-0278-5.
9 Johnson PJ.Role of alpha-fetoprotein in the diagnosis and management of hepatocellular carcinoma.J Gastroenterol Hepatol,1999,14 Suppl:S32-S36.
10Chang SK,Hlaing WW,Yu RQ,et al.Value of alpha-foetoprotein for screening of recurrence in hepatocellular carcinoma post resection.Singapore Med J,2012,53:32-35.
11Bruix J,Sherman M,Llovet JM,et al.Clinical management of hepatocellular carcinoma.Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference.European Association for the Study of the Liver.J Hepatol,2001,35:421-430.
12Huang J,Yan L,Cheng Z,et al.A randomized trial comparing radiofrequency ablation and surgical resection for HCC conforming to the Milan criteria.Ann Surg, 2010,252:903-912.DOI:10.1097/SLA.0b013e3181efc 656.
13Wang JH,Wang CC,Hung CH,et al.Survival comparison between surgical resection and radiofrequency ablation for patients in BCLC very early/early stage hepatocellular carcinoma.J Hepatol,2012,56:412-418. DOI: 10.1016/j.jhep.2011.05.020.
14Chen MS,Li JQ,Zheng Y,et al.A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatcellular carcinoma.Ann Surg,2006,243:321-328.
15Simon CJ,Dupuy DE,Mayo-Smith WW.Microwave ablation:principles and applications.Radiographics,2005,25Suppl 1:S69-S83.
16Li L,Zhang J,Liu X,et al.Clinical outcomes of radiofrequencyablation and surgical resection for small hepatocellular carcinoma:a meta-analysis.J Gastroenterol Hepatol,2012,27:51-58.DOI:10.1111/j.1440-1746.2011.06947.x.
17Tiong L,Maddern GJ.Systematic review and meta-analysis of survival and disease recurrence after radiofrequency ablation for hepatocellular carcinoma. Br J Surg,2011,98:1210-1224.DOI:10.1002/bjs.7669.
18Helmberger T,Holzknecht N,Schopf U,et al.Radiofrequency ablation of liver metastases.Technique and initial results.Radiologe,2001,41:69-76.
19Liang P,Wang Y,Yu X,et al.Malignant liver tumors:treatment with percutaneous microwave ablation-complications among cohortof 1136 patients.Radiology,2009,251:933-940.DOI:10.1148/radiol.2513 081740.
20Wright AS,Sampson LA,Warner TiC,et al.Radiofrequency versus microwave ablation in a hepatic porcine model.Radiology,2005,236:132-139.
21Ding J,Jing X,Liu J,et al.Comparison of two different thermal techniques for the treatment of hepatocellular carcinoma.European J Radiology,2013,82:1379-1384.DOI:10.1016/j.ejrad.2013.04.025.
22Lu MD,Xu MD,Xie XY,et al.Percutaneous microwave and Radiofrequency ablation for hepatocellular carcinoma.a retrospective comparative study.J Gastroenterol,2005,40:1054-1060.
23Qin LX,Tang ZY.The prognostic significance of clinical and pathological features in hepatocellular carcinoma.World J Gastroenterol,2002,8:193-199.
24Tangkijvanich P,Anukulkarnkusol N,Suwangool P,et al.Clinical characteristics and prognosis of hepatocellular carcinoma:analysis based on serum alphafetoprotein levels.J Clin Gastroenterol,2000,31:302-308.
25Ikai I,Arii S,Kojiro M,et al.Reevaluation of prognostic factors for survival after liver resection in patients with hepatocellular carcinoma in a Japanese nationwide survey.Cancer,2004,101:796-802.
26Li P,Wang SS,Liu H,et al.Elevated serum alpha fetoprotein levels promote pathological progression of hepatocellular carcinoma.World J Gastroenterol,2011,17:4563-4571.DOI:10.3748/wjg.v17.i41.4563.
27Soresi M,Magliarisi C,Campagna P,et al.Usefulness of alpha-fetoprotein in the diagnosis of hepatocellular carcinoma.Anticancer Res,2003,23:1747-1753.
Prognostic value of preoperative AFP levels in thermal ablation
WangXiming,LiuJianwei,LeiZhengqing,LiJun,XiaYong,ShenFeng.
DepartmentofHepatobiliarySurgery,EasternHepatobiliaryHospital,SecondMilitaryMedicalUniversity,Shanghai200438,China
ShenFeng,Email:shenfengehbh@sina.com
Objective To explore the prognostic value of preoperative AFP levels in thermal ablation in patients with hepatocellular carcinoma (HCC).Methods 305 consecutive patients diagnosed as having HCC with single diameter < 3 cm were retrospectively analyzed. 109 patients receieved radiofrequency (RF) and 196 patients were given microwave (MW) ablation in Eastern hepatobilliary Surgery Hospital. Cumulative survival rate and cumulative recurrence rate were observed and analyzed.Results The 1-, 3- and 5-year cumulative survival rate in patients with HCC of AFP ≥400 μg/L group vs. AFP <400 μg/L group was 83.6%, 66.9%, 49.8% vs. 96.2%, 90.0%, 74.7% respectively (P=0.001). The 1-, 3- and 5-year cumulative recurrence rate in patients with HCC of AFP ≥400 μg/L group vs. AFP <400 μg/L group was 36.3%, 61.2%, 75.2% vs. 17.6%, 38.9%, 59.0% respectively (P=0.003). AFP ≥400 μg/L was a significant risk factor for survival and recurrence of overall patients. The 1-, 3- and 5-year cumulative survival rate in patients with HCC of RF group vs. MW group was 91.7%, 79.5%, 65.8% vs. 94.8%, 82.4% and 69.4% (P=0.211). The 1-, 3- and 5-year cumulative recurrence rate in patients with HCC of RF group vs. MW group was 24.1%, 50.6%, 61.1% vs. 21.4%, 40.1%, 59.7% respectively (P=0.424).Conclusions AFP ≥400 μg/L was closely related to survival and recurrence of HCC, and it may serve as a predictive factor for patients after thermal ablation. RF and MW ablation are both effective therapies, and there are no obvious differences between them in treating HCC.
Hepatocellular carcinoma; Alpha-fetoprotein;Radiofrequency ablation; Microwave coagulation ablation
国家科技重大专项(2012ZX10002016)
200438 上海,第二军医大学东方肝胆外科医院肝外四科
沈锋,Email:shenfengehbh@sina.com
R735.7
A
10.3969/j.issn.1003-5591.2016.02.005
2015-11-20)

