帕金森病认知障碍研究进展
谢祎 肖劲松
帕金森病认知障碍研究进展
谢祎肖劲松
430071武汉大学中南医院神经内科[谢祎(博士研究生)肖劲松(通信作者)]
【DOI】10.3969/j.issn.1007-0478.2016.03.022
帕金森病(Parkinson’s Disease,PD)是中枢神经系统退行性疾病之一。运动症状有静止性震颤、肌强直、运动迟缓、姿势平衡异常,是PD诊断的主要依据[1]。非运动症状主要包括神经心理障碍(抑郁、焦虑、认知障碍、注意力缺乏、淡漠等)、自主功能障碍(直立性低血压、便秘、心悸、多汗、膀胱功能障碍等)、感觉异常(疼痛、嗅觉障碍、视觉障碍等)、睡眠障碍(失眠、快动眼行为异常、不宁腿综合症、白天嗜睡等)[2]。非运动症状可先于运动症状若干年出现[3],对患者生活质量和健康状况的影响甚于运动症状,却往往被临床医生所忽视[4]。
帕金森认知功能障碍(Parkinson’s disease cognitive impairment,PDCI) 属于非运动症状,是PD患者最重要和最常见的症状之一,给患者、家庭、公共卫生带来沉重负担。本研究就PDCI做简要阐述。
1PDCI流行病学和病理改变
PDCI包括轻度认知障碍(Parkinson’s Disease-Mild Cognitive Impairment,PD-MCI)和痴呆(Parkinson’s Disease-Dementia,PDD)[5]。MCI即在日常生活能力保存的基础上有轻度记忆或认知功能损害但未达到痴呆诊断标准[6-7]。PD-MCI以PD为病因,受损的认知领域有异质性[8],发展为痴呆的几率大于认知正常者[9]。
因研究方法有差异,流行病学结果不尽相同。Aarland等人对来自8项队列研究的1346例PD患者进行横断面流行病学研究,指出有25.8%合并MCI(95%CI 23.5~28.2),记忆损害最为常见(13.3%;11.6~15.3),其次是视空间(11.0%;9.4~13.0)和注意/执行功能受损(10.1%;8.6~11.9)[10]。Aarland等人通过对171例PD患者和3062例非PD的对照组进行为期4.2年的纵向观察,发现PD患者有33%合并痴呆,比对照组高出5.9倍(95%CI,3.9~9.1)。其中高龄、H-Y分期>2期、简易精神状态评估(Mini Mental State Examination,MMSE)<29分是PD发展为痴呆的预测因素[11]。中国PD患者认知主要受教育程度、血尿酸水平、年龄、H-Y分期和抑郁影响[12]。
从诊断PD到发生PDD的中位时间为12.1年[13],MMSE平均每年减少1分[14],病程早期认知下降速度较病程晚期慢[15]。在病程早期发现认知下降并及时干预可提高患者生活质量,减少认知障碍带来的不良影响。
PDCI的病理基础存在争议,涉及广泛的神经部位和递质系统如皮质及皮质下、边缘系统的多巴胺、胆碱能、5-羟色胺和去甲肾上腺素能递质系统。病理检查显示黑质多巴胺功能进行性下降,Meynert基底核胆碱能细胞缺失、皮质和皮质下路易小体形成以及淀粉样斑块和神经原纤维缠结等病理表现[16-17]。
2PDCI临床表现
PDCI主要影响执行功能、视空间、注意力、记忆和语言功能等认知领域,具有皮质下的特点。
2.1执行功能
执行功能指有效启动并完成有目的活动的能力,是控制从目标形成、动机形成直至成功完成的行为的认知过程。PD患者后髓板多巴胺能神经元严重受累,无意识行为出现异常,需要依赖前额叶皮质调节有意识行为进行代偿,导致患者无意识行为速度减慢[18]。
一系列标准化的测试可以用来检测PD患者的执行功能,包括韦氏卡片分类测验(Wisconsin Card Sorting Test,WCST)、连线测验(Trial Making Test,TMT)、词语流畅性(word fluency,WF) 等。Kudlicka等人在一项meta分析中发现早期、非痴呆、未行药物治疗的PD患者执行功能不同维度如语音流畅性、语意流畅性、语言交替流畅性、数字广度-逆向、韦氏卡片分类测验、连线测验等明显受损[19]。
2.2视空间
视空间知觉是指通过视觉信号对物体距离、形状、大小、方位等空间特性的知觉。PD患者视网膜节前多巴胺神经元缺失,视网膜神经纤维受损,早期即可出现视空间障碍如伸手拿物困难、物体运动速度与正常不符、辨距不良、空间抽象综合能力下降等[20]。
18F-FDG PET结果显示发生痴呆的患者后皮质代谢显著下降[20],SPECT也得出相似的结论[21],说明后皮质功能障碍也许是认知损害的早期显著特征。PD患者视空间功能和语言记忆受损较阿尔兹海默病(Alzheimer’s Disease,AD)患者更快[22]。测评视空间功能的方法有线段方向判定试验(Judgment of Line Orientation,JOLO)、画钟测验(Clock Drawing Test,CDT)以及格林宁格视空间推理智力测验(the subtest Visuospatial Reasoning of the Groningen Intelligence Test,GIT)等[23]。
2.3注意力[23]
注意力指人的心理活动指向和集中于某种事物的能力。Muslimovic等人进行一项为期3年的前瞻对照研究,纳入新诊断的PD患者89例,既往PD诊断52例,健康对照64例,发现新诊断的PD患者的注意力在诊断后的3年内显著下降。评价注意力的方法有连线测验B(Trail Making Test-part B,TMT-B)、斯普鲁色词测验C(Stroop Color Word Test part C,SCWT-C)和数字广度测验(forward and backward digit span,DIGSP-FW/BW)等。
2.4记忆力
PD患者的再认、回忆和顺行性记忆都有损害,随病程有增加趋势[24]。Leplow等人发现PDD和老年性痴呆的记忆受损具有可比性,主要表现为瞬时记忆和短时记忆受损,长时记忆相对保留[25]。Lewis纳入3组患者,分别为帕金森病伴执行功能损害患者PDE、帕金森病无认知功能损害患者PDNE、健康对照组HC,发现PDE组工作记忆较另外2组明显受损[26],说明PD患者记忆受损可以促进执行功能受损。
常用的记忆评价方法有Rey听觉语言学习测验(Rey Auditory Verbal Learning Test,RAVLT)、Rivermead行为记忆测验-逻辑记忆(Rivermead Behavioural Memory Test-Logical Memory subtest,RBMT-LM)、Wechsler记忆量表III-面部再认(Wechsler Memory Scale-III Faces Recognition subtest)等[23]。
2.5语言功能
PD语言障碍主要表现为语言流畅性下降、语音障碍、语义障碍、自发语言障碍、复述障碍、阅读理解障碍和命名障碍。
Muslimovic等人发现PD患者语言功能明显受损,在3年随访期内受损程度无明显改变[24]。Saxena等人分析PD患者音频频谱,同时以BOLD记录大脑局部血流情况,发现PD患者的声音强度明显减低、发音起始时间延迟、鼻辅音受损,与第一运动区脑血流下降、喉肌功能障碍,不能协调发音功能相关[27]。因此,对于PD患者应综合分析语言功能障碍是发音肌肉的运动障碍还是认知障碍引起。语言功能评价方法有波士顿命名测验(Boston Naming Test,BNT)[23]、等级命名(Graded Naming Test,GNT)[28]。
3PDCI诊断
3.1PD-MCI的诊断标准[28]
目前PD-MCI诊断主要依据2012年国际运动障碍协会(Movement Disorder Society,MDS)制定的PD-MCI诊断标准(表1~3),包括简易评价和全面评价,前者临床常用,后者复杂耗时主要用于科研。

表1 PD-MCI诊断标准
3.2PDD的诊断标准[29]
目前尚没有公认的PDD的诊断标准,常用的为Emre等在2007年提出的诊断标准(表4~5)。
4PDCI鉴别诊断
4.1与路易体痴呆鉴别
路易体痴呆和帕金森痴呆具有相似的病理表现和临床特点,二者神经元胞浆内有路易小体形成,临床表现都包括认知功能障碍、精神病性症状(视幻觉)和运动障碍。但前者路易小体在纹状体分布较多,认知障碍和视幻觉表现更突出;后者黑质神经元丢失严重,运动障碍和震颤表现明显[30-32]。临床上主要以痴呆和锥体外系症状出现的时间顺序对二者进行鉴别,即所谓的“1年原则”:若痴呆在锥体外系症状1年后出现,倾向诊断为帕金森痴呆,若痴呆在锥体外系症状之前或者之后1年内出现,倾向诊断为路易体痴呆。路易体痴呆患者用多巴丝肼治疗运动症状效果不佳,也可作为鉴别的依据。
4.2与额颞叶痴呆鉴别

表2 5个认知域的推荐测验示例及所需时间
注:2个极其相似的测验(如2个列表学习测验或两个故事回忆测验)在诊断MCI时不能算作两个异常测验;同样地,同1个测验中高度相关的分数(如词语表即刻和延迟回忆)在诊断MCI时不能算作2个异常测验。2个高度相关的异常分数只能增加认知障碍存在的可信度。
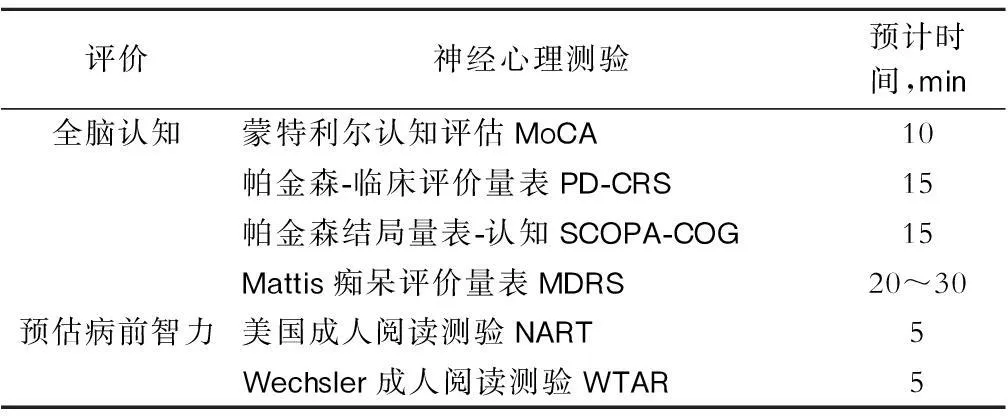
表3 全脑认知能力和预估病前智力的神经心理量表示例
额颞叶痴呆病因及发病机制不清,可能为神经元胞体特发性退行性变或轴索损伤继发胞体变化,影像学显示额颞叶萎缩。早期出现人格改变、言语障碍及行为异常临床表现,晚期出现智能衰退、遗忘、尿便失禁和缄默症。遗传学检查可发现多种tau蛋白基因编码区或10号内含子相关突变[33]。随病情进展可出现运动不能、肌强直等帕金森综合症表现,一般对多巴丝肼治疗反应差,甚至使症状加重。

表4 PDD特征

表5 很可能PDD和可能PDD诊断标准
4.3与阿尔兹海默病鉴别
PDD的认知障碍呈现波动性,多以皮质下痴呆为特征,突出表现为执行功能、注意力及视空间能力减退,记忆力障碍(回忆困难)及词汇表达流畅性下降,语言功能、定向力相对保留,而阿尔兹海默病以皮质性痴呆为主,以记忆损害(信息储存障碍,而非回忆困难)为主要临床特征,以及高级皮质功能障碍如失语、失用、失读、失认等,注意力和执行功能损害较轻[34]。
4.4与血管性痴呆鉴别
血管性痴呆多发生于脑卒中后3个月内,认知障碍特点是急剧恶化或呈阶梯样进展,临床表现及影像学证据有助于鉴别[34]。
5PDCI治疗
PD认知改变与神经系统多巴胺能、胆碱能、去甲肾上腺素能和谷氨酸等递质系统的紊乱有关,可通过调节递质治疗认知障碍。Rolinski于2012年在一项Cochrane分析中纳入6项研究共计1236例,指出胆碱酯酶抑制剂对PDD患者的总体评估能力、认知功能、行为异常和日常生活活动量表有积极的效果[35]。EXPRESS研究发现与安慰剂比较,利凡斯的明显著提高主要终点事件(总体认知和临床印象)和次要终点事件(注意力、执行功能、神经心理症状和日常活动)[36]。通过回顾性对三项大规模、多中心、随机、双盲、安慰剂对照研究中帕金森病测评量表(ADAS-cog)结果进行因素分析,Daniel Weintraub发现利凡斯的明能提高PDD的记忆和语言功能[37]。其他类型胆碱酯酶抑制剂如多奈哌齐[38]、美金刚[39]也有一定的作用。
6深部脑电刺激
目前,DBS是公认的PD患者症状治疗的外科手段,是将刺激电极植入患者脑组织深部目标核团,通过脉冲发生器发出特定频率的电刺激,对靶点进行慢性刺激以达到治疗目的,具有更好的操作性和治疗效果[40]。DBS主要用来改善PD患者的运动症状,对非运动症状如自主神经系统异常、感觉异常、睡眠障碍、神经心理障碍也有影响[41]。Parsons通过meta分析指出PD患者在DBS后认知功能相对稳定,但在执行功能、语言学习、语言流畅性和记忆方面有下降[42]。
7结论与展望
认知障碍分为PDD和PD-MCI,病程早期即可出现,严重影响PD患者的生活质量,临床表现多样,主要累及皮质下功能,诊断可参考MDS标准,需要临床医生仔细辨别。目前认为DBS对总体认知是安全的,需要进一步研究认知改变机制,以更好地指导DBS的临床应用。
参考文献
[1]Janvin CC,Aarsland D,Larsen JP.Cognitive predictors of dementia in Parkinson's disease:a community-based,4-year longitudinal study[J].J Geriatr Psychiatry Neurol,2005,18(3):149-154.
[2]Chaudhuri KR,Schapira AH.Non-motor symptoms of Parkinson's disease:dopaminergic pathophysiology and treatment[J].The Lancet Neurology,2009,8(5):464-474.
[3]Tolosa E,Gaig C,Santamar a J,et al.Diagnosis and the premotor phase of Parkinson disease[J].Neurology,2009,72(7 Suppl):S12-S20.
[4]Martinez-Martin P,Rodriguez-Blazquez C,Kurtis MM,et al.The impact of Non-Motor symptoms on Health-Related quality of Life of patients with parkinson's disease[J].Movement Disorders,2011,26(3):399-406.
[5]Caviness JN,Driver-Dunckley E,Connor DJ,et al.Defining mild cognitive impairment in Parkinson's disease[J].Mov Disord,2007,22(9):1272-1277.
[6]Petersen RC,Smith GE,Waring SC,et al.Mild cognitive impairment:clinical characterization and outcome[J].Arch Neurol,1999,56(3):303-308.
[7]Petersen RC.Mild cognitive impairment as a diagnostic entity[J].J Intern Med,2004,256(3):183-194.
[8]Kehagia AA,Barker RA,Robbins TW.Neuropsychological and clinical heterogeneity of cognitive impairment and dementia in patients with Parkinson's disease[J].The Lancet Neurology,2010,9(12):1200-1213.
[9]Janvin CC,Larsen JP,Aarsland D,et al.Subtypes of mild cognitive impairment in Parkinson's disease:progression to dementia[J].Mov Disord,2006,21(9):1343-1349.
[10]Aarsland D,Bronnick K,Williams-Gray C,et al.Mild cognitive impairment in Parkinson disease A multicenter pooled analysis[J].Neurology,2010,75(12):1062-1069.
[11]Aarsland D,Andersen K,Larsen JP,et al.Risk of dementia in Parkinson's disease:a community-based,prospective study[J].Neurology,2001,56(6):730-736.
[12]王晓君,罗蔚锋,王丽君,等.帕金森病患者认知功能与尿酸及相关因素分析[J].中华医学杂志,2009,89(23):1633-1635.
[13]Aarsland D,Kval?y JT,Andersen K,et al.The effect of age of onset of PD on risk of dementia[J].J Neurol,2007,254(1):38-45.
[14]Aarsland D,Andersen K,Larsen JP,et al.The rate of cognitive decline in Parkinson disease[J].Arch Neurol,2004,61(12):1906-1911.
[15]Evans JR,Mason SL,Williams-Gray CH,et al.The natural history of treated Parkinson's disease in an incident,community based cohort[J].J Neurol Neurosurg Psychiatry,2011,82(10):1112-1118.
[16]Zgaljardic DJ,Foldi NS,Borod JC.Cognitive and behavioral dysfunction in Parkinson's disease:neurochemical and clinicopathological contributions[J].J Neural Transm,2004,111(10/11):1287-1301.
[17]Sabbagh MN,Adler CH,Lahti TJ,et al.Parkinson disease with dementia:comparing patients with and without Alzheimer pathology[J].Alzheimer Dis Assoc Disord,2009,23(3):295-297.
[18]Dirnberger G,Jahanshahi M.Executive dysfunction in Parkinson's disease:a review[J].J Neuropsychol,2013,7(2):193-224.
[19]Kudlicka A,Clare L,Hindle JV.Executive functions in Parkinson's disease:systematic review and meta-analysis[J].Mov Disord,2011,26(13):2305-2315.
[20]Bohnen NI,Koeppe RA,Minoshima S,et al.Cerebral glucose metabolic features of Parkinson disease and incident dementia:longitudinal study[J].J Nucl Med,2011,52(6):848-855.
[21]Nobili F,Abbruzzese G,Morbelli S,et al.Amnestic mild cognitive impairment in Parkinson's disease:a brain perfusion SPECT study[J].Mov Disord,2009,24(3):414-421.
[22]Johnson DK,Galvin JE.Longitudinal changes in cognition in Parkinson's disease with and without dementia[J].Dement Geriatr Cogn Disord,2011,31(2):98-108.

[24]Whittington CJ,Podd J,Stewart-Williams S,et al.Memory deficits in Parkinson's disease[J].J Clin Exp Neuropsychol,2006,28(5):738-754.
[25]Leplow B,Dierks C,Herrmann P,et al.Remote memory in Parkinson's disease and senile dementia[J].Neuropsychologia,1997,35(4):547-557.
[26]Lewis SJ,Cools R,Robbins TW,et al.Using executive heterogeneity to explore the Nature of working memory deficits in Parkinson's disease[J].Neuropsychologia,2003,41(6):645-654.
[27]Saxena M,Behari M,Kumaran SS,et al.Assessing speech dysfunction using BOLD and acoustic analysis in parkinsonism[J].Parkinsonism Relat Disord,2014,20(8):855-861.
[28]Litvan I,Goldman JG,Tr ster AI,et al.Diagnostic criteria for mild cognitive impairment in Parkinson's disease:Movement Disorder Society Task Force guidelines[J].Mov Disord,2012,27(3):349-356.
[29]Emre M,Aarsland D,Brown R,et al.Clinical diagnostic criteria for dementia associated with Parkinson's disease[J].Movement Disorders,2007,22(12):1689-1707.
[30]Duda JE,Giasson BI,Mabon ME,et al.Novel antibodies to synuclein show abundant striatal pathology in Lewy body diseases[J].Ann Neurol,2002,52(2):205-210.
[31]Aarsland D,Ballard C,Larsen JP,et al.A comparative study of psychiatric symptoms in dementia with Lewy bodies and Parkinson's disease with and without dementia[J].Int J Geriatr Psychiatry,2001,16(5):528-536.
[32]Burn DJ,Rowan EN,Minett T,et al.Extrapyramidal features in Parkinson's disease with and without dementia and dementia with Lewy bodies:A cross-sectional comparative study[J].Mov Disord,2003,18(8):884-889.
[33]Adamec E,Chang HT,Stopa EG,et al.Tau protein expression in front temporal dementias[J].Neurosec Letter,2001,315(1):21-24.
[34]王维治.神经病学[M].北京:人民卫生出版社,2013.
[35]Rolinski M,Fox C,Maidment I,et al.Cholinesterase inhibitors for dementia with Lewy bodies,Parkinson's disease dementia and cognitive impairment in Parkinson's disease[J].Cochrane Database Syst Rev,2012,3(3):CD006504.
[36]Emre M,Aarsland D,Albanese A,et al.Rivastigmine for dementia associated with Parkinson's disease[J].N Eng J Med,2004,351(15):2509-2518..
[37]Weintraub D,Somogyi M,Meng X.Rivastigmine in alzheimer's disease and parkinson's disease dementia:an ADAS-cog factor analysis[J].Am J Alzheimers Dis Other Demen,2011,26(6):443-449.
[38]Dubois B,Tolosa E,Katzenschlager R,et al.Donepezil in parkinson's disease dementia:a randomized,double-blind efficacy and safety study[J].Mov Disord,2012,27(10):1230-1238.
[39]Stubendorff K,Larsson V,Ballard C,et al.Treatment effect of memantine on survival in dementia with Lewy bodies and Parkinson's disease with dementia:a prospective study[J].BMJ Open,2014,4(7):e005158.
[40]Benabid AL.Deep brain stimulation for Parkinson's disease[J].Curr Opin Neurobiol,2003,13(6):696-706.
[41]Hwynn N,Ul Haq I,Malaty IA,et al.Effect of deep brain stimulation on parkinson's nonmotor symptoms following unilateral DBS:A pilot study[J].Parkinsons Dis,2011,9(16):1-4.
[42]Parsons TD,Rogers SA,Braaten AJ,et al.Cognitive sequelae of subthalamic nucleus deep brain stimulation in Parkinson's disease:a meta-analysis[J].The Lancet Neurology,2006,5(7).
(2015-05-11收稿2015-06-23修回)
【中图分类号】R742.5R749.1
【文献标识码】A
【文章编号】1007-0478(2016)03-0216-05

