钛合金表面羟基磷灰石膜及组织相容性
宋雨来 谢良稳 李志民 张晓丹

摘要:在乙酸钙、磷酸二氢钙为主成分的弱酸性电解液中,以乙二胺四乙酸(EDTA)和柠檬酸作为络合剂,采用微弧氧化的方法,在钛合金表面成功地直接制备出含有羟基磷灰石(HA)的陶瓷层.随着电解液Ca/P的增加,膜层中HA含量升高,膜层表面孔洞分布更均匀,表面变粗糙.动物种植试验表明,陶瓷层覆盖植入体产生的炎症反应较弱,新的肌肉组织能够在膜层表面生长.
关键词:微弧氧化;钛合金;羟基磷灰石;组织相容性
中图分类号:TG156 文献标识码:A
钛合金因其具有良好的机械性能和一定的生物相容性和耐蚀性,受到了广大硬组织植入材料研究者的青睐[1-3].但是,钛合金硬组织植入体长期存在于生物体内,其表面产生游离的金属离子进入生物组织内会造成细胞死亡[4].一些特殊成分的陶瓷材料具有良好的生物相容性,弥补了钛合金的不足之处,但陶瓷材料的强度和韧性不足,不能完全满足硬组织植入材料的力学性能要求[5-6].因此,陶瓷材料只能在一些特定部位,有条件地替代一些金属质植入性产品.目前医学领域70%的植入性器件不得不由金属制成[7].
微弧氧化技术能在钛合金表面原位生长出含有羟基磷灰石(HA)陶瓷膜,这种成分与天然骨组织的无机物成分相同.因此,这种方法制备的钛合金植入材料结合了金属和陶瓷膜的各自优点,即植入材料表面具有良好的生物活性和生物相容性,同时,基体又具有良好的机械性能[8].基于良好的应用前景,使用微弧氧化技术在钛合金表面生成含有HA生物陶瓷膜的研究倍受关注.
大量研究表明,目前钛合金表面微弧氧化HA膜研制主要采用二步方法,即通过微弧氧化技术结合后处理技术在氧化膜层外表面生成含HA的生物陶瓷膜.在二步法制备含羟基磷灰石膜层的基本原理、工艺过程,以及膜层的组织结构控制和性能等方面取得了丰富的研究成果[9-12].近年来,采用微弧氧化技术在钛合金表面直接生成含有HA涂层的技术逐渐成为研究热点. Bai等将微弧氧化技术与电沉积技术有效结合在一起,通过在电解液中加入纳米羟基磷灰石颗粒,在钛合金表面直接制备出含有锐钛矿和羟基磷灰石的陶瓷层,膜层的HA含量与电压密切相关[13].Chen等在乙酸钙和磷酸二氢钠电解液中,用一步法在纯钛表面制备出含有锐钛矿、金红石和羟基磷灰石的陶瓷层,其方法相对于传统的二步法更为简单快速[14].Kim等在CaCl2和KH2PO4电解液中,采用一步法在钛合金表面成功制备了含有HA的陶瓷层,并认为电解液中CaCl2的浓度是影响膜层厚度重要因素[15].可见,一步法制备技术具有制备周期短、成本低、工序少的优点,但研究仍处于起步阶段,在膜层形成机制、电解液配方优化、电参数优化、成分和组织控制等方面仍需开展系统、深入的研究.
本文通过研究不同成分电解液对微弧氧化膜层组织和结构的影响,开发了高效环保的电解液配方,在弱酸性条件下,可在钛合金表面直接生成含有HA的生物陶瓷膜.并通过生物学方法,评价了膜层的组织相容性.研究结果将丰富钛合金表面微弧氧化理论,并为钛合金植入性材料的研发和应用提供可靠的实验支持.
1实验方法
1.1电解液配制
本研究以乙酸钙和磷酸二氢钙作为主成分,柠檬酸和乙二胺四乙酸(EDTA)做络合剂,用蒸馏水配置成电解液,氢氧化钾调解pH值.首先将乙酸钙和EDTA按比例混合溶解在蒸馏水中,再将磷酸二氢钙和柠檬酸按一定比例混合溶解在蒸馏水中,待两者都完全溶解后混合,在混合的溶液中通过添加氢氧化钾调节电解液的pH值至5.混合过程中用磁力搅拌器对溶液进行搅拌促进试剂溶解和防止沉淀.Ca/P是电解液配方中重要参数,实验过程中,通过设定不同的Ca/P,调整乙酸钙,EDTA加入量对电解液成分进行优化,具体电解液组成见表1.
1.2氧化膜制备
钛合金作为阳极浸入电解液中,不锈钢桶作为阴极.电参数为:电流密度10 A/dm2;频率150 Hz;占空比12%;氧化时间20 min.本实验采用恒流方式进行氧化处理,通过电压调节来控制电流密度恒定.制备过程中,开通机械搅拌器保持电解液成分均匀.试样取出后,超声波清洗5 min,电吹风吹干,自封袋中保存,待检测分析.
1.3微观组织及相组成
采用EVO18型扫描电子显微镜观察膜层表面微观形貌.采用D/Max 2500PC型X射线衍射仪分析相组成,辐射源为CuKα,电压/电流为40 kV/30 mA,扫描范围为10°~90°,扫描速度为0.5 °/min.
1.4动物种植试验
选取3只大白兔,每只白兔左右腿肌肉处分别手术植入一枚未处理钛合金植入体和微弧氧化处理植入体.术后3 d内给动物注射适量青霉素消炎针剂,一周之内隔天护理患处.8周后切开每个围绕植入体周围1 cm左右的肌肉组织,连同植入体及周围肌肉组织取下,取下的标本在福尔马林溶液中固定10 d,固定好的标本进行植入体与肌肉组织分离,将软组织进行常规石蜡包埋,石蜡切片,制成切片标本,染色后进行光学显微观察.
2结果与分析
2.1相组成
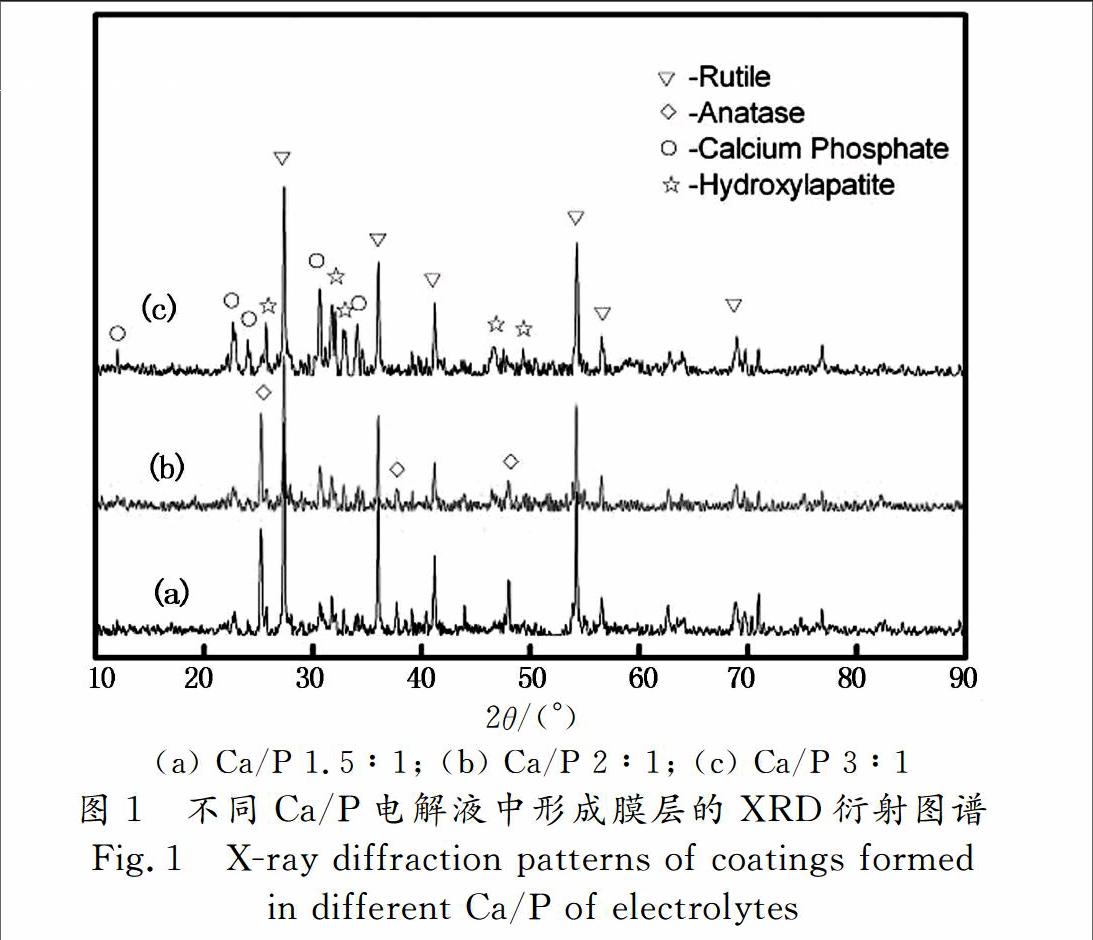
图1为不同Ca/P的电解液中形成的膜层表面XRD衍射图谱.从图中可以看出,当Ca/P为1.5/1时,膜层的主要相组成为金红石和锐钛矿,磷酸钙和羟基磷灰石的衍射峰不明显.有研究表明在等离子体的高温高压作用下,来自于基体的Ti和电解液中的O极易生成TiO2,并且当反应温度升高时,更易于金红石的形成[16].随着Ca/P的增加,锐钛矿的衍射峰降低,羟基磷灰石和磷酸钙相的衍射峰逐渐增强,说明适度增加电解液中的Ca/P有利于在氧化膜中生成羟基磷灰石.
本文采用EDTA与乙酸钙,柠檬酸与磷酸二氢钙分别络合,使磷酸二氢钙同时成为钙离子和磷酸根离子的供体,相同浓度条件下,比常用的钠盐具有更高的Ca/P,提高了电解液的利用率.通常在碱性条件下,OH-的活度较高,溶液能够提供充足的羟基促进HA形成.本文采用的电解液呈弱酸性,溶液不能直接提供大量的OH-,但是,具有较高活度的H+通过促进CaTiO3的分解提供羟基加快HA生成[15].进一步提高Ca/P,如Ca/P为4∶1和5∶1时,经肉眼观察钛合金表面均不能形成完整的氧化膜,因此未对其相组成进行检测.可见,电解液的Ca/P选取3∶1时更利于生成完整的HA膜.
2.2微观组织
图2为不同电解液Ca/P条件下制备的微弧氧化膜层表面微观形貌.从图2(a)中可以看出,当Ca/P为1.5∶1时膜层存在很多形状不规则的孔洞,数量较多,大小不一,孔洞之间的陶瓷层表面平整光滑,无裂纹产生.
图2(b)和(c)分别为Ca/P为2∶1和3∶1时膜层表面形貌.随着电解液Ca/P的增加,膜层表面粗糙度变大,表面出现大量的细小颗粒,分布相对均匀,经EDS分析结合XRD结果判断为HA颗粒.此外,膜层表面孔洞数量减少,尺寸降低,未发现裂纹.膜层表面的形貌变化可能是因为随着Ca/P增加,表面电弧数量减少,膜层中大量HA开始生成,最终导致粗糙度增加,孔洞数量降低[11-12,15].有研究表明,对羟基磷灰石植入材料而言,较大的粗糙度和适当的孔洞有利于提高膜层的组织相容性[17].
2.3生物相容性
马宋三色染色,即Masson三色法是传统经典的胶原纤维染色法[18].本研究的染色结果:细胞核呈鲜明的蓝黑色,胶原纤维呈绿色,红细胞和肌细胞呈红色.图3(a)为未处理钛合金植入体周围肌肉组织经Masson染色后在光镜下的显微组织形貌.从图中可以看到,植入体周围出现了大量呈绿色的胶原纤维,即出现大面积的纤维增生和炎症细胞,阻碍了肌肉细胞在植入体表面结合和生长[19],说明未经微弧氧化表面处理的钛合金作为植入体的组织相容性差.图3(b)为微弧氧化处理钛合金植入体周围肌肉组织经Masson染色后光镜显微组织形貌.图中红色占据大面积,肌肉与植入体表面接触处表现为多层红绿相间的形貌,且每一层绿色厚度均较小,说明植入体周围的肌肉组织中炎症细胞少,产生的胶原纤维少,即纤维增生少.肌肉组织中少量的纤维增生可以形成肉芽组织参与炎症的愈合过程[20],并且随着时间的推移,这种与肌细胞相间的少量纤维增生会慢慢分散,肌肉组织与植入体表面会更好地
结合.此外,植入体表面肌肉组织生长出新生肌肉细胞,这种肌肉细胞面向植入体表面的一侧生长,说明肌肉纤维在向植入体表面推进生长.显然,与钛合金裸露表面相比,微弧氧化表面处理膜层组织相容性好.
3结论
1) 以乙酸钙和磷酸二氢钙作为主成分,以EDTA和柠檬酸作为络合剂,在弱酸性条件下,采用微弧氧化方法,能够在钛合金表面直接生成HA陶瓷膜.
2) 随着Ca/P的增加,膜层表面变得粗糙,HA含量逐渐增加,孔洞尺寸减小,分布均匀.当Ca/P为1/3时膜层组织和成分较为理想,进一步增加Ca/P膜层会出现大面积的烧损严重破坏了完整性.
3) 动物种植试验初步证明,HA膜覆盖钛合金植入体相比钛合金植入体更有利于减少炎症反应,促进周围肌肉组织的生长,具有更好的组织相容性.
参考文献
[1]KOBAYASHI E, MATSUMOTO S, YONEYAMA T, et al.Mechanical properties of the binary titaniumzirconium alloysand their potential for biomedical materials[J].Journal of Biomedical Materials Research, 1995, 29:943 - 950.
[2]BOTHE R T, BEATON L E, DAVENPORT H A. Reaction of bone to multiple metallicimplants[J].Surgery, 1940, 7: 598-602.
[3]BRETTLE J.A survey of the literature on metallic surgical implants[J]. Injury, 1970, 2: 26-39.
[4]KIMA S H, JEONG Y H,CHOE H C. Morphology change of HA films on highly ordered nanotubular TiNbHfalloys as a function of electrochemical deposition cycle[J]. Surface & Coatings Technology,2014,259:281-289.
[5]SUCHANK W, YOSHIMURA M.Processing and properties of hydroxyapatitebased biomaterials for use as hard tissue replacementimplants[J]. Journal of Materials Research, 1998,13: 94-117.
[6]YUE X Y, YU L, ZHANG C P.Toughening mechanisms in ironcontaining hydroxyapatite/titanium composites[J]. Biomaterials,2010,31:1493-1501.
[7]TAKAO Hanawa. Biofunctionalization of titanium for dental implant[J]. Japanese Dental Science Review, 2010, 46: 93-101.
[8]HUNG K Y, CHENG S, SHI C S. Titanium surface modified by hydroxyapatite coating for dental implanting[J]. Surface & Coatings Technology,2013,231:337-345.

