IRE1-XBP1通路调控肝巨噬细胞极性的机制研究*
胡大仁,程 黎,刘 燕,刘一鸣,李金政,龚建平,苟剑林△
(1.重庆三峡中心医院肝胆外科,重庆万州 404000;2.重庆医科大学附属第二医院肝胆外科 400010)
IRE1-XBP1通路调控肝巨噬细胞极性的机制研究*
胡大仁1,程黎1,刘燕1,刘一鸣2,李金政2,龚建平2,苟剑林1△
(1.重庆三峡中心医院肝胆外科,重庆万州 404000;2.重庆医科大学附属第二医院肝胆外科400010)
[摘要]目的分离、培养LEWIS大鼠肝脏肝巨噬细胞(KCs),观察肌醇酶1-X盒连接蛋白1(IRE1-XBP1)通路活性改变对KCs功能的调控的作用机制。方法(1)采取Ⅳ型胶原酶消化肝脏联合非连续梯度离心法分离Lewis大鼠KCs;(2)鉴定后的KCs分为4组: XBP1沉默组(XBP1-shRNA组)、错义序列沉默对照组(Ctrl-shRNA组);Adv-XBP1过表达组(AdV-XBP1组)、错义序列过表达对照组(Ctrl-AdV组);(3)实时荧光定量PCR(RT-PCR)检测各组KCs中XBP1、IL-6、IFN-γ、TNF-α、IL-17转录水平;蛋白免疫印迹法(Western blot)检测JAK1、JAK2、STAT1及STAT3的蛋白表达水平;(4)流式细胞术(FCM)及激光共聚焦检测各组KCs表型的变化情况;(5)分离大鼠脾脏淋巴细胞,尼龙毛柱过滤纯化T细胞,与上述各组KCs共培养, Brdu渗入法检测T细胞增殖情况;(6) Annexin V/PI法FCM观察T淋巴细胞凋亡情况;(7)酶联免疫吸附测定(ELISA)检测上清液中IL-6、IFN-γ、TNF-α、IL-17及IL-10水平。结果(1)RT-PCR结果显示,XBP1-shRNA组中XBP1的表达量较对照组显著降低,而在Adv-XBP1组则明显上调(P<0.05);(2)FCM发现,XBP1-shRNA组中MHC-Ⅱ、CD86、CD40的表达明显低于对照组,而CD204和CD206的表达则显著高于对照组;而在Adv-XBP1组,则呈相反趋势;(3)Western blot检测发现XBP1-shRNA组中JAK1、JAK2、STAT1和STAT3的蛋白表达及其磷酸化水平均受到抑制,而在Adv-XBP1组则上述蛋白的表达及磷酸化水平得到显著增强;(4)Brdu发现抑制KCs 中IRE1-XBP1活性后T细胞增殖受到明显抑制,凋亡增加,促炎细胞因子分泌减少,抗炎细胞因子分泌增加(P<0.05),而上调KCs中IRE1-XBP1活性后T细胞增殖则明显增强,凋亡明显减少,促炎细胞因子分泌增加,抗炎细胞因子分泌减少(P<0.05)。结论KCs中IRE1-XBP1通路活性变化可以转化KCs的极性状态,并通过调节JAK-STAT家族成员表达,调控KCs自分泌细胞因子的组成成分;KCs中IRE1-XBP1通路活性变化可以影响共培养初始T淋巴细胞的增殖分化、凋亡及相关细胞因子的分泌。
[关键词]X盒结合蛋白1;肝巨噬细胞;极性调节
目前认为,急性排斥反应发生的实质是持续的炎症反应及炎症因子蓄积浸润。而抗原递呈细胞是诱导炎症反应及炎症因子趋化的核心因素[1-2]。笔者前期发现,作为肝血窦内的固有巨噬细胞,也是机体最大的抗原递呈细胞群的肝巨噬细胞(kupffer cells,KCs),活化后具有即可促进急性排斥反应,也能调控下游相关耐受分子表达改变,有利于免疫抑制的双重“性格”。但其具体机制尚不清楚。尝试增强其下游耐受相关分子的表达,仅能延缓排斥反应的发生[3-4]。其原因可能与忽略了KCs活化后M1/M2极性调节相关。
前期对肌醇酶1-X盒连接蛋白1(inositol requiring enzyme 1-X-box binding protein 1,IRE1-XBP1)通路的研究主要局限于非折叠蛋白反应(unfolded protein response,UPR)中[5]。新近文献报道,IRE1-XBP1通路活性改变参与了调节B淋巴细胞分化、树突状细胞等抗原递呈细胞功能稳态、巨噬细胞分泌性质等诸多免疫调控环节[6-7]。而KCs作为机体最大的巨噬细胞群/APC群,IRE1-XBP1通路调控KCs的作用,尚未见相关报道。本课题组认为,IRE1-XBP1通路可能在调控KCs功能及其自分泌细胞因子中起着关键作用。本研究中,笔者以大鼠肝脏KCs为靶细胞,分别转染XBP1-shRNA及AdV-XBP1,观察其功能极性的改变,以及对初始T淋巴细胞激活分化的影响,从体外实验的角度初步探讨以KCs 中IRE1-XBP1通路为作用靶点调控细胞免疫的可能机制。
1材料与方法
1.1材料健康近交系6~8周龄Lewis(Rtl1)大鼠,购于北京维通利华实验动物技术有限公司。饲养于SPF级实验室。给予标准鼠料喂养,12 h昼夜节律,正常饮水。术前8~12 h禁食。主要试剂:Ⅳ型胶原酶购于Santa Cruz公司;小鼠抗大鼠XBP1、MCH-Ⅱ、CD86、CD204、CD206、CD163抗体购自Abcam公司;兔抗大鼠JNK、JAK1、STAT3单克隆抗体购自eBioscience公司;PrimeScriptTMRTreagent Kit试剂盒购于Takara公司;酶联免疫吸附测定(ELISA)试剂盒购于Sigma公司。所有操作遵守重庆医科大学伦理委员会指南。
1.2方法
1.2.1沉默及过表达质粒的构建干扰质粒与过表达质粒及其错义序列对照质粒的构建交由上海英潍捷基贸易有限公司代为构建。选择载体分别是pcDNA3.1/Hygro-IRES2-EGFP和pcDNA6.2TM-GW/EmGFP。质粒抽取按照OMEGA质粒抽取试剂盒说明书进行,最终调整质粒浓度为500 ng/μL。参照脂质体Lipofectamine2000说明书指导进行胞内转染操作。
1.2.2KCs分离培养及分组取Lewis大鼠肝组织,加入终浓度为0.1%的Ⅳ型胶原酶后划碎并水浴,经200目细胞筛过滤后得到肝细胞悬液。经4次离心后得到含少量红细胞的肝脏非实质细胞悬液。采用2 h选择性贴壁法纯化KCs。常规培养3 d后,取KCs种于6孔板(1×106个/孔),参照脂质体Lipofectamine2000说明书指导分别转染XBP1-shRNA、AdV-XBP1及其对照质粒。分组如下:XBP1沉默组(XBP1-shRNA组,滴度为3×108TU/mL),错义序列质粒沉默对照组 (Ctrl-shRNA组,滴度为3×108TU/mL),AdV-XBP1过表达组(AdV-XBP1组,滴度为3×108TU/mL),错义序列质粒过表达对照组(Ctrl-AdV组,滴度为3×108TU/mL)。
1.2.3实时荧光定量PCR(RT-PCR)检测各组中XBP1、IL-6、IFN-γ、TNF-α和IL-17 mRNA表达水平按Trizol试剂盒说明书提取KCs及肝脏总组织RNA,XBP1上游引物:5′-ATC GTC GAC CCG GGA CTA CAG GAC CAA TA-3′,下游引物:5′-GCG CAA GCT TAT GTG ATG GTC AGG GAA AGG-3′;IL-6上游引物:5′-AGA TAA CAA GAA AGA CAA AGC CAG AGT C-3′,下游引物:5′-GCA TTG GAA ATT GGG GTA GGA AG-3′;IFN-γ上游引物:5′-ATG AAC GCT ACA CAC TGC ATC-3′,下游引物:5′-TAG GCT TTC AAT GAC TGT -3′;TNF-α上游引物:5′-TCT ACT GAA CTT CGG GGT GAT CG-3′,下游引物:5′-CGT GGG CTA CAG GCT TGT A-3′;IL-17上游引物:5′-CTC AAC CGT TCC ACG TCA CCC -3′,下游引物:5′-CCA GCT TTC CCT CCG CAT-3′;利用SYBRPremix Ex Taq Ⅱ试剂盒测定RNA的逆转录的表达情况。RT-PCR结果采取2-△△Ct法分析表达基因的表达差异,ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。以上实验均重复3次。
1.2.4蛋白免疫印迹法(Western blot)检测各组KCs中XBP1、JAK、STAT的蛋白表达按照总蛋白提取试剂盒说明书提取KCS和移植肝脏总蛋白进行含量测定,常规行Western blot测定,一抗浓度稀释成1∶200;二抗浓度稀释成1∶2 000显影后BioRad系统捕获图片,Quantity One分析。以上实验均重复3次。
1.2.5流式细胞术检测KCs表型分子表达将转染后48 h各组KCs分为LPS处理及对照两个亚组,加入不同荧光素标记的兔抗大鼠MHC-Ⅱ、CD206、CD204、CD40和单克隆抗体避光孵育2 h。打开机器及氩离子光源,预热,机器自动初始化。用标准荧光微球校准,荧光信号的变异系数设置小于3%。孵育相应二抗,磷酸盐缓冲液(PBS)洗1次,1 h内上机检测,每个亚组取1×104个细胞,FlowJo分析结果。以上实验均重复3次。
1.2.6T淋巴细胞共培养及功能检测取经卵清蛋白(OVA)皮下免疫2次的Lewis鼠脾组织制作脾细胞悬液,经梯度离心法获混合淋巴细胞悬液,用尼龙毛柱(Wako)过滤纯化。培养液中加入终浓度为100 μmol/L的Brdu工作液。将5×105个T细胞按5∶1比例与上述各转染的KCs在6孔培养板中进行混合培养72 h,按照Brdu试剂说明书进行处理,用 Image-Pro Plus6.0软件选取相同的红光作为判断所有照片阳性的统一标准,阳性率=阳性细胞数/核数量。将5×105个T细胞按5∶1配置与上述各组KCs在96孔板中混合培养72 h,每孔加入1 μg/mL OVA323-339,刺激后收集细胞液,离心后加入Annexin V-FITC及 PI,上机,激发波长为488 nm(绿光)和630 nm(红光),检测凋亡。以上实验均重复3次。
1.2.7ELISA检测取各组共培养上清液,按ELISA试剂盒标准步骤操作,检测各组中IFN-γ、TNF-α、IL-6及IL-17的表达差异。以上实验均重复3次。

2结果
2.1各组KCs中XBP1转录、表达的变化转染48 h后,荧光显微镜下可见绿色荧光蛋白大量表达。其转染效率约为87%(图1A)。RT-PCR提示:XBP1-shRNA组、Ctrl-shRNA组、AdV-XBP1组及Ctrl-AdV组中XBP1 mRNA相对表达量分别为0.58±0.07、8.81±1.28、48.65±5.82和10.31±1.74(图1B)。 XBP1-shRNA组中XBP1的转录水平较其余3组明显受到抑制(P<0.05),提示XBP1-shRNA质粒有效抑制KCs中XBP1正常生理量的表达水平;而在AdV-XBP1组中,XBP1 mRNA的转录活性较其余3组则明显上调(P<0.05)。Western blot检测各组KCs中XBP1蛋白表达水平,其结果显示:XBP1-shRNA组、Ctrl-shRNA组、AdV-XBP1组及Ctrl-AdV组中XBP1的蛋白相对表达水平分别为0.14±0.04、0.49±0.01、0.84±0.02、0.53±0.07。Western blot结果(图1C)与RT-PCR的趋势相一致。
2.2IRE1-XBP1通路对KCs极性的影响
2.2.1IRE1-XBP1通路活性对KCs表型分子的影响MHC-Ⅱ、CD40、CD86等功能分子是决定KCs抗原呈递细胞呈递功能,以及活化初始T细胞功能的关键因子,其高表达提示KCs呈M1型极化。而CD204及CD206则是M2型KCs的表面特异性标志物。FCM显示:XBP1-shRNA组中MHC-Ⅱ(28.56±1.34)%、CD40(31.75±5.87)%和CD86(18.24±2.63)%较Ctrl-shRNA组MHC-Ⅱ(68.74±12.56)%、CD40(72.60±12.45)%和CD86(57.76±9.74)%明显下调(P<0.05)。在AdV-XBP1组中,MHC-Ⅱ(89.46±21.43)%、CD40(72.60±15.74)%及CD86(86.17±24.28)%]的表达水平与Ctrl-AdV组(60.39±18.73)%、(49.24±18.45)%和(59.13±15.67)%相比则显著增加(P<0.05)。但是CD204及CD206分子在各组中的表达水平则呈相反趋势,CD204和CD206在XBP1-shRNA组的表达水平分别为(47.22±9.84)%和(45.67±11.37)%,较AdV-XBP1中CD204(12.54±3.41)%和CD206(12.31±3.34)%的明显上升(P<0.05),见图2A。
2.2.2IRE1-XBP1通路对KCs自分泌细胞因子的影响RT-PCR检测上清液中促炎细胞因子IL-6、IFN-γ、TNF-α、IL-17转录调控变化。PCR结果(图2B);XBP1-shRNA组与Ctrl-shRNA组比较,IL-6、IFN-γ、TNF-α、IL-17的mRNA表达量均受到明显的抑制(P<0.05);而AdV-XBP1组与Ctrl-shRNA组比较,这类促炎细胞因子的表达量则明显上调(P<0.05)。
2.3IRE-1-XBP1通路经由JAK-STAT通路影响KCs细胞因子分泌改变结果显示,抑制IRE1-XBP1通路的活性,JAK家族中JAK1与JAK2(图3A)和STAT家族成员中STAT1及STAT3(图3B)自身蛋白表达及其磷酸化水平均受到抑制(P<0.05)。而促进IRE1-XBP1通路的表达或传导,JAK家族及STAT家族上述成员的蛋白表达量及其磷酸化水平均得到显著提升(P<0.05)。Western blot结果提示,IRE1-XBP1调控KCs自分泌细胞因子成分改变很有可能是通过JAK-STAT通路而实施的。但有待进一步的验证。
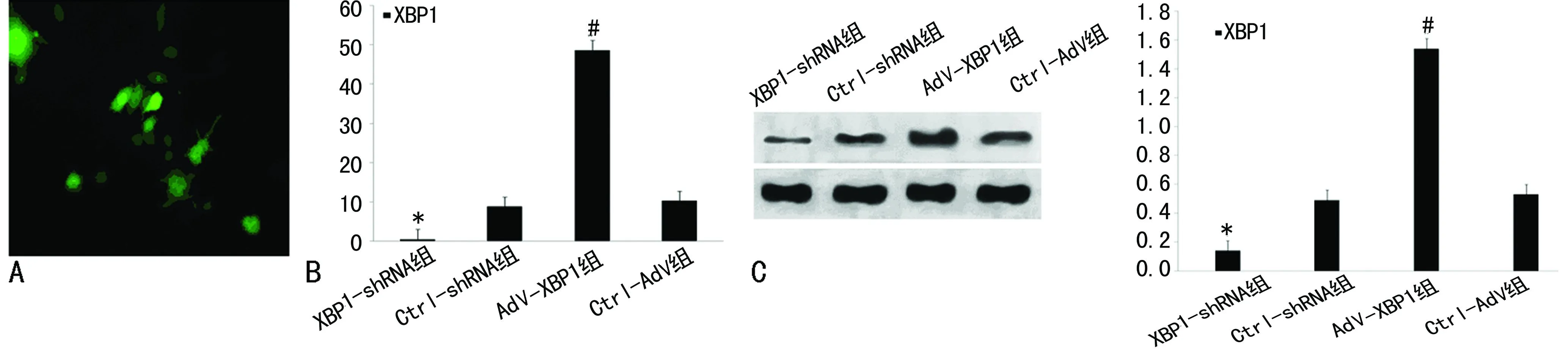
A:转染后48 h KCs内绿色荧光蛋白表达;B:RT-PCR检测转染后48 h各组KCs中XBP1的基因转录水平;C:Western blot检测KCs中XBP1蛋白的表达。
图1 转染后各组KCs中XBP1转录、表达的变化

A:各组KCs表型分子改变柱状图分析;B:各组KCs分泌细胞因子mRNA的表达水平。
图2IRE1-XBP1通路对KCs极性的影响
2.4KCs中IRE1-XBP1通路活性对活化T细胞的影响
2.4.1IRE1-XBP1通路活性对活化T细胞增殖的影响Brdu掺入法检测共培养T淋巴细胞增殖结果显示,XBP1-shRNA组中,标记了红光的阳性率为(14.69±2.31)%,较Ctrl-shRNA组的(21.32±5.41)%,T淋巴细胞分裂增殖的能力明显受到抑制(P<0.05)。而在AdV-XBP1组中,AdV-XBP1组(40.80±7.54)%较Ctrl-AdV组(22.03±4.76)%,T淋巴细胞分裂增殖的能力得到明显加强(P<0.05),见图4A。
2.4.2IRE1-XBP1通路活性对活化T细胞凋亡的影响采取Annexin V-FITC/PI法检测T淋巴细胞凋亡情况发现:T淋巴细胞在XBP1-shRNA组(42.17±8.74)%凋亡明显高于Ctrl-shRNA组(23.74±4.16)%,而在AdV-XBP1组(10.95±3.79)%凋亡明显低于Ctrl-AdV(21.87±3.72)%,差异有统计学意义(P<0.05),见图4B。
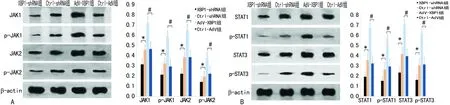
A:IRE1-XBP1对JAK1和JAK2蛋白表达及磷酸化水平的调控,B:IRE1-XBP1对STAT1和STAT3蛋白表达及磷酸化水平的调控。*:P<0.05,与Ctrl-shRNA组比较;#:P<0.05,与Ctrl-AdV组比较。
图3IRE-1-XBP1通路对JAK-STAT通路的调节
2.4.3KCs中IRE1-XBP1通路对活化T细胞分泌细胞因子的影响共培养上清液ELISA检测结果显示,IFN-γ、TNF-α、IL-6、IL-17在XBP1-shRNA组中,与Ctrl-shRNA组比较,其分泌均受到不同程度的抑制;而在AdV-XBP1组,与Ctrl-AdV比较,上述4种细胞因子的分泌显著增高(P<0.05)。但IL-10在XBP1-shRNA组中的水平却明显高于其在Ctrl-shRNA组中的表达,而AdV-XBP1组与Ctrl-AdV组比较,则IL-10分泌明显减少(P<0.05),见图5。

A:各组KCs对T淋巴细胞增殖的影响;B:各组KCs对T淋巴细胞凋亡的影响;*:P<0.05,与Ctrl-shRNA组比较,#:P<0.05,与Ctrl-AdV组比较。
图4KCs中IRE1-XBP1对初始T淋巴细胞的影响
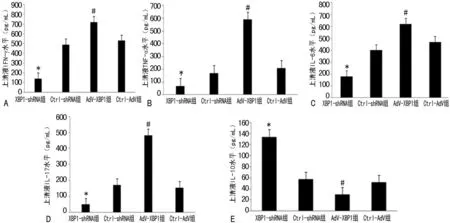
*:P<0.05,与Ctrl-shRNA组比较;#:P<0.05与Ctrl-AdV组比较。
图5各组KCs对T淋巴细胞分泌细胞因子改变的影响
3讨论
目前主流观点认为,APCs的功能和T细胞激活分化在AcR中占据关键的位置,对两者的特异性调控,可影响移植耐受或排斥免疫反应[8]。KCs通过模式识别受体(PRRs)识别外来抗原,再经由TLR4等途径,进行信号传导,发生极化。M1型KCs主要由IFN-γ及LPS等因素诱导极化,可大量分泌促炎细胞因子、促进Th1/Th17类反应,具备很强的抗原呈递功能。其表面标志物包括IL-12、MHC-Ⅱ、CD68、NOS2、IL-10等。M2型KCs与Th2型免疫反应关系密切,极化的M2型KCs表型为IL-12、MHC-Ⅱ、IL-10、CD204、CD206、IL-1decoyR[9-10]。
本实验中,通过抑制或上调IRE1-XBP1的活性及传导,发现降低KCs中IRE1-XBP1通路活性,能有效抑制经LPS活化的KCs表面MHC-Ⅱ的表达水平,与文献报道结果一致[11]。此外,抑制这一通路的活性,也削弱共刺激分子CD40及CD68的表达。但KCs表面M2型标志物CD204及CD206的表达水平则明显上升,使得KCs表型改变为MHC-Ⅱ、CD68、CD204、CD206,更符合M2型KCs的表型特征。在上调这一通路活性时,则MHC-II、CD40同CD86的表达水平得到明显的增强,而CD204及CD206的表达则明显受限。KCs表型呈MHC-Ⅱ、CD68、CD204、CD206,与M1型表型相近。此外笔者还测定了不同IRE1-XBP1活性对KCs自身分泌促炎因子的基因及蛋白的转录水平,发现抑制IRE1-XBP1通路的活性, KCs自分泌IL-6、IFN-γ、TNF-α和IL-17减少,而上调这一通路的活性,则明显促进这类促炎因子的表达。而这一改变可能是通过对JAK1、JAK2及STAT1和STAT3的蛋白及磷酸化水平的调控而实现的。但本研究未能确认IRE1-XBP1主要调控JAK-STAT中的哪一条通路,这几者间的关系还有待更深入的研究。以上结果证实,IRE1-XBP1的活性改变可以诱导KCs的极性变化。为进一步确认IRE1-XBP1通路诱导的KCs极性变化所产生的生物学效应改变,笔者将4组KCs分别与T淋巴细胞进行了共培养,发现抑制KCs中IRE1-XBP1通路,T淋巴细胞活化增殖能力被削弱,凋亡水平明显上升,且促炎细胞因子分泌受抑制,抑炎因子分泌上调。提示KCs提呈抗原激活T细胞的能力明显减弱,表现出类似于M2型KCs的生物学效应。而上调该通路,则表现出类似于M1型KCs的生物学效应。
综上所述,抑制KCs中IRE1-XBP1通路的活性,可以诱导M1样极化的KCs呈M2样转化,并表现出对炎症反应的负性调控效用。为进一步明确KCs中IRE1-XBP1通路在炎症反应亦或肝移植术后急性排斥反应中的作用积累一定的理论基础。
参考文献
[1]Wang FS,Fan JG,Zhang Z,et al.The global burden of liver disease:the major impact of China[J].Hepatology,2014,60(6):2099-2108.
[2]Germani G,Rodriguez-Castro K,Russo FP,et al.Markers of acute rejection and graft acceptance in liver transplantation[J].World J Gastroenterol,2015,21(4):1061-1068.
[3]Chen Y,Liu Z,Liang S,et al.Role of kupffer cells in the induction of tolerance of orthotopic liver transplantation in rats[J].Liver Transpl,2008,14(6):823-836.
[4]Liu YM,Chen Y,Li JZ,et al.Up-regulation of Galectin-9 in vivo results in immunosuppressive effects and prolongs survival of liver allograft in rats[J].Immunol Lett,2014,162(1 Pt A):217-222.
[5]Engel A,Barton GM.Unfolding new roles for XBP1 in immunity[J].Nat Immunol,2010,11(5):365-367.
[6]Martinon F,Chen X,Lee AH,et al.TLR activation of the transcription factor XBP1 regulates innate immune responses in macrophages[J].Nat Immunol,2010,11(5):411-418.
[7]Yang Q,Shi Y,He J,et al.The evolving story of macrophages in acute liver failure[J].Immunol Lett,2012,147(1/2):1-9.
[8]Sood S,Testro AG.Immune monitoring post liver transplant[J].World J Transplant,2014,4(1):30-39.
[9]Lawrence T,Natoli G.Transcriptional regulation of macrophage polarization:enabling diversity with identity[J].Nat Rev Immunol,2011,11(11):750-761.
[10]Sica A,Invernizzi P,Mantovani A.Macrophage plasticity and polarization in liver homeostasis and pathology[J].Hepatology,2014,59(5):2034-2042.
[11]He Y,Sun S,Sha H,et al.Emerging roles for XBP1,a sUPeR transcription factor[J].Gene Expr,2010,15(1):13-25.
The effect of IRE1-XBP1 pathway on regulation of polarization in activated Kupffer cells*
Hu Daren1,Cheng Li1,Liu Yan1,Liu Yiming2,Li Jinzheng2,Gong Jianping2,Gou Jianlin1△
(1.DepartmentofHepatobiliarySurgery,ChongqingThreeGorgesCentralHospital,Wanzhou,Chongqing404000,China;2.DepartmentofHepatobiliarySurgery,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China)
[Abstract]ObjectiveTo isolate and culture rats liver KCS,and to explore the effect of IRE1-XBP1 pathway on regulation of polarization in activated Kupffer cells(KCs).Methods(1)Rat KCs were isolated by Ⅳ type collagenase digestion and gradient centrifugation methods.(2)KCs were transfected and randomly divided into four groups:XBP1-shRNA group,Ctrl-shRNA group,AdV-XBP1 group and Ctrl-AdV group.(3)The transfection level of KCs XBP1,IL-6,IFN-γ,TNF-α and IL-17 were detected by RT-PCR;the protein expression level of JAK1,JAK2,STAT1 and STAT3 were evaluated by Western blot.(4)The changes of KCs expression type in each group were detected by flow cytometry (FCM) and the laser confocal.(5)T cells derived from rat spleen cells were co-cultured within the 4 groups of KCs mentioned above;T cells proliferation was measured by Brdu labeling assay.(6)T cells apoptosis was determined by Annexin V/PI FCM analysis.(7)The density of IL-6,IFN-γ,TNF-α,IL-17 and IL-10 in the supernatant of co culture was assessed by ELISA.Results(1)The mRNA and protein level of XBP1 were measured by RT-PCR and western blot,those in XBP1-shRNA group were significantly reduced compared with those in the other three groups,while in AdV-XBP1 groups,results demonstrated entirely the opposite tendency (P<0.05).(2)The expression of marker molecules on the surface of KCs such as MHC Ⅱ,CD86 and CD40 in XBP1-shRNA group were significantly lower (P<0.05),but CD204 and CD206 expression were much higher compared with the other three (P<0.05).However the expression tendency of these surface markers were shown the opposite results in AdV-XBP1 group (P<0.05).(3)Western blot revealed the XBP1-shRNA could statistically suppress the protein levels and phosphorylation of JAK1,JAK2,STAT1 and STAT3,which involved in the pro inflammatory cytokines regulation and KCs polarization (P<0.05).But in AdV-XBP1 group,these protein and its phosphorylation were markedly promoted (P<0.05).ELISA results collaborated with Western blot.(4)3 d after co cultured with KCs transfected with XBP1-shRNA,the levels of T lymphocyte proliferation and pro inflammatory cytokines secretion were significantly reduced,but the levels of T lymphocyte apoptosis and anti inflammatory cytokines secretion were remarkably enhanced(P<0.05).ConclusionBlockage of IRE1-XBP1 activation could alter the phenotype of active KCs to M2 like type and attenuated the capacity of antigen present of KCs,while up regulated the expression of IRE1-XBP1 pathway could change the phenotype of KCs to M1 type plus the promotion of antigen present capacity.
[Key words]X binding protein 1;Kupffer cells;polarization regulation
doi:·论著·10.3969/j.issn.1671-8348.2016.17.004
*基金项目:国家自然科学基金资助项目(81200329);重庆市卫生局项目( 2013-2-168)。
作者简介:胡大仁(1978-),主治医师,本科,主要从事肝胆胰腺疾病研究。△通讯作者,Tel:13896322336;E-mail:goujianlin8899@163.com。
[中图分类号]R392.4
[文献标识码]A
[文章编号]1671-8348(2016)17-2314-05
(收稿日期:2015-11-15修回日期:2016-01-04)

