STATs蛋白家族在口腔黏膜下纤维化及其并存口腔扁平苔藓中的表达及意义
万英明,齐 玲,田 晶,刘丽梅
(1.吉林医药学院附属医院口腔科 132021;2.吉林医药学院 132021)
STATs蛋白家族在口腔黏膜下纤维化及其并存口腔扁平苔藓中的表达及意义
万英明1,齐玲2,田晶2,刘丽梅1
(1.吉林医药学院附属医院口腔科132021;2.吉林医药学院132021)
[摘要]目的比较口腔黏膜下纤维化(OSF)、OSF并存扁平苔癣(OLP)及正常口腔黏膜组织中STATs蛋白家族的表达差异,探讨STATs蛋白家族在OSF并存OLP发生、发展中的作用机制。方法收集临床OSF病例21例 (OSF组)、OSF并存OLP13例(OSF并存OLP组),以及NBM组织10例(对照组),分离组织RNA,采用RT-PCR分析STATs蛋白家族(Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6)在OSF不同分期组织及OSF并存OLP组织中的表达差异。筛选表达差异较大的基因,进行免疫印迹杂交检测验证,并分析其磷酸化变化,探讨STATs蛋白家族在OSF并存OLP发生、发展中的作用机制。结果Stat1、Stat3、Stat5a的表达量与OSF分型呈正相关,即在OSF组中晚期黏膜组织样本中的表达量明显高于对照组(P<0.05),而Stat2、Stat4、Stat5b、Stat6在不同OSF分型中的表达量变化不显著(P>0.05)。Stat1和p-Stat1在OSF并存OLP组中的表达水平与对照组比较显著增加(P<0.05),Stat3和p-Stat3(Ser727)在OSF并存OLP组中的表达水平与对照组比较明显上调(P<0.05)。与对照组比较,Stat5a在OSF并存OLP组中显著上调,而p-Stat5a在各组中变化不显著。结论STATs蛋白家族成员Stat1、Stat3、Stat5a在OSF及其并存OLP中表达上调。
[关键词]口腔黏膜下纤维化;扁平苔藓;STATs
口腔黏膜下纤维化(oral submucous fibrosis,OSF) 是一种慢性口腔黏膜疾病,主要病理过程包括固有层的纤维组织变性和上皮萎缩,从而引起黏膜硬化,形成条索,最终引起牙关紧闭,妨碍口腔各种功能的发挥,并成为癌前状态[1]。口腔扁平苔癣(oral lichen planus,OLP)是一种慢性、浅在性炎症的角化性病变,临床表现包括上皮过度不全角化、上皮钉突形态不一,甚至伴有糜烂、馈荡。目前OLP的发病机制尚不完全明确,研究表明可能与免疫因素有关[2-3]。OSF和OLP都被WHO列为口腔癌前状态[4-5]。Pindbrog报道了OSF与OLP并存[6]。在我国目前OSF并存OLP的发病率约为6.5%[7]。OSF与OLP并存发生、发展机制的研究并不多见,而OSF与OLP并存可以导致患者张口受限、舌运动障碍甚至吞咽困难,同时OSF与OLP并存也是一种癌前状态,因此研究OSF与OLP并存的发生机制具有一定的临床意义。
STATs蛋白家族由是一种存在于细胞质,激活后能够转入核内,通过分子末端的DNA结合域与DNA结合的蛋白家族,能够与酪氨酸磷酸化信号通道耦联,发挥信号转导和转录调控作用。STATs异常表达或激活将导致细胞增殖和凋亡调节障碍,进而促进肿瘤的发生[8-9]。已经有大量研究表明,STATs的过度表达或激活存在于多种不同的人类肿瘤组织及细胞系。
本研究通过收集OSF、OLP病例,采用实时荧光定量PCR(RT-PCR)分析STATs蛋白家族在OSF不同分期组织及OSF并存OLP病例组织中的表达差异,探讨STATs蛋白家族在OSF并存OLP发生、发展中的作用机制,现报道如下。
1资料与方法
1.1一般资料
1.1.1临床组织样本按照Pindborg病理学标准及临床表现,选择收集吉林医药学院附属医院2013年4月至2015年8月就诊,并经过两名病理科医师光镜下确诊分期病例,OSF病例21例 (OSF早、中、晚期各7例,OSF组)、OSF并存OLP13例(OSF并存OLP组),以及正常口腔黏膜组织10例(对照组),组织样本釆集前均经吉林医药学院附属医院医学伦理学委员会批准,并获得患者签署知情同意书。患者性别及年龄分布见表1。
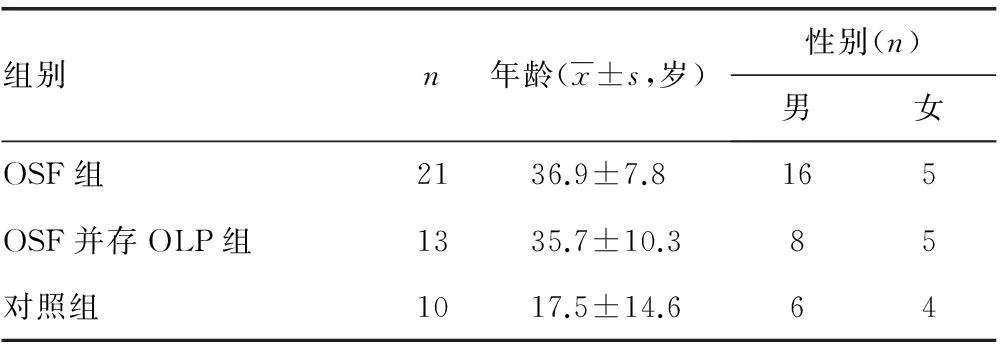
表1 临床资料年龄、性别分布
1.1.2药物试剂及仪器设备RNA提取试剂盒:购自Ambion(美国)-12183-555;逆转录试剂盒:购自Applied Biosystems(美国)-4366597;RT-PCR试剂盒:购自Bio-Rad(美国)-172-5264;Ready Prep蛋白质萃取试剂盒:购自Bio-Rad(美国);BCA蛋白质定量试剂盒:购自Vazyme Biotech(中国);Stat1、p-Stat1、Stat3、p-Stat3、Stat5a、p-Stat5a单克隆抗体:购自Santa Cruz Biotechnology(美国);辣根过氧化物酶(HRP)标记的二抗:购自北京中杉金桥生物;ECL Chemiluminescent Substrate Reagent Kit:购自Novex (美国)-WP20005;核酸定量分析仪:Qubit Fluorometer;RT-PCR 检测系统:Bio-rad-CFX96 Touch。
1.2方法
1.2.1RT-PCR测定收集的临床组织样本,经PBS(Rnase free)清洗并标记后储存于液氮。提取组织总RNA(按照RNA提取试剂盒说明进行)。Qubit Fluorometer检测RNA水平及纯度,按逆转录试剂盒说明书,将总RNA逆转录cDNA,RT-PCR检测相关基因。在NCBI数据库中查询Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6基因的mRNA序列,设计RT-PCR引物,引物委托上海生工合成。通过测定每个基因扩增的Ct值,Ct值与DNA起始拷贝数呈负相关性,以双△Ct 值法计算靶基因的相对表达水平:3次平行重复实验的平均值作为每个样本的CT值,△CT =CT(Target Gene)-CT(内参),△△CT= △CT(sample)-△CT (control),因此目的基因相对表达水平=2-△△CT,对照组的相对表达量即为20=1[10]。
1.2.2免疫印迹杂交口腔黏膜组织用RIPA裂解液裂解(加入蛋白酶抑制剂cocktail),吹打混匀。超声波裂解细胞,探针型超声冰上进行适当频率的短促冲击,裂解混合物于4 ℃,13 000 r/min离心20 min。吸取上清液于新的离心管中,用Protein Assay Kit测定蛋白水平。蛋白样品经十二烷基-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后的凝胶浸于转移缓冲液中平衡10 min,装配转移“三明治”,100 V,45~60 min。转膜结束后,用TBS漂洗PVDF膜10~15 min;将膜置入含5%(w/v) 脱脂牛奶的TBS/T封闭缓冲液中,室温摇动1 h,加入合适稀释度的一抗[用含1%(w/v)脱脂牛奶的TBST稀释],室温孵育2 h,TBST漂洗膜3次,每次5~10 min;用含0.05%(w/v)脱脂牛奶的TBST稀释的二抗(1∶10 000,HRP标记)孵育膜,室温孵育1 h;TBST漂洗膜3次,每次5~10 min。曝光,照相保存实验结果。Quantity One v4.62软件分子条带灰度值(条带轨迹定量法),以目的蛋白/内参蛋白的半定量数值作为定量根据,并作统计分析。

2结果
2.1STATs蛋白家族在不同分期OSF、OSF并存OLP病例中表达的差异Stat1、Stat3、Stat5a的表达量与OSF分型呈正相关,即在OSF组中晚期黏膜组织样本中的表达量明显高于对照组(P<0.05),而Stat2、Stat4、Stat5b、Stat6在不同OSF分型中的表达量变化不显著(P>0.05)。Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6在OSF并存OLP组中表达均高于对照组,其中Stat1、Stat3、Stat5a、Stat5b变化显著(P<0.05),见图1。

图1 STATs蛋白家族的表达差异分析
2.2OSF并存OLP组中Stat1、Stat3、Stat5a的活化状态比较根据RT-PCR试验结果,笔者筛选出OSF并存OLP组与对照组相比,变化显著的分子(Stat1、Stat3、Stat5a),免疫印迹杂交检测蛋白水平上述分子的变化情况,并进一步检测其活化形式-磷酸化水平在各组病例中的表达情况。结果表明Stat1和p-Stat1在OSF并存OLP组中的表达水平与对照组相比显著增加(P<0.01),Stat3和p-Stat3(Ser727)在OSF并存OLP组中的表达水平与对照组相比明显上调,差异有统计学意义(P<0.05)。Stat5a在OSF并存OLP组中显著上调(与对照组比较),而p-Stat5a在各组中变化不显著(图2)。
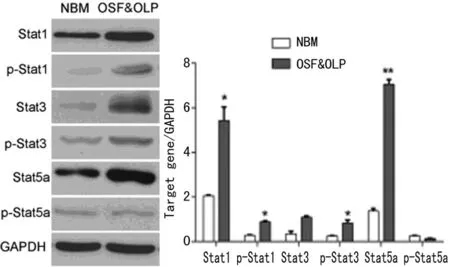
图2 Stat1、Stat3、Stat5a的磷酸化变化
3讨论
OSF是一种慢性、隐匿性的口腔黏膜病,易发于颊、软腭、唇、舌、口底、咽等部位,具有癌变倾向,临床表现主要包括,口腔黏膜上皮增生或萎缩、黏膜下层胶原的堆积和变性,在OSF中、后期出现血管闭塞、开口困难。OSF的具体机制目前尚不清楚,但咀嚼槟榔、遗传、免疫反应等因素被认为是导致OSF的综合因素,这些因素共同作用导致了OSF的发生[11-12]。OLP也是常见的慢性口腔黏膜病之一,临床上可以表现为多种复杂的联合病损,比如丘疹样的、斑块样的以及溃疡性的病变[13-14]。Pindbrog于1970年报道OSF与OLP并存[6],我国目前OSF并存OLP的发病率约为6.5%。由于OSF、OLP都被WHO列为癌前状态,因此,了解OSF、OLP的具体发生机制,对于预防治疗口腔肿瘤具有一定的指导意义。
从病理改变角度出发,细胞外基质的降解/合成平衡的紊乱是导致OSF的主要原因,主要的病理改变表现为上皮细胞形态学变化和结缔组织成分和结构的改变两个部分[15]。在OSF早期,炎性反应是重要的病理表现,随着病程延续,大量炎性分子的异常表达引起核转录因子κB(NF-κB)、转录因子AP-1(TFAP-1)及信号转导子和转录激活因子STATs的异常激活,并最终引起细胞凋亡调控异常[16-17]。上皮过度角化、上皮下固有层淋巴细胞带状浸润及基底层细胞液化变性是OLP的主要病理特征。研究表明,OLP的发生与转录因子的异常表达或激活具有相关性。临床研究表明OSF并存OLP的病理改变可以同时具有OSF、OLP的一些基本病理改变,例如在一些部位可以观察到在OSF病理改变的基础上出现了如固有层淋巴细胞浸润带、基底细胞液化变性等OLP的特征性病理改变[18-19]。
STATs蛋白家族由Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6 7个成员组成,由750~850个氨基酸组成,成员分子均含有N端结构域、DNA结构域,以及SH2/SH3结构域,以及具有转录活性功能的结构域。在生长因子、细胞因子等信号分子刺激激活后改变构型形成二聚体,并在核内聚集,结合特定的靶DNA启动子序列,促进相应的基因的转录,发挥调节细胞的生长、分化、凋亡等生物学效应,是肿瘤发生信号通路中非常的调控因子,处于持续激活状态的STATs在肿瘤的发生、发展中起着重要作用[20-21]。本研究表明,Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6在各组病例黏膜组织中的表达有差异。Stats各成员分子羧基端差异较大,因此具有相对特异的功能,Stat1、Stat2主要参与了干扰素的信号传导,而Stat4和Stat6则主要调节T细胞的分化过程,Stat3、Stat5可以被多种细胞因子激活,发挥更加复杂的生物学效应。实验结果表明,Stat1、Stat3、Stat5a的表达量与OSF分型呈正相关,即在OSF组中晚期黏膜组织样本中的表达量明显高于对照组(P<0.05),而Stat2、Stat4、 Stat5b、Stat6在不同OSF分型中的表达量变化不显著(P>0.05)。进一步研究OSF并存OLP组及对照组中STATs的表达变化,Stat1、Stat2、Stat3、Stat4、Stat5a、Stat5b、Stat6在OSF并存OLP组中的表达量均高于对照组,其中Stat1、Stat3、Stat5a、Stat5b变化显著(P<0.05)。
磷酸化修饰是Stats家族蛋白重要的翻译后修饰,JAK-STST信号通路的激活正是通过磷酸化过程来实现的[22]。因此,笔者选择表达水平变化较大的分子考察其磷酸化变化的水平。与RT-PCR结果一致,即Stat1在OSF并存OLP组中的表达水平与对照组比较显著增加(P<0.05),同时其活化形式p-Stat1在OSF并存OLP组中也显著上调,说明在OSF并存OLP状态下,Stat1处于异常活化的状态。Stat3和p-Stat3(Ser727)在OSF并存OLP组中的表达水平与对照组相比明显上调,差异有统计学意义(P<0.05)。与对照组比较,Stat5a在OSF并存OLP组中显著上调,而p-Stat5a在各组中变化不显著。对于这一结果,笔者认为可能的原因是Stat5a在OSF或OLP过程中表达量上调,但其活化过程存在组织特异性,在口腔黏膜组织中发生磷酸化水平较低。而Stats家族蛋白活化过程在OSF、OLP过程中的具体作用机制,将是下一步的研究方向。
参考文献
[1]Kamath VV.Surgical interventions in oral submucous fibrosis:a systematic analysis of the literature[J].J Maxillofac Oral Surg,2015,14(3):521-531.
[2]Krupaa RJ,Sankari SL,Masthan KM,et al.Oral lichen planus:An overview[J].J Pharm Bioallied Sci,2015,7(Suppl 1):S158-S161.
[3]李敏.MMP-9在口腔黏膜下纤维化及其并存口腔扁平苔藓中的表达及意义[D].长沙:中南大学,2012.
[4]Shivakumar HR,Batra J,Upasi AP,et al.Evaluation of elongated styloid process in patients with oral submucous fibrosis using panoramic radiographs[J].J Maxillofac Oral Surg,2014,13(4):556-559.
[5]Yanjia H,Xinchun J.The role of epithelial-mesenchymal transition in oral squamous cell carcinoma and oral submucous fibrosis[J].Clin Chim Acta,2007,383(1/2):51-56.
[6]Keshav R,Narayanappa U.Expression of proliferating cell nuclear antigen (PCNA) in oral submucous fibrosis:an immunohistochemical study[J].J Clin Diagn Res,2015,9(5):ZC20-ZC23.
[7]孟庆玉,彭解英.OSF并存OLP患者临床资料分析及病理研究[J].中国实用口腔科杂志,2011,4(2):43-45.
[8]Meier JA,Larner AC.Toward a new STATe:the role of STATs in mitochondrial function[J].Semin Immunol,2014,26(1):20-28.
[9]Qi ZL,Yin F,Lu LA,et al.Baicalein reduces lipopolysaccharide-induced inflammation via suppressing JAK/STATs activation and ROS production[J].Inflamm Res,2013,62(9):845-855.
[10]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)] method[J].Methods,2001,25(4):402-408.
[11]Franchi A,Gallo O,Paglierani M,et al.Inducible nitric oxide synthase expression in laryngeal neoplasia:correlation with angiogenesis[J].Head Neck,2002,24(1):16-23.
[12]李明,彭解英.微血管病变与口腔黏膜下纤维性变[J].临床口腔医学杂志,2006,22(10):635-636.
[13]马哲.口腔扁平苔藓发病及其恶变机理的探讨[D].石家庄:河北医科大学,2008.
[14]Alves MG,Do Carmo Carvalho BF,Balducci I,et al.Emotional assessment of patients with oral lichen planus[J].Int J Dermatol,2015,54(1):29-32.
[15]胥红,刘蜀凡,沈子华,等.口腔粘膜下纤维性变组织中Ⅰ型和Ⅲ型胶原免疫组化及定量分析[J].实用口腔医学杂志,2000,16(1):52-54.
[16]Kaur J,Jacobs R.Proinflammatory cytokine levels in oral lichen planus,oral leukoplakia,and oral submucous fibrosis[J].J Korean Assoc Oral Maxillofac Surg,2015,41(4):171-175.
[17]Khan I,Kumar N,Pant I,et al.Activation of TGF-β pathway by areca nut constituents:a possible cause of oral submucous fibrosis[J].PLoS One,2012,7(12):e51806.
[18]谢迪.MC及MCT在口腔黏膜下纤维化及其并存口腔扁平苔藓中的表达研究[D].长沙:中南大学,2012.
[19]Que GY,Peng JY.Oral submucous fibrosis complicated with lichen planus disease[J].Hunan Yi Ke Da Xue Xue Bao,2000,25(2):200.
[20]Yang J,Chatterjee-Kishore M,Staugaitis SM,et al.Novel roles of unphosphorylated STAT3 in oncogenesis and transcriptional regulation[J].Cancer Res,2005,65(3):939-947.
[21]刘玮玮.STATs蛋白家族在口腔黏膜白斑癌变中的作用研究[D].广州:南方医科大学,2011.
[22]Kile BT,Schulman BA,Alexander WS,et al.The SOCS box:a tale of destruction and degradation[J].Trends Biochem Sci,2002,27(5):235-241.
作者简介:万英明(1974-),副主任医师,硕士,主要从事口腔修复学、口腔种植医学、口腔生物力学研究工作。
doi:·经验交流·10.3969/j.issn.1671-8348.2016.16.032
[中图分类号]R246.83
[文献标识码]B
[文章编号]1671-8348(2016)16-2254-04
(收稿日期:2015-12-15修回日期:2016-02-26)

