多通道微电极记录引导下精准定位丘脑底核感觉-运动区
王军,罗晓光,任艳,何志义,王运杰
(中国医科大学附属第一医院1.神经外科;2.神经内科,沈阳 110001)
·短篇论著·
多通道微电极记录引导下精准定位丘脑底核感觉-运动区
王军1,罗晓光2,任艳2,何志义2,王运杰1
(中国医科大学附属第一医院1.神经外科;2.神经内科,沈阳 110001)
摘要目的探讨多通道微电极记录技术在脑深部电刺激术(DBS)中定位丘脑底核(STN)感觉-运动区中的意义。方法对22侧多通道微电极记录下DBS术中STN的电生理学结果进行分析,并与同期20侧单通道微电极记录下STN的电生理学结果进行比较。结果多通道微电极记录下22侧DBS术中共行64根微电极记录,其中21侧(95.5%)可以确切记录到STN的感觉-运动诱发电位,1侧可以确切记录到STN的常规放电,21侧最佳电生理学针道记录到STN放电的平均长度为(5.58±0.53)mm,其中STN感觉-运动诱发电位的平均长度为(3.27±1.54)mm;而20侧单通道微电极记录到STN放电的平均长度为(5.02±1.01)mm,其中13侧(65.0%)可记录到STN的感觉-运动诱发电位,平均长度为(1.36±0.98)mm,7侧仅可以确切记录到STN的常规放电。22 侧STN多通道微电极记录下13侧最终选择靶点与术前的解剖定位一致,吻合率为59.1%,9侧STN解剖定位靶点与电生理学功能靶点存在差异。结论DBS术中多通道微电极记录与单通道微电极记录相比,在记录到的STN放电的平均长度、感觉-运动诱发电位平均长度、确认STN感觉-运动区概率及选择最佳植入针道等多方面均有明显优势,这对DBS术中确保植入电极位置的精准提供了前提。
关键词丘脑底核;帕金森病;微电极;电生理记录
网络出版地址
丘脑底核(subthalamic nucleus,STN)是原发性帕金森病行脑深部电刺激术(deep brain stimulation,DBS)中最常用的电极植入靶点,其大小约10 mm× 10.5 mm×7 mm[1],即使如此小的神经核团,依然分为3部分:感觉-运动区、联络区和边缘区[2]。既往研究[3]发现,DBS术中将电极植入STN的感觉-运动区其术后临床效果最佳,而DBS术中STN感觉-运动区的确认则涉及微电极记录下的神经电生理功能监测[4]。目前,国内绝大多数DBS植入中心多在单通道微电极记录下确认STN感觉-运动区,但阳性率不高,为进一步提高DBS术中STN感觉-运动区确认的概率,本中心采用多通道微电极记录技术,发现DBS术中确认STN感觉-运动区的概率显著增高。
1 材料与方法
1.1一般资料
本组病例来自2015年3月至2015年10月间在中国医科大学附属第一医院帕金森及运动障碍病中心接受DBS手术的原发性帕金森病患者。其中多通道微电极记录下的DBS手术共计11例患者22 侧STN核团,患者年龄58~77岁,平均62.9岁,病史5~11年,平均7.2年。同期单通道微电极记录下的DBS手术共计10例患者20侧STN核团作为对照,患者年龄48~73岁,平均62.4岁,病史5~20年,平均8.1年。
1.2术中影像学解剖靶点选择标准
术中根据神经影像学扫描结果+手术计划系统,初步从解剖学上定位STN及其内多个可能适合的植入靶点(“红核参考法”,冠状位:STN背外侧部,即AC⁃PC下约4 mm;轴位:红核前缘+STN轴位中点偏外1~2 mm,即AC⁃PC旁约12 mm,AC⁃PC中点后约2 mm),多靶点选择后以中间针道靶点作为既定“理想植入靶点”。
1.3术中STN电生理学信号分析
根据术中微电极记录到的神经核团的放电情况,包括动作电位的放电模式(规则性、不规则性和震颤细胞放电)、放电频率、放电幅度以及背景噪音等综合判断是否为STN核放电,并进一步根据躯体感觉-运动诱发电位情况(图1),判断微电极在STN感觉-运动区中走行的距离。

图1 多通道微电极记录中躯体感觉-运动诱发电位情况Fig.1 Sensory-motor activated potentials recorded multiple electrophysiological recording electrodes
2 结果
本组所有STN在DBS术中电极植入前均行微电极记录,其中多通道微电极记录下22侧DBS术中共行64根微电极记录,其中21侧(95.5%)可以确切记录到STN的感觉-运动诱发电位,1侧可以确切记录到STN的常规放电,多通道中最佳电生理记录针道可记录到STN放电的平均长度为(5.58±0.53)mm,其中STN的感觉-运动诱发电位平均长度为(3.27±1.54)mm。而20侧单通道微电极可记录到STN放电的平均长度为(5.02±1.01)mm,其中13侧(65%)可记录到STN的感觉-运动诱发电位,平均长度为(1.36±0.98)mm,7侧仅可以确切记录到STN的常规放电。
此外,多通道微电极记录术中可根据STN电生理学结果选择最佳植入针道,其中13侧与术前的解剖定位靶点一致,吻合率为59.1%,9侧STN解剖定位靶点与电生理学功能靶点存在差异,其中6侧STN在轴位和冠状位相上其功能靶点位于理想解剖靶点针道的前方针道(二者相距2 mm),3侧STN在轴位和冠状位相上其功能靶点位于理想解剖靶点针道的外侧方针道(二者相距2 mm)(图2),术后薄层核磁共振扫描并与术中定位相结果融合,证实植入电极的位置与术中电生理学确认的功能靶点一致。
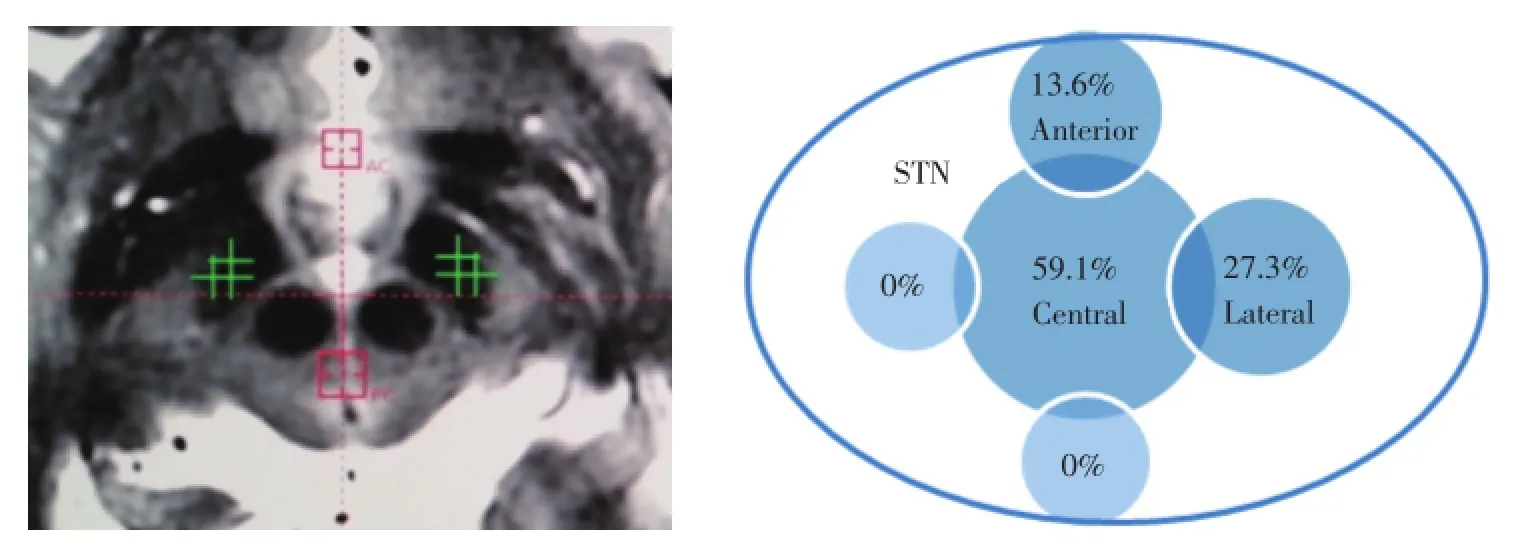
图2 前、中、外多通道微电极记录下最终针道选择情况Fig.2 The final choice in multiple electrophysiological recording electrodes
3 讨论
高频DBS是神经外科领域手术治疗原发性帕金森病最常用的术式[5],经长时间随访证明不仅可显著改善患者的震颤、僵直、运动迟缓等运动症状[5⁃7],同时对一些非运动症状,如疼痛、焦虑、睡眠障碍等,也有不同程度的改善[7⁃8]。采用帕金森病综合评分量表评定发现,DBS术后1年、5年及11年运动功能评分结果均较术前有显著改善[7],证明原发性帕金森病DBS手术效果是长期的。
既往研究发现,确保DBS手术效果长期有效的前提是颅内植入电极位置的精准,为此不同中心术中采取不同的技术和手段以确保植入不同神经核团电极位置的精准,如术中微电极记录神经元放电(动作电位)情况[9⁃10]、术中核磁共振扫描[11]或CT扫描[12]等。目前,多数学者认为术中微电极记录不同核团的神经元电生理情况是功能上确认该核团的“金标准”[10,13],但术中微电极记录系统又分为单通道微电极记录技术(记录电极根数=1)和多通道微电极记录技术(记录电极根数≥3)。目前国内绝大多数中心采用的是单通道微电极记录技术,而国际大型DBS植入中心则多采用多通道微电极记录技术,这不仅可根据术中记录到的神经元放电情况对不同核团进行初步判定,而且还能对同一核团的不同亚区进行功能鉴定,并且可根据不同微电极记录神经元放电的情况选择最佳植入针道进而最终完成颅内电极的植入。有研究发现,多通道微电极记录下电极植入STN的帕金森病患者术后运动功能的改善显著优于单通道微电极记录下电极植入的患者[3]。因此,本中心通过对同期实施手术的11例帕金森病患者22侧STN在DBS术中多通道微电极记录下的电生理学结果进行初步分析,并与同期10例帕金森病患者20侧单通道微电极记录下STN电生理学结果进行比较,探讨多通道微电极记录技术在DBS术中定位STN及其亚区中的意义。
本组帕金森病患者DBS术中均选择STN作为电极植入的靶点,由于STN从功能学上可分为感觉-运动区、联络区、和边缘区3部分,而电极植入到STN的感觉-运动区是确保术后良好效果的前提,但普通的MRI扫描仅可以初步勾勒出STN的解剖形态,无法从功能学上准确判断其感觉-运动区的位置。因此,本组病例每侧STN植入术中均行微电极记录。在微电极记录的过程中,如果电极进入STN的感觉-运动区,此时对肢体进行的感觉或运动刺激可产生感觉-运动诱发电位,以此可确认微电极进入STN的感觉-运动区(图1)。本研究结果发现,在实施多通道微电极记录下22侧DBS术中,共行64根微电极记录,其中21侧(95.5%)一次三通道微电极记录就可以确切记录到STN的感觉-运动诱发电位,仅1侧未确切记录到STN的感觉-运动诱发电位,但可以确切记录到STN的常规放电。而20侧单通道微电极记录结果分析发现,包括调整记录电极针道位置后,总计13侧(65.0%)可确切记录到STN的感觉-运动诱发电位,说明二者在确认STN感觉-运动区上的概率差异明显。而且多通道中最佳电生理记录针道可记录到STN放电的平均长度为(5.58±0.53)mm,其中STN感觉-运动诱发电位平均长度为(3.27±1.54)mm;而20侧单通道微电极可记录到STN放电的平均长度为(5.02±1.01)mm,感觉-运动诱发电位平均长度为(1.36±0.98)mm,证明多通道微电极记录技术在描计STN放电的平均长度、感觉-运动诱发电位平均长度等方面均有明显优势。
此外,本研究还发现多通道微电极记录技术在帮助术者选择最佳植入电极针道方面也有单通道微电极记录无法替代的优势,即术前通过MRI定位的STN最佳解剖植入区与术中STN电生理学结果不一致时,多通道微电极记录术中则可以根据不同记录电极针道的具体电生理学结果选择最佳植入针道。本研究发现,相当比例的患者术前通过MRI解剖定位的电极植入“理想靶点”不是其功能学上的最佳靶点(即解剖学和功能学不一致的情况),22侧STN中13侧与术前的解剖定位靶点一致(吻合率为59.1%),9侧STN解剖定位靶点与电生理学功能靶点存在差异(40.9%),其中6侧患者在轴位和冠状位相上其功能靶点位于理想解剖靶点针道的前方针道(二者相距2 mm),3侧STN在轴位和冠状位相上其功能靶点位于理想解剖靶点针道的外侧方针道(二者相距2 mm)(图2)。有文献报道,这种解剖学定位和功能学定位不一致的现象常见,还有研究发现多通道微电极记录术中仅32%~36%的最终植入电极选择的针道是中间针道,即术前MRI定位扫描后确认的解剖靶点针道,而其余64%~68%最终植入电极针道是非中间针道[3],因此认为DBS术中应用多通道微电极记录是必要的。而笔者认为这种最佳植入针道选择情况在单通道微电极记录中很难实现,原因在于DBS术中只用一根微电极记录时没有可同时进行比较的对象,所以不能直接判定中间微电极记录到的电生理信号是否是最佳的,更不能直接选择其他针道植入电极,而只能是退出中间针道的微电极后重新进行其他针道的电生理监测或移动靶点后再监测。此时由于单通道套管针较粗,反复穿刺中间针道周边2 mm左右的脑皮层可能会造成局部皮层的挫伤,而微小距离调整坐标靶点后再从同一皮层穿刺点进入难免会使微电极记录针走行针道与前一靶点针道重叠,最终影响电生理结果判断。所以笔者认为DBS术中选择多通道微电极记录不仅可以显著提高最终植入电极的准确率,而且在解剖学认定为最佳植入靶点的中间针道电生理学信号不佳时,可避免单通道微电极记录时出现的反复调整针道穿刺或调整靶点后反复局部穿刺带来的风险以及手术时间大幅延长。
此外,本研究发现多通道微电极记录术中并未增加手术出血的风险,在22侧多通道微电极记录中无1例发生症状性出血,这与既往的研究结果一致[3,13]。本研究不足之处是样本量较少,需要继续增加样本量进行更加深入细致的研究。相信在未来对更多样本量和数据分析的基础上,会得出更加具有临床指导意义的结论。
综上所述,本研究是对多通道微电极记录技术在STN DBS术中应用的初步分析,结果表明多通道微电极记录技术在记录STN放电的平均长度、感觉-运动诱发电位平均长度、确认STN感觉-运动区概率及选择最佳植入针道等多方面均有明显优势,这对DBS术中精准电极植入提供了关键的技术保障。
参考文献:
[1]BEJJANI BP,DORMONT D,PIDOUX B,et al.Bilateral subthalam⁃ic stimulation for Parkinson's disease by using three-dimensional stereotactic magnetic resonance imaging and electrophysiological guidance[J].J Neurosurg,2000,92(4):615-625.
[2]LOURENS MA,MEIJER HG,CONTARINO MF,et al.Functional neuronal activity and connectivity within the subthalamic nucleus in Parkinson's disease[J].Clin Neurophysiol,2013,124(5):967-981.
[3]TEMEL Y,WILBRINK P,DUITS A,et al.Single electrode and mul⁃tiple electrode guided electrical stimulation of the subthalamic nu⁃cleus in advanced Parkinson's disease[J].Neurosurgery,2007,61 (5 Suppl 2):346-355,355-357.
[4]LYONS MK,ZIEMBA K,EVIDENTE V.Multichannel microelec⁃trode recording influences final electrode placement in pallidal deep brain stimulation for Parkinson's disease:report of twenty con⁃secutive cases[J].Turk Neurosurg,2011,21(4):555-558.
[5]BENABID AL,CHABARDES S,MITROFANIS J,et al.Deep brain stimulation of the subthalamic nucleus for the treatment of Parkin⁃son's disease[J].Lancet Neurol,2009,8(1):67-81.
[6]JANSSEN ML,DUITS AA,TURAIHI AM,et al.Subthalamic nucle⁃us high-frequency stimulation for advanced Parkinson's disease:motor and neuropsychological outcome after 10 years[J].Stereotact Funct Neurosurg,2014,92(6):381-387.
[7]RIZZONE MG,FASANO A,DANIELE A,et al.Long-term outcome of subthalamic nucleus DBS in Parkinson's disease:from the ad⁃vanced phase towards the late stage of the disease?[J].Parkinson⁃ism Relat Disord,2014,20(4):376-381.
[8]TRAMONTANA MG,MOLINARI AL,KONRAD PE,et al.Neuro⁃psychological effects of deep brain stimulation in subjects with early stage Parkinson's disease in a randomized clinical trial[J].J Par⁃kinsons Dis,2015,5(1):151-163.
[9]BENAZZOUZ A,BREIT S,KOUDSIE A,et al.Intraoperative micro⁃recordings of the subthalamic nucleus in Parkinson's disease[J]. Mov Disord,2002,17(Suppl 3):S145-S149.
[10]GROSS RE,KRACK P,RODRIGUEZ-OROZ MC,et al.Electro⁃physiological mapping for the implantation of deep brain stimula⁃tors for Parkinson's disease and tremor[J].Mov Disord,2006,21 (Suppl 14):S259-S283.
[11]FOLTYNIE T,ZRINZO L,MARTINEZ-TORRES I,et al.MRI-guided STN DBS in Parkinson's disease without microelectrode re⁃cording:efficacy and safety[J].J Neurol Neurosurg Psychiatry,2011,82(4):358-363.
[12]BURCHIEL KJ,MCCARTNEY S,LEE A,et al.Accuracy of deep brain stimulation electrode placement using intraoperative comput⁃ed tomography without microelectrode recording[J].J Neurosurg,2013,119(2):301-306.
[13]KINFE TM,VESPER J.The impact of multichannel microelec⁃trode recording(MER)in deep brain stimulation of the basal gan⁃glia[J].Acta Neurochir Suppl,2013,117(1):27-33.
(编辑陈姜)
网络出版时间:
中图分类号R742.5
文献标志码A
文章编号0258-4646(2016)07-0644-05
DOI:10.12007/j.issn.0258⁃4646.2016.07.015
作者简介:王军(1981-),男,副教授,博士后.
通信作者:王运杰,E-mail:wyj024@vip.sina.com
收稿日期:2015-12-22
Multiple Microelectrode Guided Precise Positioning of Sensory⁃motor Area of the Subthalamic Nucleus
WANG Jun1,LUO Xiaoguang2,REN Yan2,HE Zhiyi2,WANG Yunjie1
(1.Department of Neurosurgery,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Neurology,The First Hospital,China Medical University,Shenyang 110001,China)
AbstractObjectiveTo explore the significance of multiple microelectrode guided technique in determining the sensory⁃motor area of the sub⁃thalamic nucleus(STN)in deep brain stimulation(DBS)surgeries.MethodsA total of 22 electrophysiological recording data of STNs recorded by multiple microelectrode was retrospectively analyzed,while another 20 electrophysiological recording data of STNs recorded by a single micro⁃electrode was recruited as the control group.ResultsA total of 64 microelectrodes were used in 22 STNs guided by multiple electrophysiological recording electrodes.Sensory or motor activated potentials were recorded in 21 sides(95.5%),while regular discharge was recorded in one side. The average length of typical STN activity on the optimal channel of multiple electrophysiological recording electrodes was 5.58±0.53 mm,and the average length of sensory or motor activated potentials was 3.27±1.54 mm.In contrast,the average length of typical STN activity recorded by single microelectrode was 5.02±1.01 mm.However,sensory or motor activated potentials were recorded in 13 sides(65.0%)with the average length of 1.36±0.98 mm.Among the 22 STNs guided by multiple electrophysiological recording electrodes,the final implanted target was consistent with the initially selected anatomic target in 13 sides(coincidence rate,59.1%).In 9 sides,the electrophysiological target was inconsistent with the initially selected anatomic target.ConclusionSTN DBS performed with multiple electrophysiological recording electrodes resulted in better outcomes of recording of the average length of typical STN activity or the average length of sensory or motor activated potentials of STN,final confirmation of STN sensory motor area and determination of the optimal channel of implantation.Application of multiple electrophysiological recording electrodes provides a premise for the precise electrode placement in STN DBS surgeries.
Keywordssubthalamic nucleus;Parkinson’s disease;microelectrode;electrophysiological recording

