钙和硼对菊花品种金陵丰收花粉萌发及花粉管生长的影响
韩霜

摘要:以国庆小菊金陵丰收为试验材料,使用的培养基是ME3+150 g/L PEG4000)+100 g/L 蔗糖),添加不同浓度钙和硼酸,研究不同浓度的钙和硼酸对国庆菊花粉萌发和花粉管生长的影响,旨在获得菊花花粉离体萌发最佳培养基。结果发现:硼酸对花粉萌发率影响明显,当硼酸浓度是100 mg/L时,花粉培养2 h时花粉萌发率达到最高,为1005%。外源钙能促进花粉的萌发,并影响花粉管的生长速度和生长质量,一定浓度的钙使花粉管生长笔直,在钙浓度为400 mg/L时金陵丰收花粉管生长状况最佳。外源钙浓度过高和培养时间过长时,花粉管生长出现细弱、畸形,而且容易断落。
关键词:菊花;离体培养;花粉萌发率;花粉管生长
中图分类号:S682.1+10.4+3文献标志码: A文章编号:1002-1302(2016)05-0258-03
菊花(Chrysanthemum morifolium)是我国十大传统名花和世界四大切花之一,具有很高的观赏价值。我国是菊花的起源中心,拥有3 000余个菊花品种[1]。菊花是异花授粉植物,具有自交不亲和特性,花粉生活力是决定杂交结实的重要因素之一,因此研究花粉活力对指导菊花育种具有重要理论和现实意义[2]。花粉的萌发与生长[3]要通过吸涨、停滞、花粉管发端、花粉管迅速伸长这4个阶段。研究报道,许多植物的花粉可以在培养基上萌发,如杜纪红等[3]、杜玉虎等[4]、储立明等[5]分别对桃、榆叶梅、丝瓜等花粉进行了离体培养研究。
国庆菊是菊花中的一种栽培类型,不仅具有生长繁盛、开花期长、分枝性强的优点,而且营造景观效果好、耐盐碱、成活率高[6]。花粉萌发和花粉管生长是植物受精的一个重要组成部分,不少研究表明,花粉萌发时引发的群体效应可由外源钙离子来替代,这种作用对花粉萌发和花粉管生长过程很重要[7-8]。花粉管萌发和生长需要硼的作用,花粉管顶端聚集的酯化果胶[9],是由细胞壁上聚集了细胞中多数的硼,与果胶类物质RG-Ⅱ(鼠李半乳糖醛酸-Ⅱ)结合形成的,这种酸性果胶物质有利于顶端的延展,整个花粉管内遍布这种酸性的果胶物质,使细胞壁机械强度增大[10],从而推测,硼酸可能与RG-Ⅱ结合形成果胶网络的结构,这种结构能调节细胞壁结构和性质,硼酸可防止酚类物质的积累,促进花粉管的生长[11]。本研究对国庆小菊金陵丰收花粉离体萌发培养基成分及其浓度和萌发时间进行研究,以期获得菊花最适宜的离体培养条件,为花粉萌发和活力测定提供高效、简便的方法。
1材料与方法
1.1试验材料
供试材料为菊花品种金陵丰收,该品种初花期在9月下旬,盛花期在10月中旬,该材料由南京农业大学菊花种质资源中心提供。
1.2试验方法
1.2.1花粉采集于晴天中午12:00,采取金陵丰收盛开花朵的花粉,装到离心管中,避光,备用。
1.2.2花粉萌发培养基的确定
1.2.2.1培养基成分以 ME3+150 g/L PEG4000)+100 g/L 蔗糖为培养基[1],培养基中ME3[12]的基本成分包含大量元素:370 mg/L MgSO4·7H2O、950 mg/L KNO3、412.5 mg/L NH4NO3、175 mg/L KCl、85 mg/L KH2PO4;微量元素:0.83 mg/L KI、7.45 mg/L Na2 EDTA、0.25 mg/L Na2MoO4·2H2O、0.025 mg/L CuSO4·5H2O、0.025 mg/L FeSO4·7H2O、0.025 mg/L CoCl2·6H2O;维生素B1、维生素B6各1 mg/L。
1.2.2.2 培养基设置在ME3+150 g/L PEG4000+100g/L 蔗糖的培养基[1]中加入不同浓度的钙和硼酸,其中硼酸浓度分别为5、50、100、200 mg/L,钙浓度分别为0、200、400、800 mg/L,以ME3+150 g/L PEG4000+100 g/L 蔗糖+ 0 mg/L 硼酸的培养基为对照(CKⅠ),再分别加入上述浓度的硼酸,得出最适的硼酸浓度A;再加入上述浓度的外源钙,以ME3+150 g/L PEG4000+100 g/L蔗糖+A浓度硼酸的培养基为对照(CKⅡ),从而得出最适的钙浓度B。
1.2.3花粉萌发与花粉管长度检测
1.2.3.1花粉萌发方法花粉萌发方法参照赵宏波等的方法[13加以修改,将采集来的菊花花粉,从离心管里倒出,放于玻璃纸上,然后用毛笔蘸取,轻撒适量的花粉到凹形载玻片的凹槽中,用胶头滴管吸取培养液2~3滴,滴在盛有花粉的载玻片凹槽中。将培养皿底部垫上1层吸水的滤纸,将载玻片放上,并在两旁放上吸水的脱脂棉球,用以保湿,盖上培养皿盖后放入恒温箱内20 ℃进行培养,定时取出,在显微镜下(10×10)观察统计花粉的萌发率并用显微测微尺测量花粉管的长度。
1.2.3.2花粉萌发率将花粉放于不同浓度培养基中,分别培养0.5、1、2 、4 h后从恒温培养箱里取出凹形载玻片在显微镜下观察。每种试验处理重复3次,每次重复随机观察3个视野,每个视野观察的花粉总数不少于60粒,以花粉管的长度大于花粉粒的直径为花粉萌发的标准[1],以花粉萌发率=萌发花粉粒数/花粉粒总数×100%为计算方法,最后将花粉的萌发率进行统计。
1.2.3.3显微测微尺的使用显微测微尺包括镜台测微尺和目镜测微尺,测量前,要先进行校正,镜台测微尺的中央有1个全长1 mm的刻度标尺,等分成100个小格,每小格的长度为0.01 mm,可以用它来矫正目镜测微尺每小格的长度。校正后的目镜测微尺以每小格所代表的实际长度作为测量的尺度。
1.2.3.4花粉管长度检测将花粉放于不同浓度培养基中,分别培养0.5、1.0、2.0、4.0 h后从恒温培养箱里取出凹形载玻片在显微镜下观察。每种试验处理重复3次,每个视野随机测量20个花粉管的长度,用显微镜的测微尺测量花粉管长度,计算随机测量的20个花粉管长度的平均值。
1.3统计分析
结果用“平均值±标准误”表示,用SPSS v17.0 (SPSS Inc.,Chicago,IL,USA)进行统计分析,处理之间差异显著水平用单因素邓肯检验,P<0.05。
2结果与分析
2.1硼酸对花粉萌发的影响
金陵丰收花粉萌发率随着硼酸浓度的升高而增加,与对照相比,在培养时间0~1 h内,5、50 mg/L处理中的花粉萌发率增加最显著。不同硼酸浓度处理的花粉萌发率差异显著,其中100 mg/L 2 h时的花粉萌发率达到10.050%,比50、5 mg/L花粉萌发率分别增加了89%、92%。当硼酸浓度升高到200 mg/L时,每个时间段的萌发率基本相同,而且与 100 mg/L 硼酸浓度相比,花粉萌发率有所下降(表1)。说明硼酸只有在适宜的浓度下,才会对花粉萌发率有一定促进作用,高浓度的硼酸对花粉的萌发反而有一定的抑制作用。
2.2硼酸对花粉管生长的影响
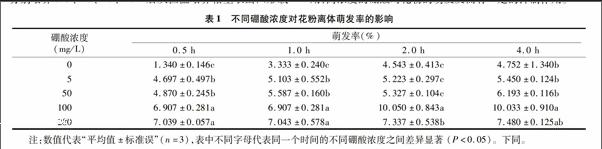
硼酸对花粉管生长具有明显影响(图1)。在无硼酸的培养基上,花粉管细长且弯曲(图1-d),加上硼酸之后,花粉管生长变粗而且直(图1-h)。不同浓度硼酸对金陵丰收花粉管生长的影响达到显著水平,在2 h之内,增加硼酸浓度金陵丰收花粉管有伸长的趋势,但2 h以后,花粉管的伸长速度明显缓慢。硼酸200 mg/L时的每个时间段的平均花粉长度与100 mg/L的相比无明显的变化。试验中发现在无硼酸和有硼酸的条件下都出现了1个花粉粒长出2根花粉管的现象(图1-d,图1-h,红色箭头)。在无硼条件下,随着时间的延长花粉管有伸长趋势,但添加硼之后能促进金陵丰收花粉管的生长(表2)。
2.3钙对花粉萌发的影响
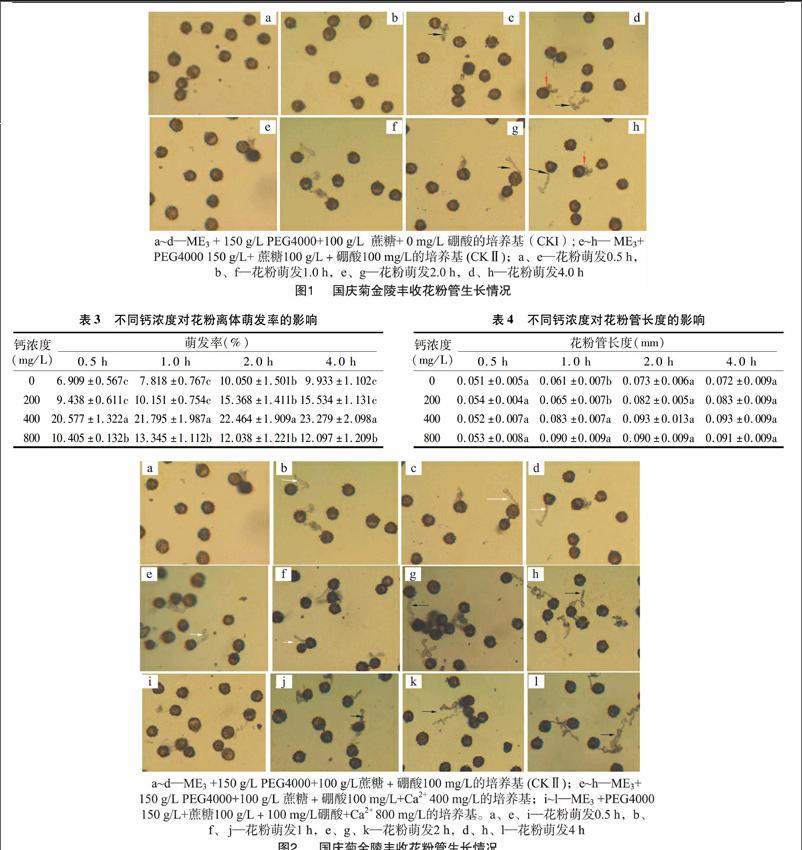
钙显著提高了金陵丰收花粉萌发率,随着钙浓度的升高花粉萌发率显著增加,以钙浓度为400 mg/L处理中的花粉萌发率最高,当其浓度增加到800 mg/L时,花粉的萌发率反而下降(表3)。
2.4钙对花粉形态和花粉管生长的影响
培养基中添加Ca2+对花粉管生长的影响不显著(表4),对花粉管品质的影响较大,外源钙浓度过高以及离体培养时间过长都不适合金陵丰收花粉管生长,当外源Ca2+达到400 mg/L时,在0~1 h期间花粉管生长正常(图2-e,图2-f),2 h后花粉生长出现异常(图2-g,图2-h);当外源Ca2+达到800 mg/L时花粉管末端细弱、畸形(图2-j至图2-l)。
3讨论
硼在植物体内含量低,分布不均匀,以花中含量最高,参与果胶物质的合成,有利于花粉管壁的形成,因此有利于花粉管的生长[14]。迄今有关硼酸对花粉萌发和花粉管生长的研究报道较多,均认为一定浓度的硼酸有利于花粉萌发和花粉管生长[15]。赵宏波等研究认为菊花花粉在离体培养0.5~2.0内,萌发率呈直线上升趋势,2 h之后花粉的萌发率增加不显著,外源硼和钙对金陵丰收花粉萌发都是必需的[13],本研究得出以上相同的结论。本研究还发现,一定浓度的钙能显著提供花粉萌发率并使生长健壮,但浓度过高或培养时间过长时花粉萌发率反而受到抑制,2 h后花粉细弱畸形。不同植物种类的花粉萌发和花粉管生长所需的最适硼酸浓度不同,杜纪红等研究表明,0.1%的硼酸可提高大多数桃品种花粉萌发率[3],本研究发现100 mg/L)硼酸对金陵丰收萌发最有利。
参考文献:
[1]李辛雷,陈发棣.菊花二倍体野生种与栽培种间杂种的幼胚拯救[J]. 林业科学,2006,42(11):42-46.
[2]龚明,曹宗巽. 钙和钙调素对花粉萌发和花粉管生长的调控[J]. 植物生理学通讯,1995,31(5):321-328.
[3]杜纪红,叶正文,苏明申,等. 桃花粉离体萌发和花粉管生长特性研究[J]. 西北植物学报,2011,31(1):64-71.
[4]杜玉虎,綦影,蒋锦标,等. 蔗糖、钙和硼对榆叶梅花粉离体萌发及花粉管生长的影响[J]. 北方园艺,2008(8):106-109.
[5]储立民,金爱红,徐冬青,等. 钙离子浓度对丝瓜花粉萌发和花粉管生长的影响[J]. 河南农业科学,2005(4):56-58.
[6]陈俊愉,崔娇鹏.地被菊培育与造景[M]. 北京:中国林业出版社,2006:6-36.
[7]龚明,杨中汉,曹宗巽.钙对花粉萌发的启动产效应和对花粉管生长的调节作用[J]. 北京大学学报:自然科学版,1995,31(2):249,238-249.
[8]胡适宜.被子植物胚胎学[M]. 北京:人民教育出版社,1982:103-136.
[9]Blevins D G,Lukaszewski K M. Boronin plantstructure and function[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1998,49:481-500.
[10]Li Y Q,Chen F,Linskens H F. Distribution of unesterified and esterified pectins in cell walls of pollen tubes of flowering plants[J]. Sexual Plant Reproduction,1994,7(3):145-152.
[11]杨晓东,孙素琴,李一勤.硼缺乏导致花粉管细胞壁多糖分布的改变[J]. 植物学报,1999,41(11):1169.
[12]Leduc N,Monnier M,Douglas G C. Germination of trinucleated pollen:formu lation of a new medium for Capsella bursa-pastoris[J]. Sexual Plant Reproduction,1990,3(4):228-235.
[13]赵宏波,陈发棣,房伟民.栽培小菊和几种菊属植物花粉离体萌发研究[J]. 南京农业大学学报,2005,28(2):22-27.
[14]Jackson J F. Borate control of energy driven protein secretion from pollen and interaction of borate with auxin or herbicide a possible role for boron in membrane events[J]. Plant Physiology and Biochemistry,1991,10:221-229.
[15]符碧. 尿素和硼及生长调节剂对荔枝花粉萌发与生长的影响[J]. 云南师范大学学报:自然科学版,2001,21(3):62-65.田慧敏,文静,任芳. 色钉菇(Chroogomphus rutilus)形态学和ITS测序鉴定 [J]. 江苏农业科学,2016,44(5):261-263.
doi:10.15889/j.issn.1002-1302.2016.05.075

