溴芬酸钠滴眼液抑菌效力研究
刘广文 丁勃


[摘要] 目的 对溴芬酸钠滴眼液中所添加的抑菌剂抑菌效力进行确认。 方法 将金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、白色念珠菌和黑曲霉作为挑战菌株,分别加入到抑菌剂含量为处方浓度0、80%、100%和120%的4组溴芬酸钠滴眼液中,在不同时间段检测样品中微生物的存活情况。 结果 不含抑菌剂的溴芬酸钠滴眼液不具有充分的抗菌活性,抑菌剂含量为处方浓度80%、100%和120%的溴芬酸钠滴眼液,均可有效抑制微生物的生长繁殖。 结论 可选择浓度为0.05mg/mL的苯扎氯铵,作为溴芬酸钠滴眼液的抑菌剂。
[关键词] 溴芬酸钠滴眼液;抑菌剂;抑菌效力;苯扎氯铵
[中图分类号] R927.2 [文献标识码] A [文章编号] 2095-0616(2016)09-45-05
[Abstract] Objective To demonstrate the effectiveness of antimicrobial preservatives for Bromfenac Sodium Eye Drops. Methods Staphylococcus aureus,Escherichia coli,Pseudomonas aeruginosa,Candida albicans and aspergillus niger were used as challenging strains and added into four sets of Bromfenac Sodium Eye Drops with concentrations of Antimicrobial preservatives at 0,80%,100% and 120% respectively.Survival rates of microbes were then examined at different points in time. Results Bromine Finn acid sodium eye drops except for the Bacteriostatic agent sample were no antimicrobial preservatives.The Bromfenac Sodium Eye Drops with concentrations of Antimicrobial preservatives at 80%,100% and 120% could inhibit the growth of microorganisms sufficiently, Conclusion Benzalkonium chloride can be used as antimicrobial preservative for Bromfenac Sodium Eye Drops.
[Key words] Bromfenac Sodium Eye Drops;Antimicrobial preservatives;Antimicrobial effectiveness;Benzalkonium chloride
本品为滴眼液,主要活性成分为溴酚酸钠,用于外眼部和前眼部的炎症性疾病的对症疗法(结膜炎、巩膜炎、术后炎症)。[1]处方中含有的辅料为聚维酮K30、硼酸、硼砂、无水亚硫酸钠、聚山梨酯80、依地酸二钠和注射用水,氢氧化钠调节pH值8.0~8.6,采用聚丙烯药用滴眼剂瓶作为内包装。本品为非甾体抗炎药,主药不具有抗菌活性,溴酚酸钠滴眼液为多剂量包装,为防止正常贮藏和使用过程中潜在的微生物污染,应添加适宜的抑菌剂,以避免药物变质对患者造成危害。[2]参照《中国药典》2015年版通则和指导原则“1121抑菌效力检查法” [2],对本品进行测定,评价最终产品的抑菌效力。
1 仪器与试药
1.1 试药
供试品批号:150201(未添加抑菌剂),150202(含处方量80%苯扎氯铵),150203(含处方量100%苯扎氯铵),150204(含处方量120%苯扎氯铵);规格:5mL﹕4.5mg(按C15H12BrNO3计);包装:聚丙烯瓶;性状:本品为黄色的澄明液体。
1.2 仪器
MJ-250I型霉菌培养箱(上海一恒科学仪器有限公司,仪器编号:WS-21-19);GHP-9270型隔水式恒温培养箱(上海一恒科学仪器有限公司,仪器编号:WS-21-15);HFsafe-900生物安全柜(上海力康医疗设备有限公司,仪器编号:WS-76-10);MLS-3780型湿热灭菌器(日本三洋公司,仪器编号:WS-41-07);VITEK 2 DensiCHEK型细菌浊仪(生物酶理埃,仪器编号:WS-96-02)。
1.3 菌种
铜绿假单胞菌[CMCC(B)10 104]、大肠埃希菌[CMCC(B)44 102]、金黄色葡萄球菌[CMCC(B)26 003]、白色念珠菌[CMCC(F)98 001]、黑曲霉 [CMCC(F)98 003],均来自中国食品药品检定研究院医学菌种保藏中心。
1.4 培养基
胰酪大豆胨琼脂培养基(批号:3103091);胰酪大豆胨液体培养基(批号3302011);沙氏葡萄糖琼脂培养基(批号3102306);沙氏葡萄糖液体培养基(批号3102387),购于环凯微生物科技有限公司,培养基适用性检查符合规定。
2 菌液制备方法
接种铜绿假单胞菌、金黄色葡萄球菌、大肠埃希菌新鲜培养物至胰酪大豆胨琼脂培养基,30~35℃,培养18~24h;接种白色念珠菌新鲜培养物至沙氏葡萄糖琼脂培养基,20~25℃,培养24~48h。将上述培养物用适量的0.9%无菌氯化钠溶液自琼脂表面洗脱,无菌操作转移至无菌试管内,比浊法制成浓度为108cfu/mL的菌悬液。接种黑曲霉新鲜培养物,至沙氏葡萄糖琼脂斜面,20~25℃,培养5~7d,至培养基斜面产生丰富的孢子,加入含0.05%聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,用含0.05%聚山梨酯80的0.9%无菌氯化钠溶液,制成浓度为108cfu/mL的孢子悬液。
3 存活菌数测定方法适用性试验
抑菌效力检查实验过程中,需要在规定的间隔时间从每个容器取供试品1mL,测定每份供试品中所含的菌数。存活微生物测定方法及适用性试验照非无菌产品微生物限度检查:微生物计数法(通则1105)进行。本次实验涉及4类供试品:未添加抑菌剂的供试品、含处方量80%苯扎氯铵的供试品、含处方量100%苯扎氯铵的供试品和含处方量120%苯扎氯铵的供试品。采用5种试验菌,分别对4类供试品进行计数方法适用性试验。
试验结果表明,抑菌剂含量不同的4类供试品,对白色念珠菌、黑曲霉和金黄色葡萄球菌有一定抑制作用,试验菌回收率达不到70%,需采用薄膜过滤法进行细菌和真菌计数;4类供试品的1∶10稀释液对5种试验菌均没有抑制作用,因此,1∶10稀释级及更高稀释级的供试液均可采用平皿法进行细菌和真菌计数
4 未添加抑菌剂供试品抑菌效力测定
测定未添加抑菌剂供试品的抑菌效力,考察其对微生物的杀灭或抑制能力,评价本品是否具有充分的抗菌活性。
本品规格为5mL,按抑菌效力检查法规定,接种菌液的体积应不超过0.05mL,实验误差较大;整个实验过程,需对供试品多次取样,原包装供试品体积无法满足实验需要。因此,将供试品转移至与本品内包装材质相同,每瓶转入供试品50mL。
取转移包装后的供试品5瓶,分别接种0.5mL铜绿假单孢菌、大肠埃希菌、金黄色葡萄球菌、白色念珠菌和黑曲霉孢子悬液,接种后,供试液染菌量为105~106cfu/mL,混匀,模20~25℃避光贮存。试验过程中,分别在6h、24h、7d和28d对供试品进行细菌计数;分别在7、14和28d对供试品进行真菌计数。同时以0.9%无菌氯化钠溶液接种试验菌作为对照,按上述方法平行操作。见表1~6。
未添加抑菌剂的供试品,6h计数,铜绿假单胞菌、金黄色葡萄球菌和大肠埃希菌减少的lg值均小于2;24h计数,金黄色葡萄球菌减少的lg值小于1,铜绿假单胞菌和大肠埃希菌减少的lg值均小于3。因此,按抑菌效力判断标准“A”和“B”,未添加抑菌剂的供试品均不符合规定。未添加抑菌剂的供试品7d计数,白色念珠菌和黑曲霉减少的lg值均大于2;28d计数,白色念珠菌和黑曲霉未恢复生长,符合抑菌效力判断标准“A”。未按“B”标准规定在第14d,对供试品中真菌进行计数。0.9%的无菌氯化钠溶液对照组,各试验菌在6h、24h、7d和28d未表现出异常的增多或降低。试验结果表明,溴芬酸钠滴眼液本身不具有充分的抗菌效力,应加入抑菌剂。
5 添加抑菌剂供试品的抑菌效力测定
本品以苯扎氯铵做为抑菌剂,处方含量为0.05mg/mL,参考苯扎氯铵安全用量相关文献,本品中用量在常规安全用量范围内。本品主要成分包括溴芬酸钠、聚维酮K30、硼酸、硼砂、无水亚硫酸钠、聚山梨酯80、依地酸二钠,本品采用聚丙烯瓶包装,参考药用辅料手册,本品成分、包装与苯扎氯铵均无配伍禁忌[3]。
虽然苯扎氯铵是滴眼液中最常用的防腐剂,但大量临床及实验研究表明,使用含苯扎氯铵的滴眼液会引起包括细胞凋亡在内的一系列眼表损伤。[4-5]因此,含有苯扎氯铵的供试品可能会增加临床不良反应的风险,且随浓度的增加,不良反应发生的风险也将提高[6]。按照中国药典抑菌效力检查法中所述:表中“A”是指应达到的抑菌效力标准,特殊情况下,如抑菌剂可能增加不良反应的风险,那至少应达到“B”的抑菌效力标准。本产品所添加的抑菌剂符合该条件,因此,对本品含处方量100%抑菌剂供试品进行抑菌效力测定,如果结果判定不能达到“A”标准,可以按照“B”标准执行。
5.1 含处方量100%苯扎氯铵的供试品抑菌效力检查试验
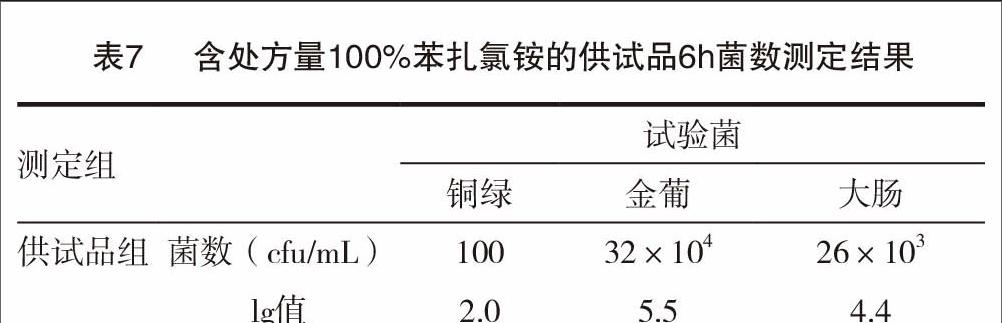
将供试品转移至与本品内包装材质相同,装量为50mL的聚丙烯瓶中,进行实验,每瓶转入供试品50mL。取转移包装后的供试品5瓶,分别接种0.5mL铜绿假单孢菌、大肠埃希菌、金黄色葡萄球菌、白色念珠菌和黑曲霉孢子悬液,使接种后供试液染菌量每1毫升约为105~106cfu,混匀,20~25℃避光贮存。试验过程中,分别在6h、24h、7d和28d对供试品进行细菌计数;分别在7、14和28d对供试品进行真菌计数。本次试验与未添加抑菌剂供试品的抑菌效力测定同时进行,见表7~9。
5.2 含处方量80%和120%苯扎氯铵的供试品抑菌效力检查试验
对处方含量80%和120%苯扎氯铵的供试品抑菌效力进行测试,考察生产过程中的投料偏差对产品的抑菌效力产生的影响。按“8.1含处方量100%苯扎氯铵的供试品抑菌效力检查试验”试验方法进行操作。见表10~13。
按抑菌效力检查法注射剂和眼用制剂抑菌效力判断标准,细菌计数按“B”标准判断,各试验菌24h减少的lg值均大于1,7d减少的lg值均大于3,28天为NI;真菌计数按“A”标准判断,各试验菌7d减少的lg值均大于2,28d为NI。含处方量80%苯扎氯铵的供试品和含处方量120%苯扎氯铵的供试品抑菌效力检查结果均符合规定。
6 讨论
按《中国药典》2015年版通则和指导原则:1121抑菌效力检查法,溴芬酸钠滴眼剂以苯扎氯铵作为抑菌剂,处方含量为0.05mg/mL,抑菌效力检查结果符合规定;含处方量80%苯扎氯铵的溴芬酸钠滴眼液和含处方量120%苯扎氯铵的供试品溴芬酸钠滴眼液抑菌效力检查结果均符合规定。
药物生产过程中,添加抑菌剂允许偏差为±20%[8]。因此,在药物研发阶段,应对抑菌剂处方浓度80%的剂量和120%的剂量,进行有效性确认,以保证投料的偏差不会对抑菌剂抗菌活性的有效性造成影响。
新版中国药典抑菌效力检查法对比原抑菌效力检查法指导原则,在操作方法、结果判断标准上均有较大调整,例如取消了“供试品接种(0时)” [8]的概念,增加了“A”“B”判断标准,增加了 “NI”“NR”结果表示方法等,新版标准对产品的抑菌效力检测更加科学合理,基苯和国外先进药典保持一致。本文以溴芬酸钠滴眼剂抑菌效力研究为例,对新版药典抑菌效力检查法进行了探索,结合试验操作对新增的名词、定义进行了解释。
[参考文献]
[1] 赵文镜,夏炎.溴芬酸钠滴眼液的制备及含量测定[J].西北药学杂志,2011,2(26):10-12.
[2] 国家药典委员会.中国药典[M].2015年版,通则和指导原则:1121抑菌效力检查法,2015:151-153.
[3] RC罗,PJ舍斯基,PJ韦勒.药用辅料手册[M].北京:化学工业出版社,2005:367-373.
[4] 黄彩虹,陈文生,陈永雄,等.苯扎氯铵的眼表毒性研究现状[J].中华眼科杂志,2014,50(4):303-305.
[5] 刘扬,刘祖国,许传超,等.苯扎氯铵对人结膜上皮细胞毒性的研究[J].中国实用眼科杂志,2008,26(6):631-634.
[6] 成海平.药品研发中防腐剂的应用及质控[J].中国新药杂志,2005,8(14):954-956.
[7] 丁勃,徐晓洁,谢元超.氢溴酸加兰他敏口服液添加抑菌剂筛选与抑菌效力研究[J].药物分析杂志,2011,31(12):2312-2317.
[8] 宁黎丽.眼用制剂研发过程中应关注抑菌剂的合理使用和质量控制[J].中国药学杂志,2007(23):1836-1838.
[9] 国家药典委员会.中国药典[M].2010年版二部附录.2010:215-216.
[10] 张乃茹,李晓莉.食品防腐剂山梨酸的研究进展[J].长春师院学报,1995(5):16-19.
[11] 沈萍,卫扬保,王静怡,等.微生物学[M].北京:高等教育出版社,2000:197.
[12] 丁勃,巩丽萍,谢元超.阿齐霉素滴眼液抑菌剂筛选与抑菌效力研究[J].中国药品标准,2012,13(4):281-284.
[13] 曹军卫,马辉文,张甲耀.微生物工程[M].北京:科学出版社,2010:82.
[14] 胡春红,陈龙,李季平,等.苯甲酸钠和山梨酸钾的复配抑菌效果研究[J].中国调味品,2012,3(37):46-49.
[15] 张新妹,胡昌勤,李艳,等.一般用途的抗生素滴眼剂的微生物限度检查方法[J].天津药学,2003,15(3):16-19.
(收稿日期:2016-01-12)

