基于超高压液相色谱-高分辨多级质谱联用技术的中药淡竹叶化学成分分析
潘智然,王腾华,朱首伦,任之尧,张靖,2
基于超高压液相色谱-高分辨多级质谱联用技术的中药淡竹叶化学成分分析
潘智然1,王腾华1,朱首伦1,任之尧1,张靖1,2
(1.广州中医药大学第二附属医院,广东 广州 510120;2.广东省中医药科学院,广东 广州510006)
摘要:目的建立基于超高压液相色谱-电喷雾-高分辨多级质谱联用技术(UHPLC-ESI-HR MSn)的中药淡竹叶醇提物的化学成分快速定性分析研究方法。方法液相采用Phenomenex kinetex C18色谱柱,乙腈-0.1%(体积分数)甲酸系统梯度洗脱,质谱采用电喷雾-离子阱-静电场轨道阱组合质谱技术,以负离子模式采集,线性离子阱内碰撞诱导解离获取多级质谱数据,轨道阱内测定高分辨质谱数据。将获取的对照成分的质谱裂解数据、液相和多维质谱信息进行分析总结并进行在线结构解析。结果 本法对淡竹叶醇提物中的主要成分峰分离良好,根据精确分子量和二级质谱碎片信息,结合对照品质谱裂解途径,从淡竹叶中快速鉴定了21个化学成分。结论本方法具有高效、高灵敏度的检测优势,能较全面地反映出淡竹叶醇提物的化学成分,可实现黄酮碳苷、黄酮及酚酸类等不同结构类型化合物鉴别,为深入阐明中药淡竹叶药效物质基础及其质量标准研究提供高效可靠的检测手段。
关键词:淡竹叶;液质联用;黄酮碳苷;化学成分
网络出版时间:2016-05-24 15:28 网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160524.1528.001.html
中药淡竹叶为禾本科(Gramineae)淡竹叶属植物淡竹叶(Lophatherum gracile Brongn.)的干燥茎叶,主产于湖南、广东、安徽、浙江、福建等地,在1977年以来的历版《中国药典》中均有收载,为岭南地区常用道地药材[1-2]。淡竹叶味甘性寒,具清热、除烦、利尿等功效,多用于热病心烦、口舌生疮、牙龈肿痛、尿路炎症等症,民间常用于治疗呼吸道感染所引起的感冒、发热等疾病[3]。
现代药理学研究显示,淡竹叶具解热、利尿、抗菌、抗肿瘤、升高血糖等多种药理作用[4-6],为卫生部公布的药食两用中药之一,在大健康产品领域如医药、保健品、功能性饮料、食用品、天然防腐剂等多方面均有较广泛的应用前景。前期的化学成分研究显示[7-8],淡竹叶中含有黄酮、酚酸及三萜类等多种成分,其中黄酮碳苷类为其主要化学结构类型。药理试验表明,6位单糖取代的黄酮碳苷类成分具有显著的体外抗呼吸道合胞病毒(RSV)活性[9]。
液相色谱-质谱联用技术(液质联用,LC-MS)具有样品预处理简单、分析速度快、灵敏度高及专属性高等特点。近年来,随着对中药复杂体系分析要求的不断提高及液质联用技术的不断更新发展,LCMS在中医药多研究领域得到广泛应用。由线性离子阱(linear ion trap quadrupole,LTQ)和静电场轨道离子阱(orbitrap)结合而形成的组合式质谱仪是近年来质谱技术发展的杰出代表,具有卓越的分辨率、多种扫描和碎裂组合[10],可同时实现母、子离子的高分辨采集及多级质谱碎裂信息获取,不仅可以鉴定已知化合物,还可以通过不同化合物的裂解规律及特征碎片离子来推断未知化合物。该组合质谱技术可为中药小分子化学成分的鉴定及分析提供更多、更准确的信息[11-12],并能有效地指导中药化学成分,尤其是微量未知成分的选择性提取和分离试验。
本文采用超高压液相色谱-电喷雾-高分辨多级质谱联用技术(UHPLC-ESI-HR MSn)技术开展淡竹叶的化学成分的质谱分析研究,建立快速、高效、准确的质谱分析方法,实现黄酮碳苷、黄酮及酚酸类等不同结构类型化学成分的快速识别,为中药淡竹叶药材质量研究、新药研发提供有利的分析依据。
1 仪器与试药
1.1 仪器
液相采用Thermo Accela超高压液相色谱仪(美国Thermo-fisher公司),由四元高压泵、自动进样器、柱温箱、二极管阵列检测器组成。液相部分通过电喷雾离子源(ESI)与LTQ-Orbitrap XL线性离子阱轨道离子阱组合式质谱仪连接(美国Thermo-fisher公司),数据采集及处理软件为Xcalibur 2.1(美国Thermo-fisher公司)。
AB135-S型十万分之一电子分析天平(瑞士Mettler Toledo公司),3K15高速冷冻离心机(德国sigma公司),AS 20500A超声波清洗仪(频率40 Hz,功率250 W,天津奥特赛恩斯仪器有限公司),步琪R-210型旋转蒸发仪(瑞士Buchi公司),DK-S26电热恒温水浴锅(上海精宏实验设备有限公司)。
1.2 试药
淡竹叶药材购自广东省中医院药房,经广州中医药大学第二临床医学院黄志海主任中药师鉴定为禾本科淡竹叶属植物淡竹叶 Lophatherum gracile Brongn.的干燥茎叶,样品现保存于广东省中医院中药制剂研究室样品室。
对照品荭草苷、异荭草苷、牡荆素、异牡荆素为本实验室从淡竹叶醇提物中分离得到(质量分数均高于95%),其结构经MS、NMR、UV等波谱学确认。
高效液相色谱级甲醇、乙腈(美国Sigma公司);质谱级甲酸(美国Thermo-fisher公司);超纯水由Milli-Q制水机(Millipore公司)制得。
2 方法与结果
2.1 对照品、供试品溶液的制备
分别称取荭草苷、异荭草苷、牡荆素、异牡荆素对照品约0.10 mg,分别用70%(体积分数,下同)甲醇溶解并定容于10 mL容量瓶中,经0.22 μm微孔滤膜滤过,制得上述4种对照品质量浓度分别为10 μg/mL的各对照品溶液。
精密称取淡竹叶粉末(过60目筛)2.0 g,置于250 mL圆底烧瓶中,用70%甲醇溶液50 mL加热回流2 h,滤过,浓缩至干。用70%甲醇溶解转移,并定容于25 mL容量瓶中,经0.22 μm微孔滤膜滤过,取续滤液为供试品溶液。
2.2 色谱条件
色谱柱为Phenomenex Kinetex C18(100 mm×2.1 mm,1.7 μm)色谱柱;流动相为0.1%(体积分数,下同)甲酸(A)、乙腈(B)梯度洗脱:0~10 min(5%B→26%B),10~18 min(26%B→42%B),18~22 min (42%B→90%B);柱温:25℃;流速:300 μL/min;进样体积:2 μL。
2.3 质谱条件
采用电喷雾离子源负离子模式,离子源参数设置如下:鞘气(N2)=3.033 8×105Pa,辅助气(N2)3.447 5×104Pa,喷雾电压2.7 kV,毛细管温度350℃,管透镜电压-130 V,毛细管电压-38 V;样品先采用高分辨质谱全扫描,质量范围为m/z 150~1 500;分辨率为FS 30 000,MS/MS 6 000;二级质谱采用动态数据依赖性扫描,碰撞能量设为35%,多级质谱选取上一级最高峰离子扫描碰撞诱导解离碎片。
2.4 条件优化
2.4.1 提取溶剂的选择 针对淡竹叶化学成分特点,对提取溶剂进行选择。分别考察了体积分数50%、70%及100%甲醇的提取效果,结果发现70%甲醇获得的色谱峰峰容量最大,故采用70%甲醇回流提取。
2.4.2 洗脱条件的优化 分别考察了甲醇-水、乙腈-水系统的洗脱效果,结果显示乙腈洗脱时效果优于甲醇,各色谱峰的分离效果更佳。在流动相中加入0.1%甲酸可提高质谱信号响应,并改善峰形,故选用乙腈-0.1%甲酸为流动相梯度洗脱。见图1。
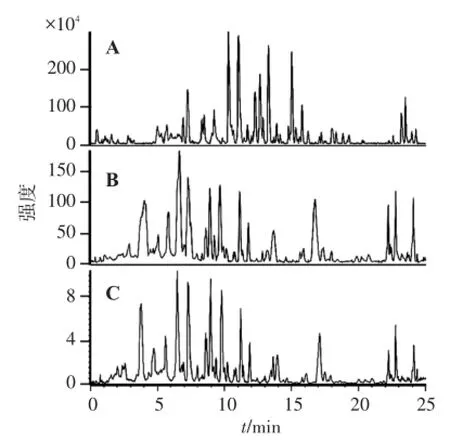
A.乙腈-0.1%甲酸系统;B.甲醇-0.1%甲酸系统;C.乙腈-0.1%乙酸系统。图1 3种不同流动相下淡竹叶醇提物的LC-MS总离子流图Figure 1 The LC-MS total ion chromatograms of the ethanolic extract from L.gracile in three different chromatographic conditions
2.5 淡竹叶醇提物的测定
按“2.1”项下方法制备供试品溶液,并按照“2.2”和“2.3”项下色谱及质谱条件,用 UHPLCLTQ-Orbitrap-MSn法对淡竹叶中化学成分进行定性分析,得供试品溶液的(-)ESI-MS总离子流(TIC)图见图2,观察可得知淡竹叶醇提物各色谱峰之间实现较好的分离。通过检测得到的各化学成分峰的保留时间和精确分子量,并结合二级质谱裂解碎片信息及与对照品、数据库及相关文献数据比对其中的21个化学成分峰进行确认,结果见表1。
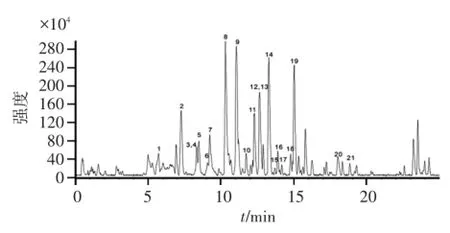
图2 淡竹叶醇提物的(-)ESI-MS总离子流图Figure 2 The total ion chromatogram of the ethanolic extract from L.gracile in negative ion mode
2.6 黄酮碳苷对照品质谱裂解规律的研究
采用质谱直接进样方法(direct infusion),分别对4种黄酮碳苷成分荭草苷、异荭草苷、牡荆素、异牡荆素在LTQ-Orbitrap质谱中的裂解规律进行研究。结果表明黄酮碳苷类成分在负离子质谱模式下均能形成稳定的[M-H]-准分子离子峰,进一步对该离子峰进行MS2-MS4裂解发现,4种黄酮碳苷成分质谱裂解途径具有高度相似性和特征性,并能和一般黄酮苷类成分明显区别,可以用于黄酮碳苷类成分的分析和鉴定,以下将以荭草苷为例,具体阐述黄酮碳苷类成分的质谱裂解规律。
荭草苷在LTQ-Orbitrap高分辨多级质谱中形成m/z 447.092 0(C21H19O11,Δ=-0.42)的[M-H]-准分子离子峰,进一步碎裂形成2个非常明显的子离子m/z 327.050 0(C17H11O7,Δ=0.28)、357.060 4 (C18H13O8,Δ=-0.21),高分辨质谱显示分别失去C4H8O4和C3H6O3的中性分子,推测该裂解发生在糖残基上。同时观察到微弱的连续失去3个H2O的中性分子形成了 m/z 429.080 4、411.070 7、393.060 2碎片离子。其中m/z 327.050 0的基峰在MS3质谱中进一步碎裂形成m/z 299.055 1(C16H11O6,Δ=0.55)和284.031 7(C15H8O6,Δ=0.71)的2个主要子离子,其中m/z 299为黄酮母核中脱去CO的碎片离子,而m/z 284为碳苷键发生均裂形成的奇电子离子碎片(odd electron,OE)。在m/z 299的MS4谱中,进一步于黄酮母核内部发生一般黄酮类特征碎裂脱去CO2形成m/z 255.065 6的碎片。见图3。
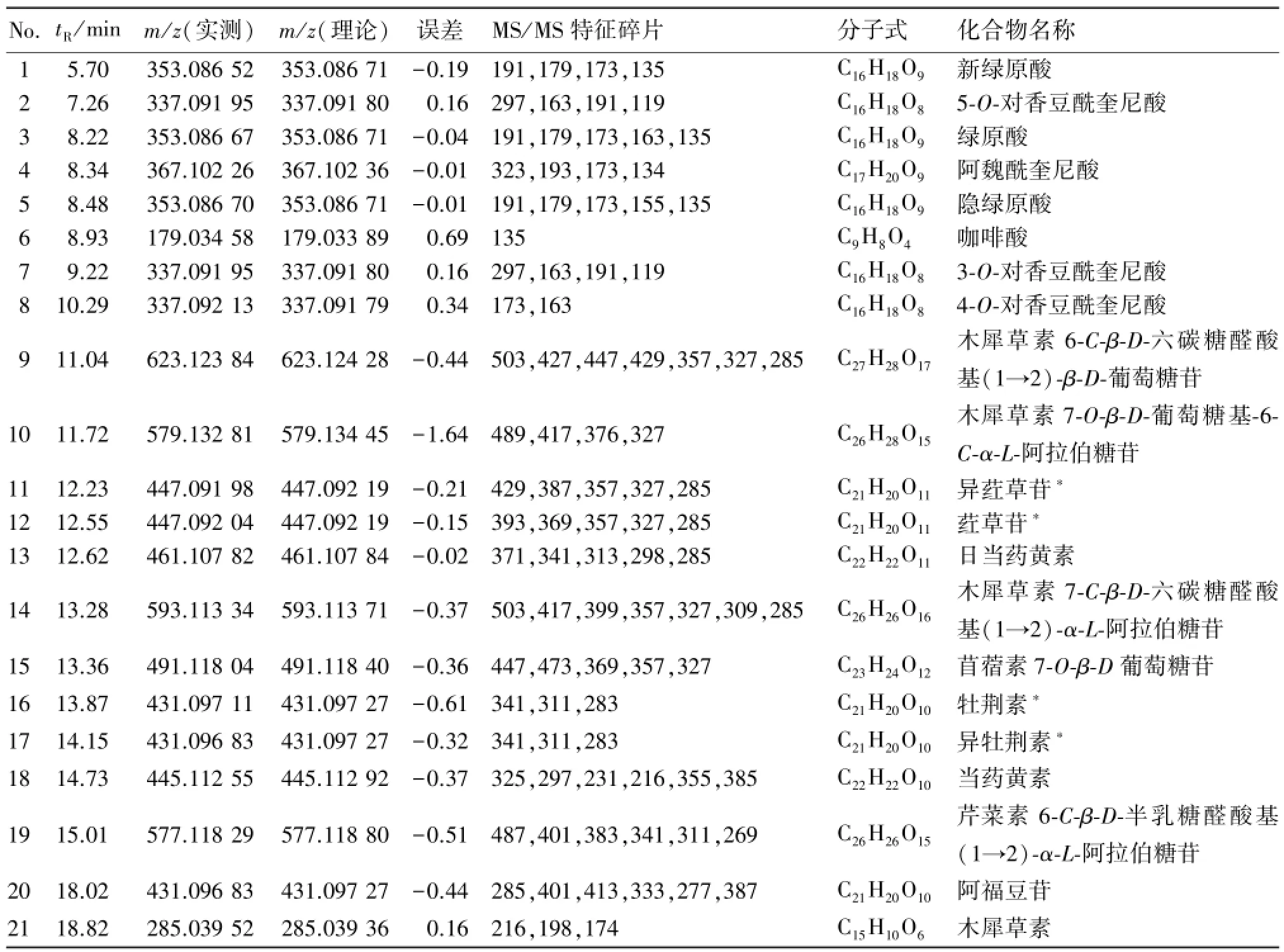
表1 淡竹叶中21个主要化学成分LC-ESI-MS/MS数据Table 1 LC-ESI-MS/MS data of 21 major compounds from L.gracile

图3 黄酮碳苷的质谱裂解途径(荭草苷)Figure 3 The MS fragment pathways of the flavone C-glycoside(orientin)
异荭草苷的苷元结构与异荭草苷一致,仅为碳苷的取代不同,如上所述,黄酮碳苷的特征裂解主要发生在碳苷内部,因此二者的特征质谱等同。同理,牡荆素、异牡荆素的特征质谱主要发生在糖的内部,均在二级质谱形成特征的[M-H-C3H6O3(90)]-、[M-H-C4H8O4(120)]-等碎片离子,由于质谱裂解途径相同,不再一一赘述。
2.7 黄酮碳苷类成分ESI-MS/MS分析
目前从淡竹叶中分离得到的黄酮碳苷主要分为以下几类:类型1,C-6位或C-8位单糖碳苷取代,如化合物11~13,16~18;类型2,7-O位单糖氧苷取代同时C-6位或C-8位单糖碳苷取代,如化合物10;类型3,C-6位糖醛酸连接单糖链碳苷取代,如化合物9、14及19。其中,通过与对照品保留时间和质谱行为的比较,化合物11、12、16、17分别鉴定为异荭草苷、荭草苷、牡荆素、异牡荆素。
类型1中黄酮碳苷类的负离子模式二级质谱图中,可观察到[M-H-C4H8O4]-、[M-H-C3H6O3]-的黄酮碳苷特征峰,此外还观察到[M-H-78]-、[MH-60]-及[M-H-18]-的碎片离子。这些离子来源于糖环的开环反应,是这一类化合物的特征碎片离子,其相对丰度远高于碳苷键裂解形成的碎片离子,黄酮碳苷的C—C键键能较氧苷中的C—O键较高,所以碳苷类化合物以糖环内部断裂的裂解方式为主[13]。
类型2中化合物10的高分辨质谱给出准分子离子峰m/z 579.132 8[M-H]-(C26H28O15),MS2谱图给出m/z 489、459、417、399、357及327等碎片峰,分别为碳苷糖环开环及脱去氧苷的碎裂产物,其碎裂方式见图4。结合其精确分子量和文献报道,推测化合物10为木犀草素7-O-β-D-葡萄糖基-6-C-α-L-阿拉伯糖苷。
类型3中化合物9,14和19的MS2谱图中,首先均可观察到2个基峰,分别为m/z 447、417、401 [M-H-176]-及m/z 429、399、383[M-H-194]-,为脱去六碳糖醛酸(葡萄糖醛酸或半乳糖醛酸)的特征碎片。此外,化合物9的MS2谱图中可观察到m/z 357[M-H-176-90]-、m/z 327[M-H-176-120]-及m/z 285[M-H-176-162]-等峰,为葡萄糖开环裂解碎片。化合物14和19的MS2谱图中可观察到m/z 357、341[M-H-176-60]-、m/z 327、311[M-176-90]-及m/z 285、269[M-H-176-132]-等峰,为五碳糖阿拉伯糖的开环裂解碎片。经与文献[9]数据对照,推断化合物19为芹菜素6-C-β-D-半乳糖醛酸基(1→2)-α-L-阿拉伯糖苷,化合物9和14尚未见文献报道。
2.8 羟基酚酸类成分的ESI-MS/MS鉴定
据文献报道,淡竹叶含有酚酸类成分,如绿原酸、咖啡酸、香草酸等[3]。化合物1、3和5均给出准分子离子峰 m/z 353.09[M-H]-及精确分子式C16H18O9,提示为同分异构体,结合数据库初步判定为单咖啡酰奎尼酸(caffeoyl-quinic acid,CQA)类成分,三者的MS2谱图分别给出基峰为m/z 191、191 和173,表明化合物1和3易脱去单咖啡酰基形成奎尼酸,化合物5易从4位羟基位置断裂形成烯醇基结构(碎裂方式见图5),通过与对照品比对确定化合物3为3-CQA(绿原酸),5-CQA与3-CQA的二维结构相同,但立体构型上存在较大差别,体现在质谱中的差异为二者的二级碎裂信号相似,但在相对丰度上有明显差异,其中5-CQA的m/z 179碎裂信号远高于3-CQA。4-CQA与3-CQA的极性相近,但在反相色谱中4-CQA的保留时间更长[14],结合文献[15]数据,确定化合物1、5分别为5-CQA(新绿原酸)和4-CQA(隐绿原酸)。
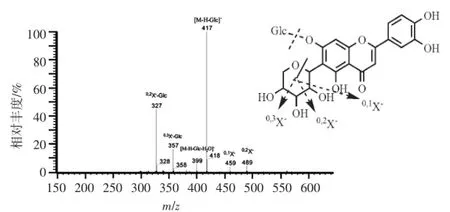
图4 化合物10的MS2质谱图Figure 4 MS2spectra of compound 10
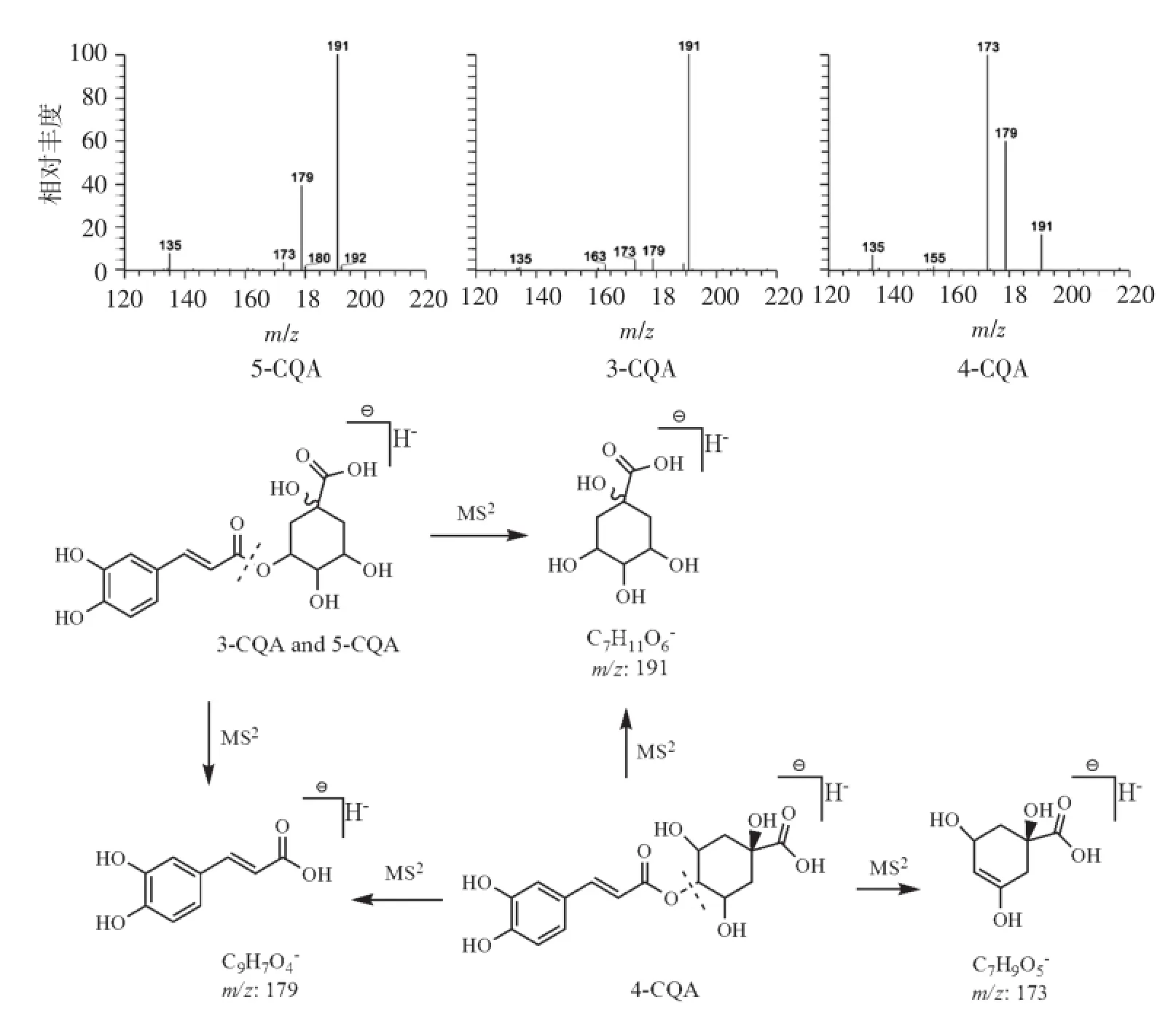
图5 化合物1,3和5的MS2质谱图及主要裂解途径Figure 5 MS2spectra of compound 1,3,5 and their major fragmentation pathways
化合物2、7和 8的准分子离子峰均为 m/z 337.09[M-H]-(C16H17O8),其二级谱基峰分别为m/z 163、163和173,其裂解途径与单咖啡酰奎尼酸成分相似,经与文献[16]数据对照,推断其结构分别为 5-pCoQA、3-pCoQA和 4-pCoQA(p-coumaroylquinic acid,对香豆酰奎尼酸)。此外,可检测到微量的游离羟基酚酸类成分,如咖啡酸(化合物6),其MS2谱图中可看到脱CO2的离子m/z 135。
3 讨论
与正离子模式比较,淡竹叶供试品溶液在负离子模式下所得成分峰较多,信号响应佳,故采用以负离子检测的分析模式,能实现大多数化合物的结构确证。在ESI负离子模式下,各化学成分峰高分辨一级质谱图主要以[M-H]-准分子离子峰存在,依靠ESI-MSn图谱可获取有效的结构碎裂信息。
结果显示,淡竹叶醇提物中主要含有羟基酚酸类、黄酮碳苷类及其他黄酮类成分。高分辨质谱给出的精确分子式信息,结合多级质谱提供的特征碎片离子及裂解途径分析策略,为淡竹叶药材的物质基础研究、质量控制提供了快速、准确的检测手段,并为进一步寻找微量成分提供重要的参考。
参考文献:
[1]国家药典委员会.中华人民共和国药典:2015年版一部[M].北京:中国医药科技出版社,2015:328.
[2]史洋,刘峰,杨东花,等.淡竹叶药效物质基础研究进展[J].中国现代中药,2014,16(7):597-600.
[3]陈烨.淡竹叶化学成分与药理作用研究进展[J].亚太传统医药,2014,10(13):50-52.
[4]刘明,吴启南,宋秋烨,等.淡竹叶清热作用药效植物基础研究[J].时珍国医国药,2009,20(8):1934-1936.
[5]郭妍.淡竹叶药材质量标准及药效学研究[D].沈阳:辽宁中医药大学,2010.
[6]孙涛,刘静,曹永孝.淡竹叶黄酮收缩血管的作用[J].中药药理与临床,2010,26(5):57-59.
[7]张靖,王英,张晓琦,等.淡竹叶化学成分研究[J].中国天然药物,2009,7(6):428-431.
[8]赵慧男,陈梅,范春林,等.淡竹叶中一个新的黄酮碳苷[J].中国中药杂志,2014,39(2):247-249.
[9]WANG Ying,CHEN Mei,ZHANG Jing,et al.Flavone C-glycosides from the leaves of Lophatherum gracile and their in vitro antiviral activity[J].Planta Med,2012,78(1):46-51.
[10]QUI Xiaohui,ZHANG Jing,HUANG Zhihai,et al.Profiling of phenolic constituents in Polygonum multiflorum Thunb. by combination of ultra-high-pressure liquid chromatography with linear ion trap-Orbitrap mass spectrometry[J].J Chromatogr A,2013,1292:121-131.
[11]ZHANG Jing,HUANG Zhihai,QUI Xiaohui,et al.Neutral fragment filtering for rapid identification of new diesterditerpenoid alkaloids in roots of aconitum carmichaeli by ultra-high-pressure liquid chromatography coupled with linear ion trap-orbitrap mass spectrometry[J].Plos one,2012,7(12):e52352.
[12]XU Wen,ZHANG Jing,ZHU Dayuan,et al.Rapid separation and characterization of diterpenoid alkaloids in processed roots of Aconitum carmichaeli using ultra high performance liquid chromatography coupled with hybrid linear ion trap-orbitrap tandemmass spectrometry[J]. J Sep Sci,2014,37(20):2864-2873.
[13]周桂芬,吕圭源.基于高效液相色谱-二极管阵列光谱检测-电喷雾离子化质谱联用鉴定铁皮石斛叶中8种黄酮碳苷化合物及裂解规律研究[J].中国药学杂志,2012,47(1):13-19.
[14]CLIFFORDMN,KNIGHTS,KUHNERTN. Discriminating between the six isomers of dicaffeoylquinic acid by LC-MSn[J].J Agric Food Chem,2005,53(10):3821-3832.
[15]李淼,王永香,孟谨,等.HPLC法测定金银花中新绿原酸等8种成分的量[J].中草药,2014,45(7):2006-2010.
[16]CLIFFORD M N,JOHNSTON K L,KNIGHT S,et al. HierarchicalschemeforLC-MSnidentificationof chlorogenic acids[J].J Agric Food Chem,2003,51(10):2900-2911.
(责任编辑:刘晓涵)
中图分类号:R284.1
文献标志码:A
文章编号:1006-8783(2016)03-0300-07
DOI:10.16809/j.cnki.1006-8783.2016031802
收稿日期:2016-03-18
基金项目:广东省中医药管理局建设中医药强省科研项目(20152136);国家自然科学基金(81402887)
作者简介:潘智然(1983—),男,主管药师,从事中药材质量控制研究,Email:1055478879@qq.com;通信作者:张靖(1983—),女,博士,助理研究员,从事中药药效物质基础及质量控制研究,电话:020-39318571,Email:ginniezj@163.com。
Identification of chemical constituents from Lophatherum gracile Brongn.by UHPLC-LTQ-Orbitrap HR MSn
PAN Zhiran1,WANG Tenghua1,ZHU Shoulun1,REN Zhiyao1,ZHANG Jing1,2
(1.The Second College of Clinic Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510120,China;2.Guangdong Province Institute of Chinese Medicine,Guangzhou 510006,China)
AbstractObjective To establish a method for qualitative analysis of chemical components from Lophatherum gracile Brongn.by UHPLC-ESI-HR MSnspectrometry.Methods A Phenomenex kinetix C18column and a gradient elution of acetonitrile-0.1%formic acid were applied for UHPLC separation.An orbitrap mass analyzer combined with a linear ion trap were used for high resolution mass spectrometry and subsequent collision-induced dissociation.Results High separation efficiency was achieved with UHPLC on constituents from L.gracile.According to the high-resolution mass information and MS/MS fragmentation behaviors 21 compounds were tentatively identified.Conclusion This work set a good example for rapid qualitative analysis of different classes of constituents from L.gracile which might be helpful for its further phytochemical study and quality control.
Key wordsLophatherum gracile UHPLC-ESI-HR MSnflavone C-glycosides chemical constituents

