关于凝固点和凝固点降低
崔 斌 李淑妮 王小芳
(1西北大学化学与材料科学学院,西安710127;2陕西师范大学化学化工学院,西安710119)
·师生笔谈·
关于凝固点和凝固点降低
崔斌1,*李淑妮2王小芳1
(1西北大学化学与材料科学学院,西安710127;2陕西师范大学化学化工学院,西安710119)
摘要:对水的凝固点、三相点、标准凝固点和正常凝固点概念及其图示进行了辨析。
关键词:凝固点;凝固点降低;三相点
在大一的普通化学或无机化学课程讲解稀溶液的通性时,常常要讲到“凝固点和凝固点降低”的问题,通常使用图1来描述该现象。由于不同的教师对单组分系统的p-T相图中的坐标含义及其点、线和面的理解不同,故在其论文、教材,以及相应的一些课件中会反映出这种差异。
图1适合于所有溶剂。最普通的溶剂是水。在单组分系统水的p-T相图(图1)中,纵坐标是系统的压力,横坐标是系统的温度,三个区域分别代表纯水的三种相态;三条曲线分别代表纯水的几个两相平衡线。水的相图中有两个特殊点,即三相点和临界点,这两个点的温度和压力是固定的,是由水的性质决定的,与外界压力没有关系。在三相点时,纯的水、冰、水蒸气三相共存,这时的平衡压力为610.1 Pa,温度为273.16 K。
自IUPAC提出标准态压力是指100 kPa以来,外压为101.325 kPa时溶剂的沸点和熔点应称为正常沸点和正常熔点,而外压为100 kPa时溶剂的沸点和熔点应称为标准沸点和标准熔点。在有的教材中,用正斜率的线来表示纯水和水溶液的固-液平衡线(由于本文仅讨论凝固点和凝固点降低的问题,所以在图1中没有示出固-液平衡线)显然欠妥。由于水的密度高于冰,故它们的固-液线的斜率都应该为负。有的书在水的相图上标出了101.325 kPa的线,让其与纯水和水溶液的固-液线和液-气线相交,以表示其熔点、沸点的变化。应该说,这样的表示也是欠妥的。图上没有空气和外压的立足之地。纯水在达到气-液两相平衡时,是看不到沸腾的。当水的蒸气压等于外压时,水会冒气泡,会看到沸腾的景象,这时的温度称为沸点。沸点的温度与外压有关。在海拔较高的地方,外界压力低于101.325 kPa,可能在较低的温度时水就沸腾了。因此,101.325 kPa没有特殊的含义,所以在水的相图上标出101.325 kPa的线是不合适的。相应地,让101.325 kPa的线与纯水和水溶液的固-液线和液-气线相交,以表示其熔点、沸点的变化也是不妥的。
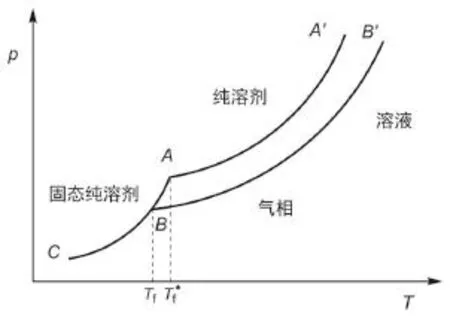
图1 单组分系统水的p-T相图
某纯物质的固、液两相达成平衡的温度称为熔点(或凝固点)。这时,固态纯溶剂的蒸气压与溶液中溶剂的蒸气压相等。根据拉乌尔定律,溶液中溶剂的蒸气压小于纯溶剂的蒸气压。对于水溶液,在凝固点时,其蒸气压应该低于水的三相点的蒸气压。
由于温度对固态纯溶剂的蒸气压有较大的影响(曲线的斜率较大),所以溶液中的溶剂的蒸气压在三相点以下的温度Tf才和固态纯溶剂的蒸气压相等,因此只有在这个温度时溶液才能和冰达成平衡状态,Tf即该溶液的凝固点。
因此,在图1所表示的凝固点下降的图中,A为纯水的三相点,B为溶液的凝固点。
对于处于101.325 kPa压力大气中的水,因溶有了空气,变成了空气(氧气、氮气)的饱和水溶液。已知在273 K和101.325 kPa时,纯氮在水中的溶解度为0.02354 cm3·g-1(相当于1.050×10-6mol·g-1),空气中N2的体积分数为0.79,其分压与体积分数成正比,所以在通常情况下,N2在水中的质量摩尔浓度为8.295×10-4mol·kg-1。在273 K和101.325 kPa时,纯氧在水中的溶解度为0.04889 cm3·g-1(相当于2.181×10-6mol·g-1),空气中O2的体积分数为0.21,所以在通常情况下O2在水中的质量摩尔浓度为4.580×10-4mol·kg-1。
在忽略水中尚可能溶解的其他少量气体的情况下,空气在水中的总质量摩尔浓度为1.288×10-3mol·kg-1。
根据水的凝固点降低公式可得空气水溶液的凝固点比纯水的凝固点降低值:

式中Kf为水的冰点下降常数。
外压可以影响固-液两相的平衡温度,但这是外压对相变温度的影响,可由Clapeyron方程计算。液面压力的改变导致固-液两相平衡温度改变的方程为:

在273.16 K时,1 mol冰融化为1 mol水吸收的热为6002J·mol-1,此时,冰的体积为19.652 cm3·mol-1,水的体积为18.018 cm3·mol-1。△V=-1.634 cm3·mol-1=-1.634×10-6m3·mol-1。
所以,
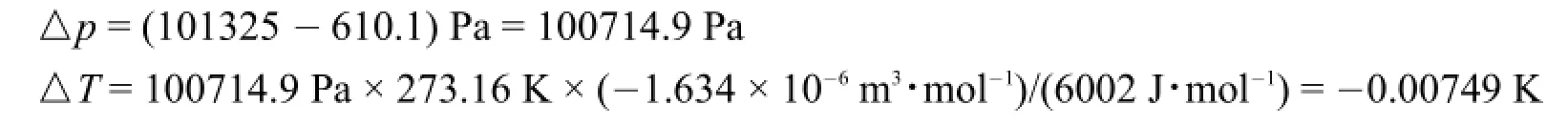
因此,水的正常凝固点(冰点)为:(273.16-0.0024-0.00749)K=273.15 K。
在忽略101.325 kPa和100 kPa压力下水中空气的溶解度的差异后,水的标准凝固点为:273.16 K-0.0024 K-(100000-610.1)Pa×273.16 K×(-1.634×10-6m3·mol-1)/(6002 J·mol-1)=273.15 K。
由于数字的修约和有效数字的取舍使得水的正常凝固点和水的标准凝固点在数值上完全相同,但其意义却不一样。
综上,在p-T图中,三相点是固定的一个点,这是纯水的特征。在通常的水中,因溶有了空气,已不再是纯水,而是一种溶液。虽然也有气-液-固三相的平衡,但此三相平衡的点将随溶液浓度的改变而改变,且还要受外界压力所影响。
本文承蒙南京大学沈文霞先生的指正,特此致谢!
参考文献
[1]戴安邦,尹敬执,严志炫,张青莲.无机化学教程.北京:人民教育出版社,1985.
[2]傅献彩,沈文霞,姚天扬,侯文华.物理化学.第5版.北京:高等教育出版社,2005.
中图分类号:O645;G64
doi:10.3866/PKU.DXHX201504018
*通讯作者,Email:cuibin@nwu.edu.cn
Concerning the Freezing Point and Freezing Point Depression
CUI Bin1,*LI Shu-Ni2WANG Xiao-Fang1
(1College of Chemistry&Materials Science,Northwest University,Xiʹan 710127,P.R.China;2School of Chemistry&Chemical Engineering,Shaanxi Normal University,Xiʹan 710119,P.R.China)
Abstract:In this paper,the concepts and graphics of the freezing point,the triple point,standard freezing point and normal freezing point of water were discussed and analyzed.
Key Words:Freezing point;Freezing point depression;Triple point

